瑞士乳杆菌及其在预防或治疗肾炎中的应用的制作方法
1.本发明属于微生物领域,具体涉及一种瑞士乳杆菌及其在预防或治疗肾炎中的应用。
背景技术:
2.肾炎由多种病因和发病机制引起,表现为血尿、蛋白尿、高血压等症状,临床表现常有重叠。狼疮肾炎(sle)是一种以多系统损害伴多种自身抗体形成为特征的自身免疫性疾病。患者体内可产生针对自身细胞核、胞质及胞膜抗原的抗体。临床常表现为发热、面部红斑、多形性皮疹、光过敏、多发性口腔溃疡、关节炎、多发性浆膜炎、血管炎、肾炎及中枢神经系统症状等,具体病因未明。
3.sle病因不确定使得在药物选择上有较大的困难,对狼疮性肾炎的治疗,需要根据临床表现、实验室检查和病理变化来决定治疗方案。一般认为,临床症状轻微,肾小球结构正常或轻微病变,轻度系膜增生者,可用抗疟药阿司匹林等治疗,可同时加用小剂量激素口服。膜型狼疮性肾炎,多用激素加细胞毒药物治疗,在治疗过程中,要防止治疗过度而冒药物毒副作用的危险。who
ꢀⅲ
型和ⅳ型(尤其是who
ꢀⅳ
型)则多采用激素加细胞毒性药物联合治疗。但上述药物风险系数较高或者副作用较大。
4.近年来,开始将sle药物的选择向益生菌方向发展。
5.申请号为202210224353.4中国专利中公开了一种植物乳杆菌,所述植物乳杆菌为植物乳杆菌cqpc02,菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no .14491。还公开了一种植物乳杆菌cqpc02在制备用于预防和/或治疗狼疮性肾炎的产品中的应用。通过建立动物模型观察了植物乳杆菌cqpc02对狼疮性肾炎的干预作用。通过检测小鼠血清中相关指标和炎症相关细胞因子水平确实了植物乳杆菌cqpc02对狼疮性肾炎的效果,并进一步采用病理学观察、组织的mrna和蛋白基因的表达检测深入的阐明了植物乳杆菌cqpc02的作用机理。但其效果相对于现有药物仍有一定差距。
6.不断筛选新的适用菌株,并将其投入肾炎的治疗对于临床应用十分必要。
7.瑞士乳杆菌是革兰氏阳性细菌中的一种,其呈长杆状,无鞭毛,无芽孢,菌落圆形,乳白色,边缘整齐,化能异养性,兼性厌氧,不液化明胶。瑞士乳杆菌具有缓解高血压,维持肠道菌群平衡,促进钙吸收,改善睡眠等功能。现有技术中尚未有对肾炎治疗效果较好的瑞士乳杆菌公开。
技术实现要素:
8.为了解决上述问题,本发明提供了一种新的瑞士乳杆菌。
9.一方面,本发明提供了一种瑞士乳杆菌。
10.所述的瑞士乳杆菌拉丁学名为lactobacillus helveticus lh-08b,保藏号为cctcc no:m2019013。
11.另一方面,本发明提供了一种瑞士乳杆菌培养物。
12.所述的培养物通过前述的瑞士乳杆菌接种于培养基进行培养后获得。
13.所述的培养基可以是固体培养基,液体培养基或半固体培养基。
14.优选地,所述的培养基可以是mrs培养基。
15.优选地,所述的培养物为发酵液,所述的培养基为液体培养基。
16.另一方面,本发明提供了一种瑞士乳杆菌冻干粉。
17.所述的冻干粉中包括前述的瑞士乳杆菌。
18.所述的冻干粉中还包括冻干保护剂。
19.所述的冻干保护剂为本领域常见的保护剂,本领域技术人员可以根据需要进行调整,如:甘油、海藻糖、蔗糖、dmso、甘露醇、氨基酸、奶粉、多糖等。
20.另一方面,本发明提供了一种菌剂。
21.所述的菌剂中包括前述的瑞士乳杆菌或瑞士乳杆菌培养物或瑞士乳杆菌冻干粉。
22.另一方面,本发明提供了一种瑞士乳杆菌的培养方法。
23.所述的培养方法包括将前述的瑞士乳杆菌接种于培养基。
24.优选地,培养条件为:37℃厌氧培养。
25.另一方面,本发明提供了前述的瑞士乳杆菌或瑞士乳杆菌培养物或瑞士乳杆菌冻干粉在制备药物或医疗器械中的应用。
26.优选地,所述的药物或医疗器械用于预防或治疗肾炎。
27.进一步优选地,所述的肾炎为狼疮肾炎。
28.另一方面,本发明提供了一种药物。
29.所述的药物中包括前述的瑞士乳杆菌或瑞士乳杆菌培养物或瑞士乳杆菌冻干粉。
30.所述的药物中还包括其他药学上可接受的载体或赋形剂,如:填充剂、崩解剂、润滑剂、粘合剂或ph调节剂中的一种或多种。
31.优选地,所述的药物用于治疗或预防肾炎。
32.进一步优选地,所述的肾炎为狼疮肾炎。
33.另一方面,本发明提供了一种医疗器械。
34.所述的医疗器械附着有前述的瑞士乳杆菌。
35.优选地,所述的医疗器械用于治疗或预防肾炎。
36.进一步优选地,所述的肾炎为狼疮肾炎。
37.本发明的有益效果:本发明提供的瑞士乳杆菌在治疗狼疮性肾炎方面有显著的效果:在小鼠狼疮性肾炎模型中,可以减少小鼠尿蛋白;减少炎症因子释放;调节血清中scr、bun、tc、tg和alb的水平;降低dsdna抗体阳性率;对肾脏组织具有修复效果;并能调节肾组织中肾炎相关mrna的表达量,与现有药物相比,具有更好的效果。
38.保藏说明拉丁学名:lactobacillus helveticus lh-08b;中文学名:瑞士乳杆菌lh-08b;保藏编号:cctcc no:m2019013;保藏时间:2019年1月4日;保藏单位:中国典型培养物保藏中心;
保藏地址:湖北省武汉市武昌区八一路299号武汉大学。
附图说明
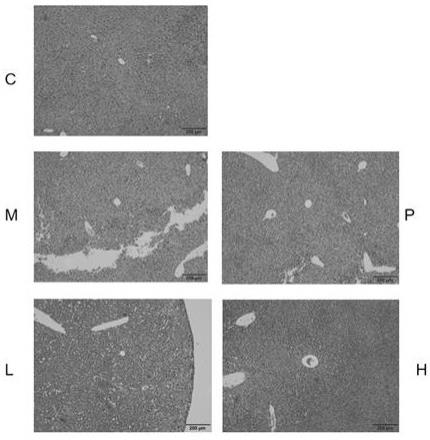
39.图1为小鼠肾脏组织的h&e染色切片。
40.图2为小鼠尿蛋白检测结果。
具体实施方式
41.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
42.本发明中,“降植烷”英文名为pristane,cas号为1921-70-6。
43.本发明中,“泼尼松”又名强的松,是一种有机化合物,化学式为c
21h26
o5,是一种糖皮质激素,具有抗炎及抗过敏作用,能抑制结缔组织的增生,降低毛细血管壁和细胞膜的通透性,减少炎性渗出,并能抑制组胺及其它毒性物质的形成与释放,还能促进蛋白质分解转变为糖。其抗炎及抗过敏作用较强,副作用较少。
44.本发明中,所有指标的检测方法,如无特别说明,均采用本领域常规试剂盒或检测标准执行。
45.实施例1瑞士乳杆菌lh-08b的分离纯化与培养1、样品来源内蒙古奶嚼口样本,无菌取样运送至善恩康生物科技有限公司实验室。
46.2、奶嚼口中乳酸菌的筛选2.1分离纯化富集培养:取0.5-2g奶嚼口样品于50ml已灭菌mrs液体培养基(1l mrs 液体培养基+0.05%l-半胱氨酸)/tpy液体培养基中,将其置于37℃无氧条件下培养24-48h,进行稀释后涂板。
47.2.2培养方案2.2.1稀释液改良的生理盐水稀释液:1l 0.9%生理盐水+0.05%l-半胱氨酸。
48.2.2.2稀释涂板法吸取上述繁殖好的细菌培养液1ml,至9ml稀释液中,得到10-1
菌液稀释液,依次做五个梯度,而后依次接种到预先准备好的固体培养皿中,涂布均匀。对每个培养皿进行相对应的稀释度标记,每个稀释度做2个平行,并留空白培养皿作对照,后将其置于37℃厌氧条件下倒置培养72h。
49.2.2.3培养基的配制(1)改良的mrs液体培养基(1l)配制,如表1:表1
(2)改良的mrs固体培养基(1l)配制,如表2:表2注:l-半胱氨酸溶液过滤除菌后,在培养基灭菌后,倒平板前加入。
50.(3)改良tpy琼脂培养基(莫匹罗星里盐添加量为50mg/l)。
51.2.2.4纯化将37℃厌氧培养72h后的平板取出,观察固体培养基上的菌落形态,包括形状、颜色、大小、表面、边缘、隆起度、透明度等,挑选不同菌落形态的单菌进行分区划线,37℃培养48h。
52.2.2.5镜检2.2.6液体培养用已灭好的牙签挑取已纯化好的菌落接于液体中,置于37℃条件下厌氧培养48h。
53.2.2.7菌种保存将培养48h后的液体试管接入到2ml甘油管中,于-80℃下进行保存。
54.2.3菌株dna提取采用细菌dna提试剂盒提取dna,经16s rrna扩增测序,鉴定为瑞士乳杆菌(lactobacillus helveticus),命名为瑞士乳杆菌lh-08b lactobacillus helveticus lh-08b。并于2019年1月4日保藏于中国典型培养物保藏中心,地址为中国
·
武汉
·
武汉大学,保藏号为cctcc no:m2019013。
55.取菌种活化后接种于mrs培养基,于37℃厌氧条件下培养24-48h,获得瑞士乳杆菌lh-08b的培养物。
56.实施例2瑞士乳杆菌lh-08b的冻干粉对实施例的培养物进行离心获取沉淀,加入冻干保护剂后冻干,获得瑞士乳杆菌lh-08b的冻干粉。
57.实施例3小鼠狼疮性肾炎模型实验采用已公开的小鼠狼疮性肾炎模型对瑞士乳杆菌lh-08b的效果进行验证。
58.在温度为20
±
1℃、湿度为30%-40%的受控环境中饲养雌性c57bl/j6小鼠。
59.给予试验小鼠常规食物和无限量的水。在小鼠适应了七天的饮食后,实验正式开始。
60.由35只小鼠组成正常组(c)、模型组(m)、药物阳性对照组(p)、低浓度菌处理组(l)和高浓度菌处理组(h)。各组处理方式如下:正常组:实验开始后的第一天腹腔注射生理盐水;模型组:实验开始后的第一天腹腔注射0.5ml的降植烷;药物阳性对照组:实验开始后的第一天腹腔注射0.5ml的降植烷;每天灌服泼尼松10mg/kg;低浓度菌处理组:实验开始后的第一天腹腔注射0.5ml的降植烷;每天灌服10
8 cfu/kg瑞士乳杆菌lh-08b;高浓度菌处理组:实验开始后的第一天腹腔注射0.5ml的降植烷;每天灌服10
9 cfu/kg瑞士乳杆菌lh-08b。
61.给药持续时间为12周,给药完毕后通过颈部解剖将小鼠宰杀,并提取其血液和内脏器官。
62.实验中测定以下指标:(1)小鼠尿蛋白试验实验开始后,每两周将小鼠安置在代谢笼中,在第一天收集小鼠的尿液,用总蛋白(tp)试剂盒(库马西亮蓝法)测定24小时内小鼠尿液中的蛋白量。
63.(2)小鼠血清和组织炎症细胞因子的测定从心脏采集小鼠全血后提取上层血清,在4℃下以1500rpm离心10分钟。市售试剂盒分析血清中炎症细胞因子il-6、il-12、肿瘤坏死因子-α(tnf-α)和干扰素-γ(ifn-γ)的水平。
64.(3)小鼠血清中血清肌酐(scr)、血尿素氮(bun)、总胆固醇(tc)、甘油三酯(tg)和白蛋白(alb)水平的测定。
65.从小鼠身上获得全血,并在4℃下以1500rpm离心10分钟。收集上层血清,市售试剂盒测定小鼠血清中的scr、bun、tc、tg和alb的水平。
66.(4)抗双链脱氧核糖核酸(dsdna)抗体检测实验期间,每两周从眼窝处取血,利用小鼠血清,用微孔板和间接免疫荧光试验来量化抗dsdna抗体。
67.(5)免疫组化肾脏组织在解剖后被保存在10%的福尔马林中。组织样本脱水48小时后嵌入石蜡,切片,用苏木精-伊红(h&e)染色。使用光学显微镜,发现组织病理学的改变。
68.小鼠组织qpcr检测在0.1克小鼠肾脏组织中加入0.9毫升正常生理盐水后,将组织组合均匀化。
69.用1.0ml rnazol提取rna。在260和280纳米处测量提取的rna的吸光度以量化rna的纯度和浓度,并将浓度调整为1微克/升。逆转录创建cdna后,制备反应系统溶液,包括1l cdna、10l sybr green pcr master mix、7μl 无菌蒸馏水和1μl上游和下游引物溶液。反应程序:95℃,60秒;95℃,15秒,40个循环;55℃,30秒;72℃,35秒;95℃,30秒。基因的相对表
达是用2
−
δδct
技术确定的,3-磷酸甘油酯脱氢酶(gapdh)作为内部参考。
70.(6)统计分析以上所有指标都平行测试三次,结果以平均值标准差报告。然后用单因素方差分析比较各组的指标值。当p《0.05时,预计有显著差异。
71.结果:(1)小鼠尿蛋白检测结果见图2。
72.(2)小鼠血清炎症细胞因子的测定 il-6(pg/ml)il-12(ng/ml)tnf-α(ng/ml)ifn-γ(pg/ml)正常10.24
±
1.242.53
±
0.11167.56
±
15.61124.37
±
10.42模型88.46
±
5.3413.95
±
0.80824.76
±
28.53682.64
±
58.62阳性药组26.85
±
5.695.19
±
0.49354.28
±
23.64311.25
±
49.76低剂量组52.31
±
6.318.47
±
0.58484.61
±
32.12397.46
±
25.49高剂量组28.64
±
2.384.82
±
0.73316.52
±
30.78296.84
±
27.91(3)小鼠血清中血清肌酐(scr)、血尿素氮(bun)、总胆固醇(tc)、甘油三酯(tg)和白蛋白(alb)水平的测定 scr(
µ
mol/l)bun(mmol/l)tc(mmol/l)tg(mmol/l)tp(g/l)alb(g/l)正常53.61
±
3.541.19
±
0.272.13
±
0.130.95
±
0.0871.69
±
7.2544.95
±
2.17模型142.79
±
12.2719.28
±
1.5419.62
±
2.4317.24
±
1.6924.23
±
2.586.97
±
0.65阳性药组75.24
±
5.336.71
±
1.027.13
±
0.936.52
±
1.3558.84
±
2.4427.86
±
2.92低剂量组112.33
±
7.2012.43
±
2.3814.51
±
1.3710.83
±
2.0156.21
±
2.3014.52
±
2.07高剂量组69.48
±
2.216.86
±
0.867.78
±
1.306.01
±
0.4262.34
±
1.5226.42
±
2.36
(4)抗双链脱氧核糖核酸(dsdna)抗体检测(阳性率) 第2周第4周第6周第8周第10周第12周正常0/10(0%)0/10(0%)0/10(0%)0/10(0%)0/10(0%)0/10(0%)模型8/10(80%)9/10(90%)10/10(100%)10/10(100%)10/10(100%)10/10(100%)阳性药组3/10(30%)5/10(50%)7/10(70%)8/10(80%)10/10(100%)10/10(100%)低剂量组5/10(50%)7/10(70%)8/10(80%)9/10(90%)10/10(100%)10/10(100%)高剂量组3/10(30%)4/10(40%)5/10(50%)7/10(70%)8/10(80%)9/10(90%)
(5)肾脏组织病理学观察如图1所示,正常组小鼠肾小球和细胞结构完整,模型组小鼠肾脏组织显示严重病变,阳性药组能够明显减少组织病变,低剂量组和高剂量组均表现出一定的治疗效果,且高剂量组效果更好。
73.(6)小鼠肾组织的mrna相对表达量正常组小鼠肾组织中nf-κb(0.24
±
0.02)、tgf-β1(0.28
±
0.04)、vegf(0.19
±
0.01)、icam-1(0.20
±
0.02)和vcam-1(0.12
±
0.01)的mrna表达最弱,iκb-α(6.57
±
0.11)的表达最强。
74.模型组iκb-α(1.28
±
0.01)表达最弱,nf-κb(0.97
±
0.03)、tgf-β1(1.06
±
0.05)、vegf(1.12
±
0.14)、icam-1(1.06
±
0.11)和vcam-1(1.15
±
0.20)表达最强。
75.阳性药组能显著上调模型组肾组织iκb-α(5.16
±
0.08)的表达,下调nf-κb(0.42
±
0.04)、tgf-β1(0.40
±
0.05)、vegf(0.42
±
0.14)、icam-1(0.38
±
0.09)和vcam-1(0.39
±
0.17)的表达。
76.瑞士乳杆菌低剂量组在一定程度上上调模型组肾组织iκb-α(4.33
±
0.05)的表达,下调nf-κb(0.52
±
0.05)、tgf-β1(0.66
±
0.22)、vegf(0.71
±
0.13)、icam-1(0.47
±
0.07)、和vcam-1(0.54
±
0.10)的表达。
77.瑞士乳杆菌高剂量组作用强于低剂量组,能够上调模型组肾组织iκb-α(5.67
±
0.26)的表达,下调nf-κb(0.37
±
0.01)、tgf-β1(0.33
±
0.16)、vegf(0.36
±
0.07)、icam-1(0.27
±
0.04)和vcam-1(0.34
±
0.11)的表达,且效果优于阳性药组,特别是在上调iκb-α、下调nf-κb(0.37
±
0.01)、下调icam-1方面差异具有显著性(p<0.05)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1