双硼嵌入多环芳烃功能分子材料及其制备和应用
1.本发明涉及功能分子材料领域,特别涉及光电性质分子材料。
背景技术:
2.稠环芳烃(pahs)分子由于其结构能够进行可控设计,并经常表现出可预测的光电性质而广泛地应用于有机场效应晶体管、有机发光二极管和有机光伏。重新排列六元环的拓扑结构或者掺入杂原子是改变分子的光电性质的有效策略,近年来,化学家们将大量注意力集中在引入杂原子来精确调节pahs的光电性质,用杂原子代替稠环芳烃中的部分碳原子,形成掺杂共轭碳骨架,可显著提高分子的稳定性和组装性能,从而提高有机光电材料的光电性能。其中硼原子由于pz空轨道使其可同时充当电子受体和和路易斯酸,当将其掺入多环芳烃中,多环芳烃的分子轨道能量和带隙可以被显著降低,特别是lumo能级,所以掺硼的多环芳烃往往可视为优秀的可见光发光材料和n型材料。这对于有机光电器件的发展有着巨大的推动作用,因为目前所研究的发光材料的发光波段大都集中于紫外光,有机半导体材料的研究应用大多集中于p型材料。但是硼原子对空气中氧气和水十分敏感,这大大限制了掺硼多环芳烃的发展。
技术实现要素:
3.针对现有问题,本发明第一目的在于,提供一种双硼嵌入多环芳烃功能分子材料,旨在提供一种具有优异传输效率,在光电材料方面具有良好应用价值的全新结构化合物。
4.本发明第二目的在于,提供所述的双硼嵌入多环芳烃功能分子材料的制备方法,旨在成功制备所述的双硼嵌入多环芳烃功能分子材料。
5.本发明第三目的在于,提供所述的双硼嵌入多环芳烃功能分子材料在制备光电材料如有机场效应晶体管中的应用。
6.本发明第四目的在于,提供包含所述双硼嵌入多环芳烃功能分子材料可作为检测对环境有害的氟化物传感器。
7.一种双硼嵌入多环芳烃功能分子材料,其具有式1结构式:
[0008][0009]
式1中,所述的x1为o、s或nr;
[0010]
所述的r1为h、烷基、取代烷基、环烷基、芳基或取代芳基;
[0011]
所述的r2为烷基、取代烷基、环烷基、芳基或取代芳基;
[0012]
所述的取代烷基、取代芳基中的取代基为卤素、cn、c
1-c6的烷基、c
1-c6的烷氧基、三氟甲基中的至少一种。
[0013]
本发明提供了一种全新三维共轭结构的化合物,且所述化合物具有集成的电荷迁
移性质,具有优异的传输效率。
[0014]
本发明中,所述的分子结构以及基团的控制是协同改善其传输效率,改善其光电材料应用性能的关键。
[0015]
本发明中,所述的烷基为c
1-c
24
的烷基;优选为c
1-c6的直链或支链烷基。
[0016]
所述的取代烷基为在c
1-c
24
优选为c
1-c6的碳链上带有一个及以上取代基的取代烷基;
[0017]
所述的芳基为苯基、五元杂环芳基、六元杂环芳基、通过苯环、五元杂环芳基、六元杂环芳基中的任意两个及以上的芳香环并和形成的稠环或者稠杂环基;
[0018]
优选地,所述的芳基为苯基;
[0019]
优选地,所述的取代芳基为在芳香环上带有一个及以上取代基的取代芳基;优选为取代苯基;
[0020]
优选地,取代烷基、取代芳基中的取代基为c
1-c6的烷基、c
1-c6的烷氧基或卤素中的至少一种。
[0021]
优选的双硼嵌入多环芳烃功能分子材料,所述的x1为o或s;
[0022]
所述的r1为h;
[0023]
所述的r2为苯基或取代苯基;所述的取代苯基为c
1-c6的烷基、c
1-c6的烷氧基、卤素、cn中的至少一个取代基取代的苯基。
[0024]
本发明所述的双硼嵌入多环芳烃功能分子材料,具备刚性的π共轭骨架和较强的分子间相互作用以及低的lumo能级。此外,其具有n型半导体的典型特征,其在薄膜上的电子传输效率为1.49
×
10-3
cm2v-1
s-1
。
[0025]
本发明还提供了所述的双硼嵌入多环芳烃功能分子材料的制备方法,通过式2化合物、烷基锂、硼源和r2mgx(格氏试剂)进行关环反应制得;
[0026][0027]
所述的式2中,x1和r1的选取范围同式1;
[0028]
所述的x为卤素;
[0029]
所述的r2mgx中的r2选取范围同式1。
[0030]
本发明研究发现,采用式2在烷基锂以及格氏试剂联合体系下进行关环反应,如此可以一步制备得到所要求的双硼嵌入多环芳烃功能分子材料,并有助于改善制备的收率和纯度。
[0031]
本发明中,所述的烷基锂为c1~c6的直链或支链烷基锂,优先为丁基锂;
[0032]
优选地,所述的硼源为bbr3、bcl3、bf3中的至少一种;
[0033]
优选地,式2中,所述的x优选为br。
[0034]
优选地,所述的r2mgx中,所述的x为cl、br或i。
[0035]
优选地,式2化合物、烷基锂、硼源和r2mgx的摩尔比为1:2~2.5:2~2.5:4~7;进一步优选为1:2.1~2.3:2.1~2.3:5.5~6.5。
[0036]
作为优选,预先将式2化合物、烷基锂、硼源进行第一段混合后进行第一段反应,随
后和r2mgx进行第二段混合后再进行第二段反应;
[0037]
其中,第一段混合和第二段混合阶段的温度小于或等于4℃,例如为-4~4℃;
[0038]
第一段反应的温度为100~140℃,优选为105~125℃;
[0039]
第二段反应的温度为15~40℃,优选为20~35℃;
[0040]
各段的反应时间可根据tlc中控确定。例如,第一段反应的时间为2~8h;第二段反应的时间为0.5~2h。
[0041]
优选地,反应阶段的溶剂为氯苯、甲苯、邻二甲苯中的至少一种;
[0042]
优选地,关环反应在无水、无氧条件下进行。
[0043]
本发明中,所述的式2可基于已知的卤化反应制备。例如本发明中,所述的
[0044]
式2通过式3化合物和卤化试剂进行卤代反应制备:
[0045][0046]
所述的式3中,x1和r1的选取范围同式1;
[0047]
优选地,所述的卤化试剂为液溴。本发明中,采用液溴,有助于高效成功制备目标产物。
[0048]
优选地,所述的卤代反应的溶剂为dcm、四氯化碳、dmf和氯仿中的至少一种;
[0049]
优选地,式3化合物和卤化试剂的摩尔比为1:2~8;优选为1:2~2.2;
[0050]
优选地,卤化反应的温度为15~35℃。
[0051]
本发明中,所述的式3可基于常规的偶联反应如铃木偶联制备。例如,所述的式3通过式4和式5进行suzuki偶联反应制备:
[0052][0053]
式4中的x1和r1的选取范围同式1;
[0054]
式5中的a为x(卤素)或otf;
[0055]
优选地,式4和式5的摩尔比为2~3:1,优选为2.2~2.5:1;
[0056]
优选地,suzuki偶联反应在钯作催化剂催化下进行,优选的催化剂为pd(pph3)4;催化剂的用量为催化量,例如为式5摩尔量的0.1~1%。
[0057]
优选地,suzuki偶联反应的温度为80~95℃,优选为85~90℃。
[0058]
反应的时间可根据tlc确定。
[0059]
本发明提供了一种所述的双硼嵌入多环芳烃功能分子材料的应用,将所述的共轭功能分子用于有机光电材料、多功能器件及职能材料等领域。
[0060]
进一步优选,将所述的三维共轭分子材料用于制备有机场效应晶体管、有机发光二极管、偏振发光有机场效应管等。
[0061]
本发明还提供了一种电子器件,其包含所述的双硼嵌入多环芳烃功能分子材料;
[0062]
优选地,所述的电子器件为有机场效应晶体管、有机发光二极管、偏振发光有机场效应管中的至少一种。
[0063]
有益效果
[0064]
本发明提供了一种全新式1结构的化合物。研究还发现,所述的式1化合物中,基于结构的联合,能够实现整体协同,能够表现出可见/近红外荧光的性质,可用于检测对环境有害的氟化物的探测器;能够表现出集成的电荷迁移性质,并能够表现出优异的传输效率。
[0065]
本发明创新地提供了所述的双硼嵌入多环芳烃功能分子,实现了构建环境稳定的两个x1和两个硼原子嵌入的多环芳烃(b2x2)。使之成为具有电荷传输性质的功能集成材料,可应用于面向高端材料需求的电子器件和光学元件等。
附图说明
[0066]
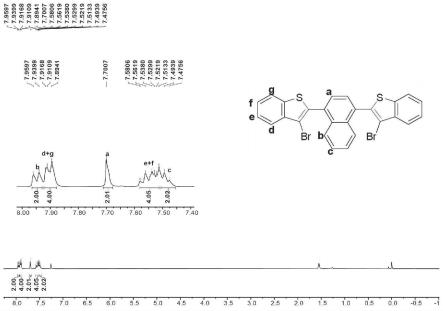
图1是制得的式2-a化合物的h-nmr图。
[0067]
图2是制得的式2-a化合物的c-nmr图。
[0068]
图3是制得的式1-a化合物的h-nmr图。
[0069]
图4是制得的式1-a化合物的c-nmr图。
[0070]
图5是制得的式1-a化合物的b-nmr图。
[0071]
图6是制得的式2-a化合物的质谱图。
[0072]
图7是制得的式1-a化合物的质谱图。
[0073]
图8是制得的式1-a化合物的单晶衍射结构图。
[0074]
图9是制得的式1-a化合物的吸收光谱和发射光谱。
[0075]
图10是制得的式1-a化合物的氟离子配位滴定的紫外可见光谱。
[0076]
图11是制得的式1-a化合物的模拟吸收光谱理论计算图。
[0077]
图12是制得的式1-a化合物的分子轨道分布的理论计算图。
[0078]
图13是基于式1-a化合物薄膜的顶栅底接触ofet的转移特性图。
[0079]
图14是基于式1-a化合物薄膜的顶栅底接触ofet的输出特性图。
具体实施方式
[0080]
测试:
[0081]
nmr测定:在bruker 400mhz核磁共振仪上对化合物1-a,2-a测试得到nmr谱图。
[0082]
质谱测定:在finnigan mat tsq 7000质谱仪上对化合物1-a,2-a测试得到质谱图。
[0083]
电化学测试:在浓度为1mmol/l化合物式1-a的无水四氢呋喃溶液中,加入电解质四丁基六氟磷酸铵(浓度为0.1mol/l)。在氮气保护下,用上海辰华的650d电化学工作站,对其进行循环伏安曲线测试,其中工作电极为玻碳电极,参比电极为ag/agcl电极,对电极为pt丝电极,扫描速率为50mvs-1
。最后再用fc/fc
+
(fc为二茂铁)进行校正。
[0084]
光谱测试:分别配制化合物式1-a,2-a的二氯甲烷溶液,其浓度为10-5
mol/l,在岛
津uv-3600plus上测试记录稳态uv-vis吸收谱图。
[0085]
单晶x射线分析:向产物式1-a的氯仿溶液中加入正己烷,然后在-20℃下缓慢蒸发,得到了适合x射线晶体分析的单晶。在安捷伦超新星x射线衍射仪上测试收集数据。
[0086]
理论计算:使用gauss 09软件,采用密度泛函理论(dft)和时间分辨-密度泛函理论(td-dft)理论计算,对化合物1-a的电子跃迁进行分析。
[0087]
实施例1
[0088]
式2-a的合成:
[0089]
化学合成法见设计式1:
[0090][0091]
称取式5-a 1.0g(2.36mmol),式4-a 1.1g(5.9mmol),量取40ml二氧六环,依次加入双口烧瓶中充分搅拌溶解,再向其中加入2mol/l的k2co3水溶液5ml(10mmol),抽换气后用氩气吹扫混合物30分钟。在氩气保护下向混合物中加入pd(pph3)423mg(0.02mmol)。反应液在90℃的温度下加热并搅拌2小时后冷却至室温,用旋蒸仪旋蒸除去溶剂。残留物用水和二氯甲烷混合溶液(体积比为1:3)提取。收集有机相并用无水na2so4干燥。用旋蒸仪旋蒸除去溶剂后直接从乙酸乙酯中洗脱,得设计式1中间产物(式3-a)(823mg,2.1mmol,收率89%)。
[0092]
将上述产物用二氯甲烷溶解,然后向溶液中滴加液溴230μl(4.4mmol)。混合物在室温下搅拌30分钟后用2mol/lna2s2o4水溶液(10mmol)淬灭。残留物用水和二氯甲烷混合溶液(体积比为1:3)提取。收集有机相并用无水na2so4干燥。用旋蒸仪旋蒸除去溶剂后直接从乙酸乙酯中洗脱,得到式2-a(1.6g,收率为97%)。
[0093]
式2-a化合物通过核磁共振氢谱、碳谱、质谱、紫外可见光谱、单晶衍射等手段确认其结构。
[0094]1h nmr(400mhz,cdcl3)δ7.95(d,j=7.9hz,2h),7.91(d,j=7.9hz,4h),
[0095]
7.70(s,2h),7.56(t,j=7.5hz,4h),7.49(t,j=7.3hz,4h)。
[0096]
13
c nmr(100mhz,cdcl3)δ138.76,138.30,136.45,132.17,132.00,130.52,128.54,126.95,126.56,125.70,125.38,123.61,122.28,108.87。
[0097]
hrms m/z:calcd for c
26h14
br2s2[m]
+
549.8900;found 549.8321(error=-1.1
[0098]
ppm)。
[0099]
式1-a的合成
[0100]
化学合成法见设计式2:
[0101][0102]
在0℃下,将1.1ml正丁基锂的正己烷溶液(2.2mol/l,2.3mmol)滴加到30ml式2-a化合物的甲苯溶液(1.09mmol)中,保持0℃搅拌0.5h后加入2.4mlbbr3的正己烷溶液(1.0mol/l,2.4mmol),保持0℃搅拌1h。然后升温至110℃搅拌6h。反应完成后在0℃下向反应液中滴加均三甲苯基溴化镁的四氢呋喃溶液6.6ml(1.0mol/l,6.6mmol),然后缓慢升温至室温(25~30℃)搅拌1h。减压下旋蒸除去溶剂,粗品经柱层析(石油醚/ch2cl2=10:1)纯化,再经二氯甲烷重结晶,得到式1-a(289mg,收率41%)。
[0103]
对产物式1-a采用顶栅底接触的ofet器件结构进行性能测试。实验过程中使用的基底为玻璃衬底。首先,使用去离子水、丙酮、异丙醇对基底进行超声清洗各1min,清洗后用氩气枪迅速吹干表面残留的异丙醇溶液,接下来用紫外臭氧处理15min以进一步地洁净基底表面;然后使用蒸镀仪蒸镀40nm的金电极,真空度为3
×
10-4
pa,蒸镀速度为5a/s,并利用掩膜工艺控制源漏电极的形状;随后配置浓度为5mg/ml的式1-a的氯苯溶液,通过旋涂(1500rpm,20s)的方法制备薄膜;保持真空蒸镀仪真空度和蒸镀速度不变,再用蒸镀仪蒸镀一层cytop绝缘层,cytop的溶质与溶剂之比为3:1;最后蒸镀一层铝栅电极,厚度为100nm。根据漏极电流与栅极电压的平方根相对于栅极电压的关系图,在饱和状态下用如下公式计算出ofet的电荷载流子迁移率为1.49
×
10-3
cm
2 v-1
s-1
。
[0104][0105]
式1-a化合物通过核磁共振氢谱、碳谱、质谱、紫外可见光谱、单晶衍射等手段确认其结构。
[0106]
式1-a的发射光谱显示,化合物式1-a在可见光/近红外区有一个荧光带,最大荧光波长为680nm,荧光量子产率为8.0%,这表明激发态的式1-a具有一定的分子内电荷转移特性。
[0107]1h nmr(400mhz,cdcl3)δ8.24(s,2h),7.98(s,2h),7.87(d,j=7.8hz,2h),7.30(t,j=8.9hz,4h),7.17(t,j=7.4hz,2h),6.93(s,4h),2.41(s,6h),2.05(s,12h);
[0108]
13
c nmr(100mhz,cdcl3)δ159.63,144.47,142.09,139.76,138.14,137.13,133.38,127.82,127.19,125.62,125.36,124.78,121.94;
[0109]
11
b nmr(128mhz,cdcl3)δ32.42;hrms m/z:calcd for c
44h35
b2s2[m]
+
648.2300;found 648.2315(error=+0.3ppm)。
[0110]
对比例1
[0111]
式1-b的合成
[0112][0113]
与实施例1相比,区别仅在于用本案例的原料式5-b替换实施例1中的式5-a,其他操作步骤、参数控制均相同,粗产品用乙酸乙酯洗涤得到289mg纯白色产品产物1-b,收率为41%。由于产物1-b分子溶解性不好,造成旋涂的薄膜质量很差,这导致产物式1-a的电子传输特性较差。
[0114]
对比例2
[0115]
式2-a的合成
[0116][0117]
与实施例1相比,区别仅在于本例中用nbs代替液br2,分别在常温条件和加热条件下将nbs滴加到产物式3-a的二氯甲烷溶液中,但均未得到目标产物式2-a。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1