一种用于检测慢病毒感染滴度的组合物、检测试剂、检测试剂盒及ddPCR检测方法与流程
本发明涉及生物检测,特别是涉及一种用于检测慢病毒感染滴度的组合物、检测试剂、检测试剂盒及检测方法。
背景技术:
1、慢病毒已被广泛用作基因载体,与其他病毒载体相比,感染能力强,能够稳定地整合进目的细胞基因组中,以及可以感染分裂细胞和非分裂细胞。慢病毒滴度测定对于病毒制备工艺流程优化,以及后续慢病毒产品的应用至关重要。为此目的而开发的分析方法分为两大类:非功能性(物理效价)和功能性(感染效价)分析。非功能检测包括p24酶联免疫吸附法、基因组rna的northern印迹法、逆转录酶法等。这些检测方法的一个常见缺点是由于非功能性病毒颗粒的存在而高估了病毒效力。病毒颗粒可能由于缺乏病毒基因组(空)、低包膜蛋白、衣壳蛋白不平衡、基因组重排等原因而不具有感染性。
2、功能效价,或感染滴度,被定义为转导单个细胞所需的病毒颗粒数。感染滴度检测可以通过耐抗生素克隆的形成或特异标记的表达来实现。当慢病毒表达荧光报告蛋白如gfp时,流式细胞术(facs)是最直接的方法。然而,facs不能区分被单个或多个病毒感染的细胞。定量pcr(qpcr)通过测量每个宿主细胞基因组的原病毒dna拷贝数来检测病毒整合。为了确定每个细胞的整合病毒,必须用含有已知数量的标准品制备标准曲线。目前为止,基于qpcr的方法被认为是检测慢病毒感染效价的金标准,并在行业中广泛使用。但是,qpcr的方法也存在通量较小、耗时长等问题。
技术实现思路
1、鉴于以上所述现有技术的缺点,本发明的目的在于提供一种用于检测慢病毒感染滴度的组合物,用于解决现有技术中慢病毒感染滴度检测方法存在通量较小、耗时长的问题,同时,本发明还将提供一种用于检测慢病毒感染滴度的检测试剂、检测试剂盒;此外,本发明还将提供一种采用ddpcr技术检测慢病毒感染滴度的检测方法。本发明针对慢病毒wpre元件和宿主细胞alb内参基因,设计相应的引物探针组合,并在同一反应体系中使用双通道ddpcr检测,相对于wpre元件与alb内参基因在不同孔的两个反应体系的单通道检测,通量增加了一倍,并且避免了加样引起的误差。
2、为实现上述目的及其他相关目的,
3、本发明的第一方面,提供一种用于检测慢病毒感染滴度的组合物,所述组合物包括wpre引物探针组合和/或alb引物探针组合;
4、所述wpre引物探针组合包括wpre上游引物、wpre下游引物和wpre探针;
5、所述wpre上游引物为seq id no.1、4、7中的至少一种,或与seq id no.1、4、7序列具有至少90%同一性的同功能序列;
6、所述wpre下游引物为seq id no.2、5、8中的至少一种,或与seq id no.2、5、8序列具有至少90%同一性的同功能序列;
7、所述wpre探针为seq id no.3、6、9中的至少一种,或与seq id no.3、6、9序列具有至少90%同一性的同功能序列;
8、所述alb引物探针组合包括alb上游引物、alb下游引物和alb探针;
9、所述alb上游引物为seq id no.10、13中的至少一种,或与seq id no.10、13、序列具有至少90%同一性的同功能序列;
10、所述alb下游引物为seq id no.11、14中的至少一种,或与seq id no.11、14、序列具有至少90%同一性的同功能序列;
11、所述alb探针为seq id no.12、15中的至少一种,或与seq id no.12、15序列具有至少90%同一性的同功能序列。
12、本方法针对慢病毒wpre元件和宿主细胞alb内参基因,设计相应的引物探针组合,并在同一反应体系中使用双通道ddpcr检测,相对于wpre元件与alb内参基因在不同孔的两个反应体系的单通道检测,通量增加了一倍,并且避免了加样引起的误差。
13、于本发明的一实施例中,所述组合物包括wpre引物探针组合和alb引物探针组合。
14、于本发明的一实施例中,所述wpre上游引物为seq id no.1,所述wpre下游引物为seq id no.2;所述wpre探针为seq id no.3;
15、或,wpre上游引物为seq id no.4,所述wpre下游引物为seq id no.5;所述wpre探针为seq id no.6;
16、或,wpre上游引物为seq id no.7,所述wpre下游引物为seq id no.8;所述wpre探针为seq id no.9。
17、于本发明的一实施例中,针对所述wpre元件的检测,有3组wpre引物探针组合,每组wpre引物探针组合包括上游引物、下游引物和探针,或与这些序列具有至少95%同一性的同功能序列。上述wpre引物探针具体包括如下表1的引物、探针:
18、
19、
20、表1
21、于本发明的一实施例中,所述wpre探针的5`端用fam修饰,3`端用bhq1修饰;其中,fam表示荧光报告基团,bhq1表示淬灭基团。荧光报告基团包括但不限于fam,淬灭基团包括但不限于bhq1。
22、于本发明的一实施例中,所述alb上游引物为seq id no.10,所述alb下游引物为seq id no.11,所述alb探针为seq id no.12;
23、或,所述alb上游引物为seq id no.13,所述alb下游引物为seq id no.14,所述alb探针为seq id no.15。
24、于本发明的一实施例中,针对所述alb元件的检测,有2组alb引物探针组合,每组alb引物探针组合包括上游引物、下游引物和探针,或与这些序列具有至少95%同一性的同功能序列。上述alb引物探针具体包括如下表2的引物、探针:
25、
26、表2
27、于本发明的一实施例中,所述alb探针的5`端用vic修饰,3`端用bhq1修饰;其中,vic表示荧光报告基团,bhq1表示淬灭基团。荧光报告基团包括但不限于vic,淬灭基团包括但不限于bhq1。
28、于本发明的一实施例中,所述wpre上游引物为与seq id no.1、4、7序列具有至少90%同一性的同功能序列;
29、所述wpre下游引物为与seq id no.2、5、8序列具有至少90%同一性的同功能序列;
30、所述wpre探针为与seq id no.3、6、9序列具有至少90%同一性的同功能序列;
31、所述alb上游引物为与seq id no.10、13序列具有至少90%同一性的同功能序列;
32、所述alb下游引物为与seq id no.11、14序列具有至少90%同一性的同功能序列;
33、所述alb探针为与seq id no.12、15序列具有至少90%同一性的同功能序列。
34、于本发明的一实施例中,所述wpre上游引物为与seq id no.1、4、7序列具有至少95%同一性的同功能序列;
35、所述wpre下游引物为与seq id no.2、5、8序列具有至少95%同一性的同功能序列;
36、所述wpre探针为与seq id no.3、6、9序列具有至少95%同一性的同功能序列;
37、所述alb上游引物为与seq id no.10、13序列具有至少95%同一性的同功能序列;
38、所述alb下游引物为与seq id no.11、14序列具有至少95%同一性的同功能序列;
39、所述alb探针为与seq id no.12、15序列具有至少95%同一性的同功能序列。
40、本发明的第二方面,提供一种用于检测慢病毒感染滴度的检测试剂,所述检测试剂包括上述用于检测慢病毒感染滴度的组合物。
41、本发明的第三方面,提供一种用于检测慢病毒感染滴度的检测试剂盒,所述检测试剂盒包括上述用于检测慢病毒感染滴度的组合物,或所述检测试剂盒包括上述检测试剂。
42、本发明的第四方面,提供一种采用ddpcr技术检测慢病毒感染滴度的检测方法,包括如下步骤:
43、步骤一、将细胞经慢病毒样品感染,对感染后的细胞进行预处理;
44、步骤二、将细胞预处理产物加入ddpcr反应体系进行ddpcr扩增反应,测定wpre元件和内参基因alb的拷贝数,计算感染滴度即可;
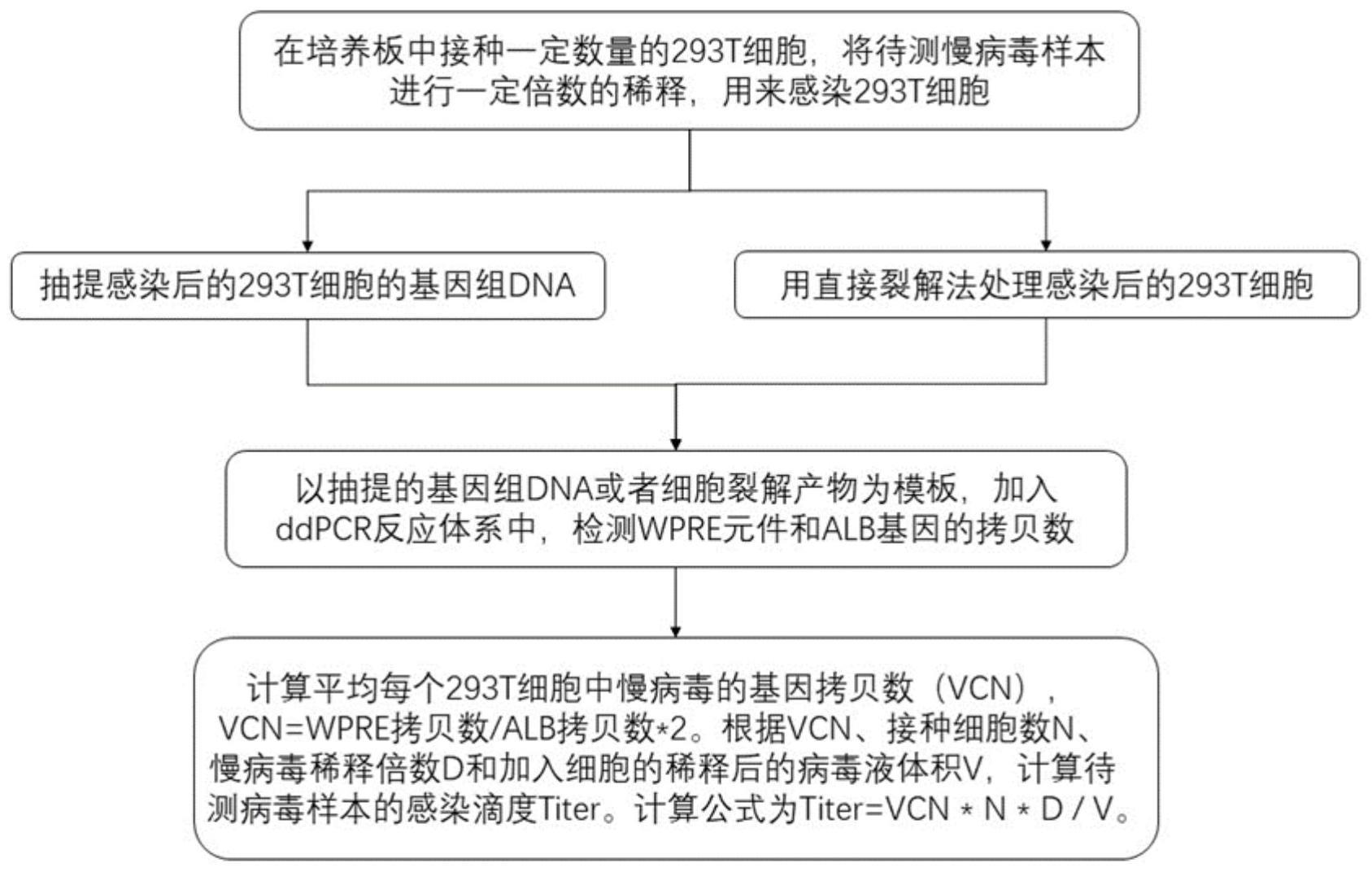
45、其中,所述ddpcr反应体系包括上述用于检测慢病毒感染滴度的组合物,或所述ddpcr反应体系包括上述检测试剂。
46、液滴数字pcr(ddpcr)是最近开发的一种技术,其功能是将pcr反应分成2万个纳升大小的微滴,在这些微滴中,pcr扩增独立进行。pcr后,对每个微滴进行荧光读取分析,确定pcr阳性和阴性微滴的数量,并通过泊松分布确定原反应中目标dna的拷贝数。
47、ddpcr反应体系中包括wpre引物探针组合和alb引物探针组合,在同一个ddpcr反应体系中同时进行两个目的片段的扩增,由此建立双通道ddpcr体系。
48、本发明涉及一种采用ddpcr技术检测慢病毒感染滴度的检测方法,微滴式数字聚合酶链式反应(ddpcr)是一种高灵敏度的定量检测方法,可以在不使用标准曲线的情况下定量基因的绝对拷贝数。
49、与qpcr相比,ddpcr的结果来自数万个数据点,而不是一个读数,因此不需要多次重复。此外,ddpcr不需要标准曲线,从而进一步简化了样品制备,改进了检测通量。另外,常规检测涉及待测慢病毒样品感染后的细胞的基因组dna提取,本发明提供了一种细胞直接裂解法,裂解产物可以直接用于ddpcr检测,因而具有通量大、操作简单、耗时短、成本低的优势。
50、于本发明的一实施例中,包括如下步骤:
51、步骤一、在细胞培养器皿中接种一定量的293t细胞,经过待测慢病毒样品感染;
52、步骤二、①提取感染后细胞的基因组dna,将基因组dna加入到ddpcr反应体系中,进行ddpcr检测;或②使用一种直接裂解的方法处理感染后的293t细胞,将得到的细胞裂解产物加入到ddpcr反应体系中,对裂解产物进行ddpcr检测;
53、步骤三、通过测定wpre元件和内参基因alb的拷贝数,计算平均每个293t细胞中慢病毒的基因拷贝数(vcn)。根据vcn和接种细胞数计算单位体积所述待测样品中慢病毒感染滴度。
54、于本发明的一实施例中,所述细胞为293t细胞。对于本发明的检测方法,可适用的细胞包括但不限于293t细胞。
55、于本发明的一实施例中,常规检测涉及待测慢病毒样品感染后的细胞的基因组dna提取。进一步地,提取感染后的细胞的基因组dna方法是:使用qiaamp dna mini kit,参考试剂盒说明书进行基因组dna提取。
56、于本发明的一实施例中,所述细胞裂解处理的具体过程为:将细胞裂解液与细胞混合后,依次在37~55℃孵育15~60min、80~95℃变性5~20min。
57、优选地,将细胞裂解液与细胞混合后,依次在55℃孵育1小时、80℃孵育10分钟。
58、于本发明的一实施例中,加入ddpcr反应体系中的,可以是细胞裂解产物原液,也可以是将细胞裂解产物进行一定倍数稀释后得到的细胞裂解产物稀释液。
59、于本发明的一实施例中,所述细胞裂解液包括如下组分:1~100mm的三羟甲基氨基甲烷盐酸盐(tris-hcl),0.001~1%的十二烷基硫酸钠(sds),50~500μg/ml的蛋白酶k。
60、于本发明的一实施例中,所述细胞裂解液包括如下组分:5~20mm的三羟甲基氨基甲烷盐酸盐,0.01~0.1%的十二烷基硫酸钠,200~300μg/ml的蛋白酶k。
61、于本发明的一实施例中,所述细胞裂解液包括如下组分:10mm的三羟甲基氨基甲烷盐酸盐,0.05%的十二烷基硫酸钠,250μg/ml的蛋白酶k。
62、本发明提供的细胞裂解液用于慢病毒感染滴度检测前处理,通过细胞裂解液将感染后的细胞直接裂解,裂解产物可以直接用于ddpcr检测,因而具有通量大、操作简单、耗时短、成本低的优势。
63、于本发明的一实施例中,所述ddpcr扩增反应包括如下步骤:
64、s1、将预处理细胞加入ddpcr反应体系中形成混合液,在90~100℃下预变性5~15min;
65、s2、将混合液在90~100℃下变性10~60s;
66、s3、将混合液在55~65℃下退火延伸0.5~2min;
67、s4、依次重复s2、s3,共计30~50个循环。
68、于本发明的一实施例中,所述ddpcr测定wpre元件和alb基因的拷贝数的步骤包括:
69、在所述ddpcr反应体系中添加wpre元件上游引物、wpre元件下游引物、wpre元件荧光探针,以及①提取的感染后细胞的基因组dna或②感染后细胞直接裂解产物,进行ddpcr检测过程,获得所述wpre元件的拷贝数;
70、在所述ddpcr反应体系中添加alb基因上游引物、alb基因下游引物、alb基因荧光探针,以及①提取的感染后细胞的基因组dna或②感染后细胞裂解产物,进行ddpcr检测过程,获得所述alb基因的拷贝数。
71、于本发明的一实施例中,通过测定wpre元件和内参基因alb的拷贝数,计算平均每个293t细胞中慢病毒的基因拷贝数(vcn),根据vcn和接种细胞数计算单位体积所述待测样品中慢病毒感染滴度。计算方式为:平均每个293t细胞中慢病毒的基因拷贝数(vcn)=wpre拷贝数/alb拷贝数×2。
72、于本发明的一实施例中,根据vcn、接种细胞数n、慢病毒稀释倍数d和加入细胞的稀释后的病毒液体积v,计算待测慢病毒样本的感染滴度titer。计算公式为titer=vcn*n*d/v。
73、如上所述,本发明的一种用于检测慢病毒感染滴度的组合物、检测试剂、检测试剂盒及ddpcr检测方法,具有以下有益效果:
74、1、本发明针对慢病毒wpre元件和宿主细胞alb内参基因,设计相应的引物探针组合,并在同一反应体系中使用双通道ddpcr检测,相对于wpre元件与alb内参基因在不同孔的两个反应体系的单通道检测,通量增加了一倍,并且避免了加样引起的误差。
75、2、本方法可选性的提供了感染慢病毒细胞的直接裂解处理方法,并将裂解产物用于ddpcr检测,相对于传统的抽提细胞dna的方法,极大的简化了操作程序,便于大通量的检测。
76、3、本方法使用的ddpcr检测技术,将pcr反应体系分割成万份以上的独立微滴,实现了单分子扩增,扩增完成后采用终点检测的方式,受pcr扩增效率的影响较小,因此可以容忍一定的pcr抑制物。
77、4、对于不能使用流式细胞仪检测的病毒滴度的测定,提供了有效的替代方案;由于ddpcr法使用的探针针对的是慢病毒载体的骨架区域,对于表达不同蛋白的慢病毒样品的感染滴度的横向工艺对比,提供了有效的检测方法。
- 还没有人留言评论。精彩留言会获得点赞!