一种与生物传感器集成的肠器官芯片、制备方法及应用
本发明涉及肠器官芯片,尤其涉及一种与生物传感器集成的肠器官芯片、制备方法及应用。
背景技术:
1、本部分的陈述仅仅是提供了与本发明相关的背景技术信息,不必然构成在先技术。
2、肠器官芯片(goc)在研究药物作用、微生物和人类疾病机制方面显示出巨大潜力。goc中的动态培养条件增加了肠道内皮屏障,有助于维持微生物组稳态并促进稳态条件下的代谢物转运。goc体外模型显示出克服传统细胞培养技术的许多局限性的希望。例如,具有机械刺激的goc可以促进人类肠道样绒毛突起的发育以及功能性粘液层的形成。
3、人结直肠细胞(caco-2)通常用于(>66%)不同的体外肠道平台,因为它们的结构和功能与分化的肠上皮细胞相似。研究表明,caco-2可在goc中形成绒毛样基底增殖性隐窝。与静态培养的caco-2相比,这种具有机械活性和微工程化的肠上皮在cyp3a4活性、葡萄糖再摄取和粘液分泌方面更接近体内肠道生理学。然而,细胞膜上分泌的载体和转运蛋白与体内肠上皮表达的载体和转运蛋白有显着差异。p-糖蛋白(p-gp)是顶端侧的一种外排转运蛋白,在caco-2细胞中过表达。这会减少药物的细胞摄取,导致多重耐药性。同样,caco-2细胞中出现低胆固醇分泌,这增加了细胞质膜的流动性。这可能导致癌胚抗原(cea)的过度表达流向基底膜外。cea是一种糖基磷脂酰肌醇锚定细胞表面糖蛋白。cea的过表达保护人结肠癌细胞免受由药物治疗、紫外线和融合生长引起的凋亡刺激。此外,cea相关细胞粘附分子6(cea-cam6)促进癌细胞的分化和侵袭,导致caco-2细胞在没有接触抑制的情况下无限增殖。为此,有必要探讨goc中caco-2细胞在不同生长分化时期分泌cea的差异和适用性,但是,现有的goc无法动态检测caco-2细胞分化过程中的cea分泌。
技术实现思路
1、为了解决上述问题,本发明提出了一种与生物传感器集成的肠器官芯片、制备方法及应用,能够动态检测caco-2细胞分化过程中的cea分泌,同时在检测cea分泌水平以及cea与caco-2细胞分化的关系的基础上,继续探讨caco-2细胞在构建goc中的适用性。
2、在一些实施方式中,采用如下技术方案:
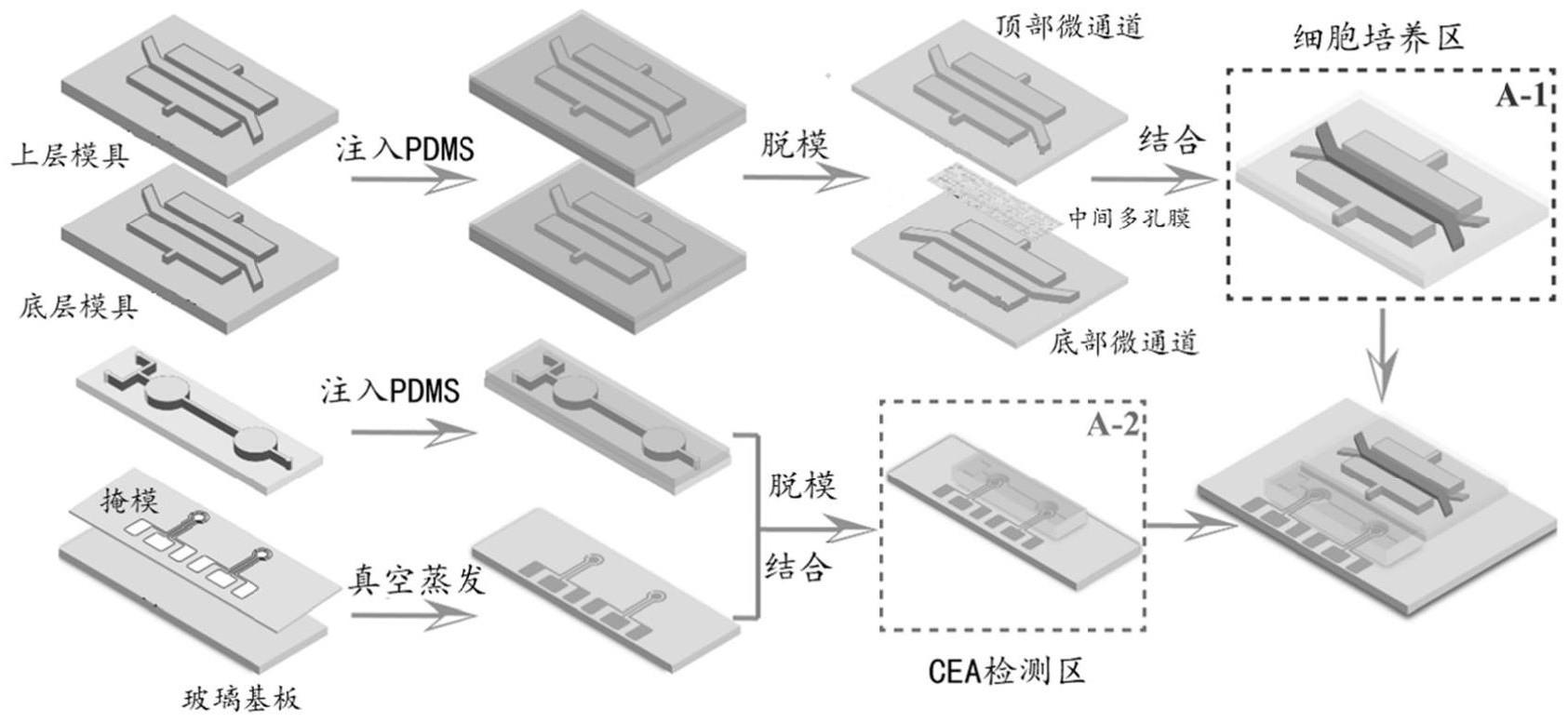
3、一种与生物传感器集成的肠器官芯片,包括:基底层,所述基底层上分别设有细胞培养区和cea检测区;
4、其中,所述细胞培养区包括顶部微通道和底部微通道,所述顶部微通道和底部微通道之间设有用于构建组织界面的中间多孔膜;
5、所述cea检测区包括至少两个腔室,生物传感器分别集成在所述腔室内,所述生物传感器经过功能化处理,使得在细胞培养区分泌的cea能够附着在生物传感器表面;cea检测区微通道依次穿过两个腔室;所述底部微通道与cea检测区微通道连通。
6、所述细胞培养区两侧设有真空腔,在所述真空腔内施加负压能够实现中间多孔膜的机械拉伸。
7、所述生物传感器工作电极的表面沉积金纳米颗粒,所述金纳米颗粒上分别经过mua/mpa和edc/nhs修饰,然后偶联癌胚抗原cea抗体。
8、将caco-2细胞培养液自细胞培养区的顶部微通道注入,caco-2细胞分泌的cea自中间多孔膜渗入底部微通道的培养液;按照设定的时间间隔将底部微通道的培养液送入cea检测区微通道;
9、培养液在流经cea检测区微通道时,cea能够附着在生物传感器的表面;每隔设定时间连续测定rct值的变化和cea浓度的变化;以确定cea与caco-2细胞分化的关系;
10、上述过程中,通过注射泵控制中间多孔膜进行机械拉伸,以模拟肠道运动。
11、在另一些实施方式中,采用如下技术方案:
12、一种与生物传感器集成的肠器官芯片的制备方法,包括:
13、制备肠器官芯片goc中细胞培养区的顶部微通道和底部微通道,在顶部微通道和底部微通道之间设置用于构建组织界面的中间多孔膜;
14、制备肠器官芯片goc中cea检测区的cea检测区微通道;所述cea检测区微通道包括了至少两个腔室;
15、在每一个腔室内分别集成生物传感器,对生物传感器进行功能化处理;
16、将底部微通道与cea检测区微通道连通;将顶部微通道、底部微通道和cea检测区微通道分别连接微流控装置。
17、作为进一步地方案,对生物传感器进行功能化处理,具体过程如下:
18、将设定量的haucl4注入检测区,在恒定电位下通过计时电流法将aunps电沉积在工作电极上,设定时间后使用无水乙醇排出并洗涤溶液;
19、灌注mua/mpa孵育设定时间,以使得羧基被引入到传感器的表面;溶液使用无水乙醇洗涤;其中mua和mpa的混合比例为7:3;
20、灌注edc/nhs孵育设定时间,以激活羧基并促进氨基与传感器上的羧基结合;溶液使用无水乙醇洗涤;其中,edc和nhs的混合比例为1:1;
21、灌注癌胚抗原cea抗体孵育设定时间,溶液使用无水乙醇洗涤。
22、作为进一步地方案,制备肠器官芯片goc中细胞培养区的顶部微通道和底部微通道,具体过程如下:
23、将pdms的基础弹性体和固化剂以设定比例混合;
24、脱气设定时间后,将pdms倒入具有微通道图案的模具中,在60℃-80℃温度下固化,分别制成微通道的顶层和底层,在顶部打孔;将顶层、中间多孔膜和底层依次通过氧等离子体结合在一起,形成以中间多孔膜为分隔的顶部微通道和底部微通道;同时在顶部微通道和底部微通道的中间位置形成真空腔。
25、作为进一步地方案,所述生物传感器的制备过程为:
26、使用超声波清洗机清洗玻璃基板,表面用氮气吹干;
27、使用氧等离子清洁器清洁玻璃表面,将带有图案的荫罩覆盖在玻璃基板上并放置在真空蒸发机中;
28、以cr作为金膜的粘合促进剂,将设定厚度的au通过使用真空蒸发沉积在玻璃上;从晶圆上剥离掩模后,即得所需的图案。
29、在另一些实施方式中,采用如下技术方案:
30、一种与生物传感器集成的肠器官芯片在动态检测caco-2细胞分化过程中的cea分泌中的应用。
31、与现有技术相比,本发明的有益效果是:
32、(1)本发明在肠器官芯片goc集成生物传感器,并对生物传感器进行功能化处理,使得肠器官芯片goc能够动态检测caco-2细胞分化过程中的cea分泌,同时在检测cea分泌水平以及cea与caco-2细胞分化的关系的基础上,继续探讨caco-2细胞在构建goc中的差异和适用性。
33、(2)本发明对生物传感器进行功能化处理的过程,能够有效提高传感器检测cea的稳定性和灵敏度。
34、本发明的其他特征和附加方面的优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本方面的实践了解到。
技术特征:
1.一种与生物传感器集成的肠器官芯片,其特征在于,包括:基底层,所述基底层上分别设有细胞培养区和cea检测区;
2.如权利要求1所述的一种与生物传感器集成的肠器官芯片,其特征在于,所述细胞培养区两侧设有真空腔,在所述真空腔内施加负压能够实现中间多孔膜的机械拉伸。
3.如权利要求1所述的一种与生物传感器集成的肠器官芯片,其特征在于,所述生物传感器工作电极的表面沉积金纳米颗粒,所述金纳米颗粒上分别经过mua/mpa和edc/nhs修饰,然后偶联癌胚抗原cea抗体。
4.如权利要求1所述的一种与生物传感器集成的肠器官芯片,其特征在于,所述顶部微通道、底部微通道和cea检测区微通道分别通过细管连接至微流控装置。
5.如权利要求1所述的一种与生物传感器集成的肠器官芯片,其特征在于,将caco-2细胞培养液自细胞培养区的顶部微通道注入,caco-2细胞分泌的cea自中间多孔膜渗入底部微通道的培养液;按照设定的时间间隔将底部微通道的培养液送入cea检测区微通道;
6.一种与生物传感器集成的肠器官芯片的制备方法,其特征在于,包括:
7.如权利要求6所述的一种与生物传感器集成的肠器官芯片的制备方法,其特征在于,对生物传感器进行功能化处理,具体过程如下:
8.如权利要求6所述的一种与生物传感器集成的肠器官芯片的制备方法,其特征在于,制备肠器官芯片goc中细胞培养区的顶部微通道和底部微通道,具体过程如下:
9.如权利要求6所述的一种与生物传感器集成的肠器官芯片的制备方法,其特征在于,所述生物传感器的制备过程为:
10.一种与生物传感器集成的肠器官芯片在动态检测caco-2细胞分化过程中的cea分泌中的应用。
技术总结
本发明公开了一种与生物传感器集成的肠器官芯片、制备方法及应用,包括:基底层,基底层上分别设有细胞培养区和CEA检测区;细胞培养区包括顶部微通道和底部微通道,顶部微通道和底部微通道之间设有用于构建组织界面的中间多孔膜;CEA检测区包括至少两个腔室,生物传感器分别集成在腔室内,生物传感器经过功能化处理,使得在细胞培养区分泌的CEA能够附着在生物传感器表面;底部微通道与CEA检测区微通道连通。本发明能够动态检测Caco‑2细胞分化过程中的CEA分泌,同时在检测CEA分泌水平以及CEA与Caco‑2细胞分化的关系的基础上,继续探讨Caco‑2细胞在构建GOC中的差异和适用性。
技术研发人员:王力,韩军磊,陈俊,赵秀华,肖光春,许崇海
受保护的技术使用者:齐鲁工业大学(山东省科学院)
技术研发日:
技术公布日:2024/1/13
- 还没有人留言评论。精彩留言会获得点赞!