一种基因修饰的CAR-NK细胞及其制备方法和应用与流程
本发明涉及一种基因修饰的car-nk细胞及其制备方法和应用,属于遗传工程。
背景技术:
1、近年来,以特异性抗肿瘤免疫疗法为首的细胞生物治疗己经初露锋芒,成为肿瘤生物治疗中重要的发展方向。自然杀伤细胞(natural killer cell,nk细胞),是除t细胞、b细胞之外的第三大类淋巴细胞,不仅与抗肿瘤、抗病毒感染和免疫调解有关,甚至参与超敏反应和自身免疫性疾病的发生。nk细胞无需抗原致敏就可直接杀伤肿瘤和病毒感染的靶细胞,而且无mhc限制性,应答速度快,在机体抗肿瘤和抗感染免疫早期即可发挥作用。
2、nk细胞的主要缺点是其在缺乏细胞因子支持的情况下,过继转移后缺乏持久性。肿瘤微环境的存在,也使得利用nk细胞治疗实体肿瘤仍然是一个挑战,它会损害nk细胞的功能,抑制其发挥免疫作用。因此,工程改造nk细胞以表达细胞因子来增强其持久性对它们的临床活性很重要。
3、cn113518821a将il-15、il-15r、il-12、il-12r中的至少一种外源核酸表达在淋巴细胞中,并使tgfβr2、cish、tigit、adora2a、或nkg2a其中至少一种功能丧失,但其实验结果中只给出了部分实验方案的数据,无法判断其余实验方案的效果。cn112292390a专利中提供了表达il-15和敲除cish的nk细胞,其主要给出的是car-cd19的数据,且敲除的是cish基因。cn113518826a专利中提供了敲除tgfβr2的nk细胞,不涉及双基因敲除。
4、lewis y抗原属于a、b、h、lewis血型家族,为ii型h物质,在人的多种上皮组织癌细胞中,如肺癌、结肠癌、卵巢癌和前列腺癌,都有lewis y抗原的非正常高表达。而健康人的lewis y抗原仅在含有上皮细胞的少数组织中以相对较低的水平表达。因此,lewisy抗原被认为是肿瘤相关抗原,是基于car-t治疗的一个有希望的靶点。
5、现有技术中有针对nk细胞进行双敲除免疫抑制因子和表达细胞因子,并进行car修饰,制备car-nk细胞的报告,但是在上述基础上,再结合lewis y单链抗体的,并未有报道。
技术实现思路
1、针对现有技术存在的不足,本发明提供一种基因修饰的car-nk细胞及其制备方法和应用,实现以下发明目的:针对nk细胞进行双敲除tigit和adora2a免疫抑制因子,同时表达il-18细胞因子,并结合lewis y单链抗体,进行car修饰,制备的car-nk细胞,对肿瘤细胞的杀伤率高;在于靶细胞共培养时,可以释放更多的tnf-α、ifn–r。
2、与现有技术相比,本发明采取以下技术方案:
3、一种基因修饰的car-nk细胞,采用含car-lewis-y的重组表达载体感染通用型nk细胞得到car-nk细胞;所述通用型nk细胞为敲除tigit基因和敲除adora2a基因,并表达il-18的nk细胞。
4、所述car-lewis-y的核苷酸序列如序列表中seq id no.6所示。
5、所述car-lewis-y由以下模块组成:leader、lewis-y单链抗体、cd8 hinge区、cd8跨膜区、cd28共刺激区、4-1bb共刺激区、cd3ζ信号传导区。
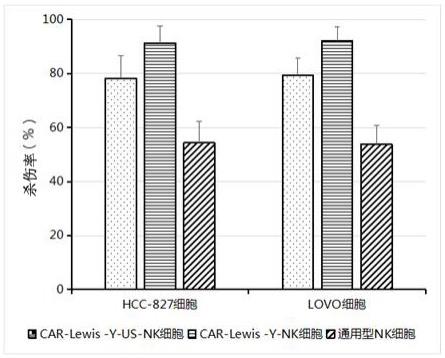
6、所述敲除tigit基因采用的sgrna的核苷酸序列如序列表中seq id no.1所示;所述敲除adora2a基因采用的sgrna的核苷酸序列如序列表中seq id no.3所示;所述il-18的核苷酸序列为序列表中seq id no.5所示。
7、所述制备方法包括制备敲除tigit和adora2a基因的nk细胞、制备表达il-18的双敲除nk细胞、含car-lewis-y的重组表达载体感染通用型nk细胞。
8、所述制备敲除tigit和adora2a基因的nk细胞的方法为:将敲除adora2a基因采用的sgrna和敲除adora2a基因采用的sgrna,同时连接到px458载体中,获得含有双靶点tigitsgrna1和adora2a sgrna1的重组载体px458-ti-ad-1,将该重组载体电转染到nk细胞中,得到敲除tigit和adora2a基因的nk细胞。
9、所述制备表达il-18的双敲除nk细胞的方法为:将il-18连接到plent-ef1α载体上,得到plent-ef1α-il-18,对其进行慢病毒包装后,感染敲除tigit和adora2a基因的nk细胞,得到表达il-18的双敲除nk细胞,即通用型nk细胞。
10、所述含car-lewis-y的重组表达载体感染通用型nk细胞的方法为:将含car-lewis-y的重组表达载体进行慢病毒包装后,感染通用型nk细胞,得到car-nk细胞。
11、所述的car-nk细胞在制备治疗抗肿瘤药物中的应用。
12、与现有技术相比,本发明取得以下有益效果:
13、(1)本发明制备的car-lewis-y-nk细胞,与靶细胞hcc-827混合培养72h后,细胞因子tnf-α的分泌量为2745 pg/ml,细胞因子ifn-γ的分泌量为3067 pg/ml,与靶细胞lovo混合培养72h后,细胞因子tnf-α的分泌量为2967pg/ml,细胞因子ifn-γ的分泌量为3557pg/ml。
14、(2)本发明制备的car-lewis-y-nk细胞对hcc-827细胞的杀伤率为91.3%,对lovo细胞的杀伤率为92.1%。
15、(3)本发明制备的car-lewis-y-nk细胞,可以明显减小肿瘤的体积。
技术特征:
1.一种基因修饰的car-nk细胞,其特征在于:采用含car-lewis-y的重组表达载体感染通用型nk细胞得到car-nk细胞;所述通用型nk细胞为敲除tigit基因和敲除adora2a基因,并表达il-18的nk细胞。
2. 根据权利要求1所述的一种基因修饰的car-nk细胞,其特征在于:所述car-lewis-y的核苷酸序列如序列表中seq id no.6所示。
3. 根据权利要求1所述的一种基因修饰的car-nk细胞,其特征在于:所述car-lewis-y由以下模块组成:leader、lewis-y单链抗体、cd8 hinge区、cd8跨膜区、cd28共刺激区、4-1bb共刺激区、cd3ζ信号传导区。
4. 根据权利要求1所述的一种基因修饰的car-nk细胞,其特征在于:所述敲除tigit基因采用的sgrna的核苷酸序列如序列表中seq id no.1所示;所述敲除adora2a基因采用的sgrna的核苷酸序列如序列表中seq id no.3所示;所述il-18的核苷酸序列为序列表中seqid no.5所示。
5.权利要求1所述car-nk细胞的制备方法,其特征在于:所述制备方法包括制备敲除tigit和adora2a基因的nk细胞、制备表达il-18的双敲除nk细胞、含car-lewis-y的重组表达载体感染通用型nk细胞。
6. 权利要求5所述car-nk细胞的制备方法,其特征在于:所述制备敲除tigit和adora2a基因的nk细胞的方法为:将敲除adora2a基因采用的sgrna和敲除adora2a基因采用的sgrna,同时连接到px458载体中,获得含有双靶点tigit sgrna1和adora2a sgrna1的重组载体px458-ti-ad-1,将该重组载体电转染到nk细胞中,得到敲除tigit和adora2a基因的nk细胞。
7.权利要求6所述car-nk细胞的制备方法,其特征在于:所述制备表达il-18的双敲除nk细胞的方法为:将il-18连接到plent-ef1α载体上,得到plent-ef1α-il-18,对其进行慢病毒包装后,感染敲除tigit和adora2a基因的nk细胞,得到表达il-18的双敲除nk细胞,即通用型nk细胞。
8.权利要求7所述car-nk细胞的制备方法,其特征在于:所述含car-lewis-y的重组表达载体感染通用型nk细胞的方法为:将含car-lewis-y的重组表达载体进行慢病毒包装后,感染通用型nk细胞,得到car-nk细胞。
9.权利要求1所述的car-nk细胞在制备治疗抗肿瘤药物中的应用。
技术总结
本发明提供一种基因修饰的CAR‑NK细胞及其制备方法和应用,属于遗传工程技术领域;采用含CAR‑Lewis‑Y的重组表达载体感染通用型NK细胞得到CAR‑NK细胞;所述通用型NK细胞为敲除TIGIT基因和敲除ADORA2A基因,并表达IL‑18的NK细胞;本发明还提供上述CAR‑NK细胞的制备方法及其应用。本发明制备的CAR‑Lewis‑Y‑NK细胞,与靶细胞HCC‑827混合培养72h后,细胞因子TNF‑α和IFN‑γ的分泌量明显增加。本发明制备的CAR‑Lewis‑Y‑NK细胞对HCC‑827细胞的杀伤率为91.3%,对LOVO细胞的杀伤率为92.1%。
技术研发人员:刘明录,郭爱萍,强邦明,张传鹏,王海燕,金海锋,王立新,冯建海
受保护的技术使用者:山东兴瑞生物科技有限公司
技术研发日:
技术公布日:2024/1/13
- 还没有人留言评论。精彩留言会获得点赞!