基于联萘酚基元的一系列手性超分子大环及制备方法与应用
本发明涉及手性和超分子化学领域,特别涉及一系列新型手性超分子主体大环的制备方法及其在手性对映体识别和区分中的应用。
背景技术:
1、手性识别广泛存在于自然界中,是生物分子通过立体特异性底物识别调控生理功能的基本模式,开发具有高选择性和高灵敏度的手性识别受体在药物分析、疾病诊断以及食品科学等领域中起着重要的作用(liu, y.; wu, z.; armstrong, d. w.; wolosker,h.; zheng, y. detection and analysis of chiral molecules as diseasebiomarkers. nat. rev. chem. 2023, 7, 355–373),同时是超分子化学的重要课题之一。大环是超分子化学的重要结构基元之一,其凭借独特的预组织空腔,可以协调多种非共价相互作用,已成为有效识别特定客体的主要工具。而通过对手性微环境进行微调,可以构建具有手性腔的大环,(jiao, j.; dong, j.; li, y.; cui, y. fine-tuning of chiralmicroenvironments within triple-stranded helicates for enhancedenantioselectivity. angew. chem. int. ed. 2021, 60, 16568–16575)进一步实现手性识别能力。众所周知,生命活动中的分子识别主要是基于水相来进行的,研究水相中大环受体的手性识别不仅有助于理解复杂生物体系中的手性识别行为,同时为对映体选择性识别、传感和拆分提供新的策略方法(han, x.-n.; li, p.-f.; han, y.; chen, c.-f.enantiomeric water-soluble octopus[3]arenes for highly enantioselectiverecognition of chiral ammonium salts in water. angew. chem. int. ed. 2022, 61,e202202527.)。尽管超分子化学家在设计大量新型手性大环主体方面取得了显著进展,但人工合成受体在水中的手性识别仍存在困难:首先,对映体选择性低(一般<3),且结合强度不高(<106m−1),限制了它们在传感和检测生物流体、食品或污水中痕量手性底物方面的潜在应用。其次,构建新的手性大环通常需要昂贵的手性柱分离,这对可扩展性和实际实施提出了挑战。因此,开发具有优异对映选择性、高亲和力和易于合成的手性大环仍然是超分子化学领域的一个重大挑战。本发明的优点是:大环合成简便,产率高,修饰方便,具有不对称发光性质,对多种非手性或手性客体具有高亲和力或高对映选择性,并在甾类化合物的传感监测等方面具有广阔的应用前景。
技术实现思路
1、本发明提供了一系列基于联萘酚基元的新型手性大环分子,解决了超分子领域中手性大环合成复杂、普遍结合不强、对映选择性不高的问题,从而能够实现高效、经济的手性大环的合成,分子识别与传感检测。
2、得到的水溶大环分子对非手性分子具有高亲和力识别作用,对手性分子具有高对映识别选择性,其中通过对甾类化合物进行的荧光阵列传感检测,实现了对14种甾类化合物的区分。
3、 本发明目的是针对手性大环合成路线繁琐、产率低、大多数需要进一步进行昂贵的手性hplc拆分、以及对映选择性和高亲和力普遍较低等问题,提供了一种简便、高效的合成手性大环的方法,得到了一系列手性大环,该方法用手性1,1′-联-2,2′-萘酚 (binol)为反应物单体,过渡金属试剂ni(cod)2为催化剂的yamamoto偶联反应一锅法高产率合成一系列多聚体超分子大环,并且能够进一步水解,得到水溶性超分子大环。其中水溶手性大环对金刚烷(g2,市售)、黄藤素(g8,市售)等分子具有高亲和力,对spinol(市售)等分子具有高对映选择性,并能够通过荧光传感检测实现对14种甾类化合物的区分。
4、本发明同时保护一系列基于联萘酚基元的手性大环分子的制备方法。
5、本发明同时保护一系列基于联萘酚基元的手性大环分子的制备方法和其在手性和非手性分子识别和检测的应用。
6、本发明公开的技术内容如下:
7、基于联萘酚基元的一系列手性超分子大环,其结构通式如下:
8、
9、其中:
10、【1】当结构通式中 部分的立体构象为 时,且
11、(1)n=2,r’ = ch2och3:为大环 rr-1
12、(2)n=3,r’ = ch2och3:为大环 rrr-1
13、(3)n=3,r’ = ch2cooch2ch3:为大环 rrr-2
14、(4)n=4,r’ = ch2och3:为大环 rrrr-1
15、(5)n=4,r’ = ch2cooch2ch3:为大环 rrrr-2
16、(6)n=4,r’ = ch2coona:为大环 rrrr-3
17、(7)n=4,r’ = ch2cooh:为大环 rrrr-4
18、【2】当结构通式中 部分的立体构象为 时,且
19、(1)n=2,r’ = ch2och3:为大环 ss-1
20、(2)n=3,r’ = ch2och3:为大环 sss-1
21、(3)n=3,r’ = ch2cooch2ch3:为大环 sss-2
22、(4)n=4,r’ = ch2och3:为大环 ssss-1
23、(5)n=4,r’ = ch2cooch2ch3:为大环 ssss-2
24、(6)n=4,r’ = ch2coona:为大环 ssss-3
25、(7)n=4,r’ = ch2cooh:为大环 ssss-4
26、本发明进一步公开了基于联萘酚基元的一系列手性超分子大环,其中大环 rr-1, rrr-1, rrrr-1其制备方法如下:
27、将ni(cod)2(市售,0.46 mmol~0.66 mmol),cod(市售,0.55 mmol~0.75 mmol),2,2'-联吡啶(市售,0.48 mmol~0.68 mmol),甲苯(0.2 ml~0.4 ml)和dmf(0.2 ml~0.4 ml)装入schlenk管,在n2气氛下于90 ℃搅拌30~50 min。然后加入溶解在2 ml~4 ml甲苯中的 r-2(0.12~0.34mmol),并将混合物在90 ℃下搅拌24~72小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法纯化,ch2cl2/etoac溶剂比例为1/0~20/1,得到白色固体的目标手性大环化合物 rr-1, rrr-1和 rrrr-1。
28、一系列手性超分子大环 ss-1, sss-1, ssss-1其制备方法如下:
29、将ni(cod)2(市售,0.46 mmol~0.66 mmol),cod(市售,0.55 mmol~0.75 mmol),2,2'-联吡啶(市售,0.48 mmol~0.68 mmol),甲苯(0.2 ml~0.4 ml)和dmf(0.2 ml~0.4 ml)装入schlenk管,在n2气氛下于90 ℃搅拌30~50 min。然后加入溶解在2 ml~4 ml甲苯中的 s-2(0.12~0.34mmol),并将混合物在90 ℃下搅拌24~72小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法纯化,ch2cl2/etoac溶剂比例为1/0~20/1,得到白色固体的目标手性大环化合物 ss-1, sss-1和 ssss-1。
30、一系列手性超分子大环 rrr-2和 rrrr-2其制备方法如下:
31、将ni(cod)2(市售,0.46 mmol~0.66 mmol),cod(市售,0.55 mmol~0.75 mmol),2,2'-联吡啶(市售,0.48 mmol~0.68 mmol),甲苯(0.2 ml~0.4 ml)和dmf(0.2 ml~0.4 ml)装入schlenk管,在n2气氛下于90 ℃搅拌30~50 min。然后加入溶解在2 ml~4 ml甲苯中的 r-3(0.12~0.34mmol),并将混合物在90 ℃下搅拌24~72小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法纯化,ch2cl2/etoac溶剂比例为1/0~20/1,得到白色固体的目标手性大环化合物 rrr-2和 rrrr-2。
32、一系列手性超分子大环 sss-2和 ssss-2其制备方法如下:
33、将ni(cod)2(市售,0.46 mmol~0.66 mmol),cod(市售,0.55 mmol~0.75 mmol),2,2'-联吡啶(市售,0.48 mmol~0.68 mmol),甲苯(0.2 ml~0.4 ml)和dmf(0.2 ml~0.4 ml)装入schlenk管,在n2气氛下于90 ℃搅拌30~50 min。然后加入溶解在2 ml~4 ml甲苯中的 s-3(0.12~0.34 mmol),并将混合物在90 ℃下搅拌24~72小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法纯化,ch2cl2/etoac溶剂比例为1/0~20/1,得到白色固体的目标手性大环化合物 sss-2和 ssss-2。
34、手性超分子大环 rrrr-3和 rrrr-4其制备方法如下:
35、将 rrrr-2(0.027 mmol)、20% naoh水溶液(1 ml~2 ml)、thf(1 ml~2 ml)、ch3oh(1ml~2 ml)的混合物在90 ℃下搅拌12 h~24 h。混合物在减压下蒸发。粗产物通过球形c18硅胶柱色谱法纯化(h2o至h2o/ch3cn = 10/1),得到目标化合物白色固体 rrrr-3。将100mg rrrr-3固体溶于水,加入10~20 ml 1m的盐酸,搅拌10~20 min后,将析出的白色沉淀抽滤,并于用10~20 ml 1m的盐酸洗涤,得到的滤渣即为目标化合物白色固体 rrrr-4。
36、手性超分子大环 ssss-3和 ssss-4,其合成步骤如下:
37、将 ssss-2(0.027 mmol)、20% naoh水溶液(1 ml~2 ml)、thf(1 ml~2 ml)、ch3oh(1ml~2 ml)的混合物在90 ℃下搅拌12 h~24 h。混合物在减压下蒸发。粗产物通过球形c18硅胶柱色谱法纯化(h2o至h2o/ch3cn = 10/1),得到目标化合物白色固体 ssss-3,将100mg ssss-3固体溶于水,加入10~20 ml 1m的盐酸,搅拌10~20 min后,将析出的白色沉淀抽滤,并于用10~20 ml 1m的盐酸洗涤,得到的滤渣即为目标化合物白色固体 ssss-4。
38、其合成步骤如下:
39、
40、
41、其中 r-1的合成参考文献(y. nojima, m. hasegawa, n. hara, y. imai, y.mazaki, chem. commun. 2019, 55, 2749–2752)
42、本发明进一步公开了基于联萘酚基元的一系列手性超分子大环在用于通过对手性和非手性分子进行识别方面的应用。实验结果显示:通过对手性和非手性分子进行识别,用来达到检测的应用;特别是通过荧光阵列传感,进行甾类的识别和传感,对甾类化合物进行区分,可以达到对14种甾类化合物的区分。
43、本发明同时保护一系列基于联萘酚基元的新型手性大环分子的制备方法和其在甾类传感中的应用。
44、本发明的工作原理:合成的水溶手性大环与客体之间具有疏水作用、静电作用等非共价相互作用,使大环对很多非手性客体(如金刚烷、黄藤素)具有高亲和力,对特定手性客体(如spinol)具有高对映选择性,因而能够对特定化合物实现识别和检测,除此之外,通过荧光阵列传感实现了对14种甾类化合物的区分。
45、一系列基于binol骨架的手性大环,结构如下:
46、
47、a. 一系列基于binol骨架的新型手性大环 rr-1, rrr-1和 rrrr-1,合成方法如下:
48、(1)将化合物 r-1(1 g)和thf(30 ml)的混合物在0 ℃下搅拌10 min,向混合物中加入nah(市售),在0 ℃下继续搅拌10 min,向混合物中加入溴甲基甲基醚(市售),室温反应12小时。用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2)纯化,得到白色固体的目标化合物 r-2(2.0 g,3.2 mmol)。
49、 1h nmr (400 mhz, cdcl3, 298 k) of r-2: δ h= 7.93 (d, j= 9.0 hz, 2h),7.75 (d, j= 8.7 hz, 2h), 7.60 (d, j= 9.0 hz, 2h), 7.43 (dd, j= 8.7, 2.0 hz, 2h),7.30 (d, j= 1.9 hz, 2h), 7.26 (s, 2h), 5.13 (d, j= 6.9 hz, 2h), 4.99 (d, j= 7.0hz, 2h), 3.21 (s, 6h).
50、(2)将含有ni(cod)2(市售)(384mg,1.4 mmol),cod(市售)(0.2ml,1.63 mmol),2,2'-联吡啶(市售)(224 mg,1.43 mmol),甲苯(1.1 ml)和dmf(1.1 ml)的schlenk管在n2气氛下于90 ℃搅拌30分钟。然后加入溶解在甲苯(5.4 ml)中的 r-2,并将混合物在90 °c下搅拌24小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2/etoac = 20/1)纯化,得到白色固体的目标手性大环化合物 rr-1, rrr-1和 rrrr-1
51、1h nmr (400 mhz, cdcl3, 298 k) of rr-1: δ h =7.88 (d, j = 9.0 hz, 4h),7.72 (d, j = 8.2 hz, 4h), 7.54 (d, j = 9.0 hz, 4h), 7.23 (dd, j = 8.3, 1.5hz, 4h), 6.95 (s, 4h), 5.07 (d, j = 6.6 hz, 4h), 4.92 (d, j = 6.6 hz, 4h),3.21 (s, 12h).
52、1h nmr (400 mhz, cdcl3, 298 k) of rrr-1: δ h = 7.83 (d, j = 9.0 hz, 6h),7.65 (d, j = 8.4 hz, 6h), 7.52 (d, j = 9.0 hz, 6h), 7.10 (d, j = 8.4 hz, 6h),6.91 (s, 6h), 5.20 (d, j = 6.8 hz, 6h), 4.98 (d, j = 6.8 hz, 6h), 3.11 (s,18h).
53、1h nmr (400 mhz, cdcl3, 298 k) of rrrr-1: δ h = 7.84 (d, j = 9.0 hz,8h), 7.65 (d, j = 8.5 hz, 8h), 7.54 (d, j = 9.0 hz, 8h), 7.35 (s, 8h), 7.22(d, j = 8.9 hz, 8h), 5.09 (d, j = 6.8 hz, 8h), 5.01 (d, j = 6.8 hz, 8h), 3.12(s, 24h).
54、b. 一系列基于binol骨架的新型手性大环 rrr-2和 rrrr-2,合成方法如下:
55、(1)将化合物 r-1(1.5g,3.4mmol,其合成参考文献y. nojima, m. hasegawa, n.hara, y. imai, y. mazaki, chem. commun. 2019, 55, 2749–2752)、cs2co3(8.8 g,27.2mmol)、溴乙酸乙酯(市售)(1.1 ml,10 mmol)和dmf(20 ml)的混合物在40 ℃下搅拌24小时。向混合物中加入饱和nh4cl溶液中,用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2)纯化,得到白色固体的目标化合物 r-3(2.0 g,3.2 mmol)。
56、 1h nmr (400 mhz, cdcl3, 298 k) of r-3: δ h= 7.92 (d, j= 9.0 hz, 2h),7.73 (d, j= 8.7 hz, 2h), 7.43 (dd, j1= 8.4 hz, j2= 1.8 hz, 2h), δ 7.34 (s, 2h),7.32 (d, j= 9.0 hz, 2h), 4.57 (m, 4h), 4.16 (m, 4h), 1.18 (t, j= 7.1 hz, 6h).13cnmr (100 mhz, cdcl3, 298 k) of r-3: δ c= 167.92, 153.25, 134.10, 128.91, 128.65,127.08, 126.64, 126.33, 120.37, 117.57, 114.14, 65.66, 60.17, 13.07. hr-esi-ms: calculated for c28h24br2nao6([ m+na]+): 638.9812; found 638.9813.
57、(2)将含有ni(cod)2(市售)(154 mg,0.56 mmol)、cod(市售)(70 mg,0.65 mmol),2,2'-联吡啶(市售)(90 mg,0.58 mmol)和甲苯(0.3 ml)和dmf(0.3 ml)的schlenk管在n2气氛下于90 ℃搅拌30分钟。然后加入溶解在甲苯(2.4 ml)中的 r-3,并将混合物在90 ℃下搅拌24小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2/etoac = 20/1)纯化,得到白色固体的目标手性大环化合物 rrr-2(23.9 mg,0.013 mmol)和 rrrr-2(21.6 mg,0.012 mmol)
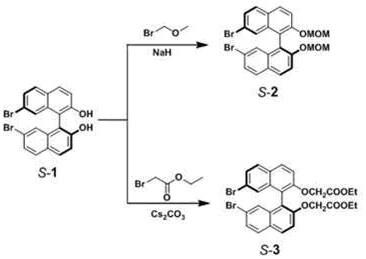
58、1h nmr (400 mhz, cdcl3, 298 k) of rrr-2: δ h =7.82 (d, j = 9.1 hz, 6h),7.64 (d, j = 8.4 hz, 6h), 7.29 (d, j = 9.2 hz, 6h), 7.25 (d, j = 8.4 hz, 6h),6.95 (s, 6h), 4.62–4.51 (m, 12h), 4.14 (q, j = 7.1 hz, 12h), 1.18 (t, j = 7.1hz, 18h).
59、1h nmr (400 mhz, cdcl3, 298 k) of rrrr-2: δ h= 7.84 (d, j= 9.0 hz, 8h),7.64 (d, j= 8.5 hz, 8h), 7.37 (s, 8h), 7.31 (d, j= 8.7 hz, 8h), 7.29 (d, j= 9.0hz, 8h), 4.52 (dd, j1= 18.8 hz, j2= 16.4 hz, 16h), 4.11 (q, j = 7.1 hz, 16h),1.14 (t, j= 7.1 hz, 24h).13c nmr (100 mhz, cdcl3, 298 k) of rrrr-2: δ c= 168.31,152.86, 137.38, 132.90, 128.26, 127.94, 127.03, 122.92, 122.29, 119.47,114.29, 66.11, 59.96, 13.00. hr-esi-ms: calculated for c112h96nao24([ m+na]+):1848.6218; found 1848.6212.
60、c. 基于binol骨架的新型手性大环 rrrr-3和 rrrr-4,合成方法如下:
61、(1)将 rrrr-2(50 mg,0.027 mmol)、20% naoh水溶液(1.0 ml)、thf(1.0 ml)、ch3oh(1.8 ml)的混合物在90 ℃下搅拌过夜。混合物在减压下蒸发。粗产物通过球形c18硅胶柱色谱法纯化(h2o至h2o/ch3cn = 10/1),得到目标化合物白色固体 rrrr-3(47 mg,0.027 mmol), 将100 mg固体 rrrr-3溶于水,加入10 ml 1m的盐酸,搅拌10 min后,将析出的白色沉淀抽滤,并于用10 ml 1m的盐酸洗涤,得到的滤渣即为目标化合物白色固体 rrrr-4。1h nmr (400 mhz, cdcl3, 298 k) of rrrr-3: δ h= 8.05 (d, j= 9.2 hz, 8h), 7.76(d, j= 8.5 hz, 8h), 7.40 (d, j= 9.2 hz, 8h), 7.25 (s, 8h), 7.22 (d, j= 8.5 hz,8h), 4.50 (d, j= 16.3 hz, 8h), 4.39 (d, j= 16.3 hz, 8h).13c nmr (100 mhz, cdcl3,298 k) of rrrr-3: δ c= 176.88, 166.63, 154.32, 132.83, 129.86, 128.28, 123.58,123.11, 118.76, 115.52, 68.97, 23.30. hr-esi-ms: calculated for c96h59nao24([ m-7na+3h]4+): 404.8337; found 404.8336.
62、d. 一系列基于binol骨架的新型手性大环 ss-1, sss-1和 ssss-1,合成方法如下:
63、(1)将化合物 s-1(1 g,2.25 mmol,其合成参考文献y. nojima, m. hasegawa, n.hara, y. imai, y. mazaki, chem. commun. 2019, 55, 2749–2752)和thf(30 ml)的混合物在0 ℃下搅拌10 min,向混合物中加入nah,在0 ℃下继续搅拌10 min,向混合物中加入溴甲基甲基醚,室温反应12小时。用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2)纯化,得到白色固体的目标化合物 s-2(2.0 g,3.2 mmol),1h nmr表征同s手性一致。
64、 (2)将含有ni(cod)2(市售)(384mg,1.4 mmol)、cod(市售)(0.2ml,1.63 mmol),2,2'-联吡啶(市售)(224 mg,1.43 mmol),甲苯(1.1 ml)和dmf(1.1 ml)的schlenk管在n2气氛下于90 ℃搅拌30分钟。然后加入溶解在甲苯(5.4 ml)中的 s-2,并将混合物在90 ℃下搅拌24小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2/etoac = 20/1)纯化,得到白色固体的目标手性大环化合物 ss-1, sss-1和 ssss-1。
65、 1h nmr (400 mhz, cdcl3, 298 k) of ss-1: δ h = 7.87 (d, j = 9.0 hz, 4h),7.72 (d, j = 8.3 hz, 4h), 7.54 (d, j = 9.0 hz, 4h), 7.23 (dd, j = 8.2, 1.6hz, 4h), 6.95 (s, 4h), 5.07 (d, j = 6.6 hz, 4h), 4.91 (d, j = 6.6 hz, 4h),3.21 (s, 12h).
66、1h nmr (400 mhz, cdcl3, 298 k) of sss-1: δ h = 7.83 (d, j = 9.0 hz, 6h),7.65 (d, j = 8.4 hz, 6h), 7.51 (d, j = 9.0 hz, 6h), 7.10 (d, j = 8.4 hz, 6h),6.91 (s, 6h), 5.19 (d, j = 6.8 hz, 6h), 4.98 (d, j = 6.8 hz, 6h), 3.11 (s,18h).
67、1h nmr (400 mhz, cdcl3, 298 k) of ssss-1: δ h = 7.83 (d, j = 9.0 hz,8h), 7.64 (d, j = 8.5 hz, 8h), 7.54 (d, j = 9.1 hz, 8h), 7.33 (s, 8h), 7.22(d, j = 8.9 hz, 8h), 5.08 (d, j = 6.7 hz, 8h), 5.01 (d, j = 6.7 hz, 8h), 3.12(s, 24h).
68、e. 一系列基于binol骨架的新型手性大环 sss-2和 ssss-2,合成方法如下:
69、(1)将化合物 s-1(1.5g,3.4mmol,其合成参考文献y. nojima, m. hasegawa, n.hara, y. imai, y. mazaki, chem. commun. 2019, 55, 2749–2752)、cs2co3(8.8 g,27.2mmol)、溴乙酸乙酯(市售)(1.1 ml,10 mmol)和dmf(20 ml)的混合物在40 ℃下搅拌24小时。向混合物中加入饱和nh4cl溶液中,用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2)纯化,得到白色固体的目标化合物 s-3。
70、 1h nmr (400 mhz, cdcl3, 298 k) of s-3: δ h= 7.91 (d, j= 9.1 hz, 2h),7.72 (d, j= 8.7 hz, 2h), 7.43 (dd, j1= 8.7 hz, j2=1.8 hz, 2h), δ 7.35 (s, 2h),7.31 (d, j= 9.3 hz, 2h), 4.56 (m, 4h), 4.16 (m, 4h), 1.17 (t, j= 7.2 hz, 6h).13cnmr (100 mhz, cdcl3, 298 k) of s-3: δ c= 167.90, 153.24, 134.09, 128.91, 128.66,127.07, 126.62, 126.31, 120.37, 117.55, 114.12, 65.63, 60.16, 13.06.
71、(2)将含有ni(cod)2(市售)(154 mg,0.56 mmol)、cod(市售)(70 mg,0.65 mmol),2,2'-联吡啶(市售)(90 mg,0.58 mmol)和甲苯(0.3 ml)和dmf(0.3 ml)的schlenk管在n2气氛下于90 °c搅拌30分钟。然后加入溶解在甲苯(2.4 ml)中的 s-3,并将混合物在90 ℃下搅拌24小时。冷却至室温后,用硅藻土过滤混合物以除去固体。收集滤液并在减压下蒸发,然后用ch2cl2萃取并用盐水洗涤。将有机层合并、干燥(na2so4)并在减压下蒸发。粗产物通过硅胶柱色谱法(ch2cl2/etoac = 20/1)纯化,得到白色固体的目标手性大环化合物 sss-2和 ssss-2。
72、 1h nmr (400 mhz, cdcl3, 298 k) of sss-2: δ h =7.82 (d, j = 9.0 hz, 6h),7.64 (d, j = 8.5 hz, 6h), 7.29 (d, j = 9.2 hz, 6h), 7.25 (d, j = 8.4 hz, 6h),6.95 (s, 6h), 4.65–4.52 (m, 12h), 4.13 (q, j = 7.1 hz, 12h), 1.18 (t, j = 7.1hz, 18h).
73、1h nmr (400 mhz, cdcl3, 298 k) of ssss-2: δ h= 7.83 (d, j= 9.1 hz, 8h),7.62 (d, j= 8.5 hz, 8h), 7.34 (s, 8h), 7.34 (d, j= 8.7 hz, 8h), 7.29 (d, j= 9.0hz, 8h), 4.51 (dd, j1= 18.8 hz, j2= 16.4 hz, 16h), 4.10 (q, j= 7.2 hz, 16h), 1.05(t, j= 7.2 hz, 24h).13c nmr (100 mhz, cdcl3, 298 k) of ssss-2:: δ c= 169.31,153.84, 138.38, 133.89, 129.25, 128.93, 128.02, 123.92, 123.28, 120.47,115.28, 67.11, 60.96, 14.00.
74、f. 基于binol骨架的新型手性大环 ssss-3和 ssss-4,合成方法如下:
75、(1)将 ssss-2(50 mg,0.027 mmol)、20% naoh水溶液(1.0 ml)、thf(1.0 ml)、ch3oh(1.8 ml)的混合物在90 ℃下搅拌过夜。混合物在减压下蒸发。粗产物通过球形c18硅胶柱色谱法纯化(h2o至h2o/ch3cn = 10/1),得到目标化合物白色固体 ssss-3。将100 mg固体 ssss-3溶于水,加入10 ml 1m的盐酸,搅拌10 min后,将析出的白色沉淀抽滤,并于用10 ml 1m的盐酸洗涤,得到的滤渣即为目标化合物白色固体 ssss-4。1h nmr (400 mhz,cdcl3, 298 k) of ssss-3: δ h= 8.00 (d, j= 9.2 hz, 8h), 7.73 (d, j= 8.8 hz, 8h),7.36 (d, j= 9.2 hz, 8h), 7.23 (s, 8h), 7.20 (d, j= 8.5 hz, 8h), 4.47 (d, j= 14.7hz, 8h), 4.36 (d, j = 14.7 hz, 8h).13c nmr (100 mhz, cdcl3, 298 k) of ssss-3: δ c= 176.93, 164.03, 154.21, 132.98, 129.81, 128.31, 123.52, 122.51, 118.53,115.17, 68.43, 23.20.
76、g. 水溶大环 rrrr-3对非手性客体金刚烷g2和黄藤素g8的识别性质:
77、通过在滴定不同当量的客体,跟踪 rrrr-3的荧光强度的变化来进行荧光滴定实验。使用origin lab 9.1软件,用1:1结合模型(guo, d.-s.; uzunova, v.d.; su, x.;liu, y.; nau, w. m. operational calixarene-based fluorescent sensing systemsfor choline and acetylcholine and their application to enzymaticreactions. chem. sci.2011, 2, 1722–1734)的非线性最小二乘拟合方程拟合荧光强度与客体浓度的关系图,以计算结合常数 ka,拟合模块从nau教授组的网站上下载(http://www.jacobs-university.de/ses/wnau)在“拟合函数”栏下。具体介绍如下:
78、i)配浓度为0.025 μm的 rrrr-3水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350–550 nm波长范围内的荧光图谱,不断的加入g2 (见图1)直至0.40 μm,监测荧光强度的变化曲线,从图1(a)中可以看出,混合物荧光强度是逐渐上升的。进一步拟合400 nm波长下的混合物荧光强度变化,从图1(b)中可以看出,结合常数 ka拟合后测定为(3.08±0.99)×108m−1。
79、 ii) 配 rrrr-3浓度为0.025 μm且g8(见图1)浓度为0.020 μm的 rrrr-3和g8的混合物水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350–550 nm波长范围内的荧光图谱,不断的加入g2(见图1)直至51.3 μm,监测荧光强度的变化曲线,从图1(c)中可以看出,混合物荧光强度是逐渐上升的。进一步拟合400 nm波长下的混合物荧光强度变化,从图1(d)中可以看出,结合常数 ka拟合后测定为(8.57±0.82)×1010m−1。图1(c)插图为总摩尔浓度为0.25 μm时, rrrr-3和g8在400 nm处荧光发射变化的job plot工作曲线,表明主客体符合1:1结合模型。
80、 h. 水溶大环 rrrr-3对手性客体spinol(市售)的识别性质:
81、通过跟踪在滴定不同当量的客体后 rrrr-3的荧光强度的变化来进行荧光滴定实验。使用origin lab 9.1软件,用1:1结合模型(guo, d.-s.; uzunova, v.d.; su, x.;liu, y.; nau, w. m. operational calixarene-based fluorescent sensing systemsfor choline and acetylcholine and their application to enzymaticreactions. chem. sci.2011, 2, 1722–1734)的非线性最小二乘拟合方程拟合荧光强度与客体浓度的关系图,以计算结合常数 ka,拟合模块从nau教授组的网站上下载(http://www.jacobs-university.de/ses/wnau)在“拟合函数”栏下。具体介绍如下:
82、i)配浓度为2.5 μm的 ssss-3水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350–550 nm波长范围内的荧光图谱,不断的加入( s)-spinol至70 μm,监测荧光强度的变化曲线,进一步拟合400 nm波长下的混合物荧光强度变化,从图2(a)中可以看出,混合物荧光强度是逐渐上升的。如图2(b),结合常数 ka拟合后测定为(9.88±2.51)×104 m−1。
83、 ii)配浓度为2.5 μm的 rrrr-3水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350–550 nm波长范围内的荧光图谱,不断的加入( s)-spinol至650 μm,监测荧光强度的变化曲线,进一步拟合400 nm波长下的混合物荧光强度变化,从图2(c)中可以看出,混合物荧光强度是逐渐下降的。如图2(d),结合常数 ka拟合后测定为(5.26±1.13)×103 m−1。
84、 iii)配浓度为2.5 μm的 ssss-3水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350–550 nm波长范围内的荧光图谱,不断的加入( r)-spinol至700 μm,监测荧光强度的变化曲线,进一步拟合400 nm波长下的混合物荧光强度变化,从图2(e)中可以看出,混合物荧光强度是逐渐下降的。如图2(f),结合常数 ka拟合后测定为(5.34±0.91)×103 m−1。
85、 iv)配浓度为2.5 μm的 rrrr-3水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350–550 nm波长范围内的荧光图谱,不断的加入( r)-spinol至45 μm,监测荧光强度的变化曲线,进一步拟合400 nm波长下的混合物荧光强度变化,从图2(g)中可以看出,混合物荧光强度是逐渐下降的。如图2(h),结合常数 ka拟合后测定为(8.65±2.03)×104m−1。
86、分析图4所得数据可以得出结论:水溶大环 rrrr-3的对手性客体spinol的对映选择性( k s/ k r或 k r/ k s)达到了18.8。
87、 i. 水溶大环 rrrr-3的甾类化合物醋酸甲地孕酮的识别性质:
88、通过跟踪在滴定不同当量的客体后 rrrr-3的荧光强度的变化来进行荧光滴定实验。使用origin lab 9.1软件,用1:1结合模型(guo, d.-s.; uzunova, v.d.; su, x.;liu, y.; nau, w. m. operational calixarene-based fluorescent sensing systemsfor choline and acetylcholine and their application to enzymaticreactions. chem. sci.2011, 2, 1722–1734)的非线性最小二乘拟合方程拟合荧光强度与客体浓度的关系图,以计算结合常数 ka,拟合模块从nau教授组的网站上下载(http://www.jacobs-university.de/ses/wnau)在“拟合函数”栏下。具体介绍如下:
89、i)配 rrrr-3浓度为0.025 μm且g8浓度为0.025 μm的 rrrr-3和g8的混合物水溶液,取2.5 ml加入比色皿中,用300 nm的波长激发,测定溶液在350~550 nm波长范围内的荧光图谱,不断的加入醋酸甲地孕酮至75 μm,监测荧光强度的变化曲线,从图3(a)中可以看出,混合物荧光强度是逐渐上升的。进一步拟合400 nm波长下的混合物荧光强度变化,从图3(b)中可以看出,结合常数 ka拟合后测定为(4.37±0.29)×1010m−1。
90、分析图3所得数据可以得出结论:水溶大环 rrrr-3的对甾类化合物醋酸甲地孕酮具有很强的识别能力。
91、 j. 水溶大环 rrrr-3, ssss-3对14种甾类化合物的阵列传感,用于区分甾类化合物,具体操作如下。
92、 测定水溶大环 rrrr-3, ssss-3对14种甾类化合物的荧光传感阵列,传感阵列由一系列浓度为0.2 μm的水溶大环 rrrr-3, ssss-3和不同浓度的甾类化合物组成传感单元,通过各传感单元对14种甾类化合物响应后产生的特征图谱实现对特定物质的识别检测,荧光传感器阵列具有灵敏度高、无需参照体系、输出信号丰富、能够成像等优点,已成为近年来传感器阵列发展的重点。
93、从图3中可以看出,图3(a) ssss-3能够区分8种甾类化合物,图3(b) rrrr-3能够区分10种甾类化合物,而两种手性的水溶大环 ssss-3和 rrrr-3共同实现了区分14种甾类化合物,进一步表明手性在本阵列传感中的重要性。
94、报道了一系列基于binol骨架的新型手性大环 rr-1, ss-1, rrr-1, sss-1, rrr-2, sss-2, rrrr-1, ssss-1, rrrr-2, ssss-2, rrrr-3, ssss-3, rrrr-4, ssss-4的合成方法:将手性纯的联萘单体 r-1和 s-1用不同取代基修饰成合环前体 r-2, s-2, r-3和 s-3,通过渡金属试剂ni (cod)2为催化剂的yamamoto偶联反应一锅法高产率合成一系列多聚体超分子大环 rr-1, ss-1, rrr-1, sss-1, rrr-2, sss-2, rrrr-1, ssss-1, rrrr-2和 ssss-2,并且能够进一步水解,得到水溶性超分子大环 rrrr-3和 ssss-3,酸化后得到取代基为羧酸的大环 rrrr-4和 ssss-4。通过多种表征方法对手性大环 rr-1, ss-1, rrr-1, sss-1, rrr-2, sss-2, rrrr-1, ssss-1, rrrr-2, ssss-2, rrrr-3, ssss-3, rrrr-4, ssss-4结构进行了表征,确定手性大环的成功合成。对水溶大环 rrrr-3, ssss-3在水中进行了进一步的研究,用荧光滴定法分别对大环 rrrr-3, ssss-3在水中对不同客体的结合常数进行测试,数据表明,水溶大环 rrrr-3, ssss-3对非手性客体具有普遍的高结合强度(107~1010),并对一系列手性客体具有高的对映选择性,选择性最高能达到18.8。这是水相中手性大环受体目前的结合强度和对映选择性的最高值。此外,荧光滴定测得了水溶大环 rrrr-3, ssss-3对甾类化合物的结合强度,我们进一步用水溶大环 rrrr-3, ssss-3对甾类化合物进行了阵列传感的测试,实现了在水里对14种甾类化合物的区分,便捷灵敏,有商业化价值。
- 还没有人留言评论。精彩留言会获得点赞!