一种DNA损伤前药、纳米颗粒、制备方法及应用
本发明涉及生物医药,尤其涉及一种dna损伤前药、纳米颗粒、制备方法及应用。
背景技术:
1、目前,乳腺癌(bc)是最常见的恶性肿瘤之一,因其发病率和死亡率高而严重威胁着全世界妇女的健康和生命。在最近研究的众多乳腺癌治疗方法中,光动力疗法(pdt)因其无创、精确度高、可控性好且局部有效的治疗方法而备受关注,前景广阔。光动力疗法是用光敏剂分子药物和激光活化治疗肿瘤、癌前病变、增生性皮肤疾病、血管性疾病的一种新方法;光敏剂分子被肿瘤细胞内化后,在特定波长的激光照射下会被激发,从而产生大量单线态氧(1o2)和其他活性氧(ros)。产生活性氧可对dna、蛋白质和不饱和脂质等关键生物大分子造成快速氧化损伤,从而导致细胞核和线粒体等关键细胞器受损,最终导致肿瘤细胞死亡。
2、然而,由于光敏剂的固有特性、肿瘤微环境的复杂性以及肿瘤细胞中存在的dna损伤修复机制,光动力疗法的治疗效果仍不尽如人意。光动力疗法实际应用受限的主要原因是光敏剂的分布和保留不足,因为大多数光敏剂的水溶性低且疏水性差。纳米载体不仅能增加光敏剂的溶解度,还能提供合适的尺寸和表面特性以延长血液循环,从而通过实体瘤的高通透性和滞留效应(epr)促进光敏剂在肿瘤部位的分布和保留。此外,肿瘤微环境中高水平的谷胱甘肽(gsh)会大量消耗激发光敏剂产生的活性氧,从而降低pdt的治疗效率。再者,肿瘤细胞具有一套复杂的dna修复机制,肿瘤细胞会立即激活复杂的细胞修复机制来对抗dna损伤。
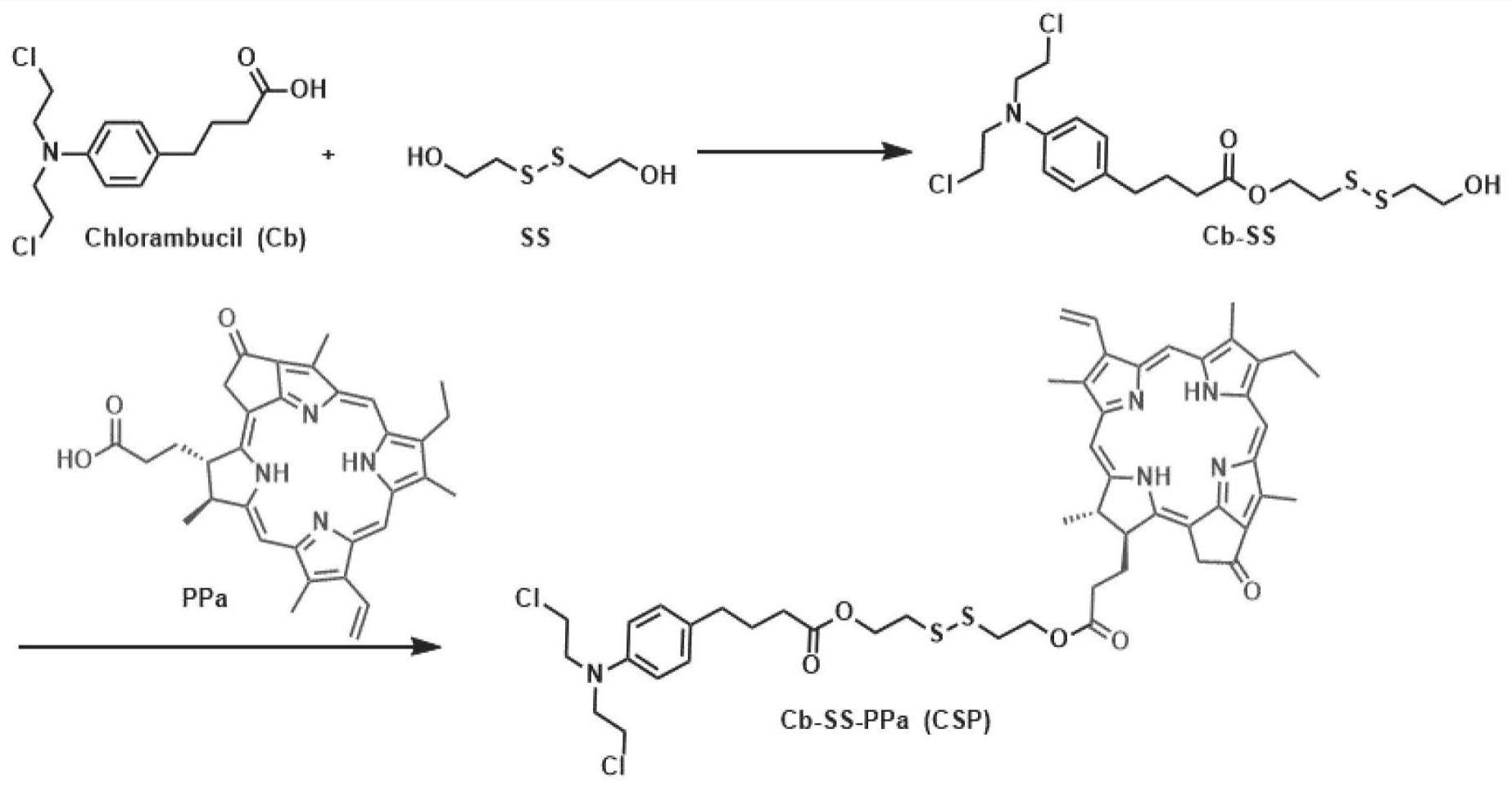
3、其中,奥拉帕尼(ola)已被美国食品药品监督管理局批准用于治疗复发性卵巢癌和晚期乳腺癌,其会通过破坏dna修复途径致死。苯丁酸氮芥是氮芥类dna烷化剂的一种,是最早用于淋巴瘤和一些实体瘤化疗的dna损伤试剂之一。苯丁酸氮芥中的n,n-双(2-氯乙基)胺基团可迅速与核酸反应,使基因组dna烷基化,导致细胞凋亡。因此,将焦脱镁叶绿酸a(ppa)、parp抑制剂(ola)和苯丁酸氮芥的功能整合到一种多功能纳米药物中,将为通过增强dna损伤和抑制dna损伤修复功能来显著提高协同化疗-光动力疗法的疗效提供新选择。
技术实现思路
1、有鉴于此,本发明的目的是提供一种dna损伤前药、纳米颗粒、制备方法及应用,能够在高gsh肿瘤微环境下实现gsh触发的苯丁酸氮芥和奥拉帕尼释放,从而分别增强dna损伤和抑制dna损伤修复功能,促进乳腺癌化疗-光动力协同疗法的效果。
2、本发明通过以下技术手段解决上述技术问题:
3、第一方面,本发明公开了一种dna损伤前药,所述前药的结构式为式ⅰ所示:
4、
5、进一步,所述前药的制备方法,包括以下步骤:
6、s1、将苯丁酸氮芥(cb)溶解在无水二氯甲烷中,然后加入4-二甲基氨基吡啶(dmap)和n,n-二环己基碳二亚胺(dcc),得到混合物一;
7、s2、将混合物一加入无水二氯甲烷(dcm)中的双(2-羟乙基)二硫醚(ss),得到混合物二;
8、s3、将混合物二在室温下搅拌,冷却反应溶液混合物并沉淀、过滤,将滤液经旋转蒸发浓缩、纯化,得到产物一(cb-ss);
9、s4、将焦脱镁叶绿酸a(ppa)溶于无水二氯甲烷(dcm)中,然后搅拌状态下加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edci)和4-二甲氨基吡啶(dmap),搅拌反应;
10、s5、在步骤s4的搅拌反应物中加入产物一(cb-ss),在室温下搅拌反应后,旋转蒸发浓缩、纯化,得到所述前药(csp)。
11、进一步,所述苯丁酸氮芥、4-二甲基氨基吡啶、n,n-二环己基碳二亚胺、双(2-羟乙基)二硫醚的摩尔比为1:1.2:1.2:2。
12、进一步,所述产物一与焦脱镁叶绿酸a的摩尔比为1.2:1。
13、第二方面,本发明还公开了上述的dna损伤前药在制备化疗-光动力疗法联合试剂药物或制备抗乳腺癌药物中的应用。
14、第三方面,本发明还公开了上述的dna损伤前药在制备光声成像产品或制备荧光成像产品中的应用。
15、第四方面,本发明还公开了一种dna损伤纳米颗粒,所述纳米颗粒包括纳米颗粒csp np和纳米颗粒csp/ola np,所述纳米颗粒cspnp为上述的前药与dspe-peg2000自组装制得,所述纳米颗粒csp/ola np上述的前药与dspe-peg2000和奥拉帕尼(ola)自组装制得。
16、第五方面,本发明还公开了一种dna损伤纳米颗粒的制备方法,所述纳米颗粒包括纳米颗粒csp np和纳米颗粒csp/ola np,所述纳米颗粒csp np的制备方法包括以下步骤:将上述的前药、dspe-peg2000分别溶于二甲基亚砜中,得到前药溶液、dspe-peg2000溶液;取前药溶液和dspe-peg2000溶液混合并分散到水中,搅拌,得到混合物三;透析去除二甲基亚砜(dmso),然后过滤溶液去除游离的前药,得到纳米颗粒csp np。
17、进一步,所述纳米颗粒csp/olanp的制备方法,包括以下步骤:将上述的前药、奥拉帕尼(ola)、dspe-peg2000分别溶于二甲基亚砜中,得到前药溶液、奥拉帕尼(ola)溶液、dspe-peg2000溶液;取上述溶液混合并分散到水中,搅拌,得到混合物四;透析去除二甲基亚砜(dmso),然后过滤溶液去除未包载的试剂,得到纳米颗粒csp/ola np。
18、进一步,所述纳米颗粒csp np的制备中,所述前药与dspe-peg2000的质量比为1:0%-20%;所述纳米颗粒csp/ola np的制备中,前药溶液、dspe-peg2000溶液和奥拉帕尼(ola)的质量比为1:0.15:0.45。
19、本发明的有益效果:
20、1、本发明的苯丁酸氮芥通过二硫键与焦脱镁叶绿酸a结合,形成具有分散稳定性的智能响应前药(cb-ss-ppa,简称csp);该前药csp与dspe-peg2000可自组装成纳米颗粒cspnp,纳米颗粒csp np还可以进一步包覆奥拉帕尼以构建纳米药物csp/ola np;这种新型纳米颗粒具有独特的性能,在增强tnbc化疗-光动力治疗方面具有更好的疗效。
21、2、本发明的peg化可以延长csp/ola np在血液中的循环时间,并通过被动靶向增加其在肿瘤区域的蓄积;当csp/ola np被癌细胞内化时,cb-ss-ppa的二硫键可在高gsh肿瘤微环境下实现gsh触发的苯丁酸氮芥和奥拉帕尼释放,从而分别增强dna损伤和破坏dna损伤修复功能。
22、3、本发明在苯丁酸氮芥和奥拉帕尼的协同作用下,焦脱镁叶绿酸a在pdt过程中诱导的氧化损伤进一步扩大,并通过促进细胞凋亡最终达到增强化学光动力疗法的目的。
技术特征:
1.一种dna损伤前药,其特征在于,所述前药的结构式为式ⅰ所示:
2.一种dna损伤前药的制备方法,其特征在于,包括以下步骤:
3.根据权利要求2所述的一种dna损伤前药的制备方法,其特征在于:所述苯丁酸氮芥、4-二甲基氨基吡啶、n,n-二环己基碳二亚胺、双(2-羟乙基)二硫醚的摩尔比为1:1.2:1.2:2。
4.根据权利要求2所述的一种dna损伤前药的制备方法,其特征在于:所述产物一与焦脱镁叶绿酸a的摩尔比为1.2:1。
5.一种如权利要求1所述的dna损伤前药在制备化疗-光动力疗法联合试剂药物或制备抗乳腺癌药物中的应用。
6.一种如权利要求1所述的dna损伤前药在制备光声成像产品或制备荧光成像产品中的应用。
7.一种dna损伤纳米颗粒,其特征在于:所述纳米颗粒包括纳米颗粒cspnp和纳米颗粒csp/ola np,所述纳米颗粒csp np为权利要求1所述的前药与dspe-peg2000自组装制得,所述纳米颗粒csp/ola np为权利要求1所述的前药与dspe-peg2000和奥拉帕尼自组装制得。
8.一种dna损伤纳米颗粒的制备方法,其特征在于:所述纳米颗粒包括纳米颗粒csp np和纳米颗粒csp/ola np,所述纳米颗粒csp np的制备方法包括以下步骤:将权利要求1所述的前药、dspe-peg2000分别溶于二甲基亚砜中,得到前药溶液、dspe-peg2000溶液;取前药溶液和dspe-peg2000溶液混合并分散到水中,搅拌,得到混合物三;透析去除二甲基亚砜,然后过滤溶液去除游离的前药,得到纳米颗粒csp np。
9.根据权利要求8所述的一种dna损伤纳米颗粒的制备方法,其特征在于:所述纳米颗粒csp/ola np的制备方法,包括以下步骤:将权利要求1所述的前药、奥拉帕尼、dspe-peg2000分别溶于二甲基亚砜中,得到前药溶液、奥拉帕尼溶液、dspe-peg2000溶液;取前药溶液、奥拉帕尼溶液、dspe-peg2000溶液混合并分散到水中,搅拌,得到混合物四;透析去除二甲基亚砜,然后过滤溶液去除未包载的试剂,得到纳米颗粒csp/ola np。
10.根据权利要求9所述的一种dna损伤纳米颗粒的制备方法,其特征在于:所述纳米颗粒csp np的制备中,所述前药与dspe-peg2000的质量比为1:0%-20%;所述纳米颗粒csp/olanp的制备中,所述前药、dspe-peg2000和奥拉帕尼的质量比为1:0.15:0.45。
技术总结
本发明涉及生物医药技术领域,公开了一种DNA损伤前药、纳米颗粒、制备方法及应用,本发明所述DNA损伤前药CSP是以光敏剂焦脱镁叶绿酸a(PPa)和DNA损伤剂苯丁酸氮芥(Cb)作为模拟药物,通过GSH响应性二硫键桥联。本发明纳米药物是利用本发明的DNA损伤前药与PARP抑制剂奥拉帕尼(Olaparib)通过纳米沉淀法制备而得。本发明能够在高GSH浓度肿瘤微环境下实现GSH触发的苯丁酸氮芥和奥拉帕尼释放,从而分别增强DNA损伤和DNA损伤修复功能障碍,促进乳腺癌化疗‑光动力协同疗法的效果。
技术研发人员:张益梅,黄政
受保护的技术使用者:重庆文理学院
技术研发日:
技术公布日:2024/1/16
- 还没有人留言评论。精彩留言会获得点赞!