包含α-因子前原序列的组合物及其用途的制作方法
背景技术:
1、活细胞分泌蛋白质是许多医学和科学过程中的一个步骤。例如,生物制造通常依赖于活细胞分泌大量生物治疗剂来进行生产。此外,mrna疫苗依赖于接种疫苗的个体细胞的蛋白质分泌。此外,许多科学学科利用活细胞蛋白质分泌进行关键实验,包括研究蛋白质的功能和结构。因此,蛋白质分泌的增强可以更低的成本、更小的疫苗剂量和更简单的蛋白质研究实验程序来实现生物制品产量的提高。
技术实现思路
1、本公开提供了用于增加哺乳动物细胞分泌多肽的技术,其中所述多肽由外源核酸(例如,dna或rna治疗剂)编码。本公开进一步确认,哺乳动物细胞中多肽分泌水平的提高可有益于许多过程,包括多肽(例如,治疗性多肽)的制造和在递送编码此类多肽的多核苷酸之后多肽在哺乳动物细胞、组织或受试者中的表达。
2、递送治疗剂的一种重要方法是将多核苷酸递送至受试者,然后利用受试者的细胞机制从递送的多核苷酸中表达治疗性多肽。这种方法的一个最新实例是引入基于mrna的sars-cov-2疫苗,所述疫苗递送编码抗原多肽的mrna以在受试者体内表达。虽然这些方法已经取得了成功,但此类方法的挑战在于,以这种方式递送的某些多肽需要在表达后从细胞中分泌出来。
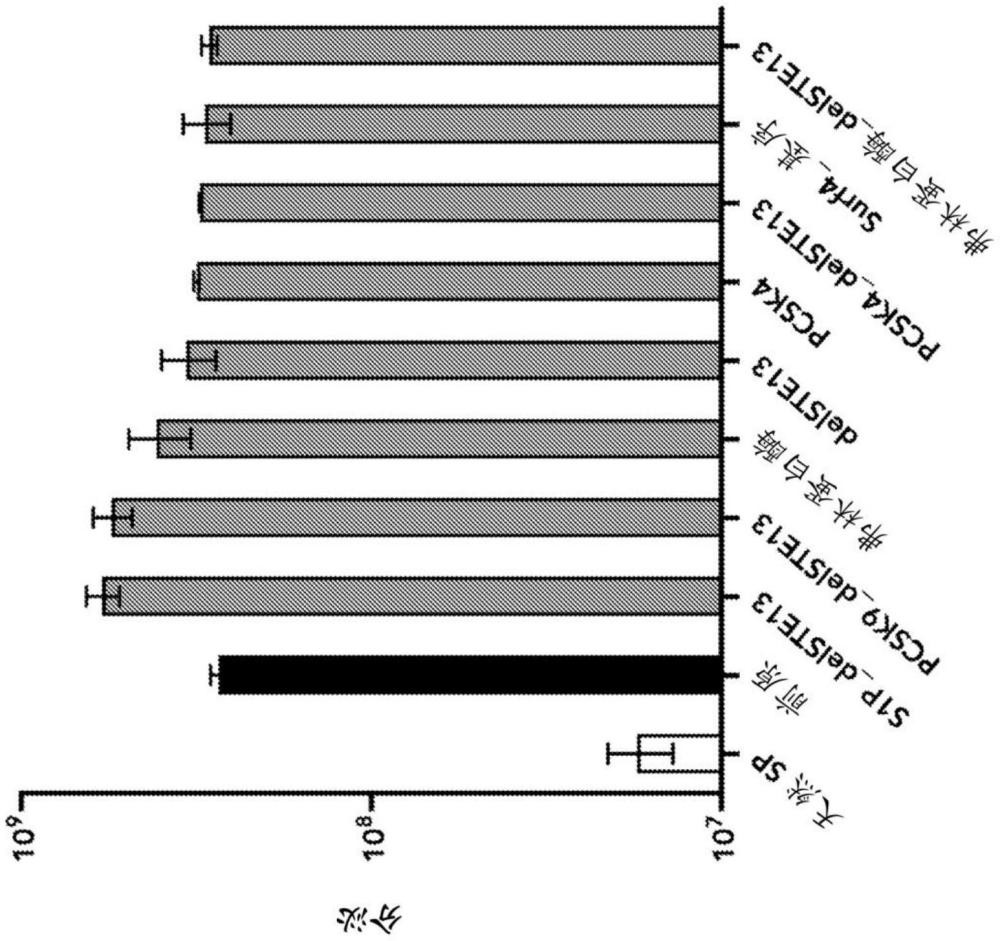
3、本公开提供了这样的见解:α-因子前原序列可用于增加细胞,特别是哺乳动物细胞的多肽分泌。因此,使用α-因子前原序列可提高有效载荷多肽(例如,治疗性多肽)的分泌水平。从施用的多核苷酸表达的有效载荷多肽的分泌水平提高反过来可以减少需要递送的多核苷酸的量(例如,降低相关成本和/或增加施用期间的患者舒适度)。
4、本文所述的用于增加有效载荷多肽表达的技术包括工程化多肽,其包含有效载荷多肽和野生型或工程化α-因子前原序列,其中野生型或工程化α-因子前原序列可操作地连接至有效载荷多肽。还提供了编码此类多肽的多核苷酸。此外,还提供了结合所述技术的细胞和方法。
5、本公开还提供了以下见解:本文公开的拟南芥根生长因子(glv)分泌肽序列单独或与本文公开的α-因子前原序列组合可用于增加例如植物细胞(例如,拟南芥细胞)的多肽分泌。
技术特征:
1.一种工程化多肽,其包含:
2.如权利要求1所述的工程化多肽,其中所述有效载荷多肽是治疗性多肽。
3.如权利要求1或2所述的工程化多肽,其中所述有效载荷多肽包含一种或多种抗原。
4.如权利要求3所述的工程化多肽,其中所述一种或多种抗原是一种或多种病毒抗原。
5.如权利要求4所述的工程化多肽,其中所述一种或多种病毒抗原是一种或多种sars-cov-2抗原。
6.如权利要求5所述的工程化多肽,其中所述一种或多种病毒抗原包括sars-cov-2受体结合结构域或其片段。
7.如权利要求5或6所述的工程化多肽,其中所述一种或多种病毒抗原包括sars-cov-2刺突蛋白或其片段。
8.如权利要求4所述的工程化多肽,其中所述一种或多种病毒抗原是一种或多种流感抗原。
9.如权利要求8所述的工程化多肽,其中所述一种或多种流感抗原是一种或多种甲型流感抗原。
10.如权利要求3所述的工程化多肽,其中所述一种或多种抗原是一种或多种细菌抗原。
11.如权利要求3所述的工程化多肽,其中所述一种或多种抗原是一种或多种癌症抗原。
12.如权利要求3所述的工程化多肽,其中所述一种或多种抗原是一种或多种古细菌抗原。
13.如权利要求1或2所述的工程化多肽,其中所述有效载荷多肽包括抗体或其片段。
14.如权利要求1或2所述的工程化多肽,其中所述有效载荷多肽包括融合蛋白,所述融合蛋白包含细胞外受体和免疫球蛋白恒定区。
15.如权利要求1或2所述的工程化多肽,其中所述有效载荷多肽包括融合蛋白,所述融合蛋白包含受体激动剂和免疫球蛋白恒定区。
16.如权利要求1或2所述的工程化多肽,其中所述有效载荷多肽包括融合蛋白,所述融合蛋白包含受体拮抗剂和免疫球蛋白恒定区。
17.如权利要求1至16中任一项所述的工程化多肽,其中所述野生型或工程化α-因子前原序列或其片段存在于所述工程化多肽的n端。
18.如权利要求1至16中任一项所述的工程化多肽,其中所述野生型或工程化α-因子前原序列或其片段存在于所述工程化多肽的c端。
19.如权利要求1至18中任一项所述的工程化多肽,其中所述工程化多肽包含野生型α-因子前原序列或其片段。
20.如权利要求19所述的工程化多肽,其中所述野生型α-因子前原序列包含根据seqidno:2、seq id no:68或seq id no:69的序列。
21.如权利要求1至18中任一项所述的工程化多肽,其中所述工程化多肽包含工程化α-因子前原序列或其片段。
22.如权利要求21所述的工程化多肽,其中所述工程化α-因子前原序列包含具有surf4结合亲和力的三肽基序。
23.如权利要求22所述的工程化多肽,其中所述三肽基序是mpl(seq id no:58)。
24.如前述权利要求中任一项所述的工程化多肽,其中所述工程化α-因子前原序列不包含ste13切割位点,任选地其中所述ste13切割位点包含eaea(seq id no:56)。
25.如前述权利要求中任一项所述的工程化多肽,其中所述工程化α-因子前原序列不包含kex2切割位点,任选地其中所述kex2切割位点包含kr(seq id no:57)。
26.如权利要求25所述的工程化多肽,其中在野生型α-因子前原序列中发现的所述kex2切割位点在所述工程化α-因子前原序列中已被人蛋白酶的蛋白酶切割位点替代。
27.如权利要求26所述的工程化多肽,其中在野生型α-因子前原序列中发现的所述kex2切割位点在所述工程化α-因子前原序列中已被s1p、pcsk4、pcsk9或弗林蛋白酶的蛋白酶切割位点替代。
28.如权利要求27所述的工程化多肽,其中:
29.如前述权利要求中任一项所述的工程化多肽,其中所述工程化α-因子前原序列包含cathc肽序列或其片段,任选地其中所述cathc肽具有根据seq id no:95的序列。
30.如前述权利要求中任一项所述的工程化多肽,其中所述工程化α-因子前原序列包含cfvii肽序列或其片段,任选地其中所述cfvii肽具有根据seq id no:96的序列。
31.如前述权利要求中任一项所述的工程化多肽,其中所述工程化α-因子前原序列包含分拣蛋白1肽序列或其片段,任选地其中所述分拣蛋白-1肽具有根据seq id no:97的序列。
32.如前述权利要求中任一项所述的工程化多肽,其中所述工程化α-因子前原序列包含bdnf肽序列或其片段,任选地其中所述bdnf肽具有根据seq id no:98的序列。
33.如权利要求1至18和21中任一项所述的工程化多肽,其中所述工程化α-因子前原序列具有根据seq id no:44、seq id no:45、seq id no:46、seq id no:47、seq id no:48、seq id no:49、seq id no:50、seq id no:51、seq id no:71、seq id no:92、seq id no:93、seq id no:94、seq id no:106、seq id no:107、seq id no:108或seq id no:109的序列。
34.如权利要求1、2和17至32中任一项所述的工程化多肽,其中所述有效载荷多肽包含根据seq id no:1、seq id no:3、seq id no:5、seq id no:7、seq id no:9、seq id no:11、seq id no:13、seq id no:15、seq id no:17、seq id no:19、seq id no:21、seq id no:23、seq id no:25、seq id no:27、seq id no:29、seq id no:31、seq id no:33、seq idno:35、seq id no:37、seq id no:39、seq id no:72或seq id no:79的序列。
35.如权利要求1所述的工程化多肽,其中所述工程化多肽具有根据seq id no:4、seqid no:6、seq id no:8、seq id no:10、seq id no:12、seq id no:14、seq id no:16、seqid no:18、seq id no:20、seq id no:22、seq id no:24、seq id no:26、seq id no:28、seqid no:30、seq id no:32、seq id no:34、seq id no:36、seq id no:38、seq id no:40、seqid no:43、seq id no:73、seq id no:74、seq id no:75、seq id no:76、seq id no:77、seqid no:78、seq id no:80、seq id no:81、seq id no:100、seq id no:101、seq id no:102、seq id no:103、seq id no:104或seq id no:105的序列。
36.如前述权利要求中任一项所述的工程化多肽,其特征在于,当在细胞、组织或受试者中评估时,所述工程化多肽以与可比较的多肽相比更高的水平从所述细胞、所述组织的细胞或所述受试者的细胞或组织中分泌出来,任选地其中所述可比较的多肽包含与所述工程化多肽相同的有效载荷多肽和不是野生型或工程化α-因子前原序列的信号肽。
37.一种多核苷酸,其编码如权利要求1至36中任一项所述的工程化多肽。
38.如权利要求37所述的多核苷酸,其中所述多核苷酸是dna。
39.如权利要求37所述的多核苷酸,其中所述多核苷酸是rna,任选地其中所述rna是mrna。
40.如权利要求39所述的多核苷酸,其中所述mrna包含帽和poly-(a)尾。
41.如权利要求39或40所述的多核苷酸,其中所述多核苷酸包含一个或多个n4-乙酰胞苷残基。
42.如权利要求39至41中任一项所述的多核苷酸,其中所述多核苷酸包含一个或多个5-羟甲基尿苷残基。
43.一种细胞,其包含如权利要求1至36中任一项所述的工程化多肽或如权利要求37至42中任一项所述的多核苷酸。
44.一种组合物,其包含如权利要求1至36中任一项所述的工程化多肽、如权利要求37至42中任一项所述的多核苷酸、或如权利要求43所述的细胞。
45.如权利要求44所述的组合物,其中所述组合物是药物组合物。
46.如权利要求45所述的组合物,其中所述药物组合物是或包括:
47.一种方法,其包括向细胞、组织或受试者施用如权利要求1至36中任一项所述的工程化多肽、如权利要求37至42中任一项所述的多核苷酸、如权利要求43所述的细胞或如权利要求44至46中任一项所述的组合物。
48.如权利要求47所述的方法,其中所述细胞是哺乳动物细胞,所述组织是哺乳动物组织,或所述受试者是哺乳动物。
49.如权利要求47或48所述的方法,其中所述受试者是人。
50.如权利要求47至49中任一项所述的方法,其中所述方法是:
51.一种制造工程化多肽的方法,其包括从细胞表达如权利要求37至42中任一项所述的多核苷酸。
52.如权利要求51所述的方法,其中所述细胞是哺乳动物细胞。
53.一种如权利要求1至36中任一项所述的工程化多肽、如权利要求37至42中任一项所述的多核苷酸、如权利要求43所述的细胞或如权利要求44至46中任一项所述的组合物的如下用途:
54.如权利要求53所述的用途,其中将所述多肽、多核苷酸、细胞或组合物施用于细胞、组织或受试者。
55.一种制备多核苷酸的方法,其包括将编码野生型或工程化α-因子前原序列的核苷酸序列添加到编码有效载荷多肽的核苷酸序列中。
技术总结
本文公开了一种工程化多肽,其包含(i)有效载荷多肽,和(ii)野生型或工程化a‑因子前原序列,其中所述野生型或工程化a‑因子前原序列可操作地连接至所述有效载荷多肽。本文还提供了编码本公开的工程化多肽的多核苷酸,以及包含此类多核苷酸或本公开的工程化多肽的组合物。还提供了制备和使用所公开的多肽、多核苷酸和组合物的方法。
技术研发人员:T·吉尔,K·贾梅,N·叶罗申科
受保护的技术使用者:螺旋纳米技术公司
技术研发日:
技术公布日:2024/9/9
- 还没有人留言评论。精彩留言会获得点赞!