一种生产丁二胺的重组大肠杆菌及其构建方法与应用
本发明属于生物,具体涉及一种生产丁二胺的重组大肠杆菌及其构建方法与应用。
背景技术:
1、1,4-丁二胺(1,4-butanediamine),即腐胺(putrescine),又称1,4-二氨基丁烷,是一种包含两个氨基的脂肪族胺。广泛应用于医药、农业和工业领域,是一种具有高价值的小分子化合物。腐胺对肠道微生物有重要的调节作用,对采后农作物具有良好的保鲜效果,可与二元酸用于合成优质工业塑料尼龙-4,6。目前聚酰胺在全球范围的需求量与日俱增。除了传统的化学合成1,4-丁二胺,生物法制备也日渐成熟,逐渐取代化学合成法,成为1,4-丁二胺合成的主流方法。其中生物法主要分为生物催化法和细胞发酵法。催化法主要以l-精氨酸为原料,通过精氨酸激酶将其转化为鸟氨酸再通过鸟氨酸脱羧酶脱羧生成1,4-丁二胺。但需要昂贵的辅酶且重复利用率低下。相较而言,发酵法具备条件温和,原料多样,生产成本低过程可控等优点。
2、随着合成生物学的发展,大肠杆菌可作为模式工业菌株,进行大宗化学品的生产,其中就包括了1,4-丁二胺。但是1,4-丁二胺的发酵生产目前仍处于研究中,亟待开发以葡萄糖为底物的高产丁二胺发酵菌株。本发明从催化生产丁二胺的思路出发,在具有高产精氨酸的底盘细胞argfm中异源表达了牛源的精氨酸激酶,过表达大肠杆菌内源的鸟氨酸脱羧酶,构建了一步发酵生产丁二胺的重组大肠杆菌。
技术实现思路
1、本发明所要解决的技术问题是针对现有技术的不足,提供一种生产丁二胺的重组大肠杆菌。
2、本发明还要解决的技术问题是提供上述重组大肠杆菌的构建方法。
3、本发明最后要解决的技术问题是提供上述重组大肠杆菌在合成丁二胺中的应用。该方法为一种清洁高效的丁二胺生物发酵方法,催化合成周期短,成本低,适合产业化大规模生产丁二胺。
4、本发明的设计原理为:在大肠杆菌中异源表达牛源的精氨酸激酶arg1及大肠杆菌内源的鸟氨酸脱羧酶spec。将此路径构建在产精氨酸的大肠杆菌argfm中,以获得一定产量的丁二胺。
5、为了解决上述技术问题,本发明采用的技术方案如下:
6、一种生产丁二胺的重组大肠杆菌,以大肠杆菌argfm为出发菌株,通过表达内源鸟氨酸脱羧酶基因spec的同时表达异源精氨酸激酶基因arg1,构建得到产丁二胺的重组大肠杆菌putfm,图1为重组大肠杆菌putfm的构建流程图。
7、其中,所述的鸟氨酸脱羧酶基因spec前含有启动子trc。
8、其中,所述的鸟氨酸脱羧酶基因spec是大肠杆菌的内源基因,其与启动子trc组成的核苷酸序列如seq id no.1所示;所述的精氨酸激酶基因arg1来源于家牛(bos taurus),其核苷酸序列如seq id no.4所示。
9、一种生产丁二胺的重组大肠杆菌的构建方法,包括如下步骤:
10、(1)合成精氨酸激酶基因arg1,通过同源重组的方式,以质粒ptrc99a为载体,构建得到质粒ptrc99a-arg1;
11、(2)合成含有启动子trc的鸟氨酸脱羧酶基因trc-spec,通过同源重组的方式,以步骤(1)得到的质粒ptrc99a-arg1为载体,构建得到质粒ptrc99a-arg1-spec;
12、(3)将步骤(2)得到的质粒ptrc99a-arg1-spec转入大肠杆菌argfm中,获得产丁二胺的重组大肠杆菌putfm。
13、其中,步骤(1)中,选择的酶切位点均为ncoi和saci,价格便宜,有助于产业化降低成本。
14、上述重组大肠杆菌在合成丁二胺中的应用也在本发明所保护的范围之内。
15、具体的,将重组大肠杆菌putfm活化后,经一级种子液体培养基洗脱转接至二级种子液体培养基中扩大培养,再接种至发酵培养基中进行发酵培养。
16、其中,所述的扩大培养,其培养条件为:35~37℃,200~220rpm条件下培养12~14h;优选的,35℃,220rpm条件下培养12h。
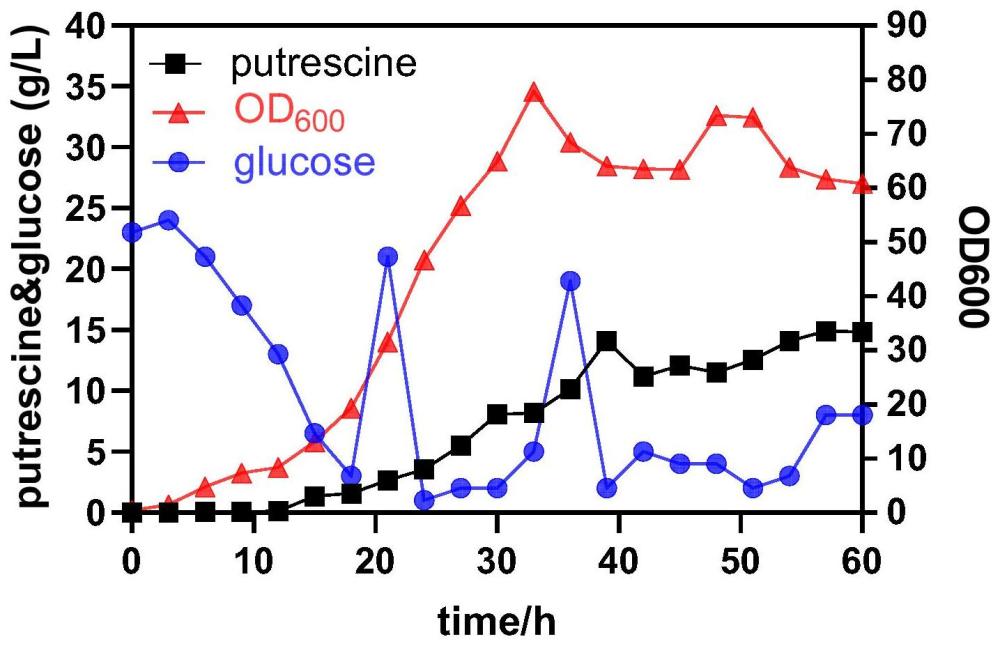
17、其中,所述的发酵培养,其发酵条件为在35~37℃、ph 7.0~7.3下共发酵48~60h。优选的,在35℃、ph 7.3的条件下共发酵60h。
18、其中,所述的发酵培养,当od600达到0.4时,加入iptg至终浓度125mm;当发酵培养基中初糖耗尽后,流加补料培养基,维持溶氧15%~35%、残糖含量1~5g/l、氨氮含量1~5g/l,继续进行发酵培养。
19、其中,所述的发酵培养基,其配方为:牛肉粉5~6g/l、酵母粉1~2g/l、葡萄糖25~30g/l、k2hpo4 3~5g/l、mgso4·7h2o 1.5~2g/l、feso4·7h2o 0.02~0.03g/l、mnso4·h2o0.02~0.03g/l、生物素0.002~0.003g/l、vb1 0.002~0.003g/l、vb30.002~0.003g/l、vb50.002~0.003g/l、(nh4)2so4 11~15g/l、氯霉素5~10mg/l、青霉素5~10mg/l、甜菜碱0.5~2.5g/l;优选的配方为:牛肉粉5.25g/l、酵母粉1.75g/l、葡萄糖25g/l、k2hpo4 3g/l、mgso4·7h2o 1.5g/l、feso4·7h2o 0.02g/l、mnso4·h2o0.02g/l、生物素0.002g/l、vb10.002g/l、vb3 0.002g/l、vb5 0.002g/l、(nh4)2so411g/l、氯霉素5mg/l、青霉素5mg/l、甜菜碱0.5g/l。
20、其中,所述的补料培养基,分为补料a和补料b;具体的,补料a的配方为:600~700g/l葡萄糖+2.25~3g/l甜菜碱,补料b的配方为:300~400g/l硫酸铵+180~200g/l谷氨酸钠;优选的,补料a的配方为:600g/l葡萄糖+2.25g/l甜菜碱,补料b的配方为:300g/l硫酸铵+180g/l谷氨酸钠。
21、有益效果:
22、(1)采用此方法生产丁二胺,异源路径在重组菌株种表达良好,可获得终产物丁二胺14.8g/l。
23、(2)细胞发酵反应过程较为温和,对环境、设备及操作人员均无害。
24、(3)本发明发酵生产丁二胺,直接以葡萄糖为原料,其成本较催化合成大幅下降。
技术特征:
1.一种生产丁二胺的重组大肠杆菌,其特征在于,以大肠杆菌argfm为出发菌株,通过表达内源鸟氨酸脱羧酶基因spec的同时表达异源精氨酸激酶基因arg1,构建得到产丁二胺的重组大肠杆菌putfm。
2.根据权利要求1所述的重组大肠杆菌,其特征在于,所述的鸟氨酸脱羧酶基因spec前含有启动子trc。
3.根据权利要求2所述的重组大肠杆菌,其特征在于,所述的鸟氨酸脱羧酶基因spec是大肠杆菌的内源基因,其与启动子trc组成的核苷酸序列如seq id no.1所示。
4.根据权利要求1所述的重组大肠杆菌,其特征在于,所述的精氨酸激酶基因arg1来源于家牛bos taurus,其核苷酸序列如seq id no.4所示。
5.权利要求1所述的生产丁二胺的重组大肠杆菌的构建方法,其特征在于,包括如下步骤:
6.权利要求1~4任意一项所述的重组大肠杆菌在合成丁二胺中的应用。
7.根据权利要求6所述的应用,其特征在于,将重组大肠杆菌putfm接种至发酵培养基中进行发酵培养,发酵条件为在35~37℃、ph 7.0~7.3下共发酵48~60h。
8.根据权利要求7所述的应用,其特征在于,所述的发酵培养,当od600到达0.4时,加入iptg至终浓度125mm;当发酵培养基中初糖耗尽后,流加补料培养基,维持溶氧15%~35%、残糖含量1~5g/l、氨氮含量1~5g/l,继续进行发酵培养。
9.根据权利要求7所述的应用,其特征在于,所述的发酵培养基,其配方为:牛肉粉5~6g/l、酵母粉1~2g/l、葡萄糖25~30g/l、k2hpo4 3~5g/l、mgso4·7h2o 1.5~2g/l、feso4·7h2o 0.02~0.03g/l、mnso4·h2o 0.02~0.03g/l、生物素0.002~0.003g/l、vb10.002~0.003g/l、vb3 0.002~0.003g/l、vb5 0.002~0.003g/l、(nh4)2so4 11~15g/l、氯霉素5~10mg/l、青霉素5~10mg/l、甜菜碱0.5~2.5g/l。
10.根据权利要求8所述的应用,其特征在于,所述的补料培养基,分为补料a和补料b,其中,补料a的配方为:600~700g/l葡萄糖+2.25~3g/l甜菜碱,补料b的配方为:300~400g/l硫酸铵+180~200g/l谷氨酸钠。
技术总结
本发明属于生物技术领域,具体涉及一种生产丁二胺的重组大肠杆菌及其构建方法与应用。本发明通过从头合成牛源的精氨酸激酶基因ARG1和内源的大肠杆菌鸟氨酸脱羧酶基因SpeC,构建质粒pTrc99a‑ARG1‑SpeC并转化至大肠杆菌ARGFM,获得单质粒的重组大肠杆菌PUTFM。该菌在特定培养基中生长良好。发酵时,通过在特定时段加入诱导剂IPTG,内源及异源基因均表达稳定。该反应体系简单、条件温和、周期适宜、副产物少,且清洁无污染,是一条简单、快速、高效的生产途径,从发酵结果看,重组大肠杆菌PUTFM能够稳定生产含14.8g/L丁二胺的发酵液,具有较高的产业化前景。
技术研发人员:陈可泉,杜旻,王昕,王靖,刘张宇
受保护的技术使用者:南京工业大学
技术研发日:
技术公布日:2024/4/8
- 还没有人留言评论。精彩留言会获得点赞!