细胞培养基及其在制备鹿茸干细胞外泌体中的应用
本发明涉及细胞培养,具体涉及细胞培养基及其在制备鹿茸干细胞外泌体中的应用。
背景技术:
1、外泌体是一种存在于细胞或体液中的纳米级小囊泡(30-150nm)。由多囊泡体(mvbs)向内出芽产生,并在多囊泡体与质膜融合后分泌到细胞外。由于外泌体在许多生理和病理过程中是细胞间通信的重要介质,因此它们参与了广泛的功能活动,如蛋白质清除、免疫、炎症反应和信号传导等。
2、干细胞来源的外泌体已被证明可以用于多种疾病的治疗或组织再生修复,包括骨关节炎、皮肤损伤、烫伤、抑制肿瘤生长和认知障碍等。这主要是由于其固有的再生能力,能够诱导血管生成,促进增殖,防止细胞凋亡,抑制炎症反应。
3、然而,外泌体产量是制约外泌体大规模应用的关键原因之一。虽然目前已有多种方法能够提升一定的外泌体产量,如:改变基因表达、调整培养液ph、氧气浓度等,但在一定程度上使外泌体的性质发生了变化,偏离了原来的应用场景。因此,让有限的细胞产生更多的外泌体且不改变外泌体原有的性质具有重要的价值和意义。
技术实现思路
1、有鉴于此,本发明要解决的技术问题在于提供细胞培养基及其在制备鹿茸干细胞外泌体中的应用,本发明提供的细胞培养基能够有效提高鹿茸干细胞外泌体产量,制备获得的鹿茸干细胞外泌体能够促进细胞增殖、细胞迁移和血管生成。
2、本发明提供细胞培养基,包括重酒石酸去甲肾上腺素、青霉素、链霉素、胎牛血清和基础培养基。
3、本发明提供的细胞培养基适合于鹿茸干细胞及其外泌体的培养,相比较其他培养基,本发明提供的细胞培养基中各组分之间相互配合,为鹿茸干细胞的增殖提供了更加有利的营养体系,能够最大程度的提高鹿茸干细胞外泌体生产效率,从而获得更准确的技术效果。
4、在一些实施例中,包括基础培养基和以下浓度的组分:
5、重酒石酸去甲肾上腺素10~50μm,青霉素50~150 u/ml,链霉素0.01~0.5 mg/ml,胎牛血清5vol%~20vol%。
6、采用上述组分及浓度范围的细胞培养基与现有技术培养基进行外泌体增殖效率对比,在此浓度范围内,本发明提供的细胞培养基能够高效扩增鹿茸干细胞,进一步提高鹿茸干细胞外泌体生产效率,从而获得更准确的技术效果。
7、在一些实施例中,所述基础培养基为dmem培养基,所述胎牛血清为去除外泌体的胎牛血清。
8、在一些具体实施例中,包括基础培养基和以下浓度的组分:
9、重酒石酸去甲肾上腺素20μm,青霉素100 u/ml,链霉素0.1 mg/ml,胎牛血清10vol%。
10、实验表明,采用以上浓度的细胞培养基,扩增并制备鹿茸干细胞外泌体效率最高,制得的鹿茸干细胞外泌体促进细胞增殖、细胞迁移和血管生成的能力最好,从而获得更准确的技术效果。
11、本发明提供了所述的细胞培养基在制备鹿茸干细胞外泌体中的应用。
12、本发明提供了鹿茸干细胞外泌体的制备方法,取鹿茸干细胞以所述的细胞培养基培养、提取获得所述鹿茸干细胞外泌体。
13、在一些实施例中,所述鹿茸干细胞的制备方法包括如下步骤:
14、步骤1、取鹿生茸区骨膜组织,经洗涤、切碎后,加入基础培养基、离心、弃上清后获得第一沉淀物;
15、步骤2、取步骤1所述第一沉淀物,经消化溶液震荡消化、离心、弃上清后获得第二沉淀物;
16、步骤3、取步骤2所述第二沉淀物经fbs终止消化、离心、弃上清后获得第三沉淀物;
17、步骤4、取步骤3所述第三沉淀物接种至培养皿中,倒置置于饱和湿度培养箱中孵育后,加入完全培养基并正置培养至细胞生长汇合度至70%~80%后,获得所述鹿茸干细胞。
18、在一些具体实施例中,
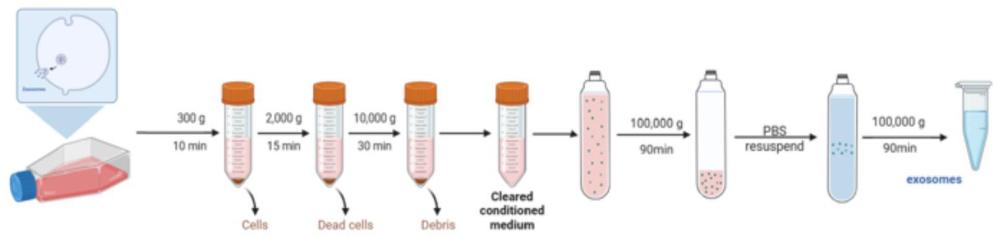
19、所述步骤1中,所述鹿生茸区骨膜组织取自健康8月龄雄性梅花鹿,在额骨上方采集开始发育变厚的生茸组织,放到含2-5倍体积的双抗的dmem 中保存,所述切碎包括使用无菌小切刀将所述鹿生茸区骨膜组织均匀切碎成1mm2左右组织块,所述基础培养基为dmem基础培养基;
20、所述步骤2中,所述消化溶液为10-100 u/ml的胶原酶i,所述消化溶液的添加体积为10~25ml,所述震荡消化采用37℃水浴震荡消化至多数组织块周围出现毛边,所述离心采用1000 rpm离心5 min;
21、所述步骤3中,所述终止消化的溶液包括10~25ml的包含10vol%fbs的完全培养基,所述离心采用1000 rpm离心5 min;
22、所述步骤4中,所述接种包括取所述第三沉淀均匀涂布在10 cm2培养皿中,加入约1~3 ml完全培养基,使细胞保持湿润,后倒置培养皿于37℃,5%co2,饱和湿度的培养箱中孵育2~4 h,加入5~10 ml完全培养基,正置后继续培养5~7天。
23、在一些实施例中,所述培养的步骤包括取所述鹿茸干细胞接种于培养瓶中,加入培养液培养2~5天,收集所述培养的上清液。
24、在一些具体实施例中,所述鹿茸干细胞的接种密度为1.0~1.5×106/75 cm2,所述完全培养基的体积为15ml,所述培养的条件包括在37℃,5% co2以及饱和湿度的细胞培养箱中培养72 h。
25、在一些实施例中,所述提取包括取所述培养的上清液经多次离心依次除去死细胞、细胞碎片、游离的细胞器后,经超高速离心获得所述鹿茸干细胞外泌体。
26、在一些具体实施例中,所述多次离心依次包括300 g离心10 min去除死细胞、2000g离心15 min除去细胞碎片、10000 g离心30 min去除游离的细胞器,所述超高速离心包括100000 g离心90 min沉淀获得所述鹿茸干细胞外泌体。
27、在一些具体实施例中,所述超高速离心的次数包括1~3次。
28、本发明提供了所述的制备方法制得的鹿茸干细胞外泌体。
29、本发明提供了所述的鹿茸干细胞外泌体在制备促进细胞增殖、细胞迁移和/或血管生成的药物中的应用。
30、本发明提供了促进细胞增殖、细胞迁移和/或血管生成的药物,包括所述的鹿茸干细胞外泌体。
31、本发明提供了细胞培养基及其在制备鹿茸干细胞外泌体中的应用,与现有技术相比,本发明具备以下效果:
32、1、与常规培养基相比,使用本发明的细胞培养基可以促进鹿茸干细胞更快地增殖,且外泌体产量提升2~3倍;
33、2、与其他促进外泌体产量的方法相比,如改变基因表达、改变培养液ph等,使用本研发的细胞培养基依旧维持ansc-exos原有性质,例如:形态、直径、分布范围、促进细胞增殖、诱导血管生成、细胞迁移的能力。
技术特征:
1.细胞培养基,其特征在于,包括基础培养基和以下浓度的组分:
2.根据权利要求1所述的细胞培养基,其特征在于,包括dmem培养基和以下浓度的组分:
3.权利要求1或2所述的细胞培养基在制备鹿茸干细胞外泌体中的应用。
4.鹿茸干细胞外泌体的制备方法,其特征在于,取鹿茸干细胞以权利要求1或2所述的细胞培养基培养、提取获得所述鹿茸干细胞外泌体。
5.根据权利要求4所述的制备方法,其特征在于,所述鹿茸干细胞的制备方法包括如下步骤:
6.根据权利要求4所述的制备方法,其特征在于,所述培养的步骤包括取所述鹿茸干细胞接种于培养瓶中,加入培养液培养2~5天,收集所述培养的上清液。
7.根据权利要求4所述的制备方法,其特征在于,所述提取包括取所述培养的上清液经多次离心依次除去死细胞、细胞碎片、游离的细胞器后,经超高速离心获得所述鹿茸干细胞外泌体。
8.权利要求4~7任一项所述的制备方法制得的鹿茸干细胞外泌体。
9.权利要求8所述的鹿茸干细胞外泌体在制备促进细胞增殖、细胞迁移和/或血管生成的药物中的应用。
10.促进细胞增殖、细胞迁移和/或血管生成的药物,其特征在于,包括权利要求8所述的鹿茸干细胞外泌体。
技术总结
本发明涉及细胞培养技术领域,具体涉及细胞培养基及其在制备鹿茸干细胞外泌体中的应用。与常规培养基相比,使用本发明的细胞培养基可以促进鹿茸干细胞更快地增殖,且外泌体产量提升2~3倍。与其他促进外泌体产量的方法相比,使用本发明的细胞培养基依旧维持AnSC‑exos原有性质,并进一步促进细胞增殖、诱导血管生成、细胞迁移的能力。
技术研发人员:李勋胜,孙红梅,岳志刚,王大涛,吕金朋,崔博
受保护的技术使用者:中国农业科学院特产研究所
技术研发日:
技术公布日:2024/11/28
- 还没有人留言评论。精彩留言会获得点赞!