催化分解N2O的催化剂及其制备方法和应用
本发明涉及氧化亚氮(n2o)直接催化分解的,具体而言,涉及催化分解n2o的催化剂及其制备方法和应用。
背景技术:
1、臭氧层是地球平流层中吸收太阳紫外线辐射的主要区域,可以保护地表生物免受紫外辐射的危害。氧化亚氮(n2o)是目前最重要的臭氧消耗物,减少n2o的排放将提高臭氧空洞的恢复速度,并减少人类活动对气候的压力。同时,n2o是一种温室气体,n2o虽然在大气中的浓度低(不到co2的1/1000),对温室效应的总体贡献小于二氧化碳,但是其温室效应潜能高达co2的310倍之多。大气中超过38%的n2o排放是人类活动的结果,因此,n2o的排放控制对减缓温室效应和臭氧消耗尤为重要。
2、工业活动是n2o减排的主要对象,主要包括硝酸和己二酸的生产。以硝酸厂的n2o减排为例,可以通过三级减排过程实现n2o的减排:
3、(1)一级减排:即源头治理,通过改进氨氧化催化剂的选择性或氨氧化或氨氧化的工艺条件,或是使用新型的硝酸生产工艺,减少n2o的形成。但硝酸生产工艺经过数十年的发展,已趋于成熟,难以短时间内在不降低氨氧化率的前提下提高其选择性的技术上有所突破;
4、(2)二级减排:在氨氧化室pt网下游安装n2o减排催化剂,去除气流中的n2o。这一级减排可以利用氨氧化室的高温环境,且对现有厂房设施的改动较少,但在氨燃烧炉内安装n2o催化剂可能导致氨氧化率的降低,进而影响硝酸的生产效率。
5、(3)三级减排:在吸收塔之后安装减排系统,以去除氨氧化室产生的n2o。对于三级减排过程,主要有以下三种技术可以实现n2o的减排:
6、高温直接分解法。高温分解法指无需催化剂,仅靠高温(通常在800℃以上)使n2o分子分解为n2和o2。这种方法能耗高,对设备要求高,且去除率较低,因此难以实现工业化。
7、选择性催化还原法。指在催化剂和还原剂的作用下,将n2o降解。还原剂通常可以使甲烷或氢气等。这种方法需要向系统中添加还原剂,很容易产生二次污染,并且还原剂的使用带来了额外的费用,增加了工艺的成本。
8、直接催化分解法。指在催化剂的作用下,将n2o分子直接分解为n2和o2,该方法能耗低,效率高,且不加入还原剂,没有二次污染,被认为是去除n2o的有效方法,是最有前景的方法。
9、直接催化分解法的核心在于催化剂的选择。n2o直接催化分解催化剂可以大致分为贵金属基催化剂、分子筛催化剂和金属氧化物催化剂。相比其他催化剂,金属氧化物催化剂具有成本低廉,且具有良好的氧化还原性能和热稳定性,已成为使用最为广泛的固体催化剂之一。在许多金属氧化物催化剂中,具有特异性尖晶石结构的co3o4催化剂由于具有良好的氧化还原性能和热稳定性而被认为是最有前景的催化剂之一。然而,未经改性的纯co3o4在成本和性能上无法满足n2o直接催化分解的需要。
技术实现思路
1、本发明的主要目的在于提供催化分解n2o的催化剂及其制备方法和应用,以解决现有技术中纯co3o4法满足n2o催化分解需求的技术问题。
2、为了实现上述目的,本发明首先提供了催化分解n2o的催化剂,技术方案如下:
3、催化分解n2o的催化剂,包括由co3o4和碱土金属碳酸盐复合而成的复合物。
4、作为本发明的催化剂的进一步改进,所述碱土金属碳酸盐为caco3、srco3、baco3中的任意几种。
5、为了实现上述目的,本发明其次提供了催化分解n2o的催化剂的制备方法,技术方案如下:
6、催化分解n2o的催化剂的制备方法,包括以下步骤:将可溶性钴盐、碱土金属碳酸盐的可溶性前驱盐、沉淀剂反应生成固液混合物,所述可溶性前驱盐与碳酸盐具有相同的碱土金属元素;所述沉淀剂含有碳酸根;收集、洗涤、干燥固液混合物中的沉淀;在空气中焙烧沉淀,即得到催化分解n2o的催化剂。
7、作为本发明的催化剂的制备方法的进一步改进,首先向沉淀剂溶液中滴加可溶性前驱盐溶液,老化5~20min,得到前驱液;然后向前驱液中滴加可溶性钴盐溶液,搅拌1.5~3h,即得到固液混合物。
8、作为本发明的催化剂的制备方法的进一步改进,可溶性钴盐、可溶性前驱盐和沉淀剂的反应在30~80℃下进行。
9、作为本发明的催化剂的制备方法的进一步改进,所述可溶性钴盐和可溶性前驱盐均为硝酸盐或盐酸盐;所述可溶性前驱盐溶液中碱土金属元素与可溶性钴盐溶液中钴元素的摩尔比为0.1~1。
10、作为本发明的催化剂的制备方法的进一步改进,沉淀剂采用碱金属的碳酸盐,洗涤时使沉淀剂中的碱金属元素残留部分在沉淀中。
11、作为本发明的催化剂的制备方法的进一步改进,焙烧温度为450~550℃,焙烧时间为2~4h。
12、为了实现上述目的,本发明进一步提供了催化分解n2o的方法,技术方案如下:
13、催化分解n2o的方法,采用上述的催化分解n2o的催化剂,或采用上述制备方法制备得到的催化分解n2o的催化剂。
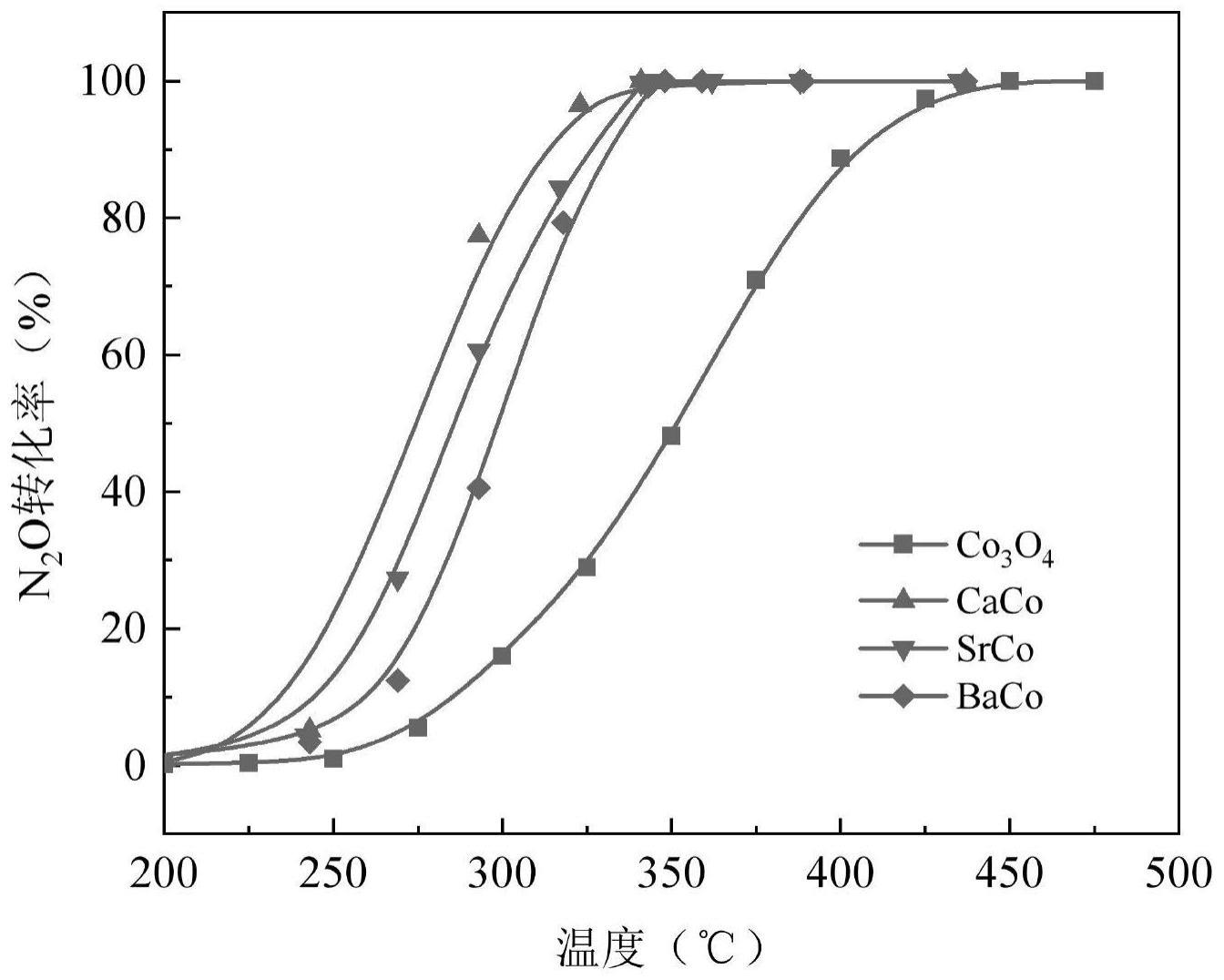
14、在本发明中,催化分解n2o的催化剂主要为由碱土金属碳酸盐和co3o4复合而成的负载型金属氧化物催化剂,利用金属氧化物和载体之间具有的强金属氧化物-载体相互作用(smosi),相较于单一的co3o4催化剂而言,活性、稳定性显著提升,成本显著降低。本发明的催化分解n2o的催化剂以碱土金属碳酸盐为载体,碱土金属碳酸盐(尤其是srco3)虽然不是常见的载体,但当引入到co3o4中时,可以显著增加co3o4组分的载流子和空穴浓度,进而提高co3o4组分的催化性能。进一步地是,本发明制备上述催化分解n2o的催化剂所采用的制备工艺简单,过程易控制,生产成本低廉。经过验证发现,本发明的催化分解n2o的催化剂在应用于n2o直接催化分解时表现出较好的低温催化活性,对杂质气体具备优异的耐受性,并且具有优异的稳定性,显著改善了co3o4应用于n2o直接催化分解时在成本和性能上的实用性,具有推广使用价值。
15、下面结合附图和具体实施方式对本发明做进一步的说明。本发明附加的方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
技术特征:
1.催化分解n2o的催化剂,其特征在于:包括由co3o4和碱土金属碳酸盐复合而成的复合物。
2.如权利要求1所述的催化分解n2o的催化剂,其特征在于:所述碱土金属碳酸盐为caco3、srco3、baco3中的任意几种。
3.权利要求1或2所述的催化分解n2o的催化剂的制备方法,其特征在于:包括以下步骤:
4.如权利要求3所述的制备方法,其特征在于:首先向沉淀剂溶液中滴加可溶性前驱盐溶液,老化5~20min,得到前驱液;然后向前驱液中滴加可溶性钴盐溶液,搅拌1.5~3h,即得到固液混合物。
5.如权利要求4所述的制备方法,其特征在于:可溶性钴盐、可溶性前驱盐和沉淀剂的反应在30~80℃下进行。
6.如权利要求4所述的制备方法,其特征在于:所述可溶性钴盐和可溶性前驱盐均为硝酸盐或盐酸盐;所述可溶性前驱盐溶液中碱土金属元素与可溶性钴盐溶液中钴元素的摩尔比为0.1~1。
7.如权利要求3所述的制备方法,其特征在于:焙烧温度为450~550℃,焙烧时间为2~4h。
8.催化分解n2o的方法,其特征在于:采用权利要求1或2所述的催化分解n2o的催化剂,或采用权利要求3-7之一所述制备方法制备得到的催化分解n2o的催化剂。
技术总结
本发明公开了催化分解N<subgt;2</subgt;O的催化剂及其制备方法和应用,解决了现有技术中纯Co<subgt;3</subgt;O<subgt;4</subgt;法满足N<subgt;2</subgt;O催化分解需求的技术问题。催化分解N<subgt;2</subgt;O的催化剂,包括由Co<subgt;3</subgt;O<subgt;4</subgt;和碱土金属碳酸盐复合而成的复合物。催化分解N<subgt;2</subgt;O的催化剂的制备方法,包括以下步骤:将可溶性钴盐、碱土金属碳酸盐的可溶性前驱盐、沉淀剂反应生成固液混合物,所述可溶性前驱盐与碳酸盐具有相同的碱土金属元素;所述沉淀剂含有碳酸根;收集、洗涤、干燥固液混合物中的沉淀;在空气中焙烧沉淀,即得到催化分解N<subgt;2</subgt;O的催化剂。催化分解N<subgt;2</subgt;O的方法,采用上述的催化分解N<subgt;2</subgt;O的催化剂,或采用上述制备方法制备得到的催化分解N<subgt;2</subgt;O的催化剂。
技术研发人员:刘勇军,张剑北
受保护的技术使用者:四川大学
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!