检测环境中甾体类激素的光学生物传感器的制备方法及应用与流程
本发明属于属于微生物检测技术领域。
背景技术:
甾体类激素是含有环戊烷多氢菲骨架结构的环戊烷多氢菲衍生物,包括性激素与肾上腺皮质激素,在维持生命、调节性功能、免疫疾病治疗及生育控制等方面有着极其重要的作用。研究表明,人类和畜禽的排泄物中含有未被分解的甾体类激素如性激素、人工合成激素类药物等大量排入环境中,人工合成激素类物质能够模仿生理激素对生物体产生诱导反应,干扰体内代谢信号通路,属于一类致癌物质。
目前,对于环境甾体类激素的检测主要以液相与质谱等大型进口仪器为主,价格昂贵、操作复杂、仅适用于实验室环境检测,并且仅能检测单一组分的已知环境甾体类激素污染物,因此迫切需要建立一种快速、灵敏、高通量、实时、原位检测环境甾体类激素总量的新方法。睾丸酮丛毛单胞菌(c.testosteroni,c.t.)atcc11996中3α-羟类固醇脱氢酶/碳酰基还原酶(3α-hsd/cr)在甾体类激素代谢途径中发挥至关重要的作用。其基因上游含有10bp回文操纵序列,其基因附近还有一个与3α-hsd/cr基因方向相反的阻遏蛋白基因repa,在没有甾体类激素时,阻遏蛋白repa与10bp回文序列基因相结合,抑制3α-hsd/cr的表达;当有甾体类激素存在时,阻遏蛋白repa与甾体类激素特异性结合,构象发生改变,从回文序列基因脱离,启动3α-hsd/cr基因的表达功能。
本发明基于c.t.菌甾体类激素代谢途径前期研究基础,即阻遏蛋白repa与回文序列基因及甾体类激素的特异性结合,采用光干涉生物亲和性检测技术建立一种非标记光学原理的甾体类激素检测新方法。通过监测dsdna与repa的相互作用引起光谱信号偏移,获得结合解离曲线,非线性拟合获得相互作用动力学参数;同时建立dsdna、repa与甾体类激素间的抑制检测法,以最大响应信号与甾体类激素浓度建立定量关系,实现甾体类激素的定量检测,为环境监测领域的生物应用提供新方法。
技术实现要素:
本发明的目的是:提供一种检测环境中甾体类激素的光学生物传感器的制备方法及应用,该传感器表面经亲和素修饰后,可以与生物素标记的能够结合甾体激素的dsdna结合,形成具有物质特异性的生物传感膜,采用光干涉生物亲和性检测技术建立一种非标记光学原理的甾体类激素检测方法,通过监测dsdna与repa的相互作用引起光谱信号偏移,获得结合解离曲线,非线性拟合获得相互作用动力学参数;同时建立dsdna、repa与甾体类激素间的抑制检测法,以最大响应信号与甾体类激素浓度建立定量关系,实现甾体类激素的定量检测。
本发明的技术方案如下:
光学生物传感器,由以下部分组成:石英光纤探针,亲和素,生物素标记的特异dna序列,以及能够与环境中甾体类激素结合的特异蛋白。光学生物传感器的制备方法是:
1)利用共价偶联技术将亲和素固定至石英光纤的底端,然后将能够与甾体类激素发生特异性结合反应的生物素修饰的dsdna包被于亲和素表面,作为传感器的传感膜。
2)将传感器的传感膜放入到不含有甾体类激素以及激素结合蛋白的样品孔中,用于观察探针的稳定性,作为下一步反应的基线。
3)然后将传感器置于不同浓度的含有甾体类激素以及激素结合蛋白的样品孔中,未与激素结合的蛋白就会与探针表面固定的特异性分子发生结合反应。
4)随后将传感器重新置于被测分子的稀释溶液中,激素结合蛋白与探针表面固定的特异性分子发生解离反应
5)对每个浓度的结合解离曲线进行分析获得对应的亲和常数。
更为详细较优的制备方法是:
1)通过共价交联法,将具有信号放大效应的链霉亲和素(sa)蛋白固定到光纤探针制备生物亲和性检测sa光纤探针,使得光纤探针能够与生物素标记的特异的dna序列结合。
2)通过退火的形式,对合成的单链dna进行复性,获得生物素标记的双链dna(biothin-dsdnaop1)。
3)将得到的biothin-dsdnaop1再进行倍比稀释,分别固定于光纤探针sa表面,光纤探针表面dsdna自组装达到饱和状态,光谱响应信号不再变化,得到最佳的包被浓度。
4)将生物素修饰的光纤探针固定至biothin-dsdnaop1,检测最大响应信号的相对标准偏差。
5)将梯度稀释的的睾丸酮标准品与repa提前孵育,然后将制备好的光纤探针插入到样品孔中,通过仪器对干涉光谱进行监测,若光谱出现漂移,则证明环境中存在甾体类激素。
本发明的应用是:
检测环境中甾体类激素的技术利用白光干涉生物分子相互作用检测系统对环境中甾体类激素含量做出判断。
本发明的有益效果如下:
高特异性:本发明中使用dna和蛋白质均具有结合特异性,即该蛋白能够与环境中的甾体类激素结合,该蛋白只能与特定序列的dna分子结合,当蛋白与甾体类激素结合后导致构象改变从而失去与特定的dna序列的结合能力。因此,可以用于检测环境中甾体类激素的含量。
高灵敏度:本发明能够检测到的环境中甾体类激素的最低检测限为0.45ng/ml。
生物安全性:本发明检测环境中甾体类激素的过程中不会对环境造成污染。
同时该方法操作简便,只需要21min即可输出数据,实现对环境中甾体类激素的快速灵敏准确的检测。
附图说明
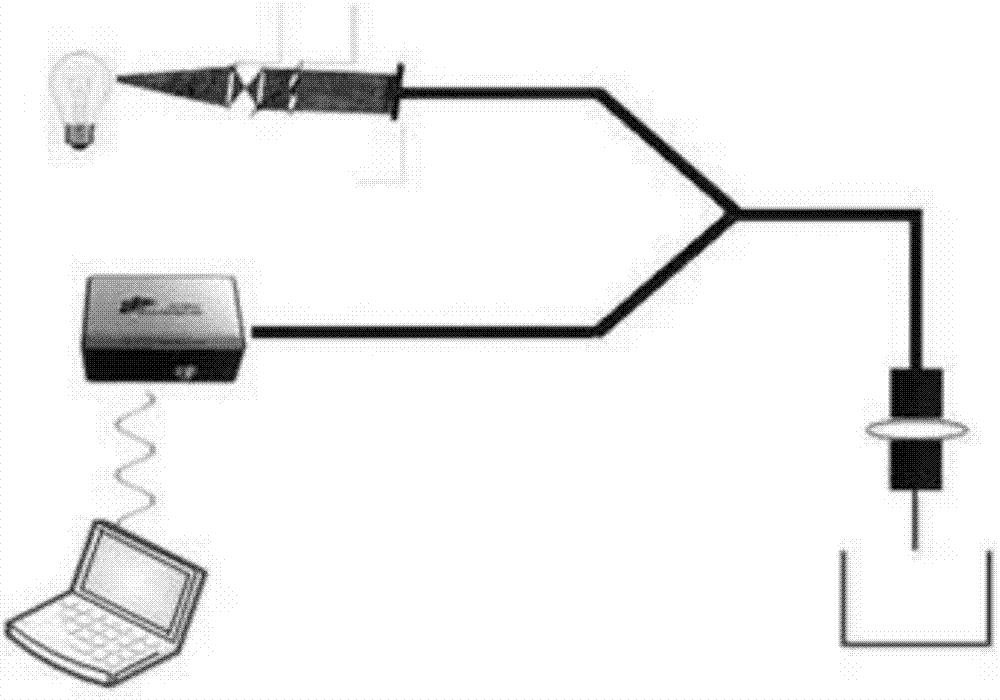
图1.为本发明搭建的固相表面增强干涉分子相互作用检测仪;
图2.固相表面增强干涉分子相互作用检测原理图;
图3.本发明中光学生物探针检测环境中甾体类激素的操作步骤示意图;
图4.表达及纯化的repa蛋白分子的电泳图;
图5.双链dna在sa光纤探针表面固定的最适浓度;
图6.sa光纤探针表面固定biotin-op1最大响应值;
图7.睾丸酮丛毛单胞菌中的dsdnaop1与阻遏蛋白repa相互作用结合与解离反应曲线;
图8.抑制法睾丸酮标准品定量检测反应曲线;
图9.抑制法睾丸酮定量检测标准曲线。
图10.表一睾丸酮丛毛单胞菌中的dsdnaop1与阻遏蛋白repa相互作用动力学参数;
图11.表二hplc方法检测水样中甾体类激素含量及加标回收实验;
图12.表三非细胞体系生物化学发光传感器方法检测水样中甾体类激素含量及加标回收实验;
图13.表四光干涉抑制法检测水样中甾体类激素含量及加标回收实验。
具体实施方式
实施例1
下面结合附图对本发明做进一步描述:
1.仪器:采用基于固相表面增强光干涉的生物分子相互作用检测仪试剂:睾丸酮标准品(testosterone);5’-biotin修饰单链dna片段op1;阻遏蛋白repa原核表达菌株bl21-pet-15b-repa;超纯水(电阻≥18.2mω.cm);
2.利用阻遏蛋白repa原核表达菌株bl21-pet-15b-repa表达出能够与睾丸酮特异结合的repa蛋白,结果如图3所示。合成单链dna(ssdna)10od,其5’末端标记生物素(biotin)。
op1:5’bioin-gcagctcggccatgtcaaagcccagcggccccgcgccc
3.制备采用下列步骤:选用的石英光纤探针的底面作为传感器的传感元件,通过共价交联法将sa蛋白固定到光纤探针下端,将光纤探针插入到含有dsdna的溶液中,利用亲和素和生物素之间的特异结合能力,将生物素化的dsdna固定于探针上获得作为传感器的传感膜,与原核表达的repa蛋白共同组成光学生物传感器。
1)光纤探针修饰:通过5%aptes与2.5%戊二醛共价交联法,将具有信号放大效应的链霉亲和素(sa)蛋白固定到光纤探针的光干涉传导膜层sio2薄膜表面,制备生物亲和性检测sa光纤探针。
2)获得生物素标记的dsdna:将长度为38nt的生物素标记的op1
(ssdna)通过退火形成双链dna(dsdna)。
3)确定dsdna的最佳包被浓度:dsdnaop1在0.125-4μm倍比稀释浓度范围内,分别固定于sa光纤探针表面,达到平衡后的光谱响应信号值如图5所示,最适浓度为1μm时,光纤探针表面dsdna自组装达到饱和状态,光谱响应信号不再变化。
4.采用固定有dsdnaop1的sa光纤探针,检测dsdnaop1与repa的亲和性。相互作用曲线如图7所示,a-g为dsdnaop1与91.776-1.434μg/ml浓度范围内倍比稀释repa的结合与解离反应曲线,h为1μm阴性对照dsdnaco与91.776μg/mlrepa的结合与解离反应曲线,i为dsdnaop1在pbs-t缓冲液空白对照中的反应曲线。对每个浓度结合曲线做
5.将不同浓度睾丸酮标准品与repa提前孵育,封闭repa激素结合位点,改变repa蛋白构象,从而无法与dsdnaop1发生特异性结合反应。抑制法检测甾体类激素反应过程曲线如图8所示,a为预混溶液中不含睾丸酮的空白对照曲线;b-k为预混溶液中含有终浓度为
0.534-546.500ng/ml范围内倍比稀释的睾丸酮标准品反应曲线;m为预混溶液中含有终浓度为1093ng/ml的睾丸酮标准品反应曲线,最大信号响应值与睾丸酮浓度呈负相关。
每浓度重复测定3次,定量检测标准曲线如图9所示,检测时间为24min,睾丸酮标准品在0.534-546.500ng/ml浓度范围内,标准曲线方程符合logistic四参数非线性拟合,r2=0.988。空白对照为100μlrepa与100μlpbs-t预混匀孵育,最低检测限(lod)为空白对照响应值3sd对应的睾丸酮浓度,经实验为0.450ng/ml,定量限(loq)为空白对照响应值10sd对应的睾丸酮浓度,经实验为2.351ng/ml。6.三种方法对采集水样甾体类激素检测结果如表表二至表四所示。结果表明,hplc方法对水样中睾丸酮单一物质无检出;其它两种方法检测的是甾体类激素总量,分别为45.81ng/l和51.30ng/l。
在加标回收实验中,本文建立的光干涉抑制法检测甾体类激素总量的相对标准偏差rsd为5.60%-12.65%,加标回收率cv为
94.40%-110.14%。
通过三种方法对水样甾体类激素的检测结果与加标回收实验结果对比,说明光干涉抑制法在总量检测方面优于hplc方法,在检测方法精密度与准确度方面优于非细胞体系生物化学发光传感器检测方法。如同图11、12、13。
seqno1:5’bioin-gcagctcggccatgtcaaagcccagcggccccgcgccc
seq
no2:mhiacgrahqkgddrrhlgrlgtaahgrnelgngfaiarvlqarlqqgslgctggdgvqahaslapgggafahshrqsilaarigqisallsrmfdngaglgflagfqcqrqwvlvksqmrgshgrdddgcglmaffqrwqkgihqlgrakiidrnhiakhlglrsqagaqhqavhalaalrqyignrllstfgrreignhfriayidaydlvtgrlqdlarsrtnaggaaayhddghvlspfvwvvmahikahheqpgymqtddviplgkiyrgpsytgatfaceetshvppslpahhhwphhpeepdsdglhayraggsgagfreagpllyracpgraaahrhrglrrqrvgagharacgvldavharaggpapphhrrracrraisscrccmwaatttaaaasrkqralqaqqpqla
〈110〉长春理工大学
〈120〉检测环境中甾体类激素的光学生物传感器的制备方法及应用
〈160〉2
〈210〉1
〈211〉1263
〈212〉dna
〈213〉睾丸酮丛毛单胞菌(comamonastestosteroni)
〈220〉
〈221〉cds
〈222〉(1)...(1260)
〈223〉该dna序列共有1263bp,其中第1261-1263位为终止密码子taa、第1-1260编码成熟,该成熟含有420个氨基酸。
〈400〉1
atgcacatagcttgcggccgggctcatcaaaaaggcgatgaccga45
methisilealacysglyargalahisleulysglyaspasparg
cgccatctcggacggctcggcacggcggcccatgggaggaacgaa90
arghisleuglyargleuglythralaalahisglyargasnglu
cttggcaatggattcgccatagcgcgggtcctgcaggcccgcctg135
leuglyasnglyphealailealaargvalleuglnalaargleu
cagcaagggagtctcggttgcaccgggggcgatggtgttcaggcg180
glnleuglyserleuglycysthrglyglyaspglyvalglnala
cacgccagcctcgccccaggcggcggcgcgtttgcgcacagccac225
hisalaserleualaproglyglyglyalaphealahisserhis
cgtcaaagcattcttgctgcccgcataggccagatttccgccctg270
argleuserileleualaalaargileglyglnileseralaleu
ctctcccgcatgttcgacaatggcgcgggccttggcttcctcgcc315
leuserargmetpheaspasnglyalaglyleuglypheleuala
ggcttccagtgccagcgccagtgggttcttgtcaaaagccagatg360
glypheglncysglnargglntrpvalleuvallysserglnmet
cgcggaagccacggacgagatgacgacggctgcgggctgatggcc405
argglyserhisglyargaspaspaspglycysglyleumetala
ttttttcagcgctggcaaaaaggcatccatcagctcggtcgcgcc450
phepheglnargtrpleulysglyilehisglnleuglyargala
aaaataattgaccgaaaccacattgccaagcaccttggtctgcgg495
lysileileaspargasnhisilealalyshisleuglyleuarg
tcccaggccggcgcacagcaccaggccgtccatgcccttgctgca540
serglnalaglyalaglnhisglnalavalhisalaleualaala
cttcgccagtacatcggcaatcgcctgctttcgaccttcggccgt585
leuargglntyrileglyasnargleuleuserthrpheglyarg
cgagagatcggcaatcacttccgcatcgcgtatatcgatgcctac630
arggluileglyasnhispheargilealatyrileaspalatyr
gatctggtgaccggccgcctccaggaccttgcgcgtagccgcacc675
aspleuvalthrglyargleuglnaspleualaargserargthr
aatgccggtggcgcagccgcttatcacgatgatggacatgtcttg720
asnalaglyglyalaalaalatyrhisaspasphishisvalleu
tctccttttgtctgggtggtgatggcgcacatcaaagcccatcat765
serprophevaltrpvalvalmetalahisilelysalahishis
gaacaaccaggctacatgcaaacggacgatgtaattcccctaggg810
gluleuproglytyrmetleuthraspaspvalileproleugly
aaaatttaccgtggcccttcctacactggcgcaacgtttgcgtgt855
lysiletyrargglyprosertyrthrglyalathrphealacys
gaggaaaccagccatgtacccccatctcttccagcccatcaccat900
glugluthrserhisvalproproserleuproalahishishis
tggccacatcaccctgaagaaccggattctgatgggctccatgca945
trpprohishisproglugluproaspseraspglyleuhisala
taccgggctggaggatcaggcgcagggtttcgagaagctggccct990
tyrargalaglyglyserglyalaglypheargglualaglypro
cttctataccgagcgtgcccgggaagggctgcagctcatcgtcac1035
leuleutyrargalacysproglyargalaalaalahisarghis
cgggggcttcggcgtcaacgagtgggcgctgggcatgcccgagca1080
argglyleuargargleuargvalglyalaglyhisalaargala
tgcggagttctcgacgctgtgcacgccagagcaggcggcccggca1125
cysglyvalleuaspalavalhisalaargalaglyglyproala
ccgcctcatcaccgacgccgtgcatgccgaagagccatatcctca1170
proprohishisargargargalacysargargalaileserser
tgcaggtgctgcatgtgggccgctacgaccacggcagcggcggcg1215
cysargcyscysmettrpalaalathrthrthralaalaalaala
tctcgcaagcagcgtgctctccaagctcagcagccgcagctcgcg1260
serarglysglnargalaleuleualaglnglnproglnleuala
- 还没有人留言评论。精彩留言会获得点赞!