一种心肌肌钙蛋白I的检测试剂盒及其制备方法与流程
本发明涉及生物检测领域,具体涉及一种心肌肌钙蛋白i的检测试剂盒及其制备方法。
背景技术:
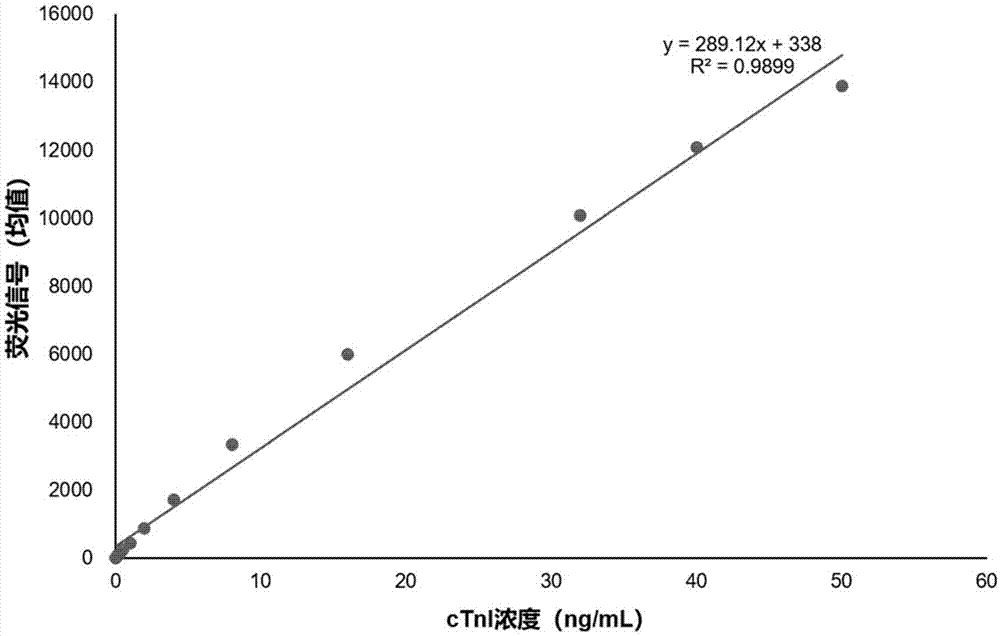
:心肌肌钙蛋白i(cardiactroponini,ctni)是心肌肌钙蛋白的亚单位,存在于心肌肌原纤维细肌丝上,是心肌细胞特有的结构蛋白。在正常情况下,血液中的ctni含量很低,当发生心肌损伤时,ctni迅速释放入血液中,致使血液中的ctni含量增高。心肌细胞损伤3小时~5小时,外周血中出现ctni升高,12小时~24小时达峰值,持续时间长,可达5天~8天,10天左右基本恢复正常。心肌肌钙蛋白i可作为急性心肌梗死(ami)的临床辅助诊断,急性冠状动脉综合征(acs)近期危险分级、预后评估及动态监测的指标。ctni常用的检测方法有elisa法、化学发光法、免疫层析法等。elisa方法检测周期长;化学发光法价格昂贵,需有专门仪器和专业人员操作,只适用于中心实验室使用,检测周期较长,不能满足临床快速检测的需要,也不适用于中小医院尤其是没有中心实验室的社区医院与乡镇医院;而荧光免疫层析法能够对急诊样本实现快速定量检测。目前,现有技术中关于心肌肌钙蛋白i免疫层析测定方法存在灵敏度较低、检测的浓度范围较小等问题,因此,开发高效的心肌肌钙蛋白检测试剂和检测方法具有重要意义。技术实现要素:为解决现有技术中存在的问题,本发明的目的是提供一种心肌肌钙蛋白i的检测试剂盒及其制备方法。本发明提供一种心肌肌钙蛋白i的检测试剂盒,所述试剂盒包括检测抗体以及示踪物标记的捕获抗体,所述捕获抗体为分别结合心肌肌钙蛋白i不同位点的两种单克隆抗体,所述检测抗体为心肌肌钙蛋白i的多克隆抗体。具体地,本发明所述的捕获抗体为与心肌肌钙蛋白i的结合位点分别为如seqidno.1所示的氨基酸序列的41-49位、83-93位和190-196位中的任意两种单克隆抗体。优选地,所述捕获抗体的两种单克隆抗体与心肌肌钙蛋白i的结合位点分别为如seqidno.1所示的氨基酸序列的41-49位和83-93位。本发明所述的心肌肌钙蛋白i的氨基酸序列如seqidno.1所示,本发明所述的单克隆抗体与心肌肌钙蛋白i的结合位点均以如seqidno.1所示氨基酸序列为依据计算。本发明所述的单克隆抗体和多克隆抗体可以为市售的抗体或采用本领域抗体制备的常规手段制备得到的单克隆抗体或多克隆抗体。本发明所述的示踪物为荧光微球。所述荧光微球的荧光物质包括但不限于稀土元素、荧光素、半导体量子点、碳量子点。优选地,所述荧光微球掺杂稀土镧系元素中的一种或多种,所述荧光微球的粒径为100~300nm。所述稀土镧系元素包括但不限于铕(eu)、钐(sm)、铒(er)、钕(nd)。作为本发明的优选实施方式,所述荧光微球掺杂有稀土镧系元素铕(eu)作为荧光物质;所述荧光微球粒径为150nm~200nm。本发明所述的荧光微球修饰有氨基或羧基,优选为羧基修饰。本发明所述的荧光微球可以为市售或利用本领域常规技术手段制备得到的荧光微球。优选地,所述荧光微球为聚苯乙烯荧光微球、聚磷腈荧光微球、三聚氰胺甲醛荧光微球、脲醛树脂荧光微球、二氧化硅荧光微球中的任意一种;更优选地,所述荧光微球为聚苯乙烯荧光微球。本发明所述的试剂盒还包括稀释液,所述稀释液包括聚乙烯吡咯烷酮(pvp)。具体地,所述稀释液包括聚乙烯吡咯烷酮和吐温-20。优选地,所述稀释液包括聚乙烯吡咯烷酮和吐温-20,还包括甘氨酸、氯化钠、bsa、酪蛋白、海藻糖中的一种或多种。更优选地,所述稀释液包括如下组分:甘氨酸、氯化钠、bsa、酪蛋白、海藻糖、吐温-20、pvp-40和proclin-300(pc-300)。作为本发明的优选实施方式,所述稀释液包括如下组分:甘氨酸0.1~0.5mol/l,氯化钠0.1~1.0%,bsa1~2%,酪蛋白0.1~0.5%,海藻糖1~3%,吐温-200.3~0.8%,pvp-400.3~1.0%,proclin-3000.1~0.5%,ph7.0~7.5。本发明所述的稀释液用于稀释反应液,以获得反应液的工作浓度。作为本发明的优选实施方式,本发明所述的试剂盒包括试纸卡、反应液和稀释液;所述试纸卡包括如下组分:底板、样品垫、硝酸纤维素膜和吸水垫,所述硝酸纤维素膜上含有所述检测抗体划线得到的检测线和异硫氰酸荧光素标记的bsa划线得到的质控线;所述反应液中含有荧光微球标记的捕获抗体和荧光微球标记的异硫氰酸荧光素抗体;所述稀释液包含聚乙烯吡咯烷酮和吐温-20。本领域技术人员应当理解,本发明所述的荧光微球标记的捕获抗体和荧光微球标记的异硫氰酸荧光素抗体可以制备为不同的形式作为试剂盒的组分,包括但不限于如下形式:(1)制备为本发明优选实施方式中的反应液的形式,在使用时可以预先将样品与反应液进行混合处理,再加样至试纸卡进行检测;(2)制备为结合垫的形式:将荧光微球标记的捕获抗体与荧光微球标记的异硫氰酸荧光素单克隆抗体混合后均匀喷涂在固相载体上,制备成结合垫。以上两种方式虽然会导致试剂盒组分的名称不同,但是其实质均为采用荧光微球标记的捕获抗体与荧光微球标记的异硫氰酸荧光素单克隆抗体混合制备得到的,因此,均在本发明的保护范围内。本发明还提供一种心肌肌钙蛋白i的检测试剂盒的制备方法,包括反应液的制备和试纸卡的制备;所述反应液中荧光微球标记的捕获抗体的制备方法包括如下步骤:(1)荧光微球的活化;(2)取心肌肌钙蛋白i单克隆抗体41-49和83-93混合作为捕获抗体,所述单克隆抗体41-49和83-93的质量比为1:1,将捕获抗体加入至活化的荧光微球溶液中进行标记反应;(3)在步骤(2)得到的荧光微球标记的捕获抗体中加入bsa处理,终止标记反应,得到荧光微球标记的捕获抗体。反应液中的荧光微球标记的异硫氰酸荧光素抗体的制备方法同荧光微球标记的捕获抗体的制备方法。本发明所述的试剂盒中的试纸卡为将所述的样品垫、硝酸纤维素膜和吸水垫固定于底板上制备得到;所述硝酸纤维素膜的制备方法包括如下步骤:(1)检测线和质控线的制备:将所述检测抗体在硝酸纤维素膜上划线得到检测线;将异硫氰酸荧光素标记的bsa在硝酸纤维素膜上划线得到质控线;(2)将步骤(1)得到的包被有检测线和质控线的硝酸纤维素膜干燥备用。作为本发明的一种优选实施方式,所述试剂盒的制备方法包括如下步骤:(1)样品垫的制备:将玻璃纤维膜用吐温-20溶液处理后干燥,得到样品垫;(2)反应液的制备:①荧光微球标记的捕获抗体的制备:使用mes(2-吗啉乙磺酸)溶液稀释荧光微球,加入edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)溶液活化荧光微球20min,得到活化的荧光微球;取心肌肌钙蛋白i单克隆抗体41-49和83-93混合作为捕获抗体,所述单克隆抗体41-49和83-93质量比为1:1,将捕获抗体加入至已活化好的荧光微球溶液中混匀搅拌2小时,在得到的荧光微球标记的捕获抗体中加入bsa处理,终止标记反应,离心得到的沉淀即为荧光微球标记的捕获抗体。②荧光微球标记的异硫氰酸荧光素抗体的制备:取异硫氰酸荧光素抗体加入至已活化好的荧光微球溶液中混匀搅拌2小时,加入bsa处理,终止标记反应,离心得到的沉淀即为荧光微球标记的异硫氰酸荧光素抗体。将上述制备得到的荧光微球标记的捕获抗体和荧光微球标记的异硫氰酸荧光素抗体混合,加入适量所述稀释液重悬即得反应液。用于检测时本领域技术人员可以根据样品的实际情况和检测的具体情况,将本发明所述试剂盒中的反应液采用本发明所述的稀释液稀释为不同的工作浓度用于样品的检测。作为本发明的优选实施方式,所述反应液的稀释倍数为5~20倍。(3)硝酸纤维素膜的制备:将心肌肌钙蛋白i的多克隆抗体在硝酸纤维素膜上划线得到检测线;将异硫氰酸荧光素标记的bsa在硝酸纤维素膜上划线得到质控线;将包被有检测线和质控线的硝酸纤维素膜干燥备用。(4)试纸卡的制备:将步骤(1)、(3)制备得到的样品垫、硝酸纤维素膜与吸水垫从左向右依次粘贴于塑料底板上,经剪裁得到试纸卡。本发明还提供所述的试剂盒或所述的制备方法制备得到的试剂盒在检测心肌肌钙蛋白i中的应用。本发明的有益效果在于:本发明通过筛选合适的心肌肌钙蛋白i免疫层析方法检测的捕获抗体、检测抗体及其组合方式,发现当捕获抗体选择心肌肌钙蛋白i单克隆抗体41-49和83-93的组合,检测抗体选择心肌肌钙蛋白i多克隆抗体时,同时辅以含有聚乙烯吡咯烷酮的稀释液,显著提高了检测的灵敏度和检测的线性范围,可以实现0.05~50ng/ml浓度范围的心肌肌钙蛋白i的检测,同时保证了检测的准确性和精密度,可用于心肌肌钙蛋白i的高效检测。附图说明图1为实施例2中检测的标准曲线图。具体实施方式下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到,其中,心肌肌钙蛋白i的所有单克隆抗体和多克隆抗体均购自海肽生物公司。实施例1检测试剂盒的制备1、样品垫的制备:样品垫选用玻璃纤维膜,将玻璃纤维素膜置于白色的pvc板上,配制0.1%吐温-20溶液作为样品垫处理液,按照45μl/cm2的处理量将样品垫处理液均匀撒落在玻璃纤维素膜上,均匀涂抹硝酸纤维素膜的正面和反面,至没有任何白点为止,然后放置于纱窗上室温平衡60min±15min。,置于37℃干燥30-72小时;2、反应液的制备:(1)聚丙乙烯荧光微球(以eu为荧光物质,荧光微球的粒径为200nm,荧光微球含有羧基修饰)用20mmmes(2-吗啉乙磺酸)(ph6.0)稀释10倍,超声1min;(2)用20mmmes溶液(ph6.0)配置5mg/ml的edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)溶液;(3)将edc溶液加入至超声处理的荧光微球中(用量为1mg荧光微球使用0.02mgedc),混合均匀,反应10min-30min进行荧光微球的活化;(4)将活化好的荧光微球进行超声处理,离心弃上清;(5)荧光微球沉淀用20mmmes(ph6.0)稀释10倍,超声均匀;(6)取两株ctni单克隆抗体41-49和83-93混合作为捕获抗体,两株单克隆抗体的质量比为1:1,混合抗体快速加入步骤(5)制备的荧光微球中(1mg荧光微球使用0.04mgctni单克隆抗体41-49与0.04mgctni单克隆抗体83-93),混合均匀,室温标记2-3小时。(7)将得到的荧光微球标记抗体超声处理,加入2%bsa处理1小时,终止标记反应,超声处理,离心弃上清。异硫氰酸荧光素单克隆抗体的标记荧光微球方法如上所述。(8)反应液制备:将上述制备得到的荧光微球标记的捕获抗体与荧光微球标记的异硫氰酸荧光素单克隆抗体混合,加入少量稀释液重悬,制备得到反应液;3、硝酸纤维素膜的处理(1)检测线的制备:将心肌肌钙蛋白i的多克隆抗体(检测抗体)用包被缓冲液(10mmpbs,2%海藻糖,0.1%pc300)稀释至浓度为2.0mg/ml,将稀释后的抗体以1.0μl/cm的含量在硝酸纤维素膜上划线得到检测线。(2)质控线的制备:称取40mgbsa,用0.025mk2co3溶液配置浓度为10mg/ml的bsa溶液,装入透析袋(d6mm12-14kd)中夹好备用。称取8mg异硫氰酸荧光素,用0.01mpbs(ph7.4)配置成浓度为0.1mg/ml异硫氰酸荧光素溶液装入100ml烧杯中,放入转子。将装有bsa溶液的透析袋放入装有异硫氰酸荧光素溶液烧杯中,2-8℃透析搅拌24小时后,取出透析袋中的溶液装入7ml玻璃瓶中,加入0.004mlpc300,异硫氰酸荧光素标记的bsa溶液的终浓度为10.0mg/ml。将质控线包被缓冲液(10mmpbs,2%海藻糖,0.1%pc300)移至操作台上,先准确量取所需质控线包被缓冲液加入至相应洁净容器中,再量取所需异硫氰酸荧光素bsa标记溶液加入至相应的质控线包被缓冲液中,混匀,使其终浓度1.0mg/ml,以0.8μl/cm的含量在硝酸纤维素膜上划线得到质控线。质控线距离pvc底板下端47mm,检测线距离pvc底板下端42mm,质控线与检测线平行设置,两者间距离为5mm左右。(3)将处理好的硝酸纤维素膜置于55℃干燥3天,干燥好的硝酸纤维素膜封袋备用。4、试纸卡的组装:8cm塑料底板和吸水垫为本领域试纸卡制备通用的部件。将上述制备得到的样品垫、包被有检测线和质控线的硝酸纤维素膜以及吸水垫自左向右依次粘贴在塑料底衬上,将贴好的中间物用斩切机切成4.0mm宽度的试剂条装入卡中,得到检测的试纸卡。5、稀释液的制备:稀释液的配方如下:0.12mol/l甘氨酸,0.85%氯化钠,1%bsa,0.15%酪蛋白,2%海藻糖,0.5%吐温-20,0.5%pvp-40,0.5%pc300,ph7.5。实施例2试剂盒检测的灵敏度分析1、ctni检测标准品的制备将ctni抗原标准品用正常人血清作为稀释液分别配制浓度为0ng/ml和50ng/ml的标准品;将两种浓度的ctni标准品溶液依次按照一定浓度进行混合,分别制备0~50ng/ml的浓度梯度的ctni检测标准品。2、检测反应将实施例1制备的试剂盒中的反应液以稀释液稀释10倍后加入步骤1得到的各浓度的检测标准品60μl,充分混匀5s~10s。分别吸取上述各浓度的检测标准品与反应液的混合液90μl,滴加到检测试纸卡样品垫上的加样孔中,取样时注意避免吸入气泡,室温放置15分钟。3、荧光信号的检测:将试纸卡置于maccurar01干式荧光免疫分析仪中获取荧光信号强度,并绘制相应的标准曲线。检测标准品的荧光信号强度如表1所示,依据此制作的标准曲线如图1所示,结果表明,以ctni单克隆抗体41-49和83-93作为捕获抗体,以ctni多克隆抗体作为检测抗体,试纸卡的检测的线性范围较大,在ctni浓度为0.05ng/ml~50ng/ml时,检测的荧光信号和标准品的浓度具有很好的线性关系(r2=0.9899)。试剂盒检测ctni的灵敏度为0.05ng/ml,检测的上限为50ng/ml。表1不同浓度ctni标准品的荧光信号强度ctni浓度(ng/ml)荧光信号(均值)0110.05400.125830.251350.5236144228674170883337165980321007540120905013892表1中荧光信号均值为3次检测的荧光信号的平均值实施例3试剂盒检测的准确度和精密度分析利用实施例1制备得到的试剂盒进行3份临床血清样本的ctni的检测。根据三份样本中ctni的含量高低分为低值、中值和高值三组,其中低值定值样本临床测量值为0.15ng/ml,中值定值样本临床测量值为0.57ng/ml,高值定值样本临床测量值为l.89ng/ml。对3份定值样本各进行重复测定10次,检测结果如表2所示。结果显示,采用实施例1制备的试剂盒进行3份定值样本的检测,其检测结果与临床测量值十分接近(10次检测的平均值与临床测量值相差仅在0.01ng/ml左右),表明本发明的ctni检测试剂盒具有高度的准确性;10次重复检测的cv值在4.42%~8.47%之间,表明ctni检测试剂盒具有很好的检测精确度。表23份临床定值样本的重复检测编号低值中值高值10.1580.5451.92920.1870.5561.82130.1420.6051.87240.1580.6161.98650.1470.5281.77560.1740.5401.93170.1580.5941.93380.1500.6081.92690.1710.4982.057100.1580.5481.824平均值0.1600.5641.905标准差0.0140.0400.084cv8.47%7.04%4.42%对比例1采用2种单克隆抗体作为捕获抗体的检测试剂盒本对比例的试剂盒采用实施例1中所述的试剂盒的制备方法制备,与实施例1的区别仅在于,采用的捕获抗体为如表3和表4所示的两种单克隆抗体混合物。检测结果如表3和表4所示,结果表明,使用其它两种不同的单克隆抗体混合作为捕获抗体的检测的灵敏度较41-49和83-93混合作为捕获抗体的灵敏度明显降低。表3捕获抗体为2种不同单克隆抗体的检测结果表4捕获抗体为2种不同单克隆抗体的检测结果对比例2采用单克隆抗体作为检测抗体本对比例的试剂盒采用实施例1中所述的试剂盒的制备方法制备,与实施例1的区别仅在于,采用的检测抗体为如表5所示的两种单克隆抗体的混合物。检测结果如表5所示,结果表明,使用两种不同的单克隆抗体混合作为检测抗体的检测的灵敏度较采用多克隆抗体作为检测抗体的灵敏度明显降低。表5检测抗体为2种不同单克隆抗体的检测结果对比例3捕获抗体的荧光微球标记方式不同本对比例的试剂盒采用实施例1中所述的试剂盒的制备方法制备,与实施例1的区别仅在于,在反应液制备时,荧光微球标记的捕获抗体的制备为采用41-49和83-93两种单克隆抗体分别标记荧光微球后,再将两种标记的荧光微球混合(两种荧光微球混合的质量比为1:1)。结果如表6所示,结果表明,使用两种单克隆抗体分别标记荧光微球后再混匀,检测的灵敏度明显降低。表6捕获抗体的不同的荧光微球标记方式的检测结果对比例4捕获抗体标记荧光微球的稀释液不同本对比例的试剂盒采用实施例1中所述的试剂盒的制备方法制备,与实施例1的区别仅在于,稀释液不同。其中,实验组为实施例1中的稀释液,采用的稀释液组分为:0.12mol/l甘氨酸,0.85%nacl,1%bsa,0.15%酪蛋白,2%海藻糖,0.5%吐温-20,0.5%pvp-40,0.5%pc300,ph7.5。对照组采用的稀释液组分为:0.12mol/l甘氨酸,0.85%nacl,1%bsa,0.15%酪蛋白,2%海藻糖,0.5%吐温-20,0.5%pc300,ph7.5。以上质量百分含量均为质量/体积百分含量。检测结果如表7所示,结果表明,通过在稀释液中添加pvp-40作为增稠剂,在表面活性剂的作用下,在加入样品进行抗体捕获反应时,可增加抗原与荧光微球包被的心肌肌钙蛋白i抗体的反应时间,试剂盒的检测灵敏度显著提高。表7采用不同的稀释液的检测结果虽然上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>迈克生物股份有限公司<120>一种心肌肌钙蛋白i的检测试剂盒及其制备方法<130>khp181113354.7<160>1<170>siposequencelisting1.0<210>1<211>209<212>prt<213>人工序列(artificialsequence)<400>1alaaspglyserseraspalaalaarggluproargproalaproala151015proileargargargserserasntyrargalatyralathrglupro202530hisalalyslyslysserlysileseralaserarglysleuglnleu354045lysthrleuleuleuglnilealalysglngluleugluarggluala505560glugluargargglyglulysglyargalaleuserthrargcysgln65707580proleugluleualaglyleuglyphealagluleuglnaspleucys859095argglnleuhisalaargvalasplysvalaspglugluargtyrasp100105110ileglualalysvalthrlysasnilethrgluilealaaspleuthr115120125glnlysilepheaspleuargglylysphelysargprothrleuarg130135140argvalargileseralaaspalametmetglnalaleuleuglyala145150155160argalalysgluserleuaspleuargalahisleulysglnvallys165170175lysgluaspthrglulysgluasnarggluvalglyasptrparglys180185190asnileaspalaleuserglymetgluglyarglyslyslyspheglu195200205ser当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1