农产品中真菌毒素污染的检测方法与流程
本发明涉及真菌毒素检测领域。更具体地说,本发明涉及一种农产品中真菌毒素污染的检测方法。
背景技术:
真菌毒素是真菌产生的次级代谢产物,它广泛存在于粮油等农产品中,对人类和动物均能产生致命的结果,真菌的种类和毒素的种类并不是一一对应的关系,会存在一种真菌能产生多种毒素的情况出现,而且真菌毒素的毒性具有累加效应,真菌毒素的毒性变化也很大,它取决于毒素的种类/数量/摄入量、持续摄入时间、环境因素等。危害比较大的真菌毒素主要有黄曲霉毒素、玉米赤酶烯酮、呕吐毒素、赭曲酶素a、伏马毒素、t2/ht2毒素等。
因为上述原因农产品中真菌毒素的检测变得至关重要;现有的检测方法有多种,但是基本操作均为样品粉碎、提取、过滤、净化和进样分析。其中,样品中的真菌毒素的提取对后续的检测有重大影响,溶剂选择的极性不准确会导致提取量较少、或者带有较多农产品自身的蛋白质或者淀粉类杂质,两者均对检测结果有较大的影响,因此需要一种针对真菌毒素的有效提取检测方法。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种农产品中真菌毒素污染的检测方法,其采用硅铝酸盐、活性炭为原料,制备吸附相,采用先浸提、吸附、再解吸的方式减少了农产品样品在进行真菌毒素含量检测时由于提取的真菌毒素含量少或混入样品的其它杂质导致检测结果出现偏差的情况,提高了检测的精度,此外由于样品和吸附相采用夹设的方式,相较于现有的直接将样品混合吸附相的操作,使得吸附相可以重复使用,样品可回收,采用解吸装置进行解吸操作,利用解吸液蒸发膨胀的压力,对吸附相上吸附的真菌毒素进行加压解吸,使得解吸效果相较于现有的常压加热浸泡方式解吸的更为完全,而且解吸液使用量少,间接提高了后续的检测精度。
为了实现根据本发明的这些目的和其它优点,提供了一种活农产品中真菌毒素污染的检测方法,包括以下步骤:
步骤一、吸附相的制备,将沼铁矿、活性炭、人工沸石或硅藻土中的一种或多种制成吸附相,吸附相用ph值6~8的磷酸盐缓冲溶液进行预处理,将得到的吸附相压成厚度为2~5cm压片,并用微纤维滤布包裹,得到吸附相成品;将待检测的农产品的样品称重后粉碎,采用微纤维滤布将样品包覆,再将所述吸附相与样品夹设,得到提取样;
步骤二、将提取样用浸提液进行三次以上的浸提,每次浸泡10~15min,浸提的次数的终点采用双向展开的方式对浸提后得到的浸提液进行薄层色谱检测确认,至浸提的浸提液中检测不到真菌毒素为止,合并多次浸提液后的洗脱液得到总提取液以及提取后的提取样;其中,浸提液为乙腈与水按照体积比8:2的比例混合得到,洗脱液质量为样品的5~10倍;
去除浸提后的提取样间的样品后,保留吸附相,采用加热后的解吸液进行解吸操作,得到总解吸液;所述解吸液为甲醇、乙酸和水按照重量份比95:4:1的比例混合得到,采用双向展开的方式对解吸后得到的解吸液进行薄层色谱检测,确认解吸终点;
合并所述总提取液和所述总解吸液,真空40~45℃,氮吹浓缩,再加入质量分数为50%乙腈水溶液定容,得到待测样;
步骤三、采用质量分数为50%乙腈水溶液配置呕吐毒素、黄曲霉素、赭曲霉毒素、t-2毒素、伏马菌素、玉米赤霉烯酮、镰刀菌烯醇、杂色曲霉素、展青霉素的标准溶液,采用高效液相色谱和三重四级杆串联质谱联用进行标准溶液的检测,绘制标准曲线;
步骤四、采用高效液相色谱和三重四级杆串联质谱联用进行待测样中真菌毒素的检测,并对照标准曲线得出对应的检测溶液中的真菌毒素的浓度,计算样品中的真菌毒素的含量。
优选的是,所述活性炭或所述人工沸石在使用前通过苄基二甲基十八烷基氯化铵水合物进行浸泡处理。
优选的是,色谱条件为:色谱柱为agilentzorbaxeclipseplusc18柱,4.6×150mm,3.5μm;柱温30℃;进样量10μl;流动相:a为含0.03%甲酸和1mm乙酸铵水溶液;b为甲醇;梯度洗脱:0~8min.22%~36%b;8~16min,36~72%b;16~27min.72~93%b;93%b冲洗10min;每次进样前,20%b平衡柱子5min;
质谱条件为:离子源为电喷雾离子源;电离方式是esi+;检测方式为多反应检测,毛细管电压为3.0kv;雾化器压力为40psi;干燥气流速为10l/min;干燥气温度为300℃。
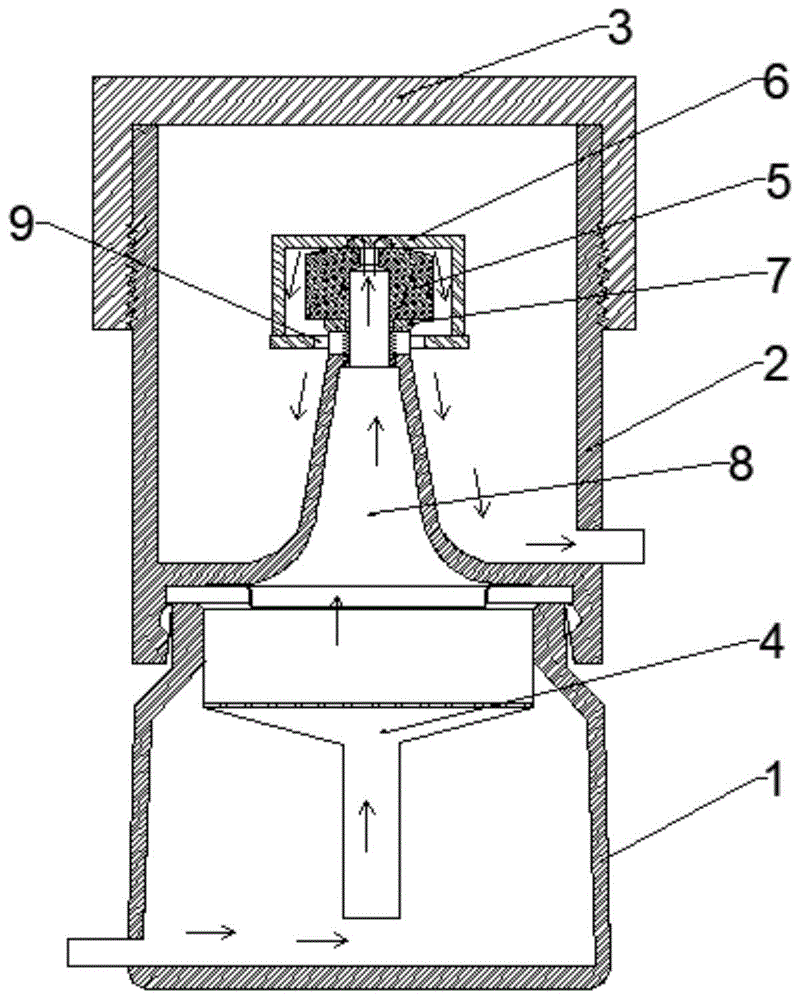
优选的是,步骤二中的解吸操作在解吸装置中进行,所述解吸装置包括:
解吸室,其上部开口,且开口处外壁边沿设有卡接的密封圈,所述解吸室内设有加热管,加热管外接电源;
填充漏斗,其为布氏漏斗状,且所述填充漏斗的外径略小于所述解吸室的上部开口的直径,所述填充漏斗上部边缘外翻,以将其架设在所述解吸室内,所述填充漏斗的填充层高于解吸室内解吸液的液面;
收集室,其密封盖设在所述解吸室的上部,所述收集室的底面向上凸起且端部开口,形成与所述解吸室连通的走液道,所述走液道的高度为所述收集室高度的一半以上,所述收集室的上部敞口,所述收集室的上部设有螺纹密封盖;其中,所述走液道的端部设有出液阀门座,所述出液阀门座下端和所述走液道通过螺纹固接,所述出液阀门座上活动套设有阀门盖,所述阀门盖的下端与所述出液阀门座的下端活动抵接,所述阀门盖下底面设有多个出液孔;
其中,所述收集室的最低处设有贯穿的解吸液出口,所述解吸室的下部设有贯穿的解吸液进口。
优选的是,所述出液阀门座和所述走液道连接处设有密封环,所述解吸室与所述收集室的连接处设有密封垫圈。
优选的是,所述解吸液进口设有单向阀。
本发明至少包括以下有益效果:
第一、其采用硅铝酸盐、活性炭等为原料,制备吸附相,减少了农产品样品在进行真菌毒素含量检测时由于提取的真菌毒素含量少或混入样品的其它杂质导致检测结果出现偏差的情况,提高了检测的精度;加热解吸液至微沸的程度,大大提高了吸附相和解吸液作用面积,提高了解吸效果,得到的解吸液中真菌毒素的浓度更高,提高了检测的精度,同时也保证了检测的真菌毒素的较高回收率,降低提取操作产生的损耗;
第二、样品和吸附相采用夹设的方式,中间间隔设有微纤维滤布,在进行浸提的过程中就完成了净化操作,相较于现有的直接将样品混合吸附相的操作,一方面检测的产品可回收,另一方面使得吸附相可以重复使用,降低检测成本;同时,中间间隔设有微纤维滤布相较于现有的样品粉碎、提取、过滤、净化和进样分析的操作流程而言,直接将提取过滤净化合成一步,简化了操作流程;
第三、采用解吸装置进行解吸操作,利用加热解吸液,使解吸液微沸,在阀门盖的作用下,解吸室内的气压略大于外界气压,使得解吸液的溶剂分子运动加快,和吸附相的接触更充分,更利于真菌毒素的解吸,使得解吸效果相较于浸泡解吸操作的效果更好,在等量毒素的条件下降低了解吸时间,使用的解吸液的量也更少,间接提高了后续的检测精度和效率。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明其中一种技术方案所述解吸装置的结构和走液示意图;
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
<实施例1>
农产品中真菌毒素污染的检测方法,检测方法包括以下步骤:
步骤一、吸附相的制备,将沼铁矿和活性炭按照1:5的重量份比混合搅拌均匀,得到吸附相,将吸附相用ph值6~8的磷酸盐缓冲溶液进行浸泡处理,将得到的吸附相压成厚度为2~5cm压片,并用微纤维滤布包裹,得到吸附相成品;
样品的制备,将待检测的农产品的样品称重后粉碎,采用微纤维滤布将样品包覆,再将所述吸附相与样品夹设,使用的吸附相的重量为待检测样品重量的10倍,得到提取样,压实,捆绑固定;
步骤二、将提取样用浸提液进行三次浸提,每次浸泡10~15min,浸提液为乙腈与水按照体积比8:2的比例混合得到,洗脱液质量为样品的8倍,当进行至第三次浸提时,薄层色谱检测不到真菌毒素,薄层色谱检测采用双向展开的方式;合并多次浸提液后的洗脱液得到总提取液以及浸提后的提取样;
将浸提后的提取样拆开,去除浸提后的提取样间的样品,保留吸附相,采用加热后的解吸液进行解吸操作,具体为将吸附相放入布氏漏斗中,采用加热至50~60℃的解吸液冲洗,合并冲洗的解吸液得到总解吸液;所述解吸液为甲醇、乙酸和水按照重量份比95:4:1的比例混合得到,检测方法同浸提操作中的薄层色谱检测法;
合并所述总提取液和所述总解吸液,真空40~45℃,氮吹浓缩,再加入质量分数为50%乙腈水溶液定容,得到待测样;
步骤三、采用质量分数为50%乙腈水溶液配置黄曲霉毒素b1、赭曲霉毒素、呕吐毒素和玉米赤霉烯酮的标准溶液,采用高效液相色谱和三重四级杆串联质谱联用进行标准溶液的检测,绘制标准曲线;
步骤四、采用高效液相色谱和三重四级杆串联质谱联用进行待测样中真菌毒素的检测,并对照标准曲线得出对应的检测溶液中的真菌毒素的浓度,计算样品中的真菌毒素的含量;
色谱条件为:
色谱柱为agilentzorbaxeclipseplusc18柱,4.6×150mm,3.5μm;柱温30℃;进样量10μl;
流动相:a为含0.03%甲酸和1mm乙酸铵水溶液;b为甲醇;
梯度洗脱:0~8min.22%~36%b;8~16min,36~72%b;16~27min.72~93%b;93%b冲洗10min;每次进样前,20%b平衡柱子5min;
质谱条件为:离子源为电喷雾离子源;电离方式是esi+;检测方式为多反应检测,毛细管电压为3.0kv;雾化器压力为40psi;干燥气流速为10l/min;干燥气温度为300℃。
<实施例2>
农产品中真菌毒素污染的检测方法,检测方法包括以下步骤:
步骤一、吸附相的制备,将沼铁矿、人工沸石或硅藻土按照1:5:2的重量份比混合搅拌均匀,得到吸附相;所述人工沸石在使用前通过苄基二甲基十八烷基氯化铵水合物进行浸泡处理,浸泡时间为15~30min,使用的苄基二甲基十八烷基氯化铵水合物的质量为人工沸石的1.5倍;将吸附相用ph值6~8的磷酸盐缓冲溶液进行浸泡处理,浸泡时间为5~10min;将得到的吸附相压成厚度为2~5cm压片,并用微纤维滤布包裹,得到吸附相成品;
样品的制备,将待检测的农产品的样品称重后粉碎,采用微纤维滤布将样品包覆,再将所述吸附相与样品夹设,其中样品可分为多份进行夹设,使用的吸附相的总重量为待检测样品总重量的10倍,得到提取样,压实,捆绑固定;
步骤二、将提取样用浸提液进行三次浸提,每次浸泡10~15min,浸提液为乙腈与水按照体积比8:2的比例混合得到,洗脱液质量为样品的8倍,当进行至第三次浸提时,薄层色谱检测不到真菌毒素,薄层色谱检测采用双向展开的方式;合并多次浸提液后的洗脱液得到总提取液以及浸提后的提取样;
将浸提后的提取样拆开,去除浸提后的提取样间的样品,保留吸附相,采用加热后的解吸液进行解吸操作,具体为将吸附相放入布氏漏斗中,采用加热至50~60℃的解吸液冲洗,合并冲洗的解吸液得到总解吸液;所述解吸液为甲醇、乙酸和水按照重量份比95:4:1的比例混合得到,检测方法同浸提操作中的薄层色谱检测法;
合并所述总提取液和所述总解吸液,真空40~45℃,氮吹浓缩,再加入质量分数为50%乙腈水溶液定容,得到待测样;
步骤三、采用质量分数为50%乙腈水溶液配置一系列真菌毒素(呕吐毒素、黄曲霉素、赭曲霉毒素、t-2毒素、伏马菌素、玉米赤霉烯酮、镰刀菌烯醇、杂色曲霉素、展青霉素等)的标准溶液,采用高效液相色谱和三重四级杆串联质谱联用进行标准溶液的检测,绘制标准曲线;
步骤四、采用高效液相色谱和三重四级杆串联质谱联用进行待测样中真菌毒素的检测,并对照标准曲线得出对应的检测溶液中的真菌毒素的浓度,计算样品中的真菌毒素的含量。
色谱条件为:色谱柱为agilentzorbaxeclipseplusc18柱,4.6×150mm,3.5μm;柱温30℃;进样量10μl;流动相:a为含0.03%甲酸和1mm乙酸铵水溶液;b为甲醇;梯度洗脱:0~8min.22%~36%b;8~16min,36~72%b;16~27min.72~93%b;93%b冲洗10min;每次进样前,20%b平衡柱子5min;
质谱条件为:离子源为电喷雾离子源;电离方式是esi+;检测方式为多反应检测,毛细管电压为3.0kv;雾化器压力为40psi;干燥气流速为10l/min;干燥气温度为300℃。
<实施例3>
农产品中真菌毒素污染的检测方法,检测方法包括以下步骤:
步骤一、吸附相的制备,吸附相的制备,将沼铁矿和活性炭按照1:5的重量份比混合搅拌均匀,得到吸附相,将吸附相用ph值6~8的磷酸盐缓冲溶液进行浸泡处理,将得到的吸附相压成厚度为2~5cm压片,并用微纤维滤布包裹,得到吸附相成品;
样品的制备,将待检测的农产品的样品称重后粉碎,采用微纤维滤布将样品包覆,再将所述吸附相与样品夹设,使用的吸附相的重量为待检测样品重量的10倍,得到提取样,压实,捆绑固定;
步骤二、将提取样用浸提液进行三次以上的浸提,每次浸泡10~15min,浸提的次数的终点采用双向展开的方式对浸提后得到的浸提液进行薄层色谱检测确认,至浸提的浸提液中检测不到真菌毒素为止,合并多次浸提液后的洗脱液得到总提取液以及提取后的提取样;其中,洗脱液为乙腈与水按照体积比8:2的比例混合得到,洗脱液质量为样品的5~10倍;
去除浸提后的提取样间的样品后,保留吸附相,采用加热后的解吸液进行解吸操作,得到总解吸液;
其中,解吸操作在解吸装置中进行,所述解吸装置如图1所示,包括:
解吸室1,其上部开口,且开口处外壁边沿设有卡接的密封圈,所述解吸室1内设有加热管,加热管外接电源;
填充漏斗4,其为布氏漏斗状,且所述填充漏斗4的外径略小于所述解吸室1的上部开口的直径,所述填充漏斗4上部边缘外翻,以将其架设在所述解吸室1内,所述填充漏斗4的填充层高于解吸室1内解吸液的液面;
收集室2,其密封盖3设在所述解吸室1的上部,所述收集室2的底面向上凸起且端部开口,形成与所述解吸室1连通的走液道8,所述走液道8的高度为所述收集室2高度的一半以上,所述收集室2的上部敞口,所述收集室2的上部设有螺纹密封盖3;其中,所述走液道8的端部设有出液阀门座5,所述出液阀门座5下端和所述走液道8通过螺纹固接,所述出液阀门座5上活动套设有阀门盖6,所述阀门盖6的下端与所述出液阀门座5的下端活动抵接,所述阀门盖6下底面设有多个出液孔9;
其中,所述收集室2的最低处设有贯穿的解吸液出口,所述解吸室1的下部设有贯穿的解吸液进口,解吸液进口设有单向阀;所述出液阀门座5和所述走液道连接处设有密封环,所述解吸室1与所述收集室2的连接处设有密封垫圈7;
具体的使用方法为,通过下部的解吸液进口向解吸室1内通解吸液,收集室2中填充浸提后的吸附相,将装置安装完毕,此时真菌毒素大部分吸附在吸附相内,解吸室1内的加热管通电,对解吸液进行加热,当解吸液温度升至50℃以上,解吸液微沸,解吸液沿走液道8上升,蒸汽压将阀门盖6顶起,解吸完带有真菌毒素的解吸液通过阀门盖下的出液孔9进入收集室2,完成解析操作,通过tlc检测解吸液出口流出的解吸液,判断解吸操作的终点。
其中,所述解吸液为甲醇、乙酸和水按照重量份比95:4:1的比例混合得到,采用双向展开的方式对解吸后得到的解吸液进行薄层色谱检测,确认解吸终点;
合并所述总提取液和所述总解吸液,真空40~45℃,氮吹浓缩,再加入质量分数为50%乙腈水溶液定容,得到待测样;
步骤三、采用质量分数为50%乙腈水溶液配置呕吐毒素、黄曲霉素、赭曲霉毒素、t-2毒素、伏马菌素、玉米赤霉烯酮、镰刀菌烯醇、杂色曲霉素、展青霉素的标准溶液,采用高效液相色谱和三重四级杆串联质谱联用进行标准溶液的检测,绘制标准曲线;
步骤四、采用高效液相色谱和三重四级杆串联质谱联用进行待测样中真菌毒素的检测,并对照标准曲线得出对应的检测溶液中的真菌毒素的浓度,计算样品中的真菌毒素的含量。
色谱条件为:色谱柱为agilentzorbaxeclipseplusc18柱,4.6×150mm,3.5μm;柱温30℃;进样量10μl;流动相:a为含0.03%甲酸和1mm乙酸铵水溶液;b为甲醇;梯度洗脱:0~8min.22%~36%b;8~16min,36~72%b;16~27min.72~93%b;93%b冲洗10min;每次进样前,20%b平衡柱子5min;
质谱条件为:离子源为电喷雾离子源;电离方式是esi+;检测方式为多反应检测,毛细管电压为3.0kv;雾化器压力为40psi;干燥气流速为10l/min;干燥气温度为300℃。
其中,实施例1~实施例3的不同之处在提取真菌毒素的手段不同,使用的吸附相不同,采用的薄层色谱检测方法/高效液相色谱和质谱的检测手段均相同;
采用方法学检测的多种真菌的毒素的标准曲线可以通用;
采用方法学的方法对实施例1~3的检测方式的检测结果进行分析,以不含真菌毒素的小麦粉为验证样品;
检测手段和指标:
薄层色谱法:
tlc检测使用的使用的展开液根据检测毒素不同,采用的展开剂不同,常见的展开剂有:黄曲霉素为:v(丙酮):v(氯仿)=9:1;呕吐毒素为:v(乙腈):v(水)=21:4;杂色曲霉素为:v(甲苯):v(甲醇):v(乙酸)=90:8:2;采用紫外/荧光灯检测器进行检测;
高效液相色谱:
真菌毒素的标准曲线绘制:
选取具有代表性的真菌毒素(包括黄曲霉毒素b1、赭曲霉毒素a、玉米赤霉烯酮、呕吐毒素),配置标准混合溶液,测量仪器对各毒素的检出限,跟据检出限调整标准溶液浓度,确定真菌毒素的线性方程、相关系数和线性范围,配制浓度见表1;
表1
由于检测手段相同,因此实施例1~3的标准溶液以及仪器检测得到,绘制的线性方程/相关系数和线性范围可以通用,此处因不是本发明检测重点,因此此处省略;
回收率检测,以不含毒素的小麦为空白样品基质,进行3个水平的添加回收实验,3个添加量分别为1倍、2倍和10倍的各真菌毒素的测定方法定量限(可以为标准溶液5),每个浓度水平进行6次重复实验,分析测定其回收率并统计;
以上回收率检测主要测定三个实施例的提取手段之间的差别;
真菌毒素质谱参考条件见表2;
表2
本发明以不含毒素的小麦为基质,进行实施例1~3的检测方法的检测相关结果方法学验证数据如表3所示;
表3
采用本发明的硅铝酸盐、活性炭等为原料,制备吸附相,减少了农产品样品在进行真菌毒素含量检测时由于提取的真菌毒素含量少或混入样品的其它杂质导致检测结果出现偏差的情况,可以看到回收率变高和相对标准偏差均有显著降低;其中由于检测的手段均相同,因此三个实施例的线性范围和检出限相同。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
- 还没有人留言评论。精彩留言会获得点赞!