一种靶向肽介导的金纳米粒生物传感器及其制备方法和应用与流程
本发明涉及医药技术领域,具体地说,是一种靶向肽介导的金纳米粒生物传感器及其制备方法和应用。
背景技术:
肺癌是全球发病率及死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-smallcelllungcancer,nsclc)是主要的肺癌类型,接近70%患者被确诊时就已经为晚期,5年生存率低于15%[siegelrl,etal.cancerstatistics,2020.cacancerjclin.2020,70(1):7-30]。近年来,pd-1/pd-l1免疫检查抑制点已经成为晚期或转移性nsclc患者一线或二线治疗新标准。但是并非所有的患者都能获益。美国国家综合癌症网络指南推荐晚期nsclc患者在使用pd-1/pd-l1抑制剂治疗前需要结合pd-l1表达水平检测结果对治疗效果进行预测后再选择治疗方式,且已经进入nsclc诊疗的临床实践[ettingerds,etal.non–smallcelllungcancer,version5.2017,nccnclinicalpracticeguidelinesinoncology.jnatlcomprcancnetw.2017,15(4):504-535]。当前pd-l1检测标本多为肿瘤组织样本,主要来源为手术切除的标本。创伤性较大,会受到肿瘤时空异质性因素的影响。且pd-l1的水平会随着治疗发生变化,组织标本实时监测无法实现,因此亟需一种可以大批量监测pd-l1水平进一步精准筛查免疫治疗获益敏感人群。
与组织样本比较,血样可以在一定程度上呈现出肿瘤患者的免疫状态,取样操作简单,可以实现实时监测。多项研究[poggiom,etal.suppressionofexosomalpd-l1inducessystemicanti-tumorimmunityandmemory.cell.2019,177(2):414-427;cheng,etal.exosomalpd-l1contributestoimmunosuppressionandisassociatedwithanti-pd-1response.nature.2018,560(7718):382–386]表明,肿瘤患者外周血中的外泌体表面的pd-l1蛋白与免疫逃逸密切相关,与pd-1/pd-l1免疫治疗的效果具有相关性。
目前检测外泌体表面蛋白主要有westernbloting、elisa、流式细胞术等,由于外泌体尺寸小,易分散,对检测设备要求比较高,westernbloting、elisa检测灵敏度较低,需要大量样本。近些年来,电化学传感器、纳米等离子体传感器等方法由于高度敏感性、操作简单、所需时间短等优点被用来检测外泌体表面蛋白。
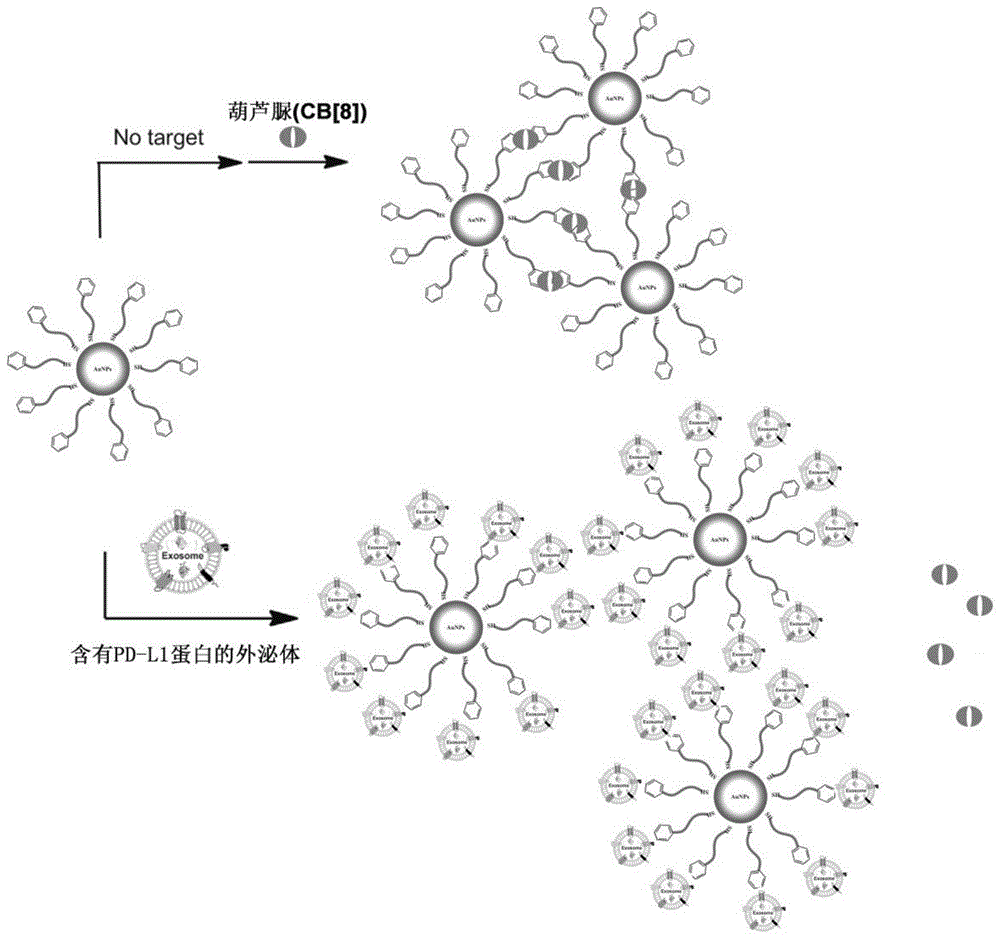
aunps具有表面等离子体共振(spr)特性,可以用于色度对比检测分析。按照mie散射理论:依据颗粒大小、性状与聚集状态的不同,aunps可以显示出不同的颜色。小粒径金纳米粒在单分散状态:吸收带比较窄,处于520nm附近,呈现红色;聚集状态或者沉淀状态:吸收带从520nm红移至574nm,呈现紫色或绿色。目前已有多种基于aunps的生物传感器采用比色法用于可见测定,例如金属离子(如cu2+、hg2+)、dna、小分子(如可卡因、三聚氰胺)及蛋白质(如凝血酶蛋白)。有研究[heitmannlm,taylorab,hartpj,urbachar,sequence-specificrecognitionandcooperativedimerizationofn-terminalaromaticpeptidesinaqueoussolutionbyasynthetichost.j.am.chem.soc.2006;128(38)]表明葫芦脲(cb[8])可以识别n端芳香残基并进行非共价二聚反应,形成块状团聚体,提示将芳香残基修饰金纳米粒后,当加入cb[8]后,cb[8]会与靶向分子结合,金纳米粒会发生解聚现象,成单分散状态。changhn等人[changhn,etal.blockingofthepd-1/pd-l1interactionbyad-peptideantagonistforcancerimmunotherapy.angewchemintedengl.2015,54(40):11760-4]报道了一种可以靶向识别pd-l1蛋白的多肽d-peptide,本发明利用d-peptide多肽n端含有苯丙氨酸可以在葫芦脲(cb[8])作用下,将d-peptide多肽修饰的金纳米粒聚合,在含有pd-l1蛋白的外泌体加入后,会使得金纳米粒解聚,为了防止空间位阻,在d-peptide的c端连接上4个甘氨酸,另外连接一个含有巯基的半胱氨酸,使得所构建的靶向肽可以修饰在金纳米粒表面。利用金纳米粒聚集和解聚,在520nm处的吸收的变化对外泌体表面pd-l1水平进行定量分析。
目前尚无一种靶向肽介导的金纳米粒用来检测外泌体表面pd-l1蛋白的生物传感器。与适配体相比,多肽具有合成简单、费用低廉,易于修饰等优点。
技术实现要素:
基于上述理论,本发明提供了一种靶向肽介导的金纳米粒生物传感器及其制备方法和应用,所构建的可以检测外泌体表面pd-l1蛋白水平的方法具有敏感性高、操作简单、所需时间短等优点。
本发明的目的在于提供一种可以检测外泌体表面pd-l1蛋白的金纳米粒生物传感器,表面修饰有可以靶向识别外泌体表面pd-l1蛋白的多肽。本发明的另一个目的是提供该金纳米粒生物传感器的制备方法;本发明的第三目的是提供该金纳米粒生物传感器在检测生物样本中外泌体表面pd-l1蛋白的水平,拟为临床上监测pd-l1水平进一步精准筛查免疫治疗获益敏感人群提供参考。
本发明所要解决的主要技术问题是:如何提高金纳米粒生物传感器的检测稳定性,以及如何缩短金纳米粒生物传感器的检测时间,同时保证金纳米粒生物传感器的灵敏度。
本发明设计了一种靶向肽介导的金纳米粒生物传感器,其中靶向肽是由苯丙氨酸、组氨酸、酪氨酸、甘氨酸、精氨酸、天冬氨酸、苏氨酸、天冬酰胺、半胱氨酸组成的多肽,由苯丙氨酸、组氨酸、酪氨酸、甘氨酸、精氨酸、天冬氨酸、苏氨酸、天冬酰胺这八种氨基酸组成的d-peptide具有靶向识别pd-l1蛋白的功能,甘氨酸用来间隔空间位阻,半胱氨酸用来提供巯基与金纳米粒连接。本发明中的金纳米粒生物传感器需要在葫芦脲(cb[8])介导下,才可以实现。
本发明的第一方面,提供一种可以识别pd-l1蛋白的靶向肽,所述的靶向肽由三个部分组成,即d-peptide与用来间隔空间位阻的4个甘氨酸部分及半胱氨酸,所述靶向肽的氨基酸序列如下所示:
pgc:fhyqrdtpksyn-ggggc(小写字母均代表d型氨基酸,seqidno:1)
其中f:苯丙氨酸;h:组氨酸;y:酪氨酸;q:谷氨酰胺;r:精氨酸;d:天冬氨酸,t:苏氨酸,p:脯氨酸;k:赖氨酸;s:丝氨酸;n:天冬酰胺,g:甘氨酸,c:半胱氨酸,氨基酸之间以肽键连接形成17肽。
所述的靶向肽缩写为pgc,p代表d-peptide(序列为fhyqrdtpksyn,seqidno:2),g代表序列gggg,c代表序列为c。
所述的d-peptide单体的化学结构如式(i)所示,所述的靶向肽的简式如式(ⅱ)所示。
式(ii)中sh为靶向肽pgc的c端的半胱氨酸上的巯基。苯环为靶向肽pgc的n端的苯丙氨酸中的苯环。
本发明的第二方面,提供一种如上所述的靶向肽介导的金纳米粒生物传感器,所述的靶向肽介导,是指靶向肽的c端的半胱氨酸的巯基与金纳米粒进行连接。
在如上所述的17肽的n端,苯丙氨酸的苯环会受到葫芦脲(cb[8])的作用下聚合,在17肽的c端的半胱氨酸的巯基用来与金纳米粒连接。所述的靶向肽介导的金纳米粒生物传感器可以简写为:aunps-pgc,缩写为au-pgc,其中au为金纳米粒,pgc为靶向肽(包裹靶向识别肽段与间隔空间位阻部分及连接部分)。
所述的靶向肽修饰的金纳米粒的结构如式(ⅲ)所示,所述靶向肽修饰的的金纳米粒与葫芦脲及外泌体相互作用的示意图如图1。
进一步的,所述的靶向肽介导的金纳米粒生物传感器中靶向肽与金纳米粒的摩尔比在25-100:1。金纳米粒的粒径在10-20nm范围内,否则对检测灵敏度有影响。
本发明的第三方面,提供一种如上所述的靶向肽介导的金纳米粒生物传感器的制备方法,包括如下步骤:
(a)通过固相合成法合成靶向肽;
(b)制备粒径为10-20nm的金纳米粒;
(c)将靶向肽与金纳米粒混合,然后通过离心去除没有结合上去的靶向肽,制得靶向肽介导的金纳米粒生物传感器体系。
进一步的,所述的步骤(c)为:将步骤(a)合成的靶向肽加入到金纳米粒水溶液中,靶向肽的总浓度为0.25-1mm,其中靶向肽与金纳米粒的摩尔比为25-100:1,加入0.1%的w/vbsa溶液稳定金纳米粒溶液,减少非特异性吸附。
进一步的,所述的金纳米粒是用氯金酸(haucl4)的柠檬酸还原法制得的。首先反应过程中所使用的所有玻璃仪器都用王水(三份hcl,一份hno3)彻底清洗过,用蒸馏水冲洗过,然后烘干备用。在1l装有冷冷凝器的圆底烧瓶中,于剧烈搅拌下加热50ml1mm的haucl4至沸腾,快速加入5ml38.8mm柠檬酸三钠,溶液逐渐由纯黄色变为深红色;再持续煮沸搅拌30min,确保反应彻底,然后将溶液慢慢冷却到室温。
在本发明的一个优选实施方式中,步骤(c)具体为:将步骤(a)合成的靶向肽加入到金纳米粒水溶液中,靶向肽的总浓度为0.45mm,其中靶向肽与金纳米粒子的摩尔比为50:1,反应的温度为4℃,反应时间为12小时。
进一步的,步骤(c)反应后的溶液,然后通过13,500g离心30min去除没有结合的靶向肽。为维持靶向肽介导的金纳米粒生物传感器较高的活性,用ph为6.2的pbs(0.1m)溶液重悬样品,在4℃保存。
本发明的第四方面,提供一种如上所述的靶向肽介导的金纳米粒生物传感器在检测外泌体表面pd-l1蛋白的水平中的应用。
所述的靶向肽介导的金纳米粒生物传感器可以用来检测包括外泌体在内的细胞外囊泡等含有pd-l1蛋白的样本的检测。
本发明的第五方面,提供一种如上所述的靶向肽介导的金纳米粒生物传感器检测外泌体表面pd-l1蛋白水平的方法,所述的靶向肽介导的金纳米粒生物传感器在葫芦脲(cb[8])介导下实现外泌体表面pd-l1蛋白水平的检测。当加入葫芦脲(cb[8])时会发生聚集,而加入含有pd-l1蛋白的外泌体之后会发生解聚现象。
进一步的,所述的外泌体表面pd-l1蛋白,为血样中分离得到的外泌体表面的pd-l1,也可以为体外肿瘤细胞培养后的培养液中分离得到的外泌体。所述的肿瘤为肺癌,乳腺癌,黑色素瘤等。
进一步的,所述的方法包括以下步骤:
将所述的靶向肽介导的金纳米粒生物传感器体系与外泌体样品混合半小时,加入浓度为0.2-1mm的葫芦脲(cb[8]),然后检测在520nm处的吸光度变化。
所述的靶向肽介导的金纳米粒生物传感器体系可以分析样本表面pd-l1蛋白的水平,可以为对针对pd-1/pd-l1免疫检查点的免疫治疗效果进行预测。
本发明提供的靶向肽介导的金纳米粒生物传感器适用于临床上用来检测患者外周血中外泌体表面的pd-l1水平,进而评估针对pd-1/pd-l1免疫检查点的免疫治疗的获益情况,不局限于肺癌,也可以用于乳腺癌、黑色素瘤等肿瘤患者的样本。
本发明优点在于:
1、本发明的靶向肽介导的金纳米粒生物传感器由可以靶向识别外泌体表面pd-l1蛋白的n端含有芳香残基的多肽修饰的金纳米粒组成,利用金纳米粒具有表面等离子体共振(spr)特性,可以用于色度对比检测分析。通过葫芦脲(cb[8])可以将两个n端含有芳香残基的分子聚合,使得修饰有n端含有芳香残基的多肽形成块状团聚体。当加入含有pd-l1蛋白的外泌体时,即可解聚金纳米粒,利用前后金纳米粒在520nm处的吸收的变化对外泌体表面pd-l1水平进行定量分析;
2、本发明的靶向肽介导的金纳米粒生物传感器采用固相合成法合成靶向肽然后通过巯基与金纳米粒结合,制备比较简单,操作比较方便,设备要求要低。可以用来检测生物样本中外泌体表面pd-l1蛋白的浓度,同时又有较好的灵敏度,因此非常适合于体外检测生物样本中的pd-l1蛋白的浓度;
3、本发明的靶向肽介导的金纳米粒生物传感器可以用来检测肺癌在内的多种癌症患者的血样中的外泌体表面的pd-l1蛋白的水平。可以为包括肺癌在内的多种癌症患者在进行pd-1/pd-l1免疫抑制剂治疗前的获益水平预测,可以用来筛选针对pd-1/pd-l1免疫抑制剂治疗敏感的患者,为临床治疗提供一种参考。
4、本发明的制备过程,反应试剂和得到的产物无毒性,不会对环境产生污染,反应条件温和,反应后得到的金纳米粒生物传感器纯化简单,易于保存,成本低廉,利于大规模推广于研究和应用领域。
附图说明
图1.靶向肽修饰的的金纳米粒与葫芦脲及外泌体相互作用的示意图。
图2.pgc的质谱图;
图3.pgc的hplc结果;
图4.靶向肽修饰的金纳米粒透射电镜图;
图5.比色分析图;
图6.外泌体表面pd-l1浓度与样品在520nm处吸光度的变化曲线。
具体实施方式
下面结合附图和实施例对本发明提供的具体实施方式作详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
实施例1:靶向肽pgc的合成及鉴定
靶向肽pgc的氨基酸序列:phehistyrglnargaspthrprolyssertyrasnglycys(phe:苯丙氨酸;his:组氨酸;tyr:酪氨酸;gln:谷氨酰胺arg:精氨酸;asp:天冬氨酸;thr:苏氨酸;pro脯氨酸lys赖氨酸ser丝氨酸asn:天冬酰胺;gly甘氨酸cys:半胱氨酸(phehistyrglnargaspthrprolyssertyrasn均为d型氨基酸;seqidno:1),pgc,由浙江昂拓莱司生物技术有限公司采用多肽固相合成法合成,缩写为pgc,利用制备高效液相色谱纯化合成的pgc,使其纯度达到95%以上。p代表d-peptide,序列为fhyqrdtpksyn(小写字母均代表d型氨基酸),g代表序列gggg,c代表序列为c。其中f:苯丙氨酸;h:组氨酸;y:酪氨酸;q:谷氨酰胺;r:精氨酸;d:天冬氨酸,t:苏氨酸,p:脯氨酸;k:赖氨酸;s:丝氨酸;n:天冬酰胺,g:甘氨酸,c:半胱氨酸,氨基酸之间以肽键连接形成17肽。质谱图见图2,高效液相色谱图见图3,质谱图说明合成成功,高效液相色谱图说明多肽纯度较纯。
实施例2:au-pgc合成及透射电镜观察
金纳米粒是用氯金酸(haucl4)的柠檬酸还原法制得的。首先反应过程中所使用的所有玻璃仪器都用王水(三份hcl,一份hno3)彻底清洗过,用蒸馏水冲洗过,然后烘干备用。在1l装有冷冷凝器的圆底烧瓶中,于剧烈搅拌下加热50ml1mm的haucl4至沸腾,快速加入5ml38.8mm柠檬酸三钠,溶液逐渐由纯黄色变为深红色。再持续煮沸搅拌30min,确保反应彻底,然后将溶液慢慢冷却到室温。将实施例1合成的靶向肽加入到合成的金纳米粒水溶液中,多肽的总浓度为0.25-1mm,其中多肽混合物与金纳米粒子的摩尔比为25-100:1,加入0.1%的w/vbsa溶液稳定金纳米粒溶液,减少非特异性吸附,4℃条件下过夜,然后通过13,500g离心30min去除没有结合的多肽。然后将pgc修饰的金纳米粒滴在300目铜网上,然后透射电镜观察,见图4,金纳米粒粒径在15nm左右,合成成功。
实施例3:比色分析
靶向肽修饰的金纳米粒aunps-pgc与不同浓度的人肺癌细胞a549来源外泌体exo孵育半个小时,其中外泌体是通过超速分离获得。然后加入0.32mm浓度的cb[8],室温条件下孵育2h,然后通过紫外-可见分光光度计(日本shimadzu公司)测量aunps、aunps-pgc、aunps-pgc+exo、aunps-pgc+exo+cb[8]、aunps-pgc+cb[8]各组吸光度。具体见图5,利用紫外-可见吸收光谱的变化来验证该方法的可行性,与单纯的aunps的典型特征吸收峰相比,将pgc加入aunps后,可观察到520nm至530nm接近10nm的位移,说明多肽pgc修饰aunps合成成功。在aunps-pgc溶液中加入exo后,aunps-pgc+exo光谱曲线没有发生明显变化,说明exo对aunps-pgc的聚集没有影响。而在aunps-pgc中加入cb[8]后,吸光度发生明显的下降,结果说明cb[8]可以诱导aunps-pgc聚集。然后加入exo的样品即曲线aunps-pgc+exo+cb[8],吸光度并未下降明显,这说明exo表面的pd-l1特异性的结合在aunps-pgc表面,导致aunps表面的可以靶向pd-l1的靶向肽pgc被外泌体占据,导致cb[8]无法聚集含有苯环残基的aunps-pgc。
实施例4:外泌体表面pd-l1浓度与样品在520nm处吸光度的变化曲线
为了评价方法的灵敏度,au-pgc在ph6.2的0.1mpbs缓冲液中与不同浓度pd-l1的外泌体(0,3,6,9,12μg/ml)孵育,加入0.32mm浓度的cb[8],然后测量在520nm的吸光度变化,并绘制曲线,如图6所示,外泌体pd-l1浓度与吸光度呈线性关系,拟合曲线为y=0.02367x+0.2640,r2=0.994,结果说明在0-12μg/ml范围内外泌体pd-l1浓度与吸光度之间呈良好的线性关系。
综合以上结果,本发明的靶向肽介导的金纳米粒生物传感器能够用来检测外泌体样品中pd-l1蛋白的浓度,为临床免疫治疗获益提供指导。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
序列表
<110>上海维洱生物医药科技有限公司
上海宝龙药业股份有限公司
宝龙药业有限公司
上海宝龙安庆药业有限公司
<120>一种靶向肽介导的金纳米粒生物传感器及其制备方法和应用
<130>/
<160>1
<170>siposequencelisting1.0
<210>1
<211>17
<212>prt
<213>人工序列(artificial)
<400>1
phehistyrglnargaspthrprolyssertyrasnglyglyglygly
151015
cys
- 还没有人留言评论。精彩留言会获得点赞!