检测目标抗体的试剂组合、试剂盒、检测系统及检测方法与流程
1.本技术属于化学发光检测技术领域,具体涉及一种检测目标抗体的试剂组合、试剂盒、检测系统及检测方法。
背景技术:
2.人的健康状况与血液成分存在一定关系。如果人出现病理状况或者受到感染,那么就会向血液中分泌特定的抗体分子,故可以通过识别血液中是否存在特定的抗体分子来判断血液的成分是否处于正常状态。检测血液中是否存在目标抗体可以采用化学发光免疫分析法(chemiluminescence immunoassay,clia)来检测。该方法将发光基团与目标抗体的特异性抗原相连,以制成检测试剂。当血液样品中不存在目标抗体时,特异性抗原无法与血液中的目标抗体特异性结合,此时,发光基团一般不具有发光活性,不会产生较强的荧光强度。当待测溶液中存在目标抗体时,该目标抗体能够特异性结合检测试剂中的抗原,形成抗原抗体复合物,此时,发光基团在发光底物的作用下发射较强的荧光。可以采用化学发光检测仪器来获得荧光强度。荧光强度的数值与血液中目标抗体的含量具有对应关系,因此,可以根据荧光强度的数值来计算出血液中目标抗体的浓度。
3.然而,上述方法采用单一荧光基团来发射荧光,并根据该单一荧光基团的荧光强度计算目标抗体的含量。由于单一荧光基团在没有目标抗体的存在下也会发射本底荧光,即便有对照试剂的存在,本底荧光也会对荧光强度的真实数值产生影响,从而在测试目标抗体的含量时造成较大的误差。
技术实现要素:
4.本技术的一些实施例的目的在于提供一种检测目标抗体的试剂组合、试剂盒、检测系统及检测方法,能够解决现有的化学发光检测法的单一荧光基团所发射的本底荧光对目标抗体的真实含量进行干扰的技术问题。本文中提到的一些实施例可以来自相同的实施例,也可以来自不同的实施例。
5.为了解决上述技术问题,本技术的一些实施例提供了一种用于检测目标抗体的试剂组合。该试剂组合至少包括:第一试剂、第二试剂、第三试剂和第四试剂。
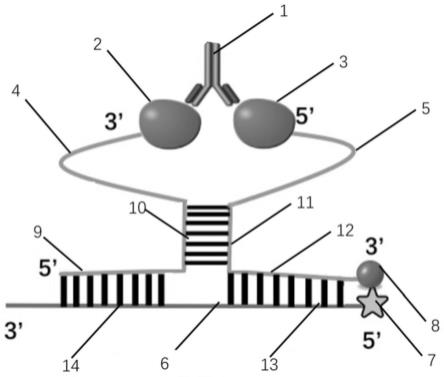
6.其中,第一试剂由第一单链dna和第一蛋白抗原偶联而成。第一单链dna含有第一dna序列和第二dna序列。第一dna序列和第二dna序列并非直接相邻,而是相隔2个或5个核苷酸。目标抗体能与第一蛋白抗原的第一抗原表位特异性结合。在本技术中,在描述单链dna时,其连接方式从左到右是从5’端到3’端。
7.第二试剂由第二蛋白抗原、第二单链dna和受体荧光基团依次偶联而成。第二单链dna具有第三dna序列和第四dna序列。第三dna序列与第四dna序列直接相连,中间并没有间隔核苷酸。第三dna序列与第二dna序列互补。目标抗体能与第二蛋白抗原的第二抗原表位特异性结合。第一蛋白抗原(又称第一支架蛋白)与第二蛋白抗原(又称第二支架蛋白)为相同的蛋白质,每个蛋白抗原分子仅由一个抗原表位能够被目标抗体的互补决定区
(complementarity determining region,cdr)特异性识别和结合。上述的第一抗原表位与第二抗原表位为相同的抗原表位,故第一蛋白抗原、第二蛋白抗原能够同时被目标抗体结合,此时能够形成稳定的抗体抗原复合物。
8.第三试剂由供体荧光基团和第三单链dna偶联而成。第三单链dna含有第五dna序列和第六dna序列。第五dna序列和第六dna序列直接相连,中间并没有间隔核苷酸。第五dna序列与第四dna序列互补,第六dna序列与第一dna序列互补。通过上述单链dna分子之间的互补配对,第一单链dna、第二单链dna和第三单链dna能够组装成颈环结构(stem-loop structure)。颈部的结构为
⊥
形,互相配对的区域呈现双螺旋结构。供体荧光基团在能被氧化剂氧化并且在不存在抗氧化剂的条件下发出第一荧光,第一荧光作为激发光在第一单链dna、第二单链dna和第三单链dna相互配对的条件下基于荧光共振能量转移效应激发受体荧光基团发出第二荧光,以便根据第二荧光的强度获得目标抗体的含量。如果没有获得第二荧光的强度,那么目标抗体的含量为0,说明此时不存在目标抗体。可以事先获得第二荧光的强度与目标抗体的含量之间的函数关系式,从而在二者之间建立起一一对应的数值关系,因此,就可以将对目标抗体的含量的测量转换为对荧光强度的数值的测量。
9.第四试剂包括抗氧化剂。该抗氧化剂能够抑制供体荧光基团被氧化而发出第一荧光。本技术各个实施例中的供体荧光基团为氧化式发光,而并非受到激发光的照射而发荧光,因此,需要在第一试剂、第二试剂和第三试剂形成稳定的结构之前防止供体荧光基团被待测溶液中的氧化性物质氧化而产生背景荧光。背景荧光属于噪音的一种,会对荧光测量的真实值产生影响,进而影响目标抗体含量的测量结果的准确性。抗氧化剂与氧化剂不能同时存在于待测样品中,以免氧化剂对供体荧光基团的氧化发光作用被抗氧化剂中和。因此,需要先移除抗氧化剂再加入氧化剂。
10.在本技术的一些实施例中,供体荧光基团与受体荧光基团之间发生荧光共振能量转移效应。第一单链dna、第二单链dna、第三单链dna在目标抗体存在的条件下互补配对,形成颈环结构,使供体荧光基团与受体荧光基团的间距小于能够发生荧光共振能量转移的极限间距,例如,在70埃至99埃的范围内,或者在7nm至10nm的范围内。
11.在本技术的一些实施例中,供体荧光基团可以为吖啶酯,受体荧光基团可以为量子点。
12.在本技术的一些实施例中,供体荧光基团的最大发射波长为430nm。
13.受体荧光基团的最大吸收波长可以在420nm至520nm的范围内,如可以为470nm。受体荧光基团的最大发射波长可以在595nm至615nm的范围内,如可以为605nm。在本技术的一些实施例中,量子点为核壳结构量子点,其核层材料选自cdse、cds、cdte、cdsete、cdzns、znte、cdses、pbs和pbte中的一种或多种,其壳层材料选自zns、znse、znses、pbs和pbses中的一种或多种。
14.在本技术的一些实施例中,量子点的粒径范围可以为3nm至5nm,也可以为4.1nm至4.2nm。
15.在本技术的一些实施例中,第一单链dna的3’末端的糖环通过第一偶联剂与第一蛋白抗原的氨基共价连接。第一单链dna的5’末端的糖环没有修饰。可选地,第一单链dna的3’末端的糖环经过nh2c7修饰基团修饰,nh2c7修饰基团通过第一偶联剂与第一蛋白抗原的氨基共价连接。可选地,第一偶联剂为双琥珀酰亚胺辛二酸酯钠盐。
16.在本技术的一些实施例中,第二单链dna的3’末端与受体荧光基团连接。可选地,第二单链dna的3’末端的糖环经过巯基修饰,受体荧光基团的表面经过氨基修饰,巯基通过第三偶联剂与受体荧光基团的表面的氨基共价连接。可选地,第三偶联剂为4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯。
17.在本技术的一些实施例中,第二单链dna的5’末端的糖环通过第二偶联剂与第二蛋白抗原的氨基共价连接。可选地,第二单链dna的5’末端的糖环经过nh2c6修饰基团修饰,nh2c6修饰基团通过第二偶联剂与第二蛋白抗原的氨基共价连接。可选地,第二偶联剂为双琥珀酰亚胺辛二酸酯钠盐。
18.在本技术的一些实施例中,第三单链dna的5’末端与供体荧光基团共价连接。可选地,第三单链dna的5’末端的糖环经过nh2c6修饰基团修饰,nh2c6修饰基团与供体荧光基团共价连接。
19.在本技术的一些实施例中,第一单链dna中,按照从5’端到3’端的顺序,第一dna序列位于第二dna序列的上游。第二单链dna中,按照从5’端到3’端的顺序,第三dna序列位于第四dna序列的上游。第三单链dna中,按照从5’端到3’端的顺序,第五dna序列位于第六dna序列的上游。
20.在本技术的一些实施例中,第一单链dna具有55个核苷酸,第一dna序列覆盖第一单链dna从5’端开始的第3至10个碱基位点,第二dna序列覆盖第一单链dna从5’端开始的第13至19个碱基位点。第二单链dna具有53个核苷酸,第三dna序列覆盖第二单链dna从5’端开始的37至43个碱基位点,第四dna序列覆盖第二单链dna从5’端开始的第44至51个碱基位点。第三单链dna具有22个核苷酸,第五dna序列覆盖第三单链dna从5’端开始的第3至10个碱基位点,第六dna序列覆盖第三单链dna从5’端开始的第11至18个碱基位点。六个dna序列之间的互补配对使得第一单链dna、第二单链dna、第三单链dna两两杂交而形成颈环结构,颈部的形状为
⊥
形。
21.在本技术的一些实施例中,第一dna序列从5’端到3’端为gctgagtt,第六dna序列从5’端到3’端为aactcagc。第二dna序列从5’端到3’端为caacgac,第三dna序列从5’端到3’端为gtcgttg。第四dna序列从5’端到3’端为gctgagat,第五dna序列从5’端到3’端为atctcagc。同一条单链dna内的两个dna序列并不相互配对,而是与另外的单链dna的dna序列相互配对。
22.在本技术的一些实施例中,第一单链dna(a first single stranded dna)的全长序列如seq id no:1所示,第二单链dna(a second single stranded dna)的全长序列如seq id no:2所示,第三单链dna(a third single stranded dna)的全长序列如seq id no:3所示。
23.在本技术的一些实施例中,第一单链dna、第二单链dna和/或第三单链dna中的g可以被
iso
g替代,c可以被
iso
c替代。
iso
g和
iso
c为非天然碱基对,以分别取代天然碱基g和c。采用非天然碱基对进行配对可以有效避免第一单链dna、第二单链dna和/或第三单链dna与待测溶液中的天然核酸进行错配,从而避免错配影响颈环结构的形成,进而避免错配所导致的测量误差。
24.其中,
iso
g的结构式为:
[0025][0026]
iso
c的结构式为:
[0027][0028]
iso
g与
iso
c的键合方式为:
[0029][0029]
表示核糖。
[0030]
在本技术的一些实施例中,第一dna序列和第六dna序列中的g被
iso
g替代,c被
iso
c替代。第一dna序列从5’端到3’端为
isogiso
ct
iso
ga
iso
gtt,第六dna序列从5’端到3’端为aa
iso
ct
iso
ca
isogiso
c。
[0031]
在本技术的一些实施例中,第二dna序列和第三dna序列中的g被
iso
g替代,c被
iso
c替代。第二dna序列从5’端到3’端为
iso
caa
isociso
ga
iso
c,第三dna序列从5’端到3’端为
iso
gt
isociso
gtt
iso
g。
[0032]
在本技术的一些实施例中,第四dna序列和第五dna序列中的g被
iso
g替代,c被
iso
c替代。第四dna序列从5’端到3’端为
isogiso
ct
iso
ga
iso
gat,第五dna序列从5’端到3’端为at
iso
ct
iso
ca
isogiso
c。
[0033]
在本技术的一些实施例中,第一单链dna的全长序列中的g被
iso
g替代,c被
iso
c替代,那么全长序列为:
[0034]aisocisogiso
ct
iso
ga
iso
gttat
iso
caa
isociso
ga
iso
ctttttttat
iso
ca
iso
cat
iso
ca
isogisogiso
ct
iso
cta
isogisociso
gtat
isogiso
ctatt
iso
g。
[0035]
在本技术的一些实施例中,第二单链dna的全长序列中的g被
iso
g替代,c被
iso
c替代,那么全长序列为:
[0036]
ta
isociso
gt
isociso
ca
iso
gaa
iso
cttta
isociso
caaa
isociso
ca
iso
ca
isocisociso
cttttttt
iso
gt
isociso
gtt
isogisogiso
ct
iso
ga
iso
gatt
iso
c。
[0037]
在本技术的一些实施例中,第三单链dna的全长序列中的g被
iso
g替代,c被
iso
c替
代,那么全长序列为:
[0038]
isociso
gat
iso
ct
iso
ca
isogiso
caa
iso
ct
iso
ca
isogiso
ca
isogisociso
g。
[0039]
在本技术的一些实施例中,第四试剂还包括载体分子,载体分子的表面结合抗氧化剂。因为供体荧光基团为氧化式发光,而非受激式发光,一旦有氧化性物质的存在,供体荧光基团便可能发出荧光。抗氧化剂的作用主要是防止供体荧光基团被这些具有氧化能力的物质氧化,从而产生对测量结果可能造成影响的背景荧光。这些具有氧化能力的物质可以来自于待测溶液或血液样本等。抗氧化剂选自大麻二酚、维生素c、维生素e、茶多酚、谷胱甘肽中的任意一种或几种。在本技术的一些实施例中,氧化剂包括过氧化氢的碱性溶液。氧化剂又可称为针对供体荧光基团的化学发光底物,因为这些底物本身就具有氧化性,可以作为氧化剂而使用。
[0040]
在本技术的一些实施例中,载体分子可以为氧化石墨烯。氧化石墨烯上的一部分羧基通过氧化亚砜缩合剂与抗氧化剂上的羟基结合,氧化石墨烯上的一部分羧基通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐与抗氧化剂上的氨基结合,从而抗氧化剂附着于氧化石墨烯上。因为抗氧化剂和氧化剂不能同时加入待测溶液中,否则氧化剂就不能使供体荧光基团氧化发光,所以在加入氧化剂之前需要从待测溶液中去除抗氧化剂。将抗氧化剂结合于氧化石墨烯载体上更有利于去除抗氧化剂。
[0041]
在本技术的各个实施例中,采用两个荧光基团之间的荧光共振能量转移来产生用于测量的第二荧光,供体荧光基团为氧化型发光,受体荧光基团为光激发型发光,并且供体荧光基团发射的第一荧光能够基于荧光共振能量转移激发受体荧光基团发射第二荧光,只需要采集二级荧光即能得到目标抗体的含量。该种检测方法排除了供体荧光基团的本底荧光对于测量结果的影响,提高了检测的灵敏度和准确性。另外,本技术各个实施例的两个荧光基团无需设置额外的激发光光源就能发射荧光信号,也降低了检测系统的复杂性,能够实现可移动式检测。再者,本技术的各个实施例中的供体荧光基团为闪光型发光,检测的时间很短,能够快速得到检测结果。
[0042]
本技术的一些实施例还提供了一种目标抗体的检测方法,其包括如下步骤:
[0043]
(1)、提供第一试剂、第二试剂、第三试剂和第四试剂;在待测溶液中加入第一试剂、第二试剂、第三试剂和第四试剂,混合后形成待测样品。
[0044]
在一些实施例中,在步骤(1)中,第一试剂由第一单链dna和第一蛋白抗原偶联而成,第一单链dna含有第一dna序列和第二dna序列,第一蛋白抗原的第一抗原表位能与目标抗体特异性结合。第二试剂由第二蛋白抗原、第二单链dna和受体荧光基团依次偶联而成,第二单链dna具有第三dna序列和第四dna序列,第三dna序列与第二dna序列互补。第二蛋白抗原的第二抗原表位能与目标抗体特异性结合。第三试剂由供体荧光基团和第三单链dna偶联而成。第三单链dna含有第五dna序列和第六dna序列,第五dna序列与第四dna序列互补,第六dna序列与第一dna序列互补。在待测溶液中含有目标抗体的条件下,第一蛋白抗原、目标抗体和第二蛋白抗原形成抗体抗原复合物,第一单链dna、第二单链dna和第三单链dna形成颈环结构,供体荧光基团与受体荧光基团位于颈环结构的同侧,故两个荧光分子之间能够发生荧光共振能量转移,由此,受体荧光基团被激发而发射第二荧光。
[0045]
(2)、从待测样品中去除用于抑制供体荧光基团被氧化而发射荧光的第四试剂,加入用于氧化供体荧光基团而发射第一荧光的氧化剂并按照受体荧光基团的最大发射波长
收集第二荧光,即排除了最大发射波长之外的其它波长的荧光。
[0046]
(3)、在没有收集到第二荧光的情况下,判断出待测溶液中没有含有目标抗体;在收集到第二荧光的强度的情况下,基于荧光强度和抗体含量的函数关系式,根据第二荧光的强度来获得待测溶液中目标抗体的含量。该函数关系是含有荧光强度值与抗体含量值的一一对应关系。
[0047]
在收集第二荧光的强度时,为了避免第一荧光对第二荧光产生干扰,可以采用滤光片过滤掉供体荧光基团被氧化后产生的荧光,只允许第二荧光透过该滤光片,由此收集受体荧光基团发出的第二荧光,根据第二荧光的强度获得目标抗体的含量。
[0048]
待测溶液可以来自于血液样本。血液的成分比较复杂,会含有多种氧化性物质,如果供体荧光基团被这些氧化性物质氧化,便会产生本底荧光,从而影响测量结果的准确性,因此,本技术为了降低本底荧光对测量结果的影响,并不采用供体荧光基团发射的第一荧光作为检测荧光信号,而采用受体荧光基团发射的第二荧光作为检测荧光信号。
[0049]
在本技术的一些实施例中,待测样品中,第一试剂的工作浓度可以为1nm至20nm。第二试剂的工作浓度可以为1nm至20nm。第三试剂的工作浓度可以为0.05nm至0.2nm。第四试剂的工作浓度可以为15μg/ml至25μg/ml。
[0050]
在本技术的一些实施例中,待测溶液来自全血样本、血清样本或者血浆样本等血液样本。
[0051]
在本技术的一些实施例中,混合的时间可以为5分钟至10分钟。
[0052]
在本技术的一些实施例中,混合的温度可以为36度至37度。
[0053]
在本技术的一些实施例中,氧化剂的体积可以为200μl,氧化剂为碱性过氧化氢溶液,ph值为8.0。该碱性过氧化氢溶液是将双氧水溶解于tbs缓冲液中进行的,其中,过氧化氢的终浓度为0.1m,tbs的终浓度为10mm。
[0054]
在本技术的一些实施例中,目标抗体包括乙肝表面抗体、丙肝表面抗体、或巨细胞病毒igg。
[0055]
在本技术的一些实施例中,经过混合后的待测样品中,第一试剂、第二试剂中的两个蛋白抗原与待测样品中的目标抗体形成抗体抗原复合物,该抗体抗原复合物使三条单链dna的互补序列的距离拉进,两两互补配对并实现dna之间的组装,从而形成颈环结构。
[0056]
本技术的一些实施例还提供了一种目标抗体检测试剂盒,其包括:第一试管、第二试管、第三试管、第四试管和第五试管。
[0057]
其中,第一试管储存第一单链dna和第一蛋白抗原的偶联物。
[0058]
第二试管储存第二蛋白抗原、第二单链dna和受体荧光基团的偶联物。第一蛋白抗原和第二蛋白抗原在目标抗体存在的条件下能与目标抗体形成抗体抗原复合物。相反,如果不存在目标抗体,那么就不会发生两个蛋白抗原与目标抗体之间的免疫反应,也不会形成抗体抗原复合物,从而就不会引发单链dna之间的组装。
[0059]
第三试管储存供体荧光基团和第三单链dna的偶联物。第一单链dna、第二单链dna和第三单链dna在抗体抗原复合物形成的条件下基于邻近效应而组装成颈环结构,颈环结构的空间构象使得供体荧光基团与受体荧光基团自发排列于颈环结构的同侧,并且二者之间的空间距离小于能够发生荧光共振能量转移的极限距离,例如,在70埃至99埃的范围内,这为两个荧光基团之间发生荧光共振能量转移提供了条件。
[0060]
第四试管储存能够抑制供体荧光基团被氧化的抗氧化剂。可选地,抗氧化剂可以修饰于载体分子上。可选地,载体分子可以选自氧化石墨烯。
[0061]
第五试管储存氧化剂。该氧化剂能够氧化供体荧光基团以发射第一荧光。氧化剂与抗氧化剂并不同时存在于待测样品中。在加入氧化剂之前,抗氧化剂和载体分子需要从待测样品中移除。因为抗氧化剂修饰于载体分子上,而载体分子氧化石墨烯呈现片层网络结构,极易从待测样品中移除,所以可以通过移除载体分子来实现对抗氧化剂的移除。另外,氧化石墨烯也能吸附游离的第三单链dna,从而吸附供体荧光基团和第三单链dna的偶联物,使得抗氧化剂抑制处于游离状态的供体荧光基团被不当氧化,从而抑制供体荧光基团不当发射背景荧光。
[0062]
在本技术的实施例中,目标抗体检测试剂盒的检测原理如下所示:
[0063]
在待测溶液中含有目标抗体的条件下,第一蛋白抗原和第二蛋白抗原能与目标抗体形成抗体抗原复合物。第一单链dna、第二单链dna和第三单链dna的距离接近,发生杂交,并自组装成颈环结构。三条单链dna中的六个dna序列两两互补配对形成颈环结构的颈部,其余的非dna序列形成颈环结构的环部。每条单链dna内部的两个dna序列不能互补配对,只能与另外的单链dna的互补序列配对。颈环结构的空间构象使得供体荧光基团与受体荧光基团位于颈环结构的同侧并且二者的距离能够保证二者之间发生荧光共振能量转移。在移除第四试剂的条件下,氧化剂能氧化供体荧光基团并使其发射第一荧光,第一荧光基于荧光共振能量转移效应激发受体荧光基团发出第二荧光,以便根据第二荧光的强度获得目标抗体的含量。
[0064]
在待测溶液中没有含有目标抗体的条件下,抗体抗原复合物和颈环结构无法形成,即便移除了抗氧化剂并且随后加入的氧化剂使供体荧光基团发射第一荧光,但是供体荧光基团与受体荧光基团的距离大于能发生荧光共振能量转移的极限距离,那么供体荧光基团就无法激发受体荧光基团发射第二荧光。无法获得第二荧光的强度说明待测溶液中目标抗体的含量为零,进而说明待测溶液中没有含有目标抗体。
[0065]
本技术的实施例中受体荧光基团在激发光的激发作用下才能发射第二荧光,如果没有第一荧光的激发作用,那么受体荧光基团就不会发射用于测量目标抗体含量的第二荧光,因此,受体荧光基团作为检测基团基本不会发射背景荧光,这保证了采用第二荧光作为检测荧光的可靠性。
[0066]
本技术的一些实施例提供了一种目标抗体检测系统,其包括:反应容器、微量注射泵、滤光片、光信号检测模块和计算模块。
[0067]
其中,反应容器具有能容纳待测溶液的容置腔室。
[0068]
微量注射泵通过注射管道与容置腔室相连通,将第一试剂、第二试剂、第三试剂和第四试剂的混合物通过注射管道注射入容置腔室中,以便与待测溶液进行混合。第一试剂由第一单链dna和第一蛋白抗原偶联而成,第二试剂由第二蛋白抗原、第二单链dna和受体荧光基团依次偶联而成,第三试剂由供体荧光基团和第三单链dna偶联而成,第四试剂含有抑制供体荧光基团被氧化而发射第一荧光的抗氧化剂。
[0069]
滤光片设于第一荧光的出射光路上,允许与受体荧光基团的最大发射波长具有相同波长的第二荧光透过。
[0070]
光信号检测模块设于第一荧光的出射光路上并位于滤光片的下游侧,获取从滤光
片透射的第二荧光。第二荧光的强度值可以为0,此时表示待测溶液中不存在目标抗体,因为受体荧光基团为受激发光,而并非氧化发光,在没有激发光激发的条件下,受体荧光基团本身是不发射第二荧光的,那么其也就不会产生背景荧光噪音,故在不存在目标抗体的条件下,第二荧光的强度能够达到零,而如果采用第一荧光作为检测荧光,由于第一荧光为氧化发光,而待测溶液中会存在氧化性物质,那么第一荧光会被这些氧化性物质氧化而发射背景荧光噪音,这使得在不存在目标抗体的条件下第一荧光的强度一般不会为0。因此,采用第二荧光作为检测荧光比采用第一荧光作为检测荧光更准确,误差更小。
[0071]
计算模块,将所述第二荧光转换为数字信号并且根据荧光强度和抗体含量的函数关系式获得待测溶液中目标抗体的含量。
[0072]
由于采用以上技术方案,本技术的一些实施例能够取得以下技术效果:
[0073]
本技术的一些实施例采用免疫反应和荧光共振能量转移效应相结合来检测待测溶液中是否含有目标抗体。具体为:
[0074]
在待测溶液中含有目标抗体的条件下,第一蛋白抗原、目标抗体和第二蛋白抗原基于免疫反应而形成抗体抗原复合物,使得第一单链dna、第二单链dna和第三单链dna的间距拉进,引发dna组装并形成颈环结构,颈环结构使得供体荧光基团与受体荧光基团位于该颈环结构的同侧,从而在二者之间产生荧光共振能量转移现象并使受体荧光基团发射第二荧光作为待测荧光信号。根据预设的荧光强度和抗体含量的函数关系式和待测荧光信号的强度来获得待测溶液中目标抗体的含量。
[0075]
在待测溶液中不存在目标抗体的条件下,抗体抗原复合物和颈环结构无法形成,受体荧光基团不会受到激发光(即第一荧光)的激发而发射第二荧光,那么就无法捕捉到待测荧光信号,说明待测溶液中不存在目标抗体。另外,即便供体荧光基团在某些氧化性物质的作用下发射背景荧光,由于颈环结构无法形成,那么此时供体荧光基团与受体荧光基团之间的空间距离大于荧光共振能量转移效应所要求的最小间距,两种荧光基团之间不会发生荧光共振能量转移效应,受体荧光基团也就不会基于该背景荧光发射第二荧光。由此实现对待测溶液中是否存在目标抗体的定性检测和对待测溶液中目标抗体含量的定量检测。
[0076]
本技术的各个实施例采用不易产生背景荧光噪音的受体荧光基团发射的第二荧光作为待测荧光信号,而不采用通常存在背景荧光噪音的供体荧光基团发射的第一荧光作为待测荧光信号,能够大幅度降低背景荧光噪音对检测结果的影响,提高检测的灵敏度和降低检测的误差,使测得的蛋白质含量更接近于真实值。
附图说明
[0077]
图1是本技术的一些实施例的抗体抗原复合物与颈环结构的示意图。
[0078]
图2是本技术的一些实施例的检测方法的示意图。图2中,当存在目标抗体(图2所示的target)时,两个相同的抗原和目标抗体会形成抗体抗原复合物,单链dna分子之间会形成颈环结构。在洗脱掉修饰了抗氧化剂的氧化石墨烯之后加入氧化剂(过氧化氢的碱液),吖啶酯被氧化剂氧化而发射430nm的第一荧光,第一荧光激发量子点发射605nm的第二荧光,此时称为signal on状态。当不存在目标抗体时(图2所示的no target),没有抗体抗原复合物和颈环结构的产生,第三单链dna由于通过π-π堆积作用吸附在氧化石墨烯表面,在洗脱掉修饰了抗氧化剂的氧化石墨烯时,第三单链dna和第三单链dna的偶联物会随着氧
化石墨烯一起被洗脱而留存在洗脱掉的液体中,吖啶酯会被液体中的氧化性物质氧化而产生背景荧光,而洗脱后留存下的液体中存在第二蛋白抗原、第二单链dna和量子点的偶联物。量子点由于没有激发光的激发而并不产生荧光,此时称为signal off状态,说明液体中并没有目标抗体。
[0079]
附图标记:目标抗体1、第一蛋白抗原2、第二蛋白抗原3、第一单链dna 4、第二单链dna 5、第三单链dna6、供体荧光基团7、受体荧光基团8、第一dna序列9、第二dna序列10、第三dna序列11、第四dna序列12、第五dna序列13、第六dna序列14、氧化石墨烯和抗氧化剂的复合物15(即第四试剂)。
具体实施方式
[0080]
以下结合具体实施方式对本技术的各个实施例的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本技术,而非对本技术的限制。另外,以下具体实施方式可以在不付出创造性劳动的前提下任意组合,以形成新的实施例。
[0081]
[用于检测目标抗体的试剂组合]
[0082]
本技术的一些实施例提供了一种试剂组合。该试剂组合用于检测待测溶液中是否存在目标抗体,由此实现对目标抗体的定性检测。并且,该试剂组合还能够在待测溶液中存在目标抗体的前提下获得该目标抗体在待测溶液中的浓度,由此实现对目标抗体含量的定量检测。
[0083]
在本技术的一些实施例中,待测溶液可以来自血液样本或其它非血液样本。其中,血液样本可以来自于全血样本、血清样本或者血浆样本。
[0084]
在本技术的一些实施例中,待检测的目标抗体的种类没有特别的限制。示例性地,目标抗体可以为乙肝表面抗体、丙肝表面抗体、或巨细胞病毒igg等。在本技术的一些实施例中,待检测的目标抗体的分子量可以在50至1000kd的范围内,也可以在100kd至500kd的范围内。
[0085]
在本技术的一些实施例中,试剂组合包括:第一试剂、第二试剂、第三试剂和第四试剂。
[0086]
其中,第一试剂由第一单链dna和第一蛋白抗原偶联而成。第一单链dna的3’末端的糖环经过nh2c7修饰基团修饰,由nh2c7修饰基团通过第一偶联剂与第一蛋白抗原的氨基共价连接。nh2c7修饰基团修饰的是第一单链dna的3’末端的糖环,而并非碱基。第一偶联剂可以为双琥珀酰亚胺辛二酸酯钠盐。第一蛋白抗原中与第一偶联剂相连的氨基并非位于第一蛋白抗原的第一抗原表位,否则第一蛋白抗原就不能与目标抗体特异性结合。第一单链dna的3’末端没有修饰基团。
[0087]
在一些实施例中,第一单链dna的全长序列如seq id no:1所示。具体序列可以为acgctgagttatcaacgactttttttatcacatcaggctctagcgtatgctattg,但是也不限于上述序列。
[0088]
在一些实施例中,第一单链dna含有第一dna序列和第二dna序列。第一单链dna中,按照从5’端到3’端的顺序,第一dna序列可以位于第二dna序列的上游。示例性地,第一dna序列从5’端到3’端可以为gctgagtt,第二dna序列从5’端到3’端为caacgac。但第一dna序列与第二dna序列并不发生互补配对。在本技术的各个实施例中,每一个单链dna内含的两个dna序列之间并不发生互补配对。不同试剂之间的单链dna才发生互补配对,从而组装成颈
环结构。
[0089]
在一些实施例中,第一单链dna具有55个核苷酸,第一dna序列覆盖第一单链dna从5’端开始的第3至10个碱基位点,第二dna序列覆盖第一单链dna从5’端开始的第13至19个碱基位点。
[0090]
在一些实施例中,第一蛋白抗原的第一抗原表位能与目标抗体特异性结合。目标抗体是能够与该第一蛋白抗原的第一抗原表位具有特异性亲和力的抗体,其只特定地识别该第一蛋白抗原的第一抗原表位,而不识别该第一蛋白抗原的其它抗原表位。
[0091]
第二试剂可以由第二蛋白抗原、第二单链dna和受体荧光基团依次偶联而成。
[0092]
在一些实施例中,第二蛋白抗原的第二抗原表位能与目标抗体特异性结合,其只特定地识别该第二蛋白抗原的第二抗原表位,而不识别该第二蛋白抗原的其它抗原表位。第一蛋白抗原与第二蛋白抗原是相同的蛋白抗原,第一抗原表位与第二抗原表位也是相同的。目标抗体是能够与该第二蛋白抗原的第二抗原表位具有亲和力的抗体。因为目标抗体是y型结构,当其同时与第一蛋白抗原和第二蛋白抗原的抗原表位相结合时,才能形成稳定的抗体抗原复合物。由此,当待测溶液中存在目标抗体时,第一蛋白抗原、第二蛋白抗原能够与目标抗体发生免疫反应而形成抗体抗原复合物。
[0093]
在一些实施例中,第二单链dna的全长序列如seq id no:2所示。具体序列可以为tacgtccagaactttaccaaaccacaccctttttttgtcgttggctgagattc,但是也不限于上述序列。
[0094]
在一些实施例中,第二单链dna具有第三dna序列和第四dna序列。第二单链dna中,按照从5’端到3’端的顺序,第三dna序列位于第四dna序列的上游。示例性地,第三dna序列从5’端到3’端为gtcgttg,第四dna序列从5’端到3’端为gctgagat。第三dna序列与第二dna序列互补。第三dna序列和第四dna序列之间不存在互补关系,因此,降低了dna链内错配的可能性。
[0095]
在一些实施例中,第二单链dna具有53个核苷酸。第三dna序列覆盖第二单链dna从5’端开始的37至43个碱基位点,第四dna序列覆盖第二单链dna从5’端开始的第44至51个碱基位点。
[0096]
在一些实施例中,第二单链dna的3’末端与受体荧光基团连接。示例性地,第二单链dna的3’末端的糖环经过巯基修饰,受体荧光基团的表面经过氨基修饰,巯基通过第三偶联剂与受体荧光基团的表面的氨基共价连接。第三偶联剂可以为4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯。
[0097]
在一些实施例中,第二单链dna的5’末端的糖环经过nh2c6修饰基团修饰,由nh2c6修饰基团通过第二偶联剂与第二蛋白抗原的氨基共价连接。第二偶联剂为双琥珀酰亚胺辛二酸酯钠盐。第二蛋白抗原中与第二偶联剂相连的氨基并非位于第二蛋白抗原的第二抗原表位,否则第二蛋白抗原就不能与目标抗体特异性结合。
[0098]
第三试剂可以由供体荧光基团和第三单链dna偶联而成。
[0099]
在一些实施例中,第三单链dna的5’末端的糖环经过nh2c6修饰基团修饰,nh2c6修饰基团与供体荧光基团共价连接。
[0100]
在一些实施例中,第三单链dna的全长序列如seq id no:3所示。具体序列可以为cgatctcagcaactcagcagcg,但是也不限于上述序列。
[0101]
在一些实施例中,第三单链dna含有第五dna序列和第六dna序列,第五dna序列和
第六dna序列之间并不互补。
[0102]
在一些实施例中,第三单链dna中,按照从5’端到3’端的顺序,第五dna序列位于第六dna序列的上游。
[0103]
在一些实施例中,第三单链dna具有22个核苷酸,第五dna序列覆盖第三单链dna从5’端开始的第3至10个碱基位点,第六dna序列覆盖第三单链dna从5’端开始的第11至18个碱基位点。第五dna序列从5’端到3’端的序列可以为atctcagc。第六dna序列从5’端到3’端的序列可以为aactcagc。
[0104]
在一些实施例中,第五dna序列与第四dna序列互补,第六dna序列与第一dna序列互补,第三dna序列与第二dna序列互补。在待测溶液中含有目标抗体时,第一蛋白抗原、第二蛋白抗原与目标抗体形成抗体抗原复合物,该抗体抗原复合物的形成会带动三条单链dna之间发生构象变化和dna组装,并借助上述dna序列之间的互补配对关系使得三条单链dna之间能够形成颈环结构,供体荧光基团与受体荧光基团位于颈环结构的同侧,并在两种荧光分子之间发生荧光共振能量转移(fluorescence resonance energy transfer,fret)。
[0105]
在一些实施例中,供体荧光基团在能被氧化剂氧化的条件下发出第一荧光,第一荧光在第一单链dna、第二单链dna和第三单链dna相互配对的条件下根据荧光共振能量转移效应激发受体荧光基团发出第二荧光,以便根据第二荧光的强度获得目标抗体的含量。当待测溶液中不存在目标抗体时,即便供体荧光基团具有较强的本底荧光,但是供体荧光基团和受体荧光基团之间的距离不满足荧光共振能量转移的产生条件,因此,受体荧光基团不会发生第二荧光。如果从待测溶液中没有获取到第二荧光强度,那么说明待测溶液中不存在目标抗体,由此能够避免仅采用一种荧光基团检测时其本底荧光带来的假阳性。当待测溶液中存在目标抗体时,两个相同的抗原同时与目标抗体相结合而形成稳定的抗体抗原复合物,三条单链dna形成颈环结构。抗体抗原复合物和颈环结构能够使得供体荧光基团和受体荧光基团的距离足以产生荧光共振能量转移效应,从而根据受体荧光基团发出的第二荧光的强度和强度含量之间的标准曲线确定目标抗体的含量。
[0106]
在一些实施例中,供体荧光基团发射荧光无需激发光的照射,而是在氧化剂的氧化作用下发光。但是受体荧光基团发射荧光需要激发光的照射,若没有激发光的照射,那么受体荧光基团本身是不会主动发射荧光的,故也就不容易产生本底荧光,因此,本技术实施例的测量结果不受到受体荧光基团的本底荧光的干扰。相比只用一种荧光基团发射荧光的方法而言,本技术的各个实施例的方法能够有效避免荧光分子的本底荧光的干扰,故测量结果更加准确。受体荧光基团的激发光来自于供体荧光基团所发出的第一荧光,但是仅有第一荧光尚不足以使受体荧光基团发射第二荧光。即便供体荧光基团存在本底荧光,如果供体荧光基团与受体荧光基团的间距大于荧光共振能量转移效应所需要的最小间距,该本底荧光也不会激发供体荧光基团发射第二荧光。而当待测溶液中存在目标抗体时,颈环结构才能使得供体荧光基团与受体荧光基团的间距小于荧光共振能量转移效应所需要的最小间距,那么供体荧光基团才能激发受体荧光基团发射第二荧光。总之,本技术的各个实施例能够有效避免供体荧光基团的本底荧光对于检测结果的影响,降低了测量的误差。
[0107]
在一些实施例中,在检测时,供体荧光基团与受体荧光基团需要能够发生荧光共振能量转移,需要满足以下条件:第一试剂、第二试剂、第三试剂在目标抗体存在的条件下
互补配对,形成颈环结构,使供体荧光基团与受体荧光基团的间距小于或等于100埃。此时,供体荧光基团发射的第一荧光能够成为受体荧光基团的激发光,从而激发受体荧光基团产生第二荧光(如图1所示)。
[0108]
在一些实施例中,供体荧光基团可以为吖啶酯。吖啶酯发射荧光并不需要激发光,而是在氧化剂的存在下实现氧化发光,由于待测溶液中可能存在氧化性物质,也能够氧化吖啶酯并使其发光,因此,吖啶酯会存在本底荧光。如果采用吖啶酯的荧光作为测量荧光,那么本底荧光会对测量荧光产生干扰,因此,为了进一步提高检测的灵敏度和降低测量误差,本技术的实施例并非采用吖啶酯的荧光作为测量荧光。吖啶酯的化学发光底物为h2o2的碱性溶液,又称氧化剂。当吖啶酯与h2o2的碱性溶液共存时,吖啶酯的分子受到过氧化氢离子进攻,吖啶酯能与过氧化氢(h2o2)形成不稳定的二氧乙烷,二氧乙烷的随后分解便会发射荧光。
[0109]
在一些实施例中,供体荧光基团吖啶酯的最大发射波长为430nm。在一些实施例中,受体荧光基团可以为量子点。受体荧光基团量子点的最大吸收波长可以在420nm至520nm的范围内,如可以为470nm,最大发射波长可以在595nm至615nm的范围内,如可以605nm。因此,本技术实施例中的供体荧光基团和受体荧光基团能够发生荧光共振能量转移效应。在一些实施例中,量子点为核壳结构量子点,其核层材料选自cdse、cds、cdte、cdsete、cdzns、znte、cdses、pbs和pbte中的一种或多种,其壳层材料选自zns、znse、znses、pbs和pbses中的一种或多种。在一些实施例中,量子点的粒径范围可以为3nm至5nm,示例性地,可以为4.1nm。
[0110]
在一些实施例中,第一单链dna、第二单链dna、第三单链dna中的g可以被
iso
g替代,c可以被
iso
c替代。因为当待测溶液来自于血液样本等时,这些样本中也存在天然核酸,所以通过引入非天然碱基对(
iso
g和
iso
c)能够避免第一单链dna、第二单链dna、第三单链dna与血液样本中的核酸发生非特异性结合,从而避免由于dna错配导致的测量误差。另外,这些非天然碱基对并不影响第一单链dna、第二单链dna、第三单链dna之间的相互配对,依然能够形成稳定的颈环结构,从而不影响第二荧光的产生。示例性地,第一单链dna的全长序列中的g被
iso
g替代,c被
iso
c替代。第二单链dna的全长序列中的g被
iso
g替代,c被
iso
c替代。第三单链dna的全长序列中的g被
iso
g替代,c被
iso
c替代。
[0111]
在一些实施例中,相互配对的第一dna序列和第六dna序列中的g被
iso
g替代,c被
iso
c替代。示例性地,第一dna序列从5’端到3’端为
isogiso
ct
iso
ga
iso
gtt,第六dna序列从5’端到3’端为aa
iso
ct
iso
ca
isogiso
c。
[0112]
在一些实施例中,相互配对的第二dna序列和第三dna序列中的g被
iso
g替代,c被
iso
c替代。示例性地,第二dna序列从5’端到3’端为
iso
caa
isociso
ga
iso
c,第三dna序列从5’端到3’端为
iso
gt
isociso
gtt
iso
g。
[0113]
在一些实施例中,相互配对的第四dna序列和第五dna序列中的g被
iso
g替代,c被
iso
c替代。示例性地,第四dna序列从5’端到3’端为
isogiso
ct
iso
ga
iso
gat,第五dna序列从5’端到3’端为at
iso
ct
iso
ca
isogiso
c。
[0114]
在上述实施例中,
iso
g的结构式可以为:
[0115][0116]
iso
c的结构式可以为:
[0117][0118]
iso
g与
iso
c的键合方式可以为:
[0119][0119]
表示核糖。
[0120]
因此,
iso
g与
iso
c之间能够产生互补配对,并不影响第一单链dna、第二单链dna、第三单链dna之间的相互配对,但又能防止第一单链dna、第二单链dna、第三单链dna与待测溶液中的天然核酸发生错配,因此,上述实施例能够降低因单链dna与天然核酸分子发生错配而导致的测量误差。
[0121]
第四试剂包括:用于供体荧光基团被氧化而发出第一荧光的抗氧化剂。在检测时,需在待测溶液中加入第一试剂、第二试剂、第三试剂和第四试剂,混合后形成待测样品。当待测样品中存在抗氧化剂时,即便第一试剂、第二试剂、第三试剂形成了颈环结构,那么供体荧光基团吖啶酯也不会发射荧光,因为抗氧化剂会抑制吖啶酯的氧化发光。因此,在检测前需要从待测样品中移除抗氧化剂。
[0122]
在一些实施例中,为了实现从待测样品中顺利移除抗氧化剂,第四试剂还包括载体分子,并将抗氧化剂结合于载体分子的表面。此时,由于载体分子具有较大的分子量,比较容易从待测样品中移除。只要移除载体分子,便能实现同时移除抗氧化剂。
[0123]
在一些实施例中,载体分子可以为氧化石墨烯(graphene oxide,go)。氧化石墨烯上的羧基通过氧化亚砜缩合剂与抗氧化剂上的羟基结合,氧化石墨烯上的羧基通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐与抗氧化剂上的氨基结合。待测溶液中加入第一试剂、第二试剂、第三试剂和第四试剂后形成待测样品,第三单链dna通过π-π堆积作用吸附在氧化石墨烯表面,其末端标记的吖啶酯(acridinium ester,ae)由于抗氧化剂的存在而无法氧化发光,即使是少部分的吖啶酯发生化学发光,即产生波长为430nm的本底荧光,也不
会对测量结果产生影响。因为在检测时所获取到的荧光来自于受体荧光基团量子点,而并非来自于吖啶酯,可以通过设置滤光片仅获取量子点发射的荧光,而过滤掉吖啶酯的本底荧光。另外,即便少部分的吖啶酯存在本底荧光,因为没有颈环结构的存在,该吖啶酯也不会基于荧光共振能量转移而激发量子点发射荧光。由此,本技术的实施例可以最大幅度降低吖啶酯的本底荧光对测量结果的影响,进而降低测量误差。在一些实施例中,量子点发射的荧光可以通过滤光片和光电倍增管(photomultiplier tube,pmt)来获得。示例性地,如果量子点发射的荧光为605nm,那么滤光片仅允许605nm波长的光通过。
[0124]
在一些实施例中,抗氧化剂可以选自大麻二酚、维生素c、维生素e、茶多酚、谷胱甘肽中的任意一种或几种。氧化剂可以包括过氧化氢的碱性溶液。在移除抗氧化剂后,加入的氧化剂能够使供体荧光基团吖啶酯发射荧光。
[0125]
本技术的实施例通过免疫反应使抗体识别目标抗体,从而使一对与抗体偶联的dna间距离拉近,进而引发dna组装、触发级联dna组装,并使得两个荧光分子之间发生荧光共振能量转移效应而产生检测信号。
[0126]
本技术的各个实施例以吖啶酯(ae)为荧光能量供体(donor),荧光量子点(qds)为荧光能量受体(acceptor),基于化学发光共振能量转移系统。通过免疫反应与dna自组装实现荧光信号放大,将对目标抗体含量的检测转化为对荧光信号强度的检测。本技术的实施例的方法可均相进行。与传统的荧光共振能量转移分析方法相比,本技术的实施例的检测方法简单、快速,不需要昂贵的激光。本技术的实施例采用第二荧光作为检测荧光,降低了第一荧光的背景干扰。本技术的实施例采用免疫反应富集目标抗体,对目标抗体的选择性好,检测灵敏度高。
[0127]
[目标抗体的检测方法]
[0128]
如图2所示,本技术的一些实施例提供了一种目标抗体的检测方法,该检测方法可以使用上述的试剂组合。关于上述的试剂组合的特征可以并入本部分。上述实施例的检测方法包括如下步骤:
[0129]
(1)、提供第一试剂、第二试剂、第三试剂和第四试剂,在待测溶液中加入第一试剂、第二试剂、第三试剂和第四试剂,混合后形成待测样品。第一试剂由第一单链dna和第一蛋白抗原偶联而成。第二试剂由第二蛋白抗原、第二单链dna和受体荧光基团依次偶联而成。第三试剂由供体荧光基团和第三单链dna偶联而成。在待测溶液中含有目标抗体的条件下,第一蛋白抗原、目标抗体和第二蛋白抗原形成抗体抗原复合物,第一单链dna、第二单链dna和第三单链dna形成颈环结构,从而供体荧光基团与受体荧光基团位于颈环结构的同侧。
[0130]
(2)、从待测样品中去除第四试剂,加入用于氧化供体荧光基团而发射第一荧光的氧化剂并按照受体荧光基团的最大发射波长收集第二荧光。第四试剂中含有用于抑制供体荧光基团被待测溶液中的氧化物质氧化的抗氧化剂。由于在抗氧化剂存在的条件下,供体荧光基团并不会发射第一荧光,那么在加入氧化剂之前,就需要事先去除抗氧化剂。另外,供体荧光基团在被氧化之前会受到抗氧化剂的抗氧化保护作用,从而也能够降低自身由于受到其它因素影响而发射的本底荧光。
[0131]
(3)、在没有收集到第二荧光的情况下,判断出待测溶液中没有含有目标抗体;在收集到第二荧光的情况下,基于荧光强度和抗体含量的函数关系式,根据第二荧光的强度
获得待测溶液中目标抗体的含量。
[0132]
本步骤中,供体荧光基团被氧化后会产生第一荧光,为了避免第一荧光对检测结果造成影响,采用滤光片过滤掉第一荧光,该滤光片仅允许受体荧光基团发出的第二荧光的透射,此时,根据第二荧光的强度获得目标抗体的含量。如果第二荧光的相对强度为0,说明待测溶液中没有含有目标抗体。如果第二荧光的相对强度不为0,那么根据第二荧光的相对强度和抗体含量的函数关系式获得待测溶液中目标抗体的含量。相对强度指的是从第二荧光信号的强度中排除了对照组的背景荧光强度之后剩余的荧光强度值。
[0133]
在一些实施例中,在待测样品中,第一试剂的工作浓度为1nm至20nm。工作浓度指的是在实际检测时各个试剂的浓度,也即各个试剂在待测样品中的终浓度。工作浓度不等于各个试剂在目标抗体检测试剂盒中的储存浓度。在一些实施例中,在待测样品中,第二试剂的工作浓度为1nm至20nm。在一些实施例中,在待测样品中,第三试剂的工作浓度为0.05nm至0.2nm。在一些实施例中,在待测样品中,第四试剂的工作浓度为15μg/ml至25μg/ml。
[0134]
在一些实施例中,待测溶液血液样本,来自全血样本、血清样本或者血浆样本。
[0135]
在一些实施例中,混合的时间为5分钟至10分钟。如果混合的时间过短,那么抗体抗原复合物和颈环结构可能尚未完全形成,供体荧光基团与受体荧光基团之间的荧光共振能量转移随后就不能完全发生,这会使测得的荧光值小于实际值。如果混合的时间过长,那么抗体抗原复合物和颈环结构可能会受到破坏,这也会使测得的荧光值小于实际值。
[0136]
在一些实施例中,混合的温度为36度至37度。
[0137]
在一些实施例中,氧化剂的体积为200μl。氧化剂为碱性过氧化氢溶液,ph值为8.0。该碱性过氧化氢溶液是将双氧水溶解于tbs缓冲液中进行的,其中,过氧化氢的终浓度为0.1m,tbs的终浓度为10mm。
[0138]
在一些实施例中,目标抗体包括乙肝表面抗体、丙肝表面抗体、或巨细胞病毒igg。但是在其它的一些实施例中,目标抗体也不限于上述几种。只要本技术的第一蛋白抗原和第二蛋白抗原能分别与同一个目标抗体特异性结合,并形成稳定的抗体抗原复合物即可。如果第一蛋白抗原和第二蛋白抗原分别与两个目标抗体相结合,那么该种结合状态是不稳定的,结合容易断裂而发生重新结合,最终第一蛋白抗原和第二蛋白抗原只同时结合1个目标抗体,此时会形成较稳定的抗体抗原复合物。抗体抗原复合物又会使第一单链dna、第二单链dna和第三单链dna距离拉进而形成颈环结构,供体荧光基团与受体荧光基团位于颈环结构的同侧,供体荧光基团才能激发受体荧光基团产生第二荧光。因此,一个目标抗体对应一个受体荧光基团,那么目标抗体的数目与受体荧光基团的荧光强度是线性关系,可以根据标准曲线所含的一元一次方程(即第二荧光的强度和抗体含量的函数关系式)和所获得的受体荧光基团的荧光强度计算出目标抗体的含量。
[0139]
在一些实施例中,具体的检测步骤如下所示:将试剂与含有目标抗体的待测血液样本或全血样本或血清样本或血浆样本相混合,在化学发光检测仪上于37℃温育反应5-10分钟,加入作为氧化剂的化学发光底物过氧化氢、氢氧化钠和tbs缓冲液,通过化学发光检测仪中pmt检测模块采集产生的化学发光荧光信号。化学发光检测仪自动调用标准曲线,根据该标准曲线含有荧光强度和抗体含量的函数关系式报出待测样本中目标抗体的浓度。
[0140]
[目标抗体检测试剂盒]
[0141]
本技术的一些实施例提供了一种目标抗体检测试剂盒,该试剂盒使用上述的检测方法进行检测。目标抗体检测试剂盒包括:第一试管、第二试管、第三试管、第四试管、第四试管、第五试管。
[0142]
其中,第一试管储存第一单链dna和第一蛋白抗原的偶联物。第一单链dna含有55个碱基,3’端修饰有nh2c7基团。3'c7氨基修饰引物购买自金斯瑞生物科技股份有限公司。nh2c7基团通过第一偶联剂双琥珀酰亚胺辛二酸酯钠盐(bs3)与第一蛋白抗原的氨基共价连接,从而形成第一单链dna和第一蛋白抗原的偶联物。
[0143]
第二试管储存第二蛋白抗原、第二单链dna和受体荧光基团的偶联物。第一蛋白抗原和第二蛋白抗原在目标抗体存在的条件下能与目标抗体形成抗体抗原复合物。第二单链dna含有53个碱基,3’端修饰巯基,5’端修饰nh2c6基团。巯基修饰试剂3'sh c6、5'aminolinker(c6)修饰引物购买自金斯瑞生物科技股份有限公司。5’端修饰是在合成循环的最后一步以亚磷酸胺的形式通过β-氰乙基化学反应添加到5’糖环上的,而不是添加到最后一个碱基上。3’末端的巯基通过第三偶联剂4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)与氨基修饰的量子点qds表面的氨基共价相连。在一些实施例中,氨基修饰的水溶性量子点的型号可以为氨基水溶性量子点(peg)-605,成分为cdse/zns,购买自西安齐岳生物科技有限公司。(peg)-605的最大吸收峰波长470nm,最大发射波长605nm,粒径为4.1nm。氨基修饰的量子点的氨基与第二单链dna的3’端的巯基偶联,形成第二单链dna和量子点的偶联物。第二单链dna的5’端的nh2c6基团通过第二偶联剂bs3与第二蛋白抗原上的氨基共价结合,形成第二蛋白抗原、第二单链dna和受体荧光基团的偶联物。
[0144]
第三试管储存供体荧光基团和第三单链dna的偶联物。第一单链dna、第二单链dna和第三单链dna在抗体抗原复合物形成的条件下能形成颈环结构;供体荧光基团与受体荧光基团能位于颈环结构的同侧。第三单链dna含有22个碱基,5’端修饰nh2c6基团。修饰引物5'aminolinker(c6)是在合成循环的最后一步以亚磷酸胺的形式通过β-氰乙基化学反应添加到第三单链dna5’末端的糖环上,而不是添加到最后一个碱基上。该修饰引物购买自金斯瑞生物科技股份有限公司。通过加入吖啶酯(nsp-dmae-nhs)形成供体荧光基团和第三单链dna的偶联物,供体荧光基团吖啶酯购买自苏州亚科科技股份有限公司,cas号为194357-64-7。第三单链dna从5’端开始的3至10个碱基位点与第二单链dna从3’端开始的3至10碱基位点(即从5’端开始的第44至51个碱基位点)的碱基完全互补。第三单链dna从3’端开始的5至12个碱基位点(即从5’端开始的第11至18个碱基位点)与第一单链dna从5’端开始的3至10个碱基位点的碱基完全互补,如图1所示。
[0145]
第四试管储存能够抑制供体荧光基团被氧化的抗氧化剂。抗氧化剂可以结合于载体分子的表面。在一些实施例中,载体分子可以为氧化石墨烯。
[0146]
第五试管储存能够氧化供体荧光基团以发射第一荧光的氧化剂。
[0147]
其中,上述实施例中的目标抗体检测试剂盒的检测原理如下:
[0148]
第三单链dna分别有8个碱基与第一单链dna、第二单链dna互补配对,其中将天然碱基对g和c更换为非天然碱基对
iso
g和
iso
c。
[0149]
在没有目标抗体存在的条件下,不会形成颈环结构,第三单链dna通过π-π堆积作用吸附在氧化石墨烯(go)表面,其末端标记的吖啶酯(ae)由于抗氧化剂的存在而无法氧化发光,即使是少部分的吖啶酯产生背景荧光,吖啶酯的化学发光(430nm波长)也因仪器的滤
光片(仅允许605nm的光透过)而无法被pmt检测到。
[0150]
在目标抗体存在的条件下,第一蛋白抗原和第二蛋白抗原能与目标抗体形成抗体抗原复合物。由于第一蛋白抗原和第一单链dna相偶联,第二蛋白抗原和第二单链dna相偶联,抗体抗原复合物使得第一单链dna和第二单链dna足够接近而形成邻位复合物,并能与第三单链dna杂交,从而第一单链dna、第二单链dna和第三单链dna形成颈环结构,供体荧光基团与受体荧光基团位于颈环结构的同侧。抗体和dna形成的复合物基本上不会被载体分子氧化石墨烯吸附,故偶联在载体分子上的抗氧化剂也基本上不会影响吖啶酯的发光。在移除第四试剂的条件下,所加入的氧化剂能氧化供体荧光基团并使其发射第一荧光,第一荧光基于荧光共振能量转移而激发受体荧光基团发出第二荧光(例如605nm),以便根据第二荧光的强度获得目标抗体的含量。
[0151]
[目标抗体检测系统]
[0152]
本技术提供了一种目标抗体检测系统,其包括:反应容器、微量注射泵、滤光片和计算模块。
[0153]
其中,反应容器具有能容纳待测溶液的容置腔室。
[0154]
微量注射泵通过注射管道与反应容器的容置腔室相连通,将第一试剂、第二试剂、第三试剂和第四试剂的混合物注射入容置腔室中;第一试剂由第一单链dna和第一蛋白抗原偶联而成,第二试剂由第二蛋白抗原、第二单链dna和受体荧光基团依次偶联而成,第三试剂由供体荧光基团和第三单链dna偶联而成,第四试剂含有抑制供体荧光基团被氧化而发射第一荧光的抗氧化剂。
[0155]
滤光片设于第一荧光的出射光路上,允许与受体荧光基团的最大发射波长相同的第二荧光透过。
[0156]
光信号检测模块设于位于荧光信号的出射光路的滤光片的下游侧,获取从滤光片透射的第二荧光。
[0157]
计算模块将第二荧光转换为数字信号并且根据荧光强度和抗体含量的函数关系式获得待测溶液中目标抗体的含量。标准曲线中含有标准方程,标准方程为一元一次方程,含有数字信号与目标抗体含量的一一对应关系。
[0158]
本技术实施例通过氧化石墨烯偶联抗氧化剂和滤光片的双重淬灭机制,结合化学发光共振能量转移和免疫分析技术,提供了一种简单、快速、灵敏的均相化学发光免疫分析蛋白检测方法。相比于现有的免疫分析方法,本技术的一些实施例具有以下特点:
[0159]
(1)、本技术的一些实施例为均相免疫分析方法,操作简单,同时大大缩短了临床检验标本周转时间(tat),无需血液标本的离心处理,可以全血上样,在5分钟左右出检测报告。
[0160]
(2)、本技术的一些实施例的吖啶酯为氧化型发光,量子点为激发型发光,能够实现吖啶酯和量子点之间的自激发式发光,而无需设置复杂的外部激发光系统,可以有效降低测量仪器的复杂度和成本。由于配套检测设备要求降低,模块减少,成本降低,故障率也大幅降低,能够实现自动化检测或小型化便携式床旁检测(poct)。
[0161]
(3)、本技术的一些实施例的吖啶酯-量子点发光体系引入双重淬灭机制(氧化石墨烯-还原剂和滤光片),本底荧光更低,检测灵敏度更高,适用于较高灵敏度的检测。
[0162]
(4)、本技术的一些实施例通过免疫反应诱发氧化石墨烯-抗氧化剂淬灭机制的开
关,外加滤光片的引入,开关效率达到了100%,结合化学发光共振能量转移效应从而使得量子点发光,无需分离和清洗步骤。
[0163]
(5)本技术的一些实施例中的dna分子含有非天然碱基对(isog和isoc),避免与样本中的核酸发生非特异性结合。
[0164]
以下结合各个制备例和各个实施例对本技术的技术作进一步的说明。
[0165]
制备例一第二单链dna和受体荧光基团(量子点)的偶联物的制备
[0166]
本制备例提供了第二单链dna和量子点的偶联物的制备方法,其包括如下步骤:
[0167]
1.配制smcc溶液:称取10mg 4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(4-(n-maleimidomethyl)cyclohexanecarboxylic acid n-hydroxysuccinimide ester,smcc)溶于1ml dmf中。smcc购买自上海阿拉丁生化科技股份有限公司,货号为n159712,cas号为64987-85-5。
[0168]
2.配制第二单链dna溶液:取10μm第二单链dna,加入1ml纯化水溶解。
[0169]
3.制备第二单链dna和量子点的偶联物:取100μl第二单链dna溶液于ep管中,加入200μl qds(购买自西安齐岳生物科技有限公司,型号为氨基水溶性量子点(peg)-605,浓度为8μm),加入3μl smcc溶液,混合均匀,37℃孵育30min。
[0170]
4.透析:将偶联好的第二单链dna和量子点的偶联物从ep管中吸出,加入至透析袋(规格5kd),扎好透析袋放入装有2-3l te溶液(10mm tris,1mm edta,ph=8.0)的烧杯中,进行透析。透析之前将透析袋提前浸泡。2-3小时更换透析液一次,共透析三次,透析完成收取透析袋中的液体于离心管中,放入2-8℃保存待用。
[0171]
制备例二供体荧光基团(吖啶酯)和第三单链dna的偶联物的制备
[0172]
本制备例提供了吖啶酯(ae)和第三单链dna的偶联物的制备方法,其包括如下步骤:
[0173]
1.配制第三单链dna溶液:取20μm第三单链dna,加入1ml纯化水溶解。
[0174]
2.配制nhs-ae溶液:称取4mg吖啶酯(nsp-dmae-nhs),溶于1ml纯化水中。吖啶酯购买自苏州亚科科技股份有限公司,cas号194357-64-7。
[0175]
3.偶联:每1mg nhs-ae溶液中,加入10μl第三单链dna溶液,于ep管中混合均匀,37℃孵育30min。
[0176]
4.透析:将偶联好的产物从ep管中吸出,加入至透析袋(规格5kd),扎好透析袋放入装有2-3l te溶液(10mm tris,1mm edta,ph=8.0)的烧杯中,进行透析(将透析袋提前浸泡),2-3小时更换透析液一次,共透析三次,透析完成收取透析袋中的液体于离心管中,放入2-8℃保存待用。
[0177]
制备例三第一单链dna和第一蛋白抗原的偶联物的制备
[0178]
本制备例提供了第一单链dna和第一蛋白抗原的偶联物的制备方法,其包括如下步骤:
[0179]
1.配制bs3溶液:称取10mg双琥珀酰亚胺辛二酸酯钠盐(bs3)溶于1ml纯化水中。bs3购买自上海阿拉丁生化科技股份有限公司,货号s304724。
[0180]
2.活化:取出分装好的第一蛋白抗原,解冻,离心混匀。每1mg第一蛋白抗原中加入3μl bs3溶液,加入6.5μl第一单链dna,于ep管中混合均匀,37℃孵育30min。
[0181]
3.透析:将第一单链dna和第一蛋白抗原的偶联物从ep管中吸出,加入至透析袋
(规格100kd),扎好透析袋放入装有2-3l pbs溶液的烧杯中,进行透析(将透析袋提前浸泡),2-3小时更换透析液一次,共透析三次,透析完成收取透析袋中的液体于离心管中,放入2-8℃保存待用。
[0182]
制备例四第二蛋白抗原、第二单链dna和受体荧光基团的偶联物的制备
[0183]
本制备例提供了第二蛋白抗原、第二单链dna和受体荧光基团的偶联物的制备方法,其包括如下步骤:
[0184]
1.配置bs3溶液:称取10mg双琥珀酰亚胺辛二酸酯钠盐(bs3)溶于1ml纯化水中。bs3购买自上海阿拉丁生化科技股份有限公司。
[0185]
2.活化:取出分装好的第二蛋白抗原,解冻,离心混匀。每1mg第二蛋白抗原中加入3μl bs3溶液,加入6.5μl第二单链dna和量子点的偶联物,于ep管中混合均匀,37℃孵育30min。
[0186]
3.透析:将第二蛋白抗原、第二单链dna和受体荧光基团的偶联物从ep管中吸出,加入至透析袋(规格100kd),扎好透析袋放入装有2-3l pbs溶液的烧杯中,进行透析(将透析袋提前浸泡),2-3小时更换透析液一次,共透析三次,透析完成收取透析袋中的液体于离心管中,放入2-8℃保存待用。
[0187]
实施例一
[0188]
本实施例基于氧化石墨烯-抗氧化剂淬灭和吖啶酯化学发光的均相免疫分析方法对血清中乙肝表面抗体(hbsab)进行检测。其中,第一蛋白抗原(又称第一支架蛋白)购买自菲鹏生物,克隆号为hbsag-11#,第二蛋白抗原(又称第二支架蛋白)与第一蛋白抗原为同一蛋白。通过上述制备例对两种抗原与相应的dna分子进行偶联。具体检测方法包括如下步骤:
[0189]
1、配制检测溶液:将第一单链dna和第一蛋白抗原的偶联物(dna1-支架蛋白1偶联物)、第二蛋白抗原、第二单链dna和量子点的偶联物(支架蛋白2-dna2-qds偶联物)、吖啶酯和第三单链dna的偶联物、抗氧化剂修饰的氧化石墨烯(go-aod)混合,使它们的最终浓度分别为10nm、10nm、0.15μm和20μg/ml。
[0190]
2、将20μl不同浓度的校准溶液或者含有乙肝表面抗体(hbsab)的血清样本与200μl检测溶液混合,37℃条件下温育5-10分钟。
[0191]
3、在温育后,通过hscl-10000化学发光仪加入200μl化学发光底物。化学发光底物包括:10mm tbs缓冲液、0.1m双氧水的碱液,ph=8.0。并立即通过光电倍增管(pmt)检测该溶液的化学发光信号,检测时间3s。根据记录的化学发光值(rlu),获得乙肝表面抗体的校准曲线和待测的血清样本中hbsab的浓度。
[0192]
经过多次检测,本实施例的hbsab的检测限为2-1000iu/ml。经过检测40例临床样本,本实施例的hbsab的检测值和罗氏测试值的误差为-3.67%-3.67%,说明本实施例的检测方法具有较高的准确度。检测结果如下表1所示。罗氏检测是指罗氏诊断hbsab定量检测试剂盒。
[0193]
表1为本实施例和罗氏检测方法的检测值的比较表
[0194][0195]
实施例二
[0196]
本实施例基于氧化石墨烯-抗氧化剂淬灭和吖啶酯化学发光的均相免疫分析方法对血清中丙肝表面抗体(hcvab)进行定性检测。其中,第一蛋白抗原(又称第一支架蛋白)购买自菲鹏生物,克隆号为c114,第二蛋白抗原(又称第二支架蛋白)与第一蛋白抗原为同一蛋白。通过上述制备例对两种抗原与相应的dna进行偶联。具体检测方法包括如下步骤:
[0197]
1、配制检测溶液:将第一单链dna和第一蛋白抗原的偶联物、第二蛋白抗原、第二单链dna和量子点的偶联物、吖啶酯和第三单链dna的偶联物、抗氧化剂修饰的氧化石墨烯混合,使它们的最终浓度分别为20nm、20nm、0.15μm和20μg/ml。
[0198]
2、将20μl不同浓度的校准溶液或者含有丙肝表面抗体的血清样本与200μl检测溶液混合,37℃条件下温育5-10分钟。
[0199]
3、在温育后,通过hscl-10000化学发光仪加入200μl化学发光底物,化学发光底物包括:10mm tbs缓冲液、0.1m双氧水的碱液,ph=8.0,并立即通过光电倍增管(pmt)检测该溶液的化学发光信号,检测时间3s。根据记录的化学发光值(rlu),获得hcvab的校准曲线和待测的血清样本中hcvab的阴性和阳性判定。
[0200]
经过检测40例临床样本,本实施例的hcvab和罗氏测试结果的阴性符合率为100%,阳性符合率为100%,总符合率为100%,说明本实施例的检测方法具有较高的准确度。具体检测如表2记载。
[0201]
表2为本实施例和罗氏检测方法的检测值的比较表
[0202][0203]
其中,阳性符合率=a/(a+c)
×
100%=100%。阴性符合率=d/(a+b)
×
100%=100%。总符合率=a+d/(a+b+c+d)
×
100%=100%。
[0204]
实施例三
[0205]
本实施例基于氧化石墨烯-抗氧化剂淬灭和吖啶酯化学发光的均相免疫分析方法对血清中巨细胞病毒igg(cmv igg)进行检测。其中,第一蛋白抗原购买自菲鹏生物,克隆号为hcmv-ag1。第二蛋白抗原(又称第二支架蛋白)与第一蛋白抗原为同一蛋白。通过上述制备例对两种抗原与相应的dna进行偶联。具体的检测方法包括如下步骤:
[0206]
1、配制检测溶液:将第一单链dna和第一蛋白抗原的偶联物、第二蛋白抗原、第二单链dna和量子点的偶联物、吖啶酯和第三单链dna的偶联物、抗氧化剂修饰的氧化石墨烯混合,使它们的最终浓度分别为20nm、20nm、0.15μm和20μg/ml。
[0207]
2、将20μl不同浓度的校准溶液或者含有巨细胞病毒igg的血清样本与200μl试剂溶液混合,37℃条件下温育5-10分钟。
[0208]
3、在温育后,通过hscl-10000化学发光仪加入200μl化学发光底物。化学发光底物包括:10mm tbs缓冲液、0.1m双氧水的碱液,ph=8.0。并立即通过光电倍增管(pmt)检测该溶液的化学发光信号,检测时间3s。根据记录的化学发光值(rlu),获得cmv igg的校准曲线和待测血清样本中cmv igg的浓度。
[0209]
经过多次检测,本实施例的cmv igg的检测限为0.25-500u/ml。
[0210]
经过检测40例临床样本,本实施例的cmv igg的检测值和罗氏测试值的误差为1.91%,说明本实施例的检测方法具有较高的准确度。具体检测如表3记载。
[0211]
表3为本实施例和罗氏检测方法的检测值的比较表
[0212][0213]
本技术已由上述相关实施例加以描述,然而上述实施例仅为实施本技术的范例。必需指出的是,已公开的实施例并未限制本技术的范围。相反地,包含于权利要求书的精神及范围的修改及均等设置均包括于本技术的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1