一种冷冻液液萃取联合Fe3O4@MWCNTs-NH2检测辣椒中多种真菌毒素的方法
一种冷冻液液萃取联合fe3o4@mwcnts-nh2检测辣椒中多种真菌毒素的方法
技术领域
1.本发明涉及一种冷冻液液萃取联合fe3o4@mwcnts-nh2检测辣椒中多种真菌毒素的方法,属于食品检测方法领域。
背景技术:
2.真菌毒素是一组天然存在的有毒化学物质,由不同的真菌物种产生,主要真菌毒素,如黄曲霉毒素(afb1、afb2、afg1和afg2)、赭曲霉毒素a(ota)、t-2毒素(t-2)与ht-2毒素(ht-2)可能会对健康造成不良影响,如致癌、致突变、致畸、细胞毒性、神经毒性、肾毒性等作用,根据国际癌症研究机构的数据,黄曲霉毒素属于第1组(对人类致癌),ota属于2b组(可能对人类致癌),t-2属于第3组(未按其对人类的致癌性进行分类)。这些真菌毒素是高度稳定和耐热的代谢物,不受传统烹饪方法的影响,这对人类的食品安全问题提出了巨大的挑战。
3.在生长、收获、储存和消费过程中受到异常气候、储藏环境和运输环境等条件的影响会造成真菌污染,在适宜的条件下,辣椒上的某些真菌会产生真菌毒素。根据我国及国际其他组织(如欧盟委员会)规定,香料中afb1和总afs(afb1、afb2、afg1和afg2的总和)的最高允许限量分别为5μg/kg和10μg/kg。此外,香料中ota的最高允许限量为15μg/kg。辣椒在收获前的生长阶段和收获后的贮运过程中,容易受到真菌毒素污染。而辣椒作为香辛料的一种,其富含油脂、色素等物质,在检测过程中造成很强的基质干扰效应,造成辣椒真菌毒素检测困难。
4.样品前处理技术是复杂基质样品中真菌毒素检测的必要步骤,起到了浓缩和提纯的作用,从而减少基质效应和对目标组分的干扰。与常规液液萃取技术相比,冷冻诱导液液萃取法操作简单,不需要额外添加试剂诱导分层,可以在较少的有机溶剂消耗下实现真菌毒素的提取和净化。
5.并且,萃取材料的选择直接关系到检测灵敏和准确度。mwcnts-nh2是目前常用于痕量分析的材料,磁性fe3o4利于重复利用。
6.现有技术中,常常见于辣椒某种真菌毒素的检测,多种辣椒真菌毒素同时检测的方法少,效能低。对于辣椒多种真菌毒素检测的方法,检测限不灵敏,定量限不低,回收率也不高。一般能同时检测到4-6种辣椒真菌毒素。检测种类多的方法,lod仅为73μg/kg,线性仅为5-600μg/kg(参见ok,chung,lee,&chun,2015;dhanshetty,shinde,goon,oulkar,elliott,&banerjee,2022;pantano et al.,2021;yogendrarajah,van poucke,de meulenaer,&de saeger,2013.)。
7.因此,建立一种准确、简便的辣椒真菌毒素检测前处理方法对预防和控制辣椒中的真菌毒素污染具有重要意义,方法具有广阔的市场推广应用前景。本发明提供的方法抑制了样品基质影响,很大限度减少辣椒复杂基质对真菌毒素检测的干扰,实现了同时对辣椒中10种真菌毒素的检测,提高了实验的效率,具有操作方便、净化效果好、高通量检测、经
济环保的特点。
技术实现要素:
8.为了解决上述问题,本发明提供一种一种冷冻液液萃取联合fe3o4@mwcnts-nh2检测辣椒中多种真菌毒素的方法,包括基于冷冻诱导液液萃取-磁固相萃取-超高效液相色谱串联四极杆飞行时间质谱法检测辣椒中多种真菌毒素的方法,本发明提供的测定方法方便、简单、灵敏,使辣椒中的各种真菌毒素能有效提取,净化,分离,检测,实验的回收率、检出限均满足实验要求,实现了对辣椒中10种真菌毒素的高通量检测。
9.首先,本发明是提供一种制备fe3o4@mwcnts-nh2的方法,包括如下步骤:
10.(1)将fecl2·
4h2o、fecl3·
6h2o、mwcnts-nh2加入到超纯水中混合均匀,得到混合溶液;其中fecl3·
6h2o、fecl2·
4h2o、mwcnts-nh2的质量比为10-12:4-5:1;控制反应条件生成fe3o4@mwcnts-nh2。
11.(2)反应结束后将沉淀分离出来,洗涤、干燥,得到fe3o4@mwcnts-nh2。
12.其中,步骤(1)的反应原理为:向分散有mwcnts-nh2的水溶液中加入fe
2+
和fe
3+
,用氢氧化钠或浓氨水作沉淀剂,将混合液中的fe
2+
和fe
3+
共同沉淀出来,沉淀转化为fe3o4,然后fe3o4在mwcnts表面成核、生长,形成氧化铁纳米颗粒。
13.具体的,步骤(1)中fe3o4@mwcnts-nh2的具体制备方法为:
14.将25mg mwcnts-nh2加入到25ml水中,之后加入107mg fecl2·
4h2o和291mg fecl3·
6h2o,搅拌2-3min,再加入2ml氢氧化铵,通过恒温磁力搅拌器让溶液在85℃下剧烈搅拌90min,整个实验在氮气保护中进行(除氧)。
15.具体的,步骤(2)中所述的分离是通过外加磁铁进行分离。
16.具体的,步骤(2)中所述的洗涤是用超纯水洗涤6次。
17.具体的,步骤(2)中所述的干燥是冷冻(-60℃)干燥24h。
18.其次,本发明目的是制备得到fe3o4@mwcnts-nh2。
19.最后,一种基于本发明所述的fe3o4@mwcnts-nh2检测辣椒中多种真菌毒素的方法,包括如下步骤:
20.(1)在辣椒粉中加入提取液进行提取;之后离心,将提取液冷冻1h,取上层溶液,得到预处理的辣椒萃取液。
21.(2)在fe3o4@mwcnts-nh2中加入步骤(1)得到的预处理的萃取液,混合均匀进行吸附,吸附完成后分离得到沉淀,之后在沉淀中加入解吸附溶剂进行洗脱,收集洗脱液,氮气吹干,残留物复溶并过滤膜,得到待测样品。
22.(3)采用超高效液相色谱-串联四极杆飞行时间质谱仪对待测样品进行检测,得到多种毒素的吸收峰面积;之后根据标准曲线得到辣椒样品中多种真菌毒素的含量。
23.具体的,所述的多种真菌毒素包括黄曲霉毒素b1(afb1)、黄曲霉毒素b2(afb2)、黄曲霉毒素g1(afg1)、黄曲霉毒素g2(afg2)、赭曲霉毒素a(ota)、杂色曲霉素(st)、桔青霉素(cit)、异烟棒曲霉素c(roqc)、ht-2毒素和t-2毒素。
24.具体的,步骤(1)中提取方法为先加超纯水浸泡,然后加提取溶剂(乙腈:甲酸=99:1,v:v);超纯水和提取溶剂比例为1:1。
25.具体的,步骤(1)中辣椒粉和最终提取液的比例以g/ml计为1:10。
26.具体的,步骤(1)提取是采用振荡提取,提取时间为1h。
27.具体的,步骤(1)中提取之后的离心是室温下6500r/min离心5min。
28.具体的,步骤(1)中冷冻的原理是冷冻诱导液液萃取,即在含有目标化合物的水溶液中加入一定量低凝固点的有机溶剂,经冷冻使水溶液结冰,其中的目标化合物转移到液态有机相中。乙腈的凝固点温度为-43.8℃,水的凝固点温度为0℃,低温引发了乙腈相与水相分离,通过冷冻将目标化合物溶解在有机溶剂中,而辣椒基质中的一些极性成分与杂质保留在水层中,极大地减小了基质干扰。冷冻温度为-18℃。
29.具体的,步骤(2)中fe3o4@mwcnts-nh2和预处理样品的比例以mg/ml计为50:6。
30.具体的,步骤(2)中所述的吸附是于振荡器中以180r/min振摇30min。
31.具体的,步骤(2)中所述的吸附的时间为30min。
32.具体的,步骤(2)中所述的分离是用外加磁铁分离得到沉淀。
33.具体的,步骤(2)中所述的蒸馏水清洗的原理是洗去磁性纳米材料上残留的提取液,减少残留提取液对解吸附溶液中的真菌毒素含量的干扰。
34.具体的,步骤(2)中洗脱时间为10min。
35.具体的,步骤(2)中洗脱可以重复进行,洗脱次数为3次。
36.具体的,步骤(2)中氮气吹干的温度为50℃。
37.具体的,步骤(2)中所述的复溶是加入乙腈/甲酸(99:1,v:v)复溶。
38.具体的,步骤(3)中所述的超高效液相色谱-串联四极杆飞行时间质谱仪,其色谱条件为:
39.色谱柱:c18柱(poroshell 120,1.9μm,agilent,2.1x 100mm)
40.柱温:30℃;流速:0.2ml/min;进样体积:10μl。
41.其质谱条件为:
42.离子化方式:电喷雾电离(esi);
43.毛细管电压:4500v;
44.雾化气压:2bar;
45.干燥气体:8l/min;
46.干燥温度:220℃。
47.具体的,步骤(3)中所述的标准曲线的制备方法为:
48.将空白辣椒样品经前处理后得到空白样品提取液,用混合标准储备液来分别配制ota质量浓度为0.5、5、50、100、200、500μg/kg,其余真菌毒素为0.5、5、10、20、50、100μg/kg的混合标准溶液,采用超高效液相色谱-串联四极杆飞行时间质谱仪对得到的上述溶液进行检测,得到吸收峰面积和浓度的对应关系,通过对应关系得到标准曲线。
49.本发明的有益效果:
50.(1)本发明采用化学共沉淀法合成fe3o4@mwcnts-nh2,大部分fe3o4被包裹在mwcnts-nh2的表面,节省了mwcnts内腔的一些吸附位点,从而提高了萃取剂的吸附性。对碳纳米管上的氨基进行了修饰,增强了碳纳米管的亲水性和分散性。同时,氨基可以作为氢键供体,通过氢键相互作用吸附分析物所含的氢键受体,有效提高了萃取剂的选择性。该萃取剂的制备简单易行,具有超顺磁性、优异的吸收率、吸附性能好等优点。
51.(2)本发明方案确定的提取溶剂为乙腈,其可以减少脂肪等亲脂物质的提取,并具
有很高的提取不同极性分子的能力,所有分析的真菌毒素均可溶于乙腈。在辣椒粉中加入超纯水浸泡,有助于膨胀基质,削弱分析物与基质成分的相互作用,有助于高效提取。再加入有机溶剂乙腈,使得亲有机试剂的真菌毒素被提取出来。在乙腈中加入1%甲酸,调节提取液的ph值,使得提取液呈弱酸性,峰响应更好,有效地提高真菌毒素的提取效率。
52.(3)冷冻诱导液液萃取是在常规液液萃取原理的基础上加入低温净化的步骤,乙腈与水常温下互溶,而在低温下会与水相分层,辣椒中的一些杂质保留在水层(下层)中,真菌毒素转移到有机相(上层)中,上层溶液呈浅黄色,下层溶液呈深红色,进一步使得提取液中的辣椒素、叶绿素和黄酮类化合物等极性干扰物分配于下层水相,达到一定净化效果,很大程度上消除了辣椒中的基质干扰。与常规液液萃取技术相比,冷冻诱导液液萃取法操作简单,不需要额外添加试剂诱导分层,可以在较少的有机溶剂消耗下实现真菌毒素的提取和净化。
53.(4)本发明提供的方法抑制了样品基质影响,很大限度减少辣椒复杂基质对真菌毒素检测的干扰,实现了同时对辣椒中10种真菌毒素的检测,提高了实验的效率,具有操作方便、净化效果好、高通量检测、经济环保的特点。
附图说明
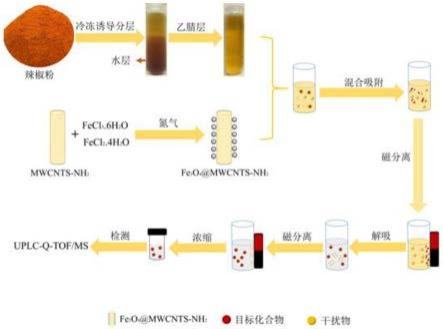
54.图1为本发明辣椒粉中真菌毒素检测的原理图。
55.图2为对照例1同实施例2样品萃取颜色对比(甲醇、丙酮的萃取液均检测不到真菌毒素;乙腈萃取液可以)。
56.图3为对照例2和实施例2的测试结果对比(乙腈萃取剂中加入甲酸能提高检测回收率)。
57.图4对照例3和实施例2的测试结果对比(冷冻诱导分层优于盐析分层)。
58.图5对照例4和实施例2的测试结果对比(fe3o4@mwcnts-nh2优于fe3o4@mwcnts)。
具体实施方式
59.以下结合实施例对本发明提供的一种基于冷冻诱导液液萃取-磁固相萃取-超高效液相色谱-串联四极杆飞行时间质谱法检测辣椒中多种真菌毒素含量的样品前处理方法和检测方法进行详细的说明,应当理解实施例是为了更好地解释本发明,不用于限制本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
60.实施例1
61.一种制备fe3o4@mwcnts-nh2的方法,包括如下步骤:
62.将25mg mwcnts-nh2加入到25ml超纯水中,然后加入107mg的fecl2·
4h2o和291mg的fecl3·
6h2o。将混合物搅拌均匀,加入2ml的氢氧化铵,在85℃的恒温水浴中将溶液剧烈搅拌90min,整个实验在氮气保护中进行。通过外置磁铁分离样品,用超纯水洗涤5-6次。最后,在冷冻干燥机中干燥24h即得fe3o4@mwcnts-nh2。
63.fe3o4@mwcnts的制备方法与上述内容相同,将mwcnts-nh2改为mwcnts即可。
64.实施例2
65.一种基于fe3o4@mwcnts-nh2检测辣椒中多种真菌毒素的方法,包括如下步骤:
66.(1)制备标准曲线:
67.在50ml离心管中称取4g辣椒粉,加入20ml超纯水,搅拌1min,将样品浸泡30min。然后加入20ml萃取溶剂(乙腈/甲酸,99:1,v/v),短暂摇动后,用摇床将样品萃取30min。离心后取上清液,冷冻1h,取上层萃取液备用。
68.在fe3o4@mwcnts-nh2(50mg)中加入上述步骤中得到的预处理的辣椒萃取液(6ml),置于摇床上吸附30min;吸附完成后用外置磁铁分离,移去上清液,用1ml蒸馏水清洗。加入解吸溶剂(乙腈/甲酸,99:1,v/v)1ml,超声30min,得到待测样品,加入不同体积的真菌毒素标准溶液,配置为含ota质量浓度为0.5、5、50、100、200、500μg/kg,其余真菌毒素为0.5、5、10、20、50、100μg/kg的混合标准溶液。
69.最后采用超高效液相色谱-串联四极杆飞行时间质谱仪进行样品分析,色谱条件为:色谱柱:c18柱(poroshell 120,1.9μm,agilent,2.1x 100mm);柱温30℃;流速0.2ml/min,进样体积10μl;质谱条件为:离子化方式:电喷雾电离(esi);毛细管电压:4500v;雾化气压2bar;干燥气体8l/min;干燥温度220℃。流动相条件为:a相为5mmol
·
l-1
乙酸铵,0.1%甲酸;b相:甲醇,梯度洗脱见表1。
70.表1流动相梯度洗脱程序
[0071][0072]
根据超高效液相色谱-串联四极杆飞行时间质谱的吸收峰和加标溶液的浓度绘制10种真菌毒素的标准曲线(表2)。从表2可以看出:在0.5-500μg/kg线性范围内,10种真菌毒素方法的线性关系良好,r2均大于0.999,方法检出限为0.2-0.9μg/kg,定量限为0.5-1.5μg/kg。
[0073]
表2 10种真菌毒素的线性回归方程、相关系数(r2)、检出限(lod)及定量限(loq)
[0074]
[0075][0076]
(2)辣椒粉的检测(如图1)
[0077]
在50ml离心管中称取4g辣椒粉,加入20ml超纯水,搅拌1min,样品浸泡30min。然后加入20ml萃取溶剂(乙腈/甲酸,99:1,v/v),短暂摇动后,用摇床将样品萃取30min。离心后取上清液,冷冻1h,取上层乙腈层备用。
[0078]
在fe3o4@mwcnts-nh2(50mg)中加入上述步骤中得到的预处理的辣椒萃取液(6ml),置于摇床上吸附30min;吸附完成后用外置磁铁分离,移去上清液,用1ml蒸馏水清洗。加入解吸剂(乙腈/甲酸,99:1,v/v)1ml,超声10min,重复洗脱两次,收集洗脱液经氮气吹干,残留物复溶后过滤膜,得到待测样品。
[0079]
采用超高效液相色谱-串联四极杆飞行时间质谱仪对待测样品进行检测,色谱条件为:色谱柱:c18柱(poroshell 120,1.9μm,agilent,2.1x 100mm);柱温30℃;流速0.2ml/min,进样体积10μl;质谱条件为:离子化方式:电喷雾电离(esi);毛细管电压:4500v;雾化气压2bar;干燥气体8l/min;干燥温度220℃。流动相条件为:a相为5mmol
·
l-1
乙酸铵,0.1%甲酸;流动相b:甲醇,梯度洗脱见表1。
[0080]
(3)加标回收率的测试
[0081]
称取辣椒样品4g分别放入50ml离心管中,添加0.1μg/mlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roq c溶液,0.5μg/ml ota溶液(添加量均为80、200、400μl),其余操作同上述内容。
[0082]
实施例3
[0083]
对本发明的方法的基质效应进行验证考察,采用本方案所开发的前处理方法来提取空白基质溶液,并配制标准曲线,以基质匹配标准曲线斜率和有机溶剂(乙腈)标准曲线斜率之比k来评价基质效应,若k值介于0.9~1.1之间,则说明基质效应不明显,k大于1.1时为基质增强效应,小于0.9则是基质抑制效应,对10种真菌毒素进行了基质效应考察,考察结果见表3。
[0084]
表3 10种真菌毒素的基质效应考察
[0085]
[0086][0087]
实施例4
[0088]
计算实施例2中10种真菌毒素加标回收率及相对标准偏差,结果如表4。
[0089]
表4辣椒样品中10种真菌毒素加标回收率及相对标准偏差
[0090]
[0091][0092]
实施例5
[0093]
解吸液乙腈-甲酸(99:1,v/v)用量的优化
[0094]
调整实施例2中解吸溶剂乙腈-甲酸(99:1,v/v)用量为1、3、5、8、10ml,其他和实施例2保持一致,进行检测;其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roq c溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0095]
测试结果如表5,从表5可以看出:解吸液体积为1ml时得到了较高的回收率,10种毒素的回收率在77.96%~99.71%,当解吸剂的体积继续增大时,进一步稀释了真菌毒素的浓度,回收率逐渐降低。因此,确定解吸剂体积为1ml。
[0096]
表5不同解吸溶剂用量的测试结果
[0097][0098]
实施例6
[0099]
fe3o4@mwcnts-nh2用量的优化
[0100]
调整实施例2步骤(2)中fe3o4@mwcnts-nh2磁性纳米材料的用量为20、30、40、50、60、70mg,其他和实施例2保持一致,进行检测。其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μl afb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roq c溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0101]
检测结果如表6。从表6可以看出:当fe3o4@mwcnts-nh2的量为50mg时,即可获得最高的提取效率。继续增加吸附剂的量,不会增大提取效率,在相同洗脱剂的条件下,反而会降低洗脱效率,因此,fe3o4@mwcnts-nh2的量最优为50mg。
[0102]
表6不同用量fe3o4@mwcnts-nh2的测试结果
[0103][0104][0105]
实施例7
[0106]
吸附时间的优化
[0107]
调整实施例2中吸附的时间为10、20、30、40、50min,其他和实施例2保持一致,进行
检测;其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roq c溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0108]
测试结果如表7,从表7可以看出:在10~30min内,吸附效率随混合液振荡时间延长而显著提高,之后基本趋于平稳。30min时,得到了较高的吸附效率,10种毒素的吸附率在78.35%~99.01%,继续增加萃取时间吸附率变化不明显,萃取基本达到平衡。这一结果表明,真菌毒素在fe3o4@mwcnts-nh2磁性材料上30min左右可达到吸附平衡。
[0109]
表7不同吸附时间的测试结果
[0110][0111]
对照例1
[0112]
将实施例2中的萃取溶剂(乙腈/甲酸,99:1,v/v)改为甲醇、丙酮,其他条件和实施例2保持一致,进行检测;其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roqc溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0113]
萃取液颜色如图2,从图2可以看出:甲醇、丙酮作为萃取溶剂时,提取液中杂质较多,提取液颜色深,污染色谱柱。检测后发现真菌毒素的干扰峰多,严重影响定量的精密度,检测不到真菌毒素。与其他两种溶剂相比,乙腈提取的基质干扰较少,不同极性的真菌毒素均可以很好地溶于乙腈中。因此选择乙腈作为萃取溶剂。
[0114]
对照例2
[0115]
将实施例2中的萃取溶剂(乙腈/甲酸,99:1,v/v)改为乙腈,其他条件和实施例2保持一致,进行检测;其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roqc溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0116]
测试结果如图3,从图3可以看出:萃取溶剂为乙腈/甲酸(99:1,v/v)的回收率更高。在乙腈中加入1%甲酸,在酸性环境中目标化合物的氢键作用会加强,可以提高真菌毒素的峰响应值,因此回收率更高。因此选择乙腈/甲酸(99:1,v/v)作为萃取溶剂。
[0117]
对照例3
[0118]
将实施例2中的冷冻诱导分层改为盐析分层,无水硫酸镁与氯化钠的添加量为4g与1g,加入后涡旋混合五分钟,然后用离心机离心五分钟(6500r/min),取分层的上清液。其他条件和实施例2保持一致,进行检测;其中加标回收率的测试条件为:辣椒样品4g放入
50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roqc溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0119]
测试结果如图4,从图4可以看出:冷诱导分层的回收率高于盐析分层的回收率。在盐析分层的结果中,除了afb1外,其余九种真菌毒素的回收率均低于70%,达不到检测要求。在盐析分层中,需要额外添加盐来诱导分层,引入了新的干扰物质,在涡旋混合过程中可能会吸附一部分真菌毒素。根据实验现象,冷诱导分层的上层溶液为浅黄色,盐析分层的上层溶液为深黄色,说明冷诱导分层的净化效果更好,检测时的峰响应更好。与冷诱导分层相比,盐析分层增加了实验操作,如涡旋混合、离心等,使操作更加繁琐。综上,选择冷诱导液液萃取作为前处理方法。
[0120]
对照例4
[0121]
将实施例2中fe3o4@mwcnts-nh2改为实施例1中制备的fe3o4@mwcnts,其他和实施例2保持一致,进行检测;其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roqc溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0122]
测试结果如图5,从图5可以看出:fe3o4@mwcnts-nh2的吸附效率要明显好于fe3o4@mwcnts,这可能是因为碳纳米管表面修饰的氨基可以增强碳纳米管的亲水性和分散性,同时氨基可以作为氢键供体,通过氢键吸附分析物中的氢键受体,有效提高萃取剂的选择性。因此选择fe3o4@mwcnts-nh2作为吸附剂。
[0123]
对照例5
[0124]
将实施例2中解吸溶剂乙腈/甲酸(99:1,v/v)改为乙腈、乙腈/甲醇(50:50,v/v)、甲醇、甲醇/甲酸(99:1,v/v),其他和实施例2保持一致,进行检测;其中加标回收率的测试条件为:辣椒样品4g放入50ml离心管中,添加200μlafb1、afb2、afg1、afg2、ht-2、t-2、st、cit、roq c溶液(浓度均为0.1μg/ml),ota溶液(浓度为0.5μg/ml)。
[0125]
测试结果如表8,从表8可以看出:解吸溶剂乙腈-甲酸(99:1,v/v)的回收率最高。与甲醇相比,乙腈的回收率更高,因为乙腈对不同极性的化合物有较高的提取能力。并且加入甲酸的解吸溶剂的回收率更高,在酸性环境下,检测时峰响应更好,提高了分析性能。因此选择乙腈/甲酸(99:1,v/v)作为解吸溶剂。
[0126]
表8不同解吸溶剂的测试结果
[0127]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1