灵芝栽培的高效方法及其培养基与流程
本发明属于灵芝栽培领域,尤其涉及一种灵芝栽培的高效方法及其培养基。
背景技术:
灵芝(ganodermalucidumkarst)是一种药用价值与营养价值均较高的药用食用菌,自古以来一直被视为珍贵的中药材。现代药理研究表明,灵芝具有增强机体免疫力,抗肿瘤,保肝解毒,改善心血管系统,抗病毒等功效。灵芝的药效成份主要有灵芝多糖类、三萜类、核苷类、氨基酸等,另还含有钼、锌、锰、铁、硒、钡等多种微量元素。大型仿野生栽培的灵芝不仅产量与药用价值高于一般小灵芝,而且具有观赏收藏价值。灵芝生产中存在的主要问题是菌种质量与数量不能满足灵芝生产发展的需要,目前南方地区灵芝菌袋生产普遍使用固体菌种,采用固体菌种的缺点是:菌种本身生长期长(30天)、不耐贮存、接种后吃料慢。而液体菌种具有生长周期短(300l液体菌种培养仅需6天即可达到用于生产的标准)、菌龄一致、发育均一和整齐健壮等特点,克服了固体菌种的不足。
尽管如此,灵芝液体菌种在应用过程中依然存在各种问题:
(1)液体培养基中需要加入酵母膏、蛋白胨等成份,因此培养基成本高;
(2)许多食用菌生产厂都在郊区及偏远农村,电力供应不稳定,液体发酵过程中遇到停电时,整个发酵罐菌液就全部污染杂菌而报废;
(3)发酵罐属于高压消毒设备,通常与接种室、培养室不在一个区域。发酵罐生产出的大量的液体菌种移动不方便,目前普通采用加长出液管的方法接种,或将菌袋接种时搬到发酵罐附近,接完又搬到培养区,这二种方法都增加了菌袋的污染率;
(4)高质量灵芝仿野生栽培采用相思树枝条为材料时,液体菌种直接接种于相思树枝条上时,由木材结构紧密,不利于液体菌种附着,加之相思树枝条营养成份多为大分子木质素、纤维素,也不利于液体菌种短期快速恢复生长,因而菌袋成活率较低。
技术实现要素:
本发明需要解决的技术问题是提供一种生产成本低、污染几率小、营养好且菌丝生长期短、产量高的灵芝栽培的高效方法及其培养基。
为解决上述技术问题,本发明采用以下技术方案:
灵芝栽培的高效培养基,包括用于液体母种培养的培养基a和用于发酵罐液体菌种培养的培养基b;培养基a以土豆、平菇子实体为主要成份,培养基b以黄豆、平菇子实体、灵芝出菇袋废菌渣为主要成份。
灵芝栽培的高效培养基,包括培养基a、b、c、d,其中:
培养基a的配方为每1000ml培养液中含有土豆200.0g、米糠50.0g、灵芝出菇袋废菌渣50.0g、平菇子实体10.0g、磷酸二氢钾3.0g、硫酸镁1.5g、蔗糖25.0g,水700-900ml,定容至1000ml;
培养基b的配方为每1000ml培养液中含有土豆100.0g、米糠50.0g、灵芝出菇袋废菌渣50.0g、平菇子实体40.0g、黄豆粉5.0g、磷酸二氢钾6.0g、硫酸镁2.5g、葡萄糖10.0g、发酵食品消泡剂0.1ml,水700-900ml,定容至1000ml;
培养基c的配方为每1000g培养基中含有棉子壳400.0g、灵芝出菇袋废菌渣370.0g、甘蔗渣100.0g、玉米芯100.0g、石膏粉10.0g、过磷酸钙10.0g、磷酸二氢钾10.0g,培养基加水600-700ml;
培养基d的配方为每1000g培养基中含有相思树枝条1000g,培养基加水600-700ml。
培养基a按以下操作配制:将土豆、米糠、灵芝出菇袋废菌渣、平菇子实体这4种成分混在一起,搅碎,加水700ml,煮至沸腾,维持沸腾10分钟,过滤,去渣,留滤汁;将磷酸二氢钾、硫酸镁、蔗糖加入滤液,混合搅拌溶解;加水使最终培养基体积达1000ml;
培养基b按以下操作配制:将土豆、米糠、灵芝出菇袋废菌渣、平菇子实体、黄豆粉这5种成分混在一起拌均,煮至沸腾,过滤,去渣留滤液;将消泡剂、磷酸二氢钾、硫酸镁、葡萄糖加到适量的水中溶解;将滤液和水溶液混合,并加水使最终培养液体积达到1000ml;
培养基c按以下操作配制:将棉子壳、灵芝出菇袋废菌渣、甘蔗渣、玉米芯、石膏粉这5种成分混在一起拌均;将过磷酸钙、磷酸二氢钾在适量的水中溶解;将混合物和水溶液混合,并加水使最终培养基含水量达到65%;
培养基d按以下操作配制:将相思树枝条材料泡水12-15小时至持水量达65%。
使用上述培养基进行灵芝栽培的高效方法,将培养基a用于液体母种培养,将培养基b用于发酵罐液体菌种培养,将培养基c用于刚接入出菇袋的液体菌种的活化生长,将培养基d用于出菇袋菌丝体培养。
上述灵芝栽培的高效方法,包括以下步骤:
(1)将培养基a分装于1000ml的玻璃瓶,每瓶培养液500ml,120℃灭菌60分钟,灭菌后培养基冷却至室温,接入1.0cm×1.0cm×1.0cm大小的固体母种,25-28℃室温下摇床培养,摇床摇速150转/分,培养时间5天,得到菌丝密度占培养液80%的液体母种;
(2)将培养基b分装于450l的发酵罐,每罐装培养液300l,120℃下60分钟,灭菌后培养液冷却至室温,接入1000ml液体母种,28℃室温下培养,维持罐压0.03-0.05mpa,气磊压力表0.15mpa,培养时间5-6天,得到菌丝球密度占80%的液体菌种;
(3)发酵罐液体培养基接种培养24小时后,每隔12小时从取样口取样测定有无杂菌感染;
(4)将配好的培养基d分装于40cm×60cm聚丙烯塑料袋中,每袋装干料4000g,在培养基d表面加80g的培养基c,平铺表面,扎好袋口,在120℃下消毒灭菌240分钟,然后取出,冷却至室温待用;移入接种室接种,每袋接入80ml液体菌种,28℃室温下培养,培养时间60-65天,得到长满菌丝的出菇袋;
(5)将长满菌丝的菌袋剥去塑料袋,放于地面消毒好的大棚或林下,在菌袋表面盖一层塑料地膜,室温控制在25-28℃,维持5-7天,期间每天掀开薄膜二次以通风换气,每次掀开时间10分钟;
(6)在完成后熟作用的菌袋表面覆土,土层2-3cm厚,覆土后浇一次透水,以后每隔3-4天淋一次水;
(7)菇房温度28-35℃,空气湿度80-90%,覆盖营养土的菌袋菇蕾未出土之前,每隔3-4天淋一次水;当50%以上菌袋都有菇蕾形成后,3天淋一次透水,直至采收;每批采后停止喷水5-7天。
发酵罐的排气管上安装有二个逆止阀,发酵罐的气泵处安装有一个五级过滤装置的贮气罐。
步骤(4)中接种使用移动式接种壶,移动式接种壶主要由通过耐高压胶管依次连接的气磊、过滤器、不锈钢贮菌液容器、接种枪组成,贮菌液容器顶部设装液口、侧部设背带。
针对现有灵芝栽培存在的问题,发明人以平菇子实体、灵芝出菇袋废菌渣为对象,通过不同材料组合试验研究,研制了低成本高产的灵芝栽培的高效培养基,包括用于液体母种培养的培养基a和用于发酵罐液体菌种培养的培养基b;培养基a以土豆、平菇子实体为主要成份,培养基b以黄豆、平菇子实体、灵芝出菇袋废菌渣为主要成份。其中,平菇是一种比较常见的栽培范围广、产量高、售价低的食用菌品种,它的新鲜子实体蛋白质含量达5-6%,干品中多糖含量达2-3%,将平菇子实体做为蛋白质营养补充到液体菌中培养基中,有利于降低培养基成本,同时,由于平菇与灵芝同属真菌,营养利用率会有累加效应。据此,发明人还建立了相应的栽培方法,该法中:出菇袋培养基以相思树枝条枝条为主,通过相思树枝条培养基表面添加表面吸物力与吸附面积较大的有机材料(液体菌种活化辅助培养料棉子壳、玉米粉、灵芝出菇袋废菌渣等)来增加液体菌种的附着力与恢复生长力;同时,发明人对发酵罐和接种装置进行了改进。应用本发明的技术体系可以替代原有的液体菌种配方,并使发酵罐发酵成功率达100%,菌袋接种成活率100%,缩短菌丝生产周期、提高产量,降低成本。
相对于现有技术,本发明的突出优势具体在于:
(1)液体菌种生产配方成本下降。原配方生产时每100升培养液需加酵母膏250g,成本为17.0元(34元/500g),采用本发明液体菌种生产配方后,用平菇子实体提取液替代酵母膏,现配方每100升培养液需加平菇子实体4.0kg,平菇市场价5.0元/kg计算,平菇子实体4.0kg成本20.0元,比对照降低41.2%。
(2)赤灵芝采用固体菌种时,母种生长需10天、原种生长需30天(菌瓶规格:25×20cm)、栽培种生长需25天(菌瓶规格:25×20cm),出菇袋生长需90天(菌袋规格:40×60cm),共155天,第一年生物转化率25.5%;采用本发明的液体菌种后,液体母种需7天、发酵罐液体菌种生长需5-7天,出菇袋生长需60-65天,共72-79天,仅出菇袋生长阶段就比对照缩短了30-25天,第一年生物转化率32.2%,比对照提高25.8%。
(3)采用未改状发酵罐进行液体菌种生产时,液体菌种培养成功率20%。采用改装后状发酵罐进行液体菌种生产时,可以阻止突然停电时所造成的外界气体向发酵罐的回流;液体菌种培养成功率100%,污染率为0。采用所发明的移动式液体接种壶进行接种,免去了菌袋搬动至发酵罐旁边接种及菌袋接种后搬回培养房所用的劳动力成本,解决液体菌种接种时的运输问题,接种效率为1270袋/6人/小时,菌袋污染率1.5%。
赤灵芝采用固体菌种时,接种效率为490袋/6人/小时,菌袋污染率4.2%。采用本发明的液体菌种后,接种效率为1270袋/6人/小时,菌袋污染率1.5%,接种效率比对照提高159.2%;菌袋污染率下降64.2%。
灵芝菌袋生产时间缩短,生物转化率得到提高。采用本发明改进的发酵罐、移动接种壶、发酵液配方进行液体菌种生产与应用,灵芝出菇菌袋生产时间由原来的90-100天,缩短到60-65天;赤灵芝第一年生物转化率由25.6%提高到了32.2%,提高幅度为25.8%;黑灵芝第一年生物转化率由22.6%提高到了25.1%,提高幅度为11.1%。
附图说明
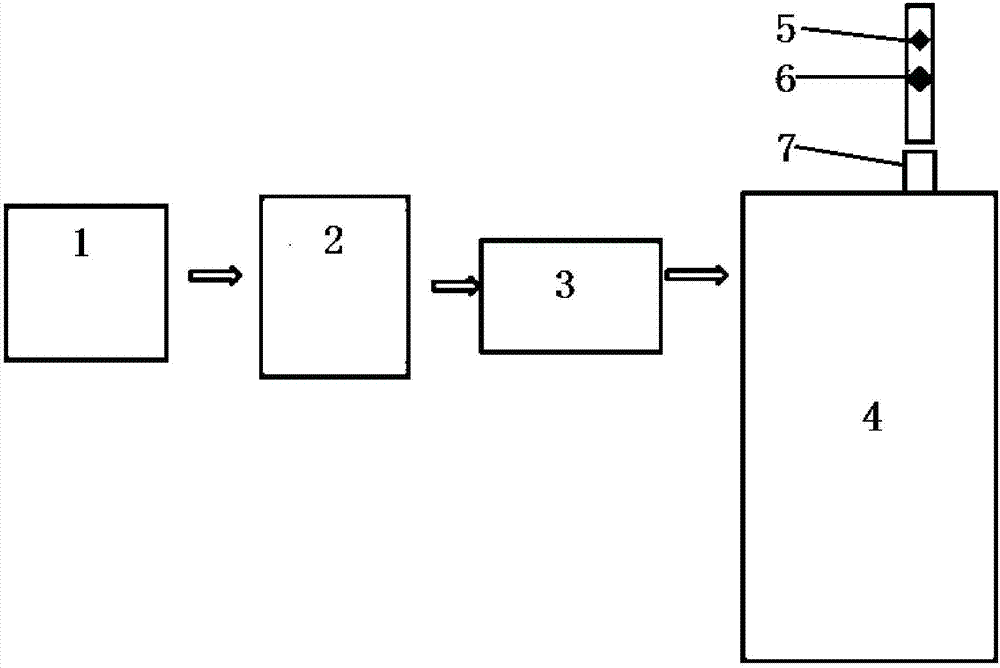
图1是移动式接种壶,图中:1气磊,2过滤器,3装菌液容器,4接种枪,5背带,6装液口。
图2是发酵罐,图中:1气磊,2贮气罐,3五级过滤器,4发酵罐,5逆止阀,6排气管,7排气孔。
具体实施方式
实施例1本发明用于赤灵芝的栽培
(1)培养基配制
培养基a配方:每1000ml培养液中含有土豆200.0g、米糠50.0g、灵芝出菇袋废菌渣50.0g、平菇子实体10.0g、磷酸二氢钾3.0g、硫酸镁1.5g、蔗糖25.0g,水700-900ml,定容至1000ml;
培养基a制法:将土豆、米糠、灵芝出菇袋废菌渣、平菇子实体这4种成分混在一起,搅碎,加水700ml,煮至沸腾,维持沸腾10分钟,过滤,去渣,留滤汁;将磷酸二氢钾、硫酸镁、蔗糖加入滤液,混合搅拌溶解;加水使最终培养基体积达1000ml;
培养基b配方:每1000ml培养液中含有土豆100.0g、米糠50.0g、灵芝出菇袋废菌渣50.0g、平菇子实体40.0g、黄豆粉5.0g、磷酸二氢钾6.0g、硫酸镁2.5g、葡萄糖10.0g、发酵食品消泡剂(型号df-1209,广东德丰消泡剂有限公司生产)0.1ml,水700-900ml,定容至1000ml;
培养基b制法:将土豆、米糠、灵芝出菇袋废菌渣、平菇子实体、黄豆粉这5种成分混在一起拌均,煮至沸腾,过滤,去渣留滤液(其中土豆煮前切为薄片,灵芝出菇袋废菌渣、平菇子实体煮前先粉碎)将消泡剂、磷酸二氢钾、硫酸镁、葡萄糖加到适量的水中溶解;将滤液和水溶液混合,并加水使最终培养液体积达到1000ml;
培养基c配方:每1000g培养基中含有棉子壳400.0g、灵芝出菇袋废菌渣370.0g、甘蔗渣100.0g、玉米芯100.0g、石膏粉10.0g、过磷酸钙10.0g、磷酸二氢钾10.0g,培养基加水600-700ml;
培养基c制法:将棉子壳、灵芝出菇袋废菌渣、甘蔗渣、玉米芯、石膏粉这5种成分混在一起拌均;将过磷酸钙、磷酸二氢钾在适量的水中溶解;将混合物和水溶液混合,并加水使最终培养基含水量达到65%左右;
培养基d配方:每1000g培养基中含有相思树枝条1000g,培养基加水600-700ml。
培养基d制法:将相思树枝条(直径8-10cm)材料泡水12-15小时至持水量达65%左右。
(2)培养基的分装、消毒灭菌、接种
将培养基a分装于1000ml的玻璃瓶,每瓶培养液500ml,120℃灭菌60分钟,灭菌后培养基冷却至室温,接入大约1.0cm×1.0cm×1.0cm大小的固体母种,25-28℃室温下摇床培养,摇床摇速150转/分,培养时间5天,得到菌丝密度占培养液80%左右的液体母种;
将培养基b分装于450l的发酵罐,每罐装培养液300l,120℃下60分钟,灭菌后培养液冷却至室温,接入大约1000ml液体母种,28℃室温下培养,维持罐压0.03-0.05mpa,气磊压力表0.15mpa左右,培养时间5-6天,得到菌丝球密度占80%左右的液体菌种;
将配好的培养基d分装于40cm×60cm聚丙烯塑料袋中,每袋装干料约4000g,在培养基d表面加约80g的培养基c,平铺表面,扎好袋口,在120℃下消毒灭菌240分钟,然后取出,冷却至室温待用;移入接种室接种,每袋接入80ml液体菌种,28℃室温下培养,培养时间60-65天,得到长满菌丝的出菇袋;
(3)菌丝后熟作用:将长满菌丝的菌袋剥去塑料袋,放于地面消毒好的大棚或林下,在菌袋表面盖一层塑料地膜,室温控制在25-28℃,维持5-7天,期间每天掀开薄膜二次以通风换气,每次掀开时间10分钟。
(4)覆土:在完成后熟作用的菌袋表面覆土,土层2-3cm厚,覆土后浇一次透水,以后每隔3-4天淋一次水,使土层表面湿润即可;
(5)灵芝出菇期管理
菇房温度28-35℃,空气湿度80-90%,覆盖营养土的菌袋菇蕾未出土之前,每隔3-4天淋一次水,使土层表面湿润即可;当50%以上菌袋都有菇蕾形成后,3天淋一次透水,直至采收;每批采后停止喷水5-7天,以促进菌丝恢复生长。
结果
(1)此次栽培试验生产发酵罐8罐,污染率为0;
(2)灵芝菌袋覆盖营养土15天左右,50%菌袋菇蕾,菇蕾生现20天左右,子实体成熟,采收;第一次采后约60天左右,第二批菇蕾形成,菇蕾生现20天左右,子实体成熟,采收;第二次采后约60天左右,第三批菇蕾形成,菇蕾生现20天左右,子实体成熟,采收。每批次采收后,清理菌块表面,重新补覆土,放置7天,待菌生恢复生长后,同前期一样重复管理。第一批菇生物转化率12.8%,第三批菇生物转化率9.9%,第三批菇生物转化率9.5%,共采收三批,第一年总生物转化率32.2%。
(3)第三批采后,菌袋覆土越冬,至第二年3月下旬开始,恢复水份与空气湿度管理。水分管理约20天左右,菇蕾出现,再过20天,子实体成熟,采收;第一次采后约60天左右,第二批菇蕾形成,菇蕾生现20天左右,子实体成熟,采收;第二次采后约60天左右,第三批菇蕾形成,菇蕾生现20天左右,子实体成熟,采收。每批次采收后,清理菌块表面,重新补覆土,放置7天,待菌生恢复生长后,同前期一样重复管理。第一批菇生物转化率7.1%,第二批菇生物转化率6.5%,第三批菇生物转化率6.8%,共采收三批,第二年总生物转化率20.4%。
二年生物学转化率共计52.5%。
实施例2本发明用于黑灵芝的栽培
栽培方法参照实施例1。
结果
(1)此次栽培试验生产发酵罐11罐,污染率为0;
(2)灵芝菌袋覆盖营养土20天左右,50%菌袋菇蕾,菇蕾出现25天左右,子实体成熟,采收;第一次采后约60天左右,第二批菇蕾形成,菇蕾出现25天左右,子实体成熟,采收;第二次采后约60天左右,第三批菇蕾形成,菇蕾出现25天左右,子实体成熟,采收;。每批次采收后,清理菌块表面,重新补覆土,放置7天,待菌生恢复生长后,同前期一样重复管理。第一批菇生物转化率9.7%,第三批菇生物转化率8.9%,第三批菇生物转化率6.5%,共采收三批,第一年总生物转化率25.1%。
(3)第三批采后,菌袋覆土越冬,至第二年4月中旬开始,恢复水份与空气湿度管理。水分管理约20天左右,菇蕾出现,再过25天左右,子实体成熟,采收;第一次采后约60天左右,第二批菇蕾形成,菇蕾出现25天左右,子实体成熟,采收;第二次采后约60天左右,第三批菇蕾形成,菇蕾出现25天左右,子实体成熟,采收。每批次采收后,清理菌块表面,重新补覆土,放置7天,待菌生恢复生长后,同前期一样重复管理。第一批菇生物转化率9.3%,第二批菇生物转化率7.1%,第三批菇生物转化率6.2%,共采收三批,第二年总生物转化率22.6%。
二年生物学转化率共计47.7%。
实施例3固体菌种与本发明液体菌种栽培的对照
(一)采用固体菌种接种与本发明液体接种及培养基对赤灵芝出菇袋菌丝生长与产量情况(结果见表1)
常规段木出菇袋栽培配方(ck):杂木枝条80.0%、杂木屑12.0%、米糠6%、石膏粉1.0%、过磷酸钙1.0%;
本发明出菇袋培养基栽培配方c/d(同实施例1):培养基d:相思树枝条100%,每袋附加80g菌丝恢复生长辅助培养料(培养基c)。
参照实施例1做好出菇袋培养基,并装袋(袋规格40cm×60cm)、灭菌,然后分别接种固体菌种与液体菌种,菌袋在25-28℃培养室培养。
菌袋菌丝长满后,按实施例1进行菌丝后熟作用、覆土及出菇管理。
表1传统培养基与本发明培养基c对赤灵芝出菇袋菌丝生长的影响比较
表1试验结果采用邓肯氏新复极差(dmrt)法进行分析,数据后相同大小写字母表示在1%和5%水平上差异不显著(表2、3、4、5同)。表中生物转化率(%)=子实体鲜重/菌袋培养料干重×100%。
从表1中可见:在传统段木袋栽出菇方式下,采用本发明液体菌种所制做的菌袋,在试验时间下,其处理菌丝生长速度明显优于固体菌种所接出菇袋,但生物转化率二者无明显差别;在本发明相思树枝条袋栽出菇方式下,采用本发明液体菌种所制做的菌袋,在试验时间下,其处理菌丝生长速度明显优于固体菌种所接出菇袋及传统段木袋栽的固体菌种与液体菌种处理,且生物转化率在四个处理中最高。
试验表明,本发明出菇袋培养基与配合本发明液体菌种情况下,在缩短赤灵芝菌丝生长时间与提高产量方面具有较大的优势。
(二)采用固体菌种接种与本发明液体接种及培养基对黑灵芝出菇袋菌丝生长与产量情况(结果见表2)
常规段木出菇袋栽培配方(ck):杂木枝条80.0%、杂木屑12.0%、米糠6%、石膏粉1.0%、过磷酸钙1.0%;
本发明出菇袋培养基栽培配方c/d(同实施例1):培养基d:相思树枝条100%,每袋附加80g菌丝恢复生长辅助培养料(培养基c)。
参照实施例1做好出菇袋培养基,并装袋(袋规格40cm×60cm)、灭菌,然后分别接种固体菌种与液体菌种,菌袋在25-28℃培养室培养。
菌袋菌丝长满后,按实施例1进行菌丝后熟作用、覆土及出菇管理。
表2传统培养基与本发明培养基c对黑灵芝出菇袋菌丝生长的影响比较
表1试验结果采用邓肯氏新复极差(dmrt)法进行分析,数据后相同大小写字母表示在1%和5%水平上差异不显著。表中生物转化率(%)=子实体鲜重/菌袋培养料干重×100%。
从表2中可见:在传统段木袋栽出菇方式下,采用本发明液体菌种所制做的菌袋,在试验时间下,其处理菌丝生长速度明显优于固体菌种所接出菇袋,但生物转化率二者无明显差别;在本发明相思树枝条袋栽出菇方式下,采用本发明液体菌种所制做的菌袋,在试验时间下,其处理菌丝生长速度明显优于固体菌种所接出菇袋及传统段木袋栽的固体菌种与液体菌种处理,且生物转化率在四个处理中最高。
试验表明,本发明出菇袋培养基与配合本发明液体菌种情况下,在黑灵芝缩短菌丝生长时间与提高产量方面具有较大的优势。
实施例4传统发酵罐与本发明改进发酵罐栽培的对照
如图1所示,相对于传统发酵罐,本发明发酵罐的排气管上安装有二个逆止阀,以防止菌液发酵期间突发停电造成外界不良空气进入所引起的发酵失败(污染),发酵罐的气泵处安装有一个五级过滤装置的贮气罐,可以防止菌液发酵期间突发停电造成无气供应导于外界不良空气进入所引起的发酵失败及菌丝体缺氧坏死。
(一)采用本发明改进的发酵罐与未改进的发酵罐(ck)进行液体培养时,液体菌种成品率比较(结果见表3)
培养基a、b的配制、分装、消毒灭菌、接种参照实施例1进行。
发酵罐液体培养基接种培养24小时后,每隔12小时从取样口取样测定有无杂菌感染(培养基涂布法)。
细菌感染与否采用为酚红肉汤液体培养基检测,其主要成份为:蛋白胨1%,葡萄糖0.3%,牛肉膏0.3%,氯化钠0.5%,酚红0.003%。将所测样品接入培养基,如有细菌感染,则培养液变红;霉菌感染与否采用肉汤固体培养基检测,其主要成份为:蛋白胨1%,葡萄糖0.3%,牛肉膏0.3%,氯化钠0.5%,琼脂粉6.0g/l。将所测样品按划线接种法接入培养基,30-32℃下培养3天,观察霉菌感染情况。
表3本发明改装发酵罐与未改装发酵罐所培养的菌液成品率对比(试验品种:赤灵芝)
表4本发明改装发酵罐与未改装发酵罐所培养的菌液成品率对比(试验品种:黑灵芝)
从表3、4中可见:在培养期间持续供电的条件,原装发酵罐与本发明改进发酵罐生产的菌液质量相同,均无细菌与霉菌检出。在培养48小时后停电20分钟的条件下,采用本发明发酵所生产的液体菌种无细菌与霉菌检出,但是赤灵芝与黑灵芝原装发酵罐在培养120小时后,均全部感染,而且以霉菌感染为主。这说明,在突然停电的情况下,原装发酵罐排气管部位有外界空气进入,而将空气中的霉菌孢子带到了培养液,而本发明发酵罐在排气管处加了二个逆止阀,从而阻止了停电期间外界空气的入侵。
试验表明,本发明发酵罐在应对突发停电所引进菌液感染方面比原装发酵罐有明显的优势。
实施例5传统接种与本发明改进的移动式接种壶的对照
如图2所示,本发明设计的移动式接种壶(约30l)主要由通过耐高压胶管依次连接的气磊(含压力表)、过滤器、不锈钢贮菌液容器、接种枪组成,贮菌液容器顶部设装液口、侧部设背带。
用法:将不锈钢贮菌液容器、过滤器(过滤器孔径0.2μm)、压力表、接种枪、耐高压胶管放在一起做一个包装,120℃下灭菌20分钟,冷却待用;采用火焰封口法,通过发酵罐的排液管,将发酵好的液体菌种移入移动式接种壶;移动式接种壶移运到放于消毒好的菌袋的接种室,接种。
表5本发明移动式接种壶接种液体菌种与常规固体菌种接种效率与菌袋成品率比较
从表5中可见:采用本发明移动式接种壶接种液体菌种接种菌袋,接种效率显著高于使用固体菌种,也明显的高于发酵罐排液管加长接种的方法,同时菌袋污染率只有0.6%,明显低于其它处理。因此,本发明移动式接种壶在接种液体菌种上可较大的提高生产效率,并减少菌袋污染率。
- 还没有人留言评论。精彩留言会获得点赞!