一种山奈酚(4-O-甲基)葡萄糖苷类化合物在抗虫药剂中的应用的制作方法
本发明属于杀虫剂领域,具体涉及山奈酚-(4-o-甲基)葡萄糖苷化合物在杀虫药物中的用途。
背景技术:
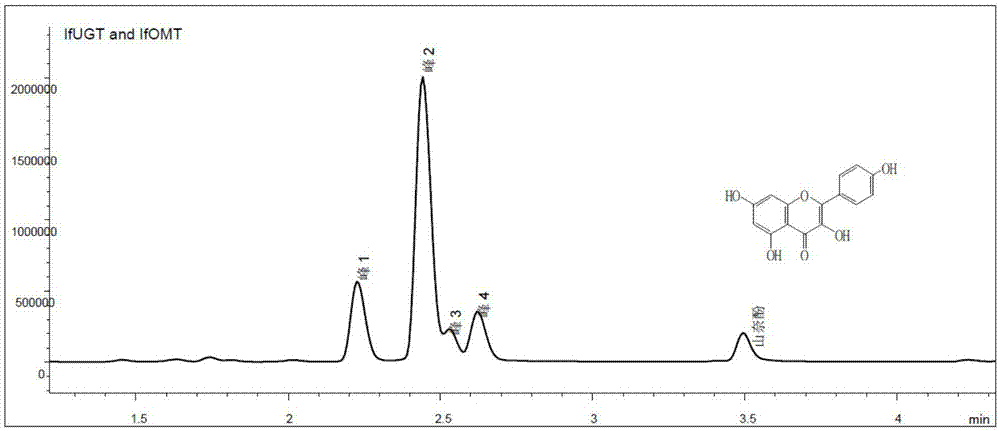
:山奈酚(kaempferol)是一种常见的天然黄酮类植物次生代谢产物,其广泛存在于多种植物的根、叶和果实中。山奈酚具有抗氧化、抗炎症、抑制肿瘤生长及保护肝细胞、抑制血小板聚集和黏附作用等活性,因此受到人们的广泛关注。然而,山奈酚仅微溶于水,且在哺乳动物体内的代谢稳定性差,容易受到来自生物体及外界的多种因素的影响,导致自身降解,活性降低,极大地阻碍了它的应用。葡萄糖基化和甲基化是生物体内常见的修饰反应,可以改变化合物的水溶性、稳定性等理化性质,从而影响其生物有效性,获得更有价值的活性化合物。目前已知的山奈酚糖基化产物有葡萄糖苷、鼠李糖苷、芦丁糖苷、芸香糖苷等。据研究,糖苷类山奈酚比起其苷元,抗氧化的活性显著减弱。山萘酚-3-o-芸香糖苷能明显降低血液以及脑组织中胆碱脂酶活性,并降低海马中兴奋性氨基酸递质,提高脑组织中乙酰胆碱及单胺类、抑制性氨基酸神经递质含量,因而可用于制备防治老年痴呆疾病的药物。山奈酚-3-o-β-d-葡萄糖苷对大肠杆菌、绿脓杆菌、乳链球菌、金黄色葡萄球菌、枯草芽孢杆菌均具有一定抑制效果,最小抑菌浓度(mic)分别为250、250、250、125和125μg/ml。一些山奈酚糖苷具有抑制hdac的活性,如山奈酚-3-o-α-l-吡喃阿拉伯糖苷(54.46%)、山奈酚-3-o-β-d-吡喃木糖苷(45.86%)、山奈酚-3-o-β-d-吡喃葡萄糖苷(43.01%)、山奈酚-3-o-β-d-乙酰基葡萄糖苷(39.61%)等,活性高于其苷元。但山奈酚衍生物的抗虫活性少有报道。山奈苷是山奈酚3,7位鼠李糖苷(kaempferol-3,7-dirhamnoside),具有抗大菜粉蝶(pierisbrassicae)的活性。技术实现要素:本发明将葡糖基转移酶异源表达载体prs425m-ifugt和氧甲基转移酶异源表达载体pxw06f-ifomt转入营养缺陷型酵母受体bj5464进行异源表达,并进行山奈酚饲喂,通过hplc-hrms检测山奈酚衍生物。通过增大发酵规模,获取足量提取物后进行分离、纯化,得到山奈酚7-o-β-d-(4-o-甲基)葡萄糖苷(化合物1)、山奈酚3-o-β-d-(4-o-甲基)葡萄糖苷(化合物2)和山奈酚4'-o-β-d-(4-o-甲基)葡萄糖苷(化合物3)三种山奈酚(4-o-甲基)葡萄糖苷衍生物,其中化合物2和3的结构未见报道。溶解度实验结果显示:化合物1在水、甲醇、乙醇等多种常用溶剂中的溶解度要明显高于山奈酚本身,并且与山奈酚葡萄糖苷类化合物4的溶解度相当。另外,稳定性实验结果显示:化合物1在大肠杆菌、酿酒酵母以及哺乳动物细胞内的稳定性要明显强于对应的山奈酚葡萄糖苷类化合物4,说明化合物1具有良好的溶解性和代谢稳定性。其化学结构如式(1)所示:因此,本发明的目的是提供一种水溶性好、稳定性强的山奈酚(4-o-甲基)葡萄糖苷类化合物即化合物1作为杀虫药剂中的应用。因而也提供含有上述化合物的杀虫药剂。优选的,杀虫是指杀锦铃虫、或小菜蛾。本发明通过实验表明具有有益的技术效果。具体来说,通过血腔注射法评估了山奈酚、山奈酚葡萄糖苷类化合物4–6以及山奈酚(4-o-甲基)葡萄糖苷类化合物1–3对4龄末期棉铃虫的致死和生长抑制作用。结果显示:化合物1–3在20ng/g剂量下表现出不同程度的杀虫活性,其中化合物1的活性最强,致死率高达85%(p<0.05);化合物1–3在2ng/g剂量下能够抑制棉铃虫生长,并导致棉铃虫产生拒食效应,其中化合物1的效果最为显著(p<0.05)。另外,本发明通过体外细胞毒活性实验评估了化合物1–3对哺乳动物细胞的生长抑制作用。结果显示:化合物1–3对四种人源肿瘤细胞(a549、hepg2、hela和mcf-7)和一种非洲绿猴肾细胞(vero)均未表现出明显的生长抑制作用(ic50≥25.0μm),说明化合物1–3对人体具有良好的安全性。因此,化合物1–3有望开发成绿色环保、高效低毒的杀虫农药,具备广泛的应用前景。附图说明图1山奈酚经生物转化后产生3种糖甲基化衍生物的色谱图。图2山奈酚经生物转化后产生1种糖基化衍生物和3种糖甲基化衍生物的质谱图。图3化合物4(上)和化合物1(下)在酵母培养48h后hplc-ms色谱图。图4化合物4(上)和化合物1(下)在大肠杆菌培养48h后hplc-ms色谱图。图5化合物4和化合物1在a549培养6,12,24h后的水解比例。图6化合物4和化合物1在mcf-7培养6,12,24h后的水解比例。图7化合物4和化合物1在vero培养6,12,24h后的水解比例。图8山奈酚及其葡萄糖苷类衍生物在20ng/(gbodyweight)剂量下对棉铃虫的致死作用。图9山奈酚及其葡萄糖苷类衍生物在2ng/(gbodyweight)剂量下对棉铃虫体重增长的影响。图10山奈酚及其葡萄糖苷类衍生物在20ng/(gbodyweight)剂量下对棉铃虫的影响。图11山奈酚及其葡萄糖苷类衍生物对1龄小菜蛾的致死作用。图12山奈酚及其葡萄糖苷类衍生物对3龄小菜蛾的致死作用。图13山奈酚及其葡萄糖苷类衍生物对3龄小菜蛾的体重影响。具体实施方式下面通过具体实施方式的详细描述来进一步阐明本发明,但并不是对本发明的限制,仅仅作示例说明。实施例1应用糖基转移酶重组载体prs425m-ifugt与o-甲基转移酶重组载体pxw06f-ifomt实现对山奈酚的糖基甲基化修饰1.1仪器与材料实验中所用菌株和载体:玫烟色棒束孢菌isariafumosoroseaaccc37775和酵母菌s.cerevisiaebj5464-npga、酵母表达载体prs425m-ifugt和pxw06f-ifomt,均来源于中国农业科学院生物技术所,由本发明人实验室自行保存。实验所用试剂均为国产分析纯产品。培养基:大肠杆菌培养基为lb培养基(1%蛋白胨、0.5%酵母提取物、1%nacl,ph7.0)。sc--leu缺陷培养基(1%葡萄糖、6.7%difcotmyeastnitrogenbasew/oaminoacids、-leu/-trpdosupplement)。ypd培养基(1%酵母膏,2%peptone蛋白胨,2%葡萄糖)。ypd低糖培养基(1%酵母膏,2%peptone蛋白胨,1%葡萄糖.)若制固体培养基,加入2%琼脂粉。高效液相色谱仪为agilent1290infinityii,色谱柱rrhdeclipseplusc18,4.6x100mm。实施例中其它未注明具体条件的实验方法,按照常规方法进行,分子克隆按(newyork:coldspringharborlaboratorypress,1989)实验室手册中所述的条件,或按照制造厂商所建议的条件。1.2实验方法采取二步法发酵技术,首先将适量的酵母转化子菌体接种至相应的25-ml-leu/-trp液体缺陷培养基中,30℃、200r·min-1培养16h左右,再加入ypd低糖培养基25ml,同时分别加入5mg山奈酚纯品继续培养48h;用乙酸乙酯提取发酵产物,乙酸乙酯与发酵液的比例为1:1,即用50ml的乙酸乙酯提取发酵产物;旋转蒸发仪回收乙酸乙酯干燥萃取物,1ml甲醇复溶萃取物。将上述所得发酵产物经高速离心后用通过高效液相(hplc)色谱和高分辨质谱(hrms/ms)检测。hplc检测条件如下:采用乙腈-水为流动相进行梯度洗脱,梯度洗脱条件:梯度洗脱条件:0~5min,乙腈从10%→50%;5~10min,乙腈从50%→95%;10~12min,乙腈为95%;12~12.5min,乙腈从95%→10%;12.5~13min,乙腈为10%。流速0.5ml·min-1,检测波长为300nm。hrms/ms检测条件如下:负离子模式,碰撞能量25v。1.3实验结果与分析hplc分析结果显示:饲喂原料山奈酚几乎完全转化生成得到四种衍生物。通过hrms分析发现,转化后的四个峰中,峰1化合物的分子量比山奈酚的分子量多出162amu,推测为葡萄糖基化产物,峰2-4化合物的分子量比山奈酚的分子量多出176amu,推测为甲基葡萄糖基化产物。通过hrms/ms分析发现,当碰撞能量为15ev时,峰2-4化合物的二级质谱基峰均为山奈酚[m+h]+的分子量,并未发现山奈酚甲基化后[m+h]+的分子量,说明糖基与甲基同时脱落,因此甲基修饰极有可能在糖基的羟基上,而非山奈酚的羟基上。重组菌株发酵产物色谱图及质谱图见图1和图2。实施例2化合物1-3的提取分离及结构鉴定2.1仪器与材料实验中所用溶剂氯仿、甲醇、乙酸乙酯为北京化工试剂厂生产,均为分析纯。色谱纯乙腈为fisherchemical公司生产。柱层析硅胶为青岛海洋化工厂生产(200~300目)。薄层硅胶层析板为烟台黄务硅胶开发试验厂生产。buchir-300型旋转蒸发仪,buchii-300型触控中央控制单元,buchiv-300型ptfe膜式真空泵,buchib-300型电热恒温水浴锅,均由瑞士buchi公司生产。低温冷却液循环泵由上海知信实验仪器技术有限公司生产。半制备高效液相色谱仪为安捷伦1260infinityii,c18色谱柱为安捷伦zorbaxrx-c18(5μm,9.4×250mm)。hresi-ms仪器为agilentms6530q-tof型质谱仪,直接进样测定。核磁共振谱谱用brukeraviii400m型超导核磁共振仪测定,以氘代二甲基亚砜残留溶剂峰作标定,氘代二甲基亚砜为美国剑桥公司(cil)生产。2.2实验方法10l发酵液用等体积乙酸乙酯萃取三次,有机相经减压浓缩后得总浸膏(1.9g)。总浸膏经正相硅胶柱层析,依次以体积比为100:0,98:2,95:5和90:10的氯仿-甲醇溶液洗脱。收集95:5洗脱的馏分,上半制备高效液相色谱,以体积比为23:77的乙腈-水溶液为流动相,分离得到化合物1(20mg,tr=12.2min)、化合物2(32mg,tr=10.1min)和化合物3(50mg,tr=14.2min)。2.3实验结果与分析通过解析高分辨质谱、一维和二维核磁共振谱,鉴定了化合物1–3的结构如式(1)所示。其中,化合物1为已报道的山奈酚7-o-β-d-(4-o-甲基)葡萄糖苷,化合物2和3分别为山奈酚3-o-β-d-(4-o-甲基)葡萄糖苷和山奈酚4'-o-β-d-(4-o-甲基)葡萄糖苷,该结构未见报道。化合物1–3的结构鉴定数据如下:化合物1:高分辨质谱m/z461.1009[m-h]-,calcd.461.1089,分子式为c22h22o11;1hnmr(400mhz)和13cnmr(400mhz)数据归属如表1所示。化合物2:高分辨质谱m/z461.1114[m-h]-,calcd.461.1089,分子式为c22h22o11;1hnmr(400mhz)和13cnmr(400mhz)数据归属如表1所示。化合物3:高分辨质谱m/z461.1106[m-h]-,calcd.461.1089,分子式为c22h22o11;1hnmr(400mhz)和13cnmr(400mhz)数据归属如表1所示。表1.化合物1–3的核磁共振数据(测试溶剂为氘代二甲基亚砜)。实施例3山奈酚及其糖苷类衍生物的溶解性测试3.1实验目的确定糖甲基化对山奈酚在不同溶剂中的溶解度影响。3.2实验方法分别称取山奈酚与化合物1各1mg,置于25℃±2℃1ml的不同溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如看不见溶质颗粒或液滴时,即视为完全溶解。所选取溶剂有蒸馏水,甲醇,乙醇等。3.3实验结果及分析山奈酚及其糖基化衍生物(化合物4)、糖甲基化衍生物(化合物1)在不同溶剂中的溶解性如表4所示。表4山奈酚与化合物1在不同溶剂中的溶解性溶剂山奈酚化合物4化合物1蒸馏水-+-+-+甲醇++++++++乙醇++++++++dmf++++++1%dmso++++++++0.1%tween20+++++0.1%tritonx100+++++注:不溶-;微溶-+;部分溶解+;大部分溶解++;完全溶解+++如表4所示,糖基化和糖甲基化与修饰前相比,均能显著提高山奈酚的溶解性。但根据hplc液相谱图可见,糖甲基化后的产物水溶性要略低于糖基化产物。实施例4化合物1与化合物4在大肠杆菌和酿酒酵母细胞中的稳定性比较4.1实验目的在酵母和大肠杆菌自身酶系的作用下,比较糖甲基化修饰产物化合物1-3与甲基化修饰前的糖苷化合物4-6在相同条件下的水解稳定性。4.2实验方法在用ypd培养的50ml酵母bj5464中分别添加2mg糖甲基化修饰产物化合物1,与甲基化修饰前的糖苷化合物4,样品溶解在100μl色谱甲醇中,空白对照为等体积色谱甲醇。30℃、200r·min-1分别培养48h后,用乙酸乙酯提取发酵产物,乙酸乙酯与发酵液的比例为1:1,即用50ml的乙酸乙酯提取发酵产物;旋转蒸发仪回收乙酸乙酯干燥萃取物,1ml甲醇复溶萃取物。在用lb培养的50ml大肠杆菌dh5-alpha中分别添加2mg糖甲基化修饰产物化合物1,与甲基化修饰前的糖苷化合物4,样品溶解在100μl色谱甲醇中,空白对照为等体积色谱甲醇。30℃、200r·min-1分别培养48h后,用乙酸乙酯提取发酵产物,乙酸乙酯与发酵液的比例为1:1,即用50ml的乙酸乙酯提取发酵产物;旋转蒸发仪回收乙酸乙酯干燥萃取物,1ml甲醇复溶萃取物。将上述所得发酵产物经高速离心后用高效液相色谱检测。hplc检测条件如下:色谱柱kromasil100-5-c18,采用乙腈-h2o为流动相进行梯度洗脱,梯度洗脱条件:梯度洗脱条件:0~5min,乙腈10%;5~15min,乙腈从10%→95%;15~25min,乙腈为95%;25~28min,乙腈从95%→10%;28~31min,乙腈为10%。流速0.8ml·min-1,检测波长为300nm。4.3实验结果及分析分析化合物1-3和化合物4-6在同样培养时间下的萃取产物色谱图。化合物1和化合物4在酵母培养48h后的萃取产物色谱图如图3所示。化合物1和化合物4在大肠杆菌培养48h后的萃取产物色谱图如图4所示。通过色谱图可以看出糖基化衍生物在48h后均发生明显水解;但糖甲基化产物在培养过程中较为稳定,未发生明显水解现象,说明葡萄糖上发生的甲基化能增加糖基化产物的稳定性,防止化合物被酶降解。实施例5化合物1和化合物4在哺乳动物细胞内的稳定性比较5.1仪器与材料两种人源肿瘤细胞株即人肺癌a549细胞和人乳腺癌mcf-7细胞以及非洲绿猴肾表皮vero细胞均购自中国科学院昆明动物研究所;胎牛血清fbs,rpmi1640培养液、dmem培养液购自gibco,usa。高效液相色谱仪为agilent1290infinityii,色谱柱为rrhdeclipseplusc18,4.6×100mm。5.2实验方法取对数生长期的人肺癌a549细胞、人乳腺癌mcf-7细胞以及非洲绿猴肾表皮vero细胞加入96孔板中,每孔含有约5000个细胞。再分别加入山奈酚葡萄糖苷化合物4和山奈酚(4-o-甲基)葡萄糖苷化合物1,每孔最终含有培养液100μl,各样品终浓度为25μm。每组设4个平行孔,置于二氧化碳培养箱中37℃分别培养6、12和24小时后,取出96孔板并冷冻干燥。随后每孔加入100μl甲醇,超声提取15min,重复两次后合并提取液,14000转离心4min,收集上清液。将上述所得上清液用高效液相色谱检测,对色谱峰峰面积进行积分计算对应化合物的水解比例。采用乙腈-水为流动相进行梯度洗脱,梯度洗脱条件为:0~5min,乙腈从10%→50%;5~10min,乙腈从50%→95%;10~12min,乙腈为95%;12~12.5min,乙腈从95%→10%;12.5~13min,乙腈为10%。流速0.5ml·min-1,检测波长为300nm。5.3实验结果及分析:在不同细胞系中,比较化合物1和化合物4在同样培养条件下的水解百分比例。结果如表3所示。通过表3可以看出糖基化衍生物在24h后均发生明显水解;但糖甲基化产物在培养过程中较为稳定,未发生明显水解现象,说明甲基化能增加葡萄糖苷类衍生物的稳定性,防止化合物被哺乳动物细胞的酶降解。表3化合物1和化合物4在哺乳细胞培养条件下的水解百分比例化合物4和化合物1在a549培养6,12,24h后的水解比例请参见图5。化合物4和化合物1在mcf-7培养6,12,24h后的水解比例参见图6。化合物4和化合物1在vero培养6,12,24h后的水解比例请参见图7。实施例6山奈酚及其糖苷类化合物的细胞毒活性6.1仪器与材料酶标仪为genoismicroplatereader(tecangenios,swizerland);四种人源肿瘤细胞株即人肺癌a549细胞、人肝癌hepg2细胞、人宫颈癌hela细胞、人乳腺癌mcf-7细胞以及非洲绿猴肾表皮vero细胞均购自中国科学院昆明动物研究所;胎牛血清fbs,rpmi1640培养液、dmem培养液购自gibco,usa;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt)购自amresco,usa。6.2实验方法取对数生长期的人肺癌a549细胞、人肝癌hepg2细胞、人宫颈癌hela细胞、人乳腺癌mcf-7细胞、非洲绿猴肾表皮vero细胞加入96孔板中,每孔含有约5000个细胞。再加入不同浓度的山奈酚和化合物1–6,并以阿霉素为阳性对照,以未加样品的细胞孔作为对照组,每组设4个平行孔,置于二氧化碳培养箱中37℃培养72小时,实验终止前4小时加入20μlmtt(5mg/ml)溶液,再培养4小时,弃去培养液后加入150μldmso,待结晶溶解后在酶联检测仪上检测570nm波长下每孔的od值。按下列公式求出生长抑制率,再由spss(17.0)软件求出半数抑制浓度(ic50值)。结果见表2,其中ic50用mean±s.e.m表示。6.2实验结果与分析由表2中的结果可见,化合物1–3对哺乳动物细胞未表现出明显的细胞毒性。表2.山奈酚及其糖苷类衍生物的肿瘤细胞生长抑制活性(ic50,μm)。实施例7山奈酚及其糖苷类化合物对棉铃虫杀虫能力测试7.1实验目的通过血腔注射法,测试并比较山奈酚及其6种葡萄糖苷类化合物对棉铃虫生长的影响,展示化合物1-6的杀虫活性。7.2实验方法先用甲醇将六种化合物稀释成100μg/ml的母液,之后用水稀释成10μg/ml(20ng/(gbodyweight))和1μg/ml(2ng/(gbodyweight))的溶液进行处理。选择4龄末期的棉铃虫进行注射处理,每头虫注射2μl,用10%的甲醇作对照。每处理注射10头虫,3次重复。5d后统计结果并取样。7.3实验结果及分析在20ng/(gbodyweight)的剂量下,山奈酚及其葡萄糖基化衍生物(化合物4-6)均未表现出显著的杀虫活性,棉铃虫致死率与空白对照相当;而竟甲基化修饰后的化合物1-3则表现出不同程度的杀虫作用,特别是化合物1致死效果显著(p<0.05).在2ng/(gbodyweight)的剂量下,山奈酚及其葡萄糖苷类化合物(1-6)均未表现出明显的致死效果,但化合物1-6均在不同程度上导致昆虫生长迟缓,且化合物1-3使昆虫表现出拒食效应,特别是化合物1效果最为显著(p<0.05).山奈酚及其葡萄糖苷类衍生物在20ng/(gbodyweight)剂量下对棉铃虫的致死作用见图8。山奈酚及其葡萄糖苷类衍生物在2ng/(gbodyweight)剂量下对棉铃虫体重增长的作用见图9。山奈酚及其葡萄糖苷类衍生物在20ng/(gbodyweight)剂量下对棉铃虫影响的图片见图10。实施例8山奈酚及其糖苷类化合物对小菜蛾杀虫能力测试8.1实验目的通过化合物涂抹叶片并喂食,测试并比较山奈酚及其6种葡萄糖苷类化合物对小菜蛾生长的影响,展示化合物1-6的杀虫活性。8.2实验方法将山奈酚及其6种衍生物溶解于dmso中,配制成10mm的溶液。将10μl的溶液加入到990μl1ml0.1%的tritonx-100水溶液中,最终浓度为0.1mm,然后均匀涂在甘蓝叶片上,晾干后放入垫有滤纸的培养皿中,接入1龄期或3龄期小菜蛾幼虫。72h后检查试虫的死亡率。每个处理15只测试昆虫,3个重复。8.3实验结果及分析除化合物5外,其它5种糖基化衍生物对1龄小菜蛾的杀虫活性均显著高于对照组(山奈酚)(p<0.05)。针对3龄小菜蛾,化合物1-6处理下小菜蛾死亡率有所增加,但与对照相比差异不显著;化合物1和化合物2导致小菜蛾体重显著降低(p<0.05).山奈酚及其葡萄糖苷类衍生物对1龄小菜蛾的致死作用见图11。山奈酚及其葡萄糖苷类衍生物对3龄小菜蛾的致死作用见图12。山奈酚及其葡萄糖苷类衍生物对3龄小菜蛾的体重影响见图13。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1