薄荷挥发油的新用途的制作方法
本发明涉及薄荷挥发油的用途,尤其涉及薄荷挥发油对中药材或作物根腐病及对中药材或作物地上部多种病害的防治作用,属于生物农药技术领域。
背景技术:
植物挥发油是存在于植物中的一类具有芳香气味、可随水蒸气蒸馏出来而又与水不相混溶的挥发性油状成分,挥发油为一混合物,其组分较为复杂,挥发油成分中以萜类成分多见,另外,尚含有小分子脂肪族化合物和小分子芳香族化合物;
植物挥发油不仅用于传统医药、食品、烟草、酒精和烟草,还可用于植物保护(杀虫、抑菌、除草等),植物挥发油作为植物源农药应用于植物保护领域,与建议的无公害农药理念一致。从这个意义上说,植物挥发油也可以被归类为第三代农药。三七(Panax notoginseng(Burk.)F.H.Chen)为五加科人参属多年生草本植物,具有散瘀止血、消肿定痛等功效,随着社会需求量不断增加,三七种植面积也迅速增加,其病害问题日益严重,已成为三七生产的主要障碍;目前,对三七病害的防治主要依赖各种化学药剂,化学农药虽有效,却大大增加了农民的投入成本,更严重污染了土壤和降低了药材品质,存在“3R”(残留、抗药性和再生)问题。
薄荷(Mentha haplocalyx Briq.)为唇形科植物,是一种有特种经济价值的芳香作物,薄荷既可作为调味剂,又可作香料;是辛凉性发汗解热药,治流行性感冒、头疼、目赤、身热、咽喉、牙床肿痛等症;外用可治神经痛、皮肤瘙痒、皮疹和湿疹等。
目前,未见与本发明技术方案相关的文献公开。
技术实现要素:
本发明目的在于提供一种薄荷挥发油的新用途,即其在防治中药材或作物根腐病中的应用,所述根腐病的致病菌为腐皮镰刀菌(Fusarium solani)、腐霉(Pythium aphanidermatum)、毁坏柱孢霉(Cylindrocarpon destructans)等。
本发明薄荷挥发油还可应用在防治导致中药材或作物地上部发生病害的致病菌中;所述致病菌为灰霉菌(Botrytis cinerea)、胶孢炭疽菌(Colletotrichum gloeosporioides)、立枯丝核菌(Rhizoctonia solani)等。
本发明所述的薄荷挥发油的用途,是将薄荷挥发油用作制备防治中药材或作物根腐病或者防治引起中药材或作物地上部发生病害的致病菌的制剂,即以薄荷挥发油为活性成分,在制备防治致病菌制剂中的应用。
本发明所述防治致病菌制剂的成分(或有效成分)为薄荷挥发油,还可以加入一种或多种中药和农作物病害防治制剂上可接受的辅料,或者与其他活性成分复配发挥协同抑菌作用。
薄荷挥发油可以通过现有技术设备制备成各种剂型的农药或各种形态的化肥。
本发明中薄荷挥发油是通过常规水蒸气蒸馏法提取,无水硫酸钠干燥挥发油而制得,该制备方法简单,所需试剂成本低,有利于大量生产。
薄荷挥发油作为一种天然的杀菌活性物质,在使用后其活性消失或被微生物分解,对环境无污染,对人畜安全;由于薄荷挥发油是植物源提取物,其有效成分复杂多样,对病原菌为多成分多靶点的作用机制,使得靶标生物不易产生对某种或某几种成分产生抗药性,从而获得持久的防治效果。与化学合成农药相比,薄荷挥发油的有效成分易挥发、易降解,抑菌而不杀菌,因此不易对其它的有益微生物造成危害,改善土壤微生态结构,促进植物与微生物协同进化,保护生态环境,提高中药材或作物的品质。
薄荷挥发油可通过抑制病原菌孢子萌发和菌丝生长来降低植物发病率和病情指数;通过和化学农药协同增效,达到减少化学农药施用的目的。
配制50mg/mL的薄荷挥发油溶液,溶剂为含有体积浓度1%的DMSO和体积浓度0.1%的吐温80的水溶液,测试薄荷挥发油对三七根腐病发生的3种主要致病菌腐皮镰刀菌(Fusarium solani)、腐霉(Pythium aphanidermatum)和毁坏柱孢霉(Cylindrocarpon destructans)的作用,以及导致三七地上部病害发生的3种致病菌灰霉菌(Botrytis cinerea)、胶孢炭疽菌(Colletotrichum gloeosporioides)、立枯丝核菌(Rhizoctonia solani)菌丝生长的作用;实验结果显示薄荷挥发油对孢子萌发和菌丝生长有抑制作用;将薄荷挥发油与化学农药恶霉灵进行复配,发现对P.aphanidermatum菌株的抑菌效果具有协同作用,对其他菌株无协同或加和作用。
本发明所述降低三七病害发生的薄荷挥发油具有投入低、制备简单、使用方便、效率高、易挥发、低毒、低残留的特点;在国家大力发展有机农业的大背景下,薄荷发油是比较理想的克服三七病害的化学药剂替代品,对农业的可持续发展具有重要意义,在农业生产中有较广阔的应用前景。
附图说明
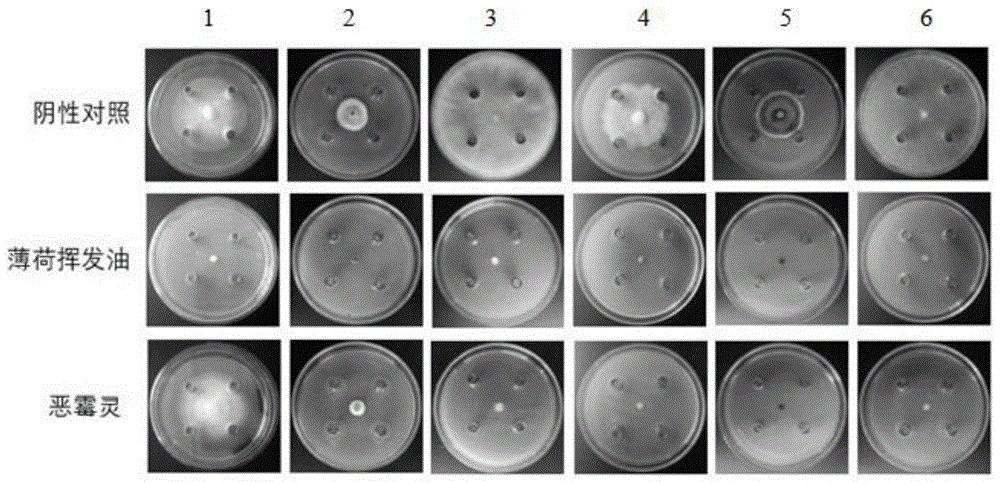
图1是本发明中薄荷挥发油对腐皮镰刀菌(1)、毁坏柱孢霉(2)、腐霉(3)、灰霉菌(4)、胶孢炭疽菌(5)、立枯丝核菌(6)的菌落生长的抑制结果;
图2是本发明中薄荷挥发油对腐皮镰刀菌、毁坏柱孢霉、腐霉、灰霉菌、胶孢炭疽菌、立枯丝核菌的菌落生长的抑菌率结果。
具体实施方式
下面通过附图和实施例对本发明作进一步详细说明,但本发明保护范围不局限于所述内容,实施例中方法如无特殊说明均为常规方法,使用的试剂如无特殊说明均为常规市售试剂或按常规方法配制的试剂。
实施例1:薄荷挥发油的制备
(1)将300g薄荷药材粉碎,按照料液比为1:8的比例加入蒸馏水2400mL浸泡过夜,采用水蒸气蒸馏法进行提取,提取时间为6h,冷凝收集溜出液;
(2)提取出来的溜出液用无水硫酸钠干燥,除去所含水份,即得薄荷挥发油,放进棕色样品瓶里,密封,-20℃保存待用。
实施例2:致病菌的活化
(1)马铃薯葡萄糖琼脂培养基(PDA):马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水1000mL;
(2)将分离自三七根部和地上部的致病菌进行纯化鉴定,鉴定为腐皮镰刀菌(Fusarium solani)、腐霉(Pythium aphanidermatum)、毁坏柱孢霉(Cylindrocarpon destructans)、灰霉菌(Botrytis cinerea)、胶孢炭疽菌(Colletotrichum gloeosporioides)和立枯丝核菌(Rhizoctonia solani),将上述菌种接种在PDA培养基上进行活化,接种3~4次后,取生长旺盛的菌株备用。
实施例3:GC-MS测定薄荷挥发油的化学组分
(1)GC条件:仪器型号:Agilengt Technologies 7890B-5977B;色谱柱:HP-5MS 30m×250μm×0.25μm;
(2)EI源电离源温度:230℃;四级杆温度:150℃;扫描范围:30~500m/z;进样口温度:285℃;分流比10:1;进样量:1μl;电子能量:70eV;柱温箱升温程序:50℃保持4min,5℃/min升温至120℃,1℃/min升温至180℃,10℃/min升温至280℃保持16min;其中RI值根据正构烷烃连续碳(C9-C25)的保留时间计算得到,将化合物的保留时间和质谱与NIST17.L数据库进行数据比对,确定最终化合物,检测结果见下表:
通过GC-MS分析干样薄荷的挥发油成分,在干样薄荷中检测到49个有效成分,占挥发油总含量的94.17%。
实施例4:测定薄荷挥发油对实施例2中6种致病菌菌丝生长的影响
(1)无菌操作条件下,在每个培养皿中倒入15mL PDA培养基,待冷却凝固后,取实施例2中在PDA培养基上培养7d的致病菌,用直径5mm的打孔器沿菌落边缘打取菌块,接种于培养基中央;
(2)将4个无菌牛津杯距离真菌块25mm处等距离放置;
(3)将实施例1干燥后的薄荷挥发油用含有体积浓度1%的DMSO和体积浓度0.1%的吐温80的水溶液溶解,制得浓度为50mg/mL薄荷挥发油液体;
(4)在每个牛津杯中加入200μL步骤(3)的50mg/mL薄荷挥发油液体(事先用0.22μm有机系滤头过滤除菌),于微生物培养箱中28℃恒温培养,以不加薄荷挥发油的含有体积浓度1%的DMSO和体积浓度0.1%的吐温80的水溶液和恶霉灵为对照,每个处理设5个重复;
(5)培养箱中培养7d后,采用“十字交叉法”测量菌落直径;
结果见图1、2,从图1、2中可以看出薄荷挥发油对这6种病原菌具有广谱的抑菌作用且抑菌率高,抑制率都达到了100%;而化学药剂恶霉灵浓度为5mg/mL时对腐皮镰刀菌、毁坏柱孢霉、腐霉、灰霉病、胶孢炭疽菌、立枯丝核菌的抑制率分别是11.06%、54.66%、88.00%、88.81%、100%、86.00%。
实施例5:薄荷挥发油MIC测定
(1)将实施例1干燥后的薄荷挥发油用含有体积浓度2%的DMSO和体积浓度0.1%的吐温80的水溶液溶解,用二倍稀释法配置浓度范围为75.00-0.15mg/mL的多个浓度梯度液体,阳性药恶霉灵、单体化合物左旋香芹酮、D-柠檬烯用同样方法配置成浓度范围为2.50-0.0048mg/mL的液体;
(2)取实施例2中生长7d的病原菌,用20mL 1/4PDA液体培养基(不添加琼脂,马铃薯和葡萄糖的量为常规培养基的1/4)冲洗培养基,然后制成孢子浓度为1×104个/mL的孢子悬浮液;
(3)在96孔板中加入0.22μm微孔滤膜过滤除菌的50μL薄荷挥发油和150μL步骤(2)中制成的孢子悬浮液;
(4)空白对照是50μL含有体积浓度2%DMSO和体积浓度0.1%吐温80的水溶液以及150μL PDA液体培养基;阳性对照为50μL含有体积浓度2%DMSO和体积浓度0.1%吐温80的水溶液以及150μL步骤(2)中的孢子悬浮液;
(5)96孔板28℃恒温培养36h,然后检查孔内真菌生长情况;在595nm处用酶标仪(Thermo 1510)测量每个孔的吸光度,结果见下表:
注:同一行不同字母表示不同处理有显著性差异(P<0.05);
结果显示不同菌株抑制机理是不一样的,所以薄荷挥发油对每个菌的抑制效果是不一致的。
实施例6:薄荷挥发油与恶霉灵联合作用测定
(1)依据实施例5得到的薄荷挥发油和恶霉灵的MIC,配置成最高浓度为8倍MIC,然后采用二倍稀释法配制8个稀释梯度;
(2)将不同浓度的薄荷挥发油(25μL)和不同浓度的恶霉灵(25μL)组合添加在96孔板内,然后每个孔中加入实施例5步骤(2)中制成的孢子悬浮液(150μL);
(3)150μL实施例5步骤(2)中制成的孢子悬浮液与50μL含有体积浓度2%的DMSO和体积浓度0.1%的吐温80的水溶液为阴性对照;
(4)96孔板在28℃恒温保存36h,在595nm处用酶标仪(Thermo 1510)比色,检测真菌生长情况;
(5)联合用药的MIC测定:以无真菌孔生长对应的药物浓度作为薄荷挥发油与恶霉灵联用的MIC;
(6)FIC计算:挥发油的FIC=挥发油与恶霉灵联用的MIC/挥发油的MIC,恶霉灵的FIC=挥发油与恶霉灵联用的MIC/恶霉灵的MIC;
(7)FICI=挥发油的FIC+恶霉灵的FIC,其中FICI≤0.5为协同作用,0.5<FICI≤1为加和作用,1<FICI≤4为无关作用,FICI>4为拮抗作用,结果见下表;
- 还没有人留言评论。精彩留言会获得点赞!