人CDK13发育缺陷综合症小鼠模型及其制备方法和用途与流程
本发明属于生物工程领域,涉及一种小鼠模型,尤其涉及一种基因敲除小鼠,具体来说是一种人cdk13发育缺陷综合症小鼠模型及其制备方法和用途。
背景技术:
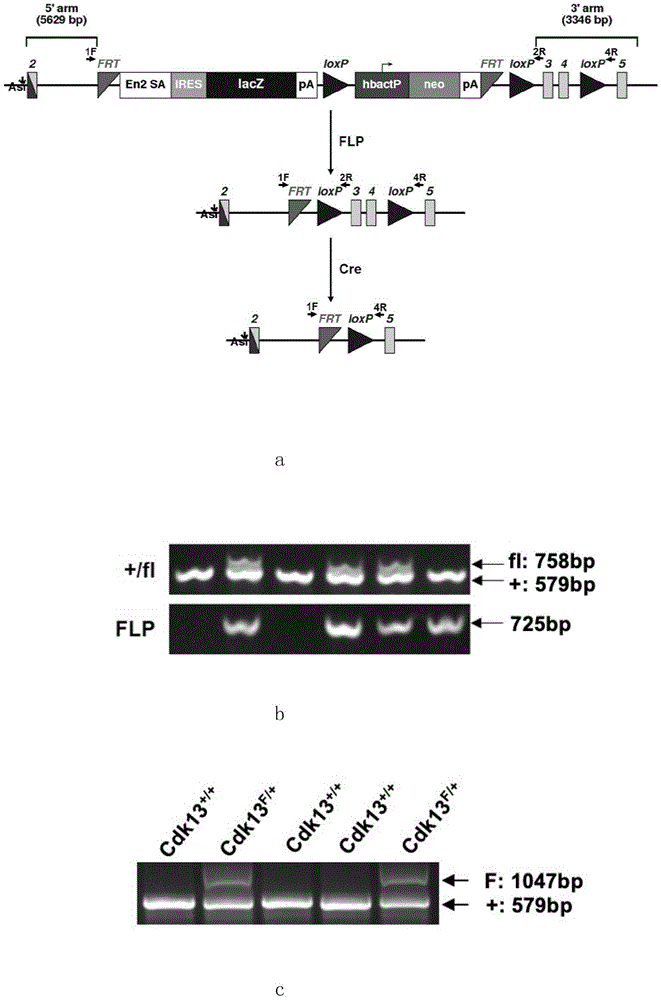
:细胞周期蛋白依赖性激酶13(cdk13)是一种从酵母到人类都高度保守的丝氨酸/苏氨酸磷酸激酶(bartkwiaketal.,2010),通过和cyclink形成复合物从而催化rna聚合酶ii蛋白c端ser2位点发生磷酸化(blazeketal.,2011;greifenbergetal.,2016)。cdk13也参与转录调控(blazeketal.,2011;panetal.,2015;greifenbergetal.,2016),rna可变剪接(berroetal.,2008;liangetal.,2015)和轴突的延伸(chenetal.,2014)。通过人外显子组测序发现cdk13蛋白保守的丝氨酸-苏氨酸催化结构域内一系列错义突变和先天性心脏病、智力障碍和发育缺陷等相关(sifrimetal.,2016)。另一个包含4293例发育异常患者的大规模外显子组测序也发现cdk13的突变(mcraeetal.,2017)。进一步的基因和表型特征也验证了这些突变,并且定义了这种综合征的各种新的临床特征,例如面部及指端异常,智力障碍和发育迟缓,被称之为cdk发育缺陷综合症(bostwicketal.,2017;hamiltonetal.,2018;akkeretal.2018)。但目前尚不知晓cdk13突变是否直接导致这种发育缺陷综合症,也不清楚导致表型缺陷背后的机制。因此建立相应的小鼠模型来研究确立cdk13突变与患者中缺陷综合征的关系与机制,从而为该疾病的治疗提供潜在线索,就显得尤为重要。技术实现要素:本发明目的在于提供一种人cdk13发育缺陷综合症小鼠模型及其制备方法和用途,所述的这种人cdk13发育缺陷综合症小鼠模型及其制备方法和用途要解决现有技术中没有合适的动物模型来研究人cdk13发育缺陷综合症,同时要解决现有技术中用于治疗人cdk13发育缺陷综合症的药物效果不佳的技术问题。本发明提供了一种人cdk13发育缺陷综合症小鼠模型,为cdk13+/-或者cdk13-/-。本发明还提供了上述人cdk13发育缺陷综合症小鼠模型的制备方法,包括如下步骤:1)一个构建cdk13flox小鼠的步骤,将cdk13第三、四外显子两侧分别带有loxp位点的cdk13tm1a(eucomm)hmgues细胞株扩增后注射进野生型小鼠囊胚,通过胚胎移植,获得f0代小鼠,f0代小鼠再与野生型小鼠交配,繁育获得f1代小鼠,其基因型为cdk13f/+,所述的f1代小鼠在第三、四外显子两侧分别带有loxp位点的cdk13flox小鼠,即cdk13flox小鼠;2)一个制备cdk13+/-敲除小鼠的步骤;将步骤1)构建的在第三、四外显子两侧分别带有loxp位点的cdk13flox小鼠先与flp工具小鼠交配,获得的小鼠的基因型为cdk13fl/+;flp,然后再与野生型小鼠交配获得不带neo和flp的子代cdk13flox小鼠,然后不带neo和flp的子代cdk13flox小鼠与生殖细胞中特异性表达的ddx4-cre工具小鼠进行杂交,敲除cdk13基因第三和第四外显子,得到ddx4-cre;cdk13fl/+小鼠,再将获得的ddx4-cre;cdk13fl/+小鼠与野生型小鼠交配得到cdk13+/-小鼠。进一步的,将cdk13+/-雄鼠与cdk13+/-雌鼠交配,获得cdk13-/-小鼠。进一步的,步骤1)中,野生型小鼠为c57bl/6小鼠。本发明还提供了上述人cdk13发育缺陷综合症小鼠模型在筛选用于治疗人cdk13发育缺陷综合症的药物中的用途。本发明还提供了组蛋白去乙酰化酶hdacs抑制剂在制备治疗人cdk13发育缺陷综合症的药物中的用途。本发明人经过研究,建立了一种遗传稳定、表型与人cdk13发育缺陷综合症吻合的小鼠模型,这种小鼠模型的cdk13基因失活,可用于研究cdk13基因的生物学功能方面,也可用于筛选治疗人cdk13发育缺陷综合症的新药及其他治疗方法。本发明和已有技术相比,其技术进步是显著的。本发明通过利用这模型筛选治疗人cdk13发育缺陷综合症药物,筛选到可以明显改善cdk13缺陷小鼠记忆的小分子saha。附图说明:图1a显示了cdk13等位基因敲除构建和方法;图1b显示通过dna凝胶电泳带谱鉴定对照、杂合子(cdk13f/+)胚胎基因型;图1c显示通过dna凝胶电泳带谱鉴定和flp小鼠杂交后子代小鼠野生型、杂合子(cdk13fl/+)胚胎基因型;图1d显示通过dna凝胶电泳带谱鉴定和ddx-cre小鼠杂交后子代小鼠野生型、杂合子(cdk13fl/+)胚胎基因型;图1e显示通过dna凝胶电泳带谱鉴定野生型、杂合子(cdk13+/-)、纯合子(cdk13-/-)胚胎基因型;图1f显示了western-blot检测cdk13蛋白表达水平,*标注非特异性条带。图2a显示了不同发育阶段对照与cdk13突变胚胎的表型(比例尺:e9.5,0.5mm;e11.5,1mm;e13.5,2mm);图2b显示了胚胎体积(对照组n=47;cdk13+/-,n=88;cdk13-/-,n=9);图2c显示了胚胎质量(对照组n=36;cdk13+/-,n=74;cdk13-/-,n=6);图2d显示了胎盘质量(对照组n=34;cdk13+/-,n=67;cdk13-/-,n=6)数据在表型下方;数据均以中位数-四分位间距显示。ns,无显著差异,*p<0.05,****p<0.0001。图3显示了e13.5cdk13敲除胚胎表型缺陷;其中,a为e13.5cdk13-/-胚胎面部异常(比例尺:1mm);b为e13.5cdk13-/-胚胎胸腔/背部积水(比例尺:2mm);c为cdk13-/-胚胎神经管异常;d为e13.5cdk13-/-胚胎指端异常(比例尺:0.5mm)。图4a显示了e13.5天对照组,cdk13+/-和cdk13-/-胚胎心脏横截面he染色,cdk13-/-胚胎心脏有室缺,胚胎基因型如图片顶部所示。e13.5胚胎心脏左心室壁厚度比较位于底层(比例尺:底层,20μm,其他,100μm);图4b显示了左心室壁厚度统计(ns,无显著差异;*,p<0.05)。图5显示了用水迷宫测试(mwm)来进行智力水平测试。在训练完后第3(图5a)、5天(图5b)分别记录小鼠在每个象限所花的时间,图中还各自显示了每一组代表性游泳轨迹并统计了训练过程找到平台的时间(control,n=11;cdk13+/-,n=12)。四个象限包括northwest,northeast,southwestandsoutheast。*p<0.05。连续训练7天,对照组和cdk13+/-小鼠找到隐藏的平台所花时间(图5c)。图6a显示了control小鼠及cdk13+/-小鼠场景恐惧记忆测试。在测试过程中每两分钟统一一次小鼠恐惧时间所占的比例。control(n=15);cdk13+/-(n=14)。数据d-g统计结果均为mean±s.e.m.*p<0.05,**p<0.01,***p<0.001。图6b显示了训练阶段control(n=15)以及cdk13+/-(n=14)突变体小鼠的恐惧时间占比。图7a显示了野生型control小鼠以及cdk13+/-小鼠在测试时游动的距离统计。横坐标为测试时间。*p<0.05。图7b显示了旷场实验。野生型小鼠(control,n=14)以及cdk13+/-(n=14)小鼠在30分钟内移动的总距离。*p<0.05。图8显示了存活下来的25天雄性小鼠cdk13nko(nestin-cre;cdk13fl/fl)以及它的同窝对照(control)小鼠(cdk13fl/fl)的体型(a)及各组织(脑,心,肺,睾丸,肝和肾)的大小比较(b)。图9显示了cdk13nko小鼠及其对照鼠脑冠状切片的he染色。a:显示cdk13nko雄性p0小鼠侧脑室增大。b:侧脑室面积占整脑面积比例的统计结果(n=6)。测量选取从小鼠冠状切片嘴前端至侧脑室部分[1],每隔200μm选择一张切片。每只小鼠选择五张切片进行定量统计。*p<0.05。图10a显示了本发明的实验设计与实施示意图;b显示了抑制剂处理前和处理72小时后,e9.5胚胎原代神经上皮细胞中和钙信号通路相关基因ppp3cc转录水平检测;c显示了抑制剂处理前和处理72小时后,e9.5胚胎原代神经上皮细胞中和钙信号通路相关基因epdr1转录水平检测;d显示了抑制剂处理前和处理72小时后,e9.5胚胎原代神经上皮细胞中和钙信号通路相关基因cacna1h转录水平检测。野生型小鼠(control)杂合子小鼠(cdk13+/-)分别以dmso处理作为阴性对照。表观遗传抑制剂,例如unc(unc0638),saha,和gsk(gsk343),以及用于处理的小分子浓度如图所示。ns,nosignificance;*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。图11a显示了本发明的实验实施流程示意图;b和c显示了野生型小鼠以及cdk13+/-小鼠在对照溶剂处理或者抑制剂saha(50mg/kg)处理后进行场景恐惧记忆测试。b:在训练阶段的恐惧时间比例。c:在测试阶段每隔2.5分钟统计一次小鼠的恐惧比例。(control/veh,n=15;cdk13+/-/veh,n=14;cdk13+/-/saha,n=12)。数据均显示为mean±s.e.m.。*p<0.05。具体实施方式:下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列具体实施例中未注明的具体条件的实验方法,通常按照常规条件,或按照制造厂商使用说明书中所建议的条件,未标注出处的试剂均为常规市售试剂。本发明采用的cdk13tm1a(eucomm)hmgues细胞株购自eummcr。ddx4-cre工具小鼠为常用的工具小鼠,由中国科学院上海生物化学和细胞生物学研究所陈德桂研究员赠送。野生型c57bl/6小鼠购买自上海斯莱克实验动物有限公司。flp工具小鼠购买自上海南方模式生物研究中心。nestin-cre小鼠为常用的工具小鼠,由同济大学生命科学与技术学院邱安东教授赠送。所有小鼠均依照学校相关规定进行管理,进行的所有实验均经过同济大学动物管理委员会批准。为了怀孕时间准确,我们在傍晚将发情雌鼠和雄鼠合笼,将第二天早晨确定有栓的雌鼠所怀胚胎定义为e0.5。实施例1cdk13flox小鼠的构建采用在cdk13第三、四外显子两侧分别带有loxp位点的cdk13tm1a(eucomm)hmgues细胞株(图1a第一行所示),将es细胞克隆经扩增后,注射进c57bl/6小鼠囊胚中,通过胚胎移植,获得f0代高嵌合鼠。高比例的f0代高嵌合小鼠与c57bl/6小鼠交配,繁育获得f1代小鼠,其基因型为cdk13f/+。f1代小鼠出生后2周左右,剪尾用蛋白酶k55℃消化过夜得到dna模板,用pcr引物进行pcr扩增鉴定小鼠基因型,从而获得阳性杂合子cdk13flox小鼠(在第三、四外显子两侧分别带有loxp位点的cdk13flox小鼠)。具体实施过程:小鼠出生后2周左右,剪脚趾和尾巴鉴定基因型。剪下的鼠尾或脚趾置于1.5mlep管中,加入100μl鼠尾消化裂解液(100mmtris-hcl(ph8.0),5mmedta,0.2%sds,200mmnacl使用前加入终浓度100μg/ml蛋白酶k,混匀后使用),55℃水浴裂解过夜;裂解过夜后将裂解液置于95℃加热10分钟使proteasek失活,之后加入400μlddh2o稀释裂解液,混匀后10000g离心1分钟,取上清1μl作为pcr反应模版,检测小鼠基因型。根据cdk13基因序列(genbank号:ac154219,ac154828),设计和合成下列三条引物,通过三条引物来鉴定cdk13flox小鼠基因型。其中野生小鼠基因组只扩出579bp野生条带,杂合小鼠能扩出两条带型(野生条带+:579bp,突变条带f:1047bp)(图1b)。pcr反应体系如下:pcr反应程序如下:预变性:95℃10分钟。扩增循环:95℃变性20秒,57℃退火20秒,72℃延伸1分钟;共35循环。循环后延伸:72℃延伸5分钟。鉴定引物:cdk13_1f:5’-ctaagggcaaccttgaatgt-3’(seqidno.1)cdk13_2r:5’-ggggaggggtgtaagtcata-3’(seqidno.2)cdk13_3:5’-tgctttacggtatcgccgct-3’。(seqidno.3)实施例2cdk13+/-敲除小鼠的获得2.1将实施例1构建的在第三、四外显子两侧分别带有loxp位点的cdk13flox小鼠(图1b),先与flp工具小鼠(flp重组酶可以让frt位点发生重组从而去掉两个frt位点间的序列)交配(图1aflp步骤所示,通过frt位点重组从而去掉frt位点间的neo等序列),得到的小鼠的基因型为cdk13fl/+;flp,并按照下述方式来鉴定小鼠基因型,然后再通过与野生型小鼠交配从而最终获得不带neo和flp的子代cdk13flox小鼠(cdk13fl/+)(图1c)。我们使用实施例1所述鼠尾裂方法获得鼠尾裂解液作为模板进行pcr鉴定小鼠的基因型。通过下面引物来鉴定cdk13小鼠基因型:(1)cd13_1f和cdk13_2r引物鉴定是否含有去neo的突变条带。cdk13_1f:5’-ctaagggcaaccttgaatgt-3’(seqidno.1)cdk13_2r:5’-ggggaggggtgtaagtcata-3’(seqidno.2)pcr产物:去neo后突变条带fl(758bp),野生条带+(579bp)。(2)flp_f和flp_r引物用来鉴定flp的阳性和阴性:flp_f:5'-cactgatattgtaagtagtttgc-3'(seqidno.4)flp_r:5'-ctagtgcgaagtagtgatcagg-3'(seqidno.5)pcr产物:flp阳性条带为725bp。2.2不带neo和flp的子代cdk13flox小鼠再与生殖细胞中特异性表达的ddx4-cre工具小鼠(cre重组酶可以让loxp位点发生重组从而去掉两个loxp位点间的序列)进行杂交从而在生殖细胞中特异性敲除cdk13基因第三和第四外显子(图1acre步骤所示),再将获得的子代小鼠在2周左右剪尾消化,pcr扩增鉴定得到ddx4-cre;cdk13fl/+小鼠(图1d);我们使用实施例1所述鼠尾裂方法获得鼠尾裂解液作为模板进行pcr鉴定小鼠的基因型。通过下面引物来鉴定ddx4-cre;cdk13fl/+小鼠基因型:(1)cdk13_1f和cdk13_2r引物鉴定有去neo的突变条带。cdk13_1f:5’-ctaagggcaaccttgaatgt-3’(seqidno.1)cdk13_2r:5’-ggggaggggtgtaagtcata-3’(seqidno.2)pcr产物:去neo后突变条带fl(758bp),野生条带+(579bp)。(2)cre_f和cre_r引物用来鉴定cre阳性和阴性。cre_f:5’-gaacctgatggacatgttcagg-3’(seqidno.6)cre_r:5’-agtgcgttcgaacgctagagcctgt-3’(seqidno.7)pcr产物:cre阳性条带为320bp。2.3将获得的ddx4-cre;cdk13fl/+小鼠与野生型c57bl6小鼠交配得到cdk13+/-小鼠(图1e)。我们使用实施例1所述鼠尾裂方法获得裂解液作为模板进行pcr鉴定小鼠的基因型。通过下面引物来鉴定cdk13+/-小鼠基因型:cdk13_1f:5’-ctaagggcaaccttgaatgt-3’(seqidno.1)cdk13_2r:5’-ggggaggggtgtaagtcata-3’(seqidno.2)cdk13_4r:5’-acaactgcttttctggaggag-3’(seqidno.8)pcr产物:cd13_1f和cdk13_2r引物鉴定野生条带+(579bp);cdk13_1f和cdk13_4r这对引物用来鉴定敲除外显子后的“-”条带(723bp)。通过western-blot检测发现在e13.5cdk13-/-小鼠胚胎中,cdk13蛋白确实是缺失的(图1f)。实施例3cdk13全身敲除小鼠胚胎致死,颅面部发育缺陷,指部与心脏发育缺陷,智力障碍。将cdk13+/-雄鼠与发情的cdk13+/-雌鼠交配,第二天检查雌鼠阴道精栓,记为e0.5天。根据上述方式来鉴定胚胎基因型,我们发现cdk13基因敲除纯合子胚胎仅能存活至胚胎发育15.5天(e15.5)。进一步研究表明,e9.5和e11.5条件下存活的cdk13-/-胚胎比例分别为19%和15%(根据孟德尔定律,其理论值为25%),且体积均小于野生型(wt)胚胎(图2,表1)。表1野生型和cdk13胚胎表型及发育阶段。含存活胚胎与死亡/被吸收胚胎(出生前死亡)比例。在e13.5时,cdk13-/-胚胎仅占10%,而16%则为死亡/被吸收胚胎(表1)。存活的e13.5cdk13-/-胚胎表型显示出多种异常:90%cdk13-/-胚胎有左前肢/右前肢指端异常,70%有颅面部发育缺陷,50%体积更小(图3,表2),所有cdk13-/-胚胎都伴随胎盘生长缺陷(图2)。小鼠编号基因型表型#488-1cdk13-/-个头小,额面部畸形,右前肢指畸形。胸腔和背部积水#433-8cdk13-/-个头小,额面部畸形,右前肢指畸形。胸腔积水#473-1cdk13-/-个头小,右前肢指畸形。胸腔积水#28-5cdk13-/-额面部畸形,左前肢指畸形。胸腔和背部积水#28-6cdk13-/-额面部畸形,右前肢指畸形。胸腔和背部积水#141-1cdk13-/-额面部畸形,指畸形。胸腔积水,神经管畸形#107-1cdk13-/-个头小,额面部畸形,右前肢指畸形。胸腔和背部积水#72-1cdk13-/-额面部畸形,右前肢指畸形。胸腔和背部积水#135-1cdk13-/-个头小,额面部畸形,左前肢指畸形。胸腔和背部积水#20-1cdk13-/-无明显缺陷#107-2cdk13-/-,cre胚胎致死#163-7cdk13-/-胚胎致死#148-9cdk13-/-胚胎致死#83-1cdk13-/-胚胎致死#26-4cdk13-/-胚胎致死,额面部畸形#194-6cdk13-/-胚胎致死表2cdk13-/-e13.5胚胎表型。列出了e13.5尚且存活的十个纯合子胚胎表型,以及6个确定基因型的cdk13-/-死胎的表型。各胚胎表型和编号如图表所示。值得注意的是,几乎所有e13.5cdk13-/-胚胎都有胸腔/背部积液(图3),而这些在cdk13+/+或cdk13+/-胚胎中没有发现。由于绝大部分cdk13综合症患者均患有chd,我们在e13.5cdk13-/-胚胎中检测了心脏发育情况。事实上,取e13.5的胚胎进行常规的病理切片h&e染色分析,发现几乎所有cdk13-/-胚胎均表现出室间隔缺损,心室壁厚度也比野生型胚胎薄50%左右(图4)。he染色操作方法:小鼠处死,取出需要的组织。组织用4%的多聚甲醛4℃固定过夜。组织脱水使用50%的乙醇处理30分钟,60%的乙醇处理30分钟,75%的乙醇处理过夜,95%的乙醇处理30分钟再用无水乙醇处理三次,用二甲苯清洁处理两次,最终用3次石蜡(39602004,leica)来充分浸透。样品被包埋进石蜡并切成5μm(脑:10μm)厚的切片并依据说明书进行he染色(beyotimebiotechnology)。最终用中性树脂封片。综上,这些缺陷与cdk13突变的患者中症状类似。携带cdk13错义突变的患者还拥有智力残疾这个一致特征。但令人诧异的是,我们仅仅在1/10的e13.5cdk13-/-胚胎中发现了严重的神经管缺陷(表2)。为了检测在成年阶段cdk13ko对神经元/行为活动的影响,我们选取了3-4个月龄的cdk13+/-小鼠并利用水迷宫实验测试评估了它们的空间学习记忆能力。如果没有特别提出,所有用于行为学实验的小鼠均是c57bl/6背景的小鼠(雄性,4-6个月)。水迷宫实验(mwm)操作方法如下:我们向蓝色塑料水槽中注水至没过圆形平台(直径10cm)约0.5-1.0cm,水温控制在20±1.0℃。水槽直径为120cm,被分为四个象限(northwest,northeast,southwestandsoutheast)。我们在水槽所放置的房间墙壁上设计了一些视觉线索。安装于头顶的摄像头将记录每只小鼠的游泳活动及运动轨迹,据此我们可以利用视频跟踪系统分析小鼠到达平台的时间,游泳的总距离以及在各个平台花费的时间及游动的距离等信息。每只小鼠将经历为期一周,每天四轮的训练过程。每轮训练中,小鼠将随机从四个象限之一面朝池壁放下。如果能在60秒(用秒表手动计时)内找到平台,我们允许它在平台上休息20秒。如果不能找到平台,60秒后我们将被引导至平台休息20秒。在训练之后的1,3,5天我们进行了测试。测试阶段我们将平台移除,允许小鼠在水池中自由寻找平台60秒,我们将分析小鼠在目标象限停留的时间比例。我们使用旷场实验来衡量小鼠的运动水平。旷场平台是一个方形的塑胶玻璃盒子(放于不透明的柜子中以减少视觉干扰)。在旷场开始之前小鼠被放于测试房间适应环境60分钟。之后,每只小鼠被温柔的放于旷场中让其自由探索30分钟。每轮测试结束后,我们用75%的酒精将平台清扫干净。我们将记录运动的总距离。转棒测试操作方法:转棒实验开始之前小鼠放于待测试的房间适应30分钟。首先,将小鼠放于恒定转速5r.p.m.的转棒上适应60秒。休息10分钟后,将小鼠放到加速转棒上(五分钟从5r.p.m.加速到50r.p.m.)并记录每只小鼠停留在转棒上的时间。每只小鼠进行五次测试(每次测试之间间隔60分钟)。在连续训练7天后,对照组和cdk13+/-小鼠都能够快速及准确的找到隐藏的平台(图5)。然而,在测试阶段,对照组小鼠在训练后第三天显示出对目标象限(northeastplatform)的明显偏好(图5),但cdk13+/-小鼠却没有这种倾向性。此外,在训练后第三天及第五天cdk13+/-小鼠待在目标象限的时间也比control小鼠短得多。我们还使用了场景恐惧实验来评估cdk13+/-小鼠的学习记忆能力。场景恐惧实验操作方法:在训练日,首先将小鼠放于待测试房间适应环境30分钟,然后将小鼠放于训练环境中。让小鼠自由探索环境两分钟后给与6次1ma的足底电击(每次两秒,间隔两分钟),训练过程总过12分钟。训练之后将小鼠放回饲养笼。训练24小时之后,小鼠被再次放回训练环境中持续十分钟并记录每只小鼠的恐惧时间比例。为了测试saha的作用,给每只小鼠腹腔注射5ul/g仅含2%dmso或含2%dmso及10mg/mlsaha的2-hydroxypropyl-β-cyclodextrin(50%v/v)。注射3小时之后,按照之前的流程训练及测试小鼠的恐惧程度。在训练阶段control和cdk13+/-小鼠有着相似的恐惧反应,但在测试阶段cdk13+/-小鼠的恐惧时间要明显比control小鼠短(图6)。我们还做了转棒和旷场实验来评估小鼠行为活动的改变,我们发现相比对照组小鼠cdk13+/-小鼠的自发运动水平增加了(图7)。总之,这些行为学研究表明,cdk13缺失是cdk13综合症病人智力残疾及行为学改变的原因。实施例4神经系统特异性cdk13敲除小鼠的构建与功能验证e13.5cdk13-/-胚胎以及成年cdk13+/-小鼠的表型分析说明cdk13综合症患者的缺陷可能是发育/细胞命运决定失败导致的。为了验证这种可能性,我们首先通过杂交cdk13fl/fl和nestin-cre小鼠(神经系统中特异性表达的cre工具鼠)来评估cdk13缺失对小鼠早期神经发育的影响。nestin-cre;cdk13fl/fl(cdk13nko)小鼠虽然可以出生(p0)(体型比同窝的对照组nestin-cre;cdk13fl/+小鼠小),但15只小鼠中除了两只以外其余的都没活过出生当天(p0)(表3)。表3显示的是活过p1的cdk13nko小鼠数量。小鼠基因型及数目显示于图表中。分子表示的是存活小鼠数目,分母表示获得小鼠的总数。p0cdk13nko新生鼠的脑明显比对照组小,只有对照组小鼠的2/3。这两只幸存的cdk13nko小鼠的体重和器官(包括脑,心脏,肺,肝,肾脏和睾丸)大小也一直比对照组小鼠小(图8)。p0cdk13nko小鼠的进一步病理分析还显示其侧脑室(lv)明显增大,几乎是野生型小鼠的两倍大(图9)。实施例5利用人cdk13发育缺陷综合症的小鼠模型进行初步的药物筛选,发现saha可能成为治疗cdk13综合症病人智力水平缺陷的一种潜在的药物。我们利用构建的小鼠模型进行了初步的小分子化合物的筛选,首先我们利用分离培养的小鼠脑原代细胞(对照组和cdk13+/-组)进行了初筛。我们首先检测了一些已知小分子化合物例如unc0638,bio,saha(vorinostat)和gsk343,分别是组蛋白h3k9me2/3甲基转移酶g9a抑制剂,gsk-3α/β抑制剂,组蛋白去乙酰化酶hdacs抑制剂和组蛋白h3k27me3甲基化酶ezh2抑制剂,然后用real-timepcr的方法来检测其能否逆转cdk13敲除导致的部分基因表达下调。real-timepcr方法:小鼠组织或者培养细胞的总rna由rnaisoplus(takara)萃取。cdna由2μg的总rna在m-mlv逆转录酶(promega)的作用下合成。实时荧光定量pcr使用2×sybrgreenqpcrmastermix(lowrox)(biotool)。我们使用实时定量pcr仪(lightcycler96,roche)来测定sybrgreen的信号。分别用saha(1um)、unc0638(1um)、bio(1um)、gsk343(10nm)处理e9.5对照和cdk13+/-脑原代细胞72小时,而后随机选取e9.5cdk13+/-胚胎中8个下调基因检测表达回调。6个基因的表达水平在处理后有不同程度的回升,其中hdacs和g9a抑制剂saha和unc0638对钙信号相关基因ppp3cc,notch3,epdr1和cacna1h的转录回升作用似乎比其他抑制剂更有效(图10)。神经上皮细胞分离的步骤:e9.5胚胎的头部用无ca2+和mg2+离子的pbs清洗一次,然后用0.1%的胰酶(gibco)和0.001%dnase1于4℃消化18分钟,终止消化使用含有1%胎牛血清(fbs,gibco)以及0.001%dnase的dmem/f12(gibco)。在解剖镜下小心的去除神经管周围的结缔组织,留下的神经上皮没有任何中胚层、血管以及外胚层的包裹。之后用无ca2+和mg2+离子的pbs清洗一次神经管,接着用含0.025%胰酶,0.001%dnase1,10mmhepes(ph7.6)以及0.5mmedta的pbs溶液37℃消化12分钟以解离细胞。用含有10%fbs的dmem/f12终止消化,然后300g离心5分钟沉淀细胞。用细胞培养液(含有1×b27,20ng/mlbfgf,8ug/mlheparin的dmem/f12)重悬细胞沉淀并接种于提前包被poly-l-lysine和laminin的培养板上。对于药物处理,unc0642(selleck)用dmso配置为1mm(1000×),saha(selleck)用dmso配置为1mm(1000×),gsk343(selleck)用dmso配置为10μm(1000×)。用培养基稀释这些化学药物到1×,处理细胞72小时后收取细胞。dmso处理细胞作为对照。我们接下来检测是否cdk13+/-小鼠(4-5个月;)的记忆缺陷能被saha(50mg/kg)或unc0642(5mg/kg)给逆转,我们通过腹腔注射的方式在给药后3小时进行场景恐惧记忆实验来进行验证。我们发现相比溶剂处理对照组别,saha可以显著地改善cdk13+/-小鼠受损的记忆,但unc0642却未能改善cdk13+/-小鼠受损的记忆(图11)。因此saha可能成为治疗cdk13综合症病人智力水平缺陷的一种潜在的药物,而且我们的小鼠模型可以用来大规模的筛选治疗cdk13发育缺陷综合症的药物。结论:cdk13是一种从酵母到人类都高度保守的分子量165kda的丝氨酸/苏氨酸磷酸激酶,可参与基因转录调控,rna可变剪接和轴突的延伸等过程。在患有先天性心脏病,面部及指端异常,智力障碍及发育迟缓的患儿中发现存在该基因的突变,但其生物学功能并不清楚。本发明人通过构建cdk13敲除小鼠模型,成功模拟了人cdk13突变患者所具有的症状,比如先天性心脏病、面部及指端畸形、发育迟缓,以及成年后的智力障碍等,从而确立了cdk13突变与患者中缺陷综合症的关系,为进一步研究cdk13的生物学功能和cdk13发育缺陷综合症的机制与治疗提供了基础。本发明人构建的cdk13功能缺陷小鼠首次成功再现了携带cdk13功能丧失突变患者的多种症状,可以作为该综合症的遗传稳定、表型明确的小鼠模型,可以用来筛选治疗该综合症的药物和方法。本发明人发现使用组蛋白去乙酰化酶的抑制剂saha,可以使来自cdk13+/-小鼠的原代胚胎神经细胞中下调的神经相关基因得以回升,cdk13+/-成年小鼠记忆也得到明显改善,这为进一步治疗人cdk13发育缺陷综合症提供了线索。序列表<110>同济大学青岛高等研究院<120>人cdk13发育缺陷综合症小鼠模型及其制备方法和用途<160>8<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1ctaagggcaaccttgaatgt20<210>2<211>20<212>dna<213>人工序列(artificialsequence)<400>2ggggaggggtgtaagtcata20<210>3<211>20<212>dna<213>人工序列(artificialsequence)<400>3tgctttacggtatcgccgct20<210>4<211>23<212>dna<213>人工序列(artificialsequence)<400>4cactgatattgtaagtagtttgc23<210>5<211>22<212>dna<213>人工序列(artificialsequence)<400>5ctagtgcgaagtagtgatcagg22<210>6<211>22<212>dna<213>人工序列(artificialsequence)<400>6gaacctgatggacatgttcagg22<210>7<211>25<212>dna<213>人工序列(artificialsequence)<400>7agtgcgttcgaacgctagagcctgt25<210>8<211>21<212>dna<213>人工序列(artificialsequence)<400>8acaactgcttttctggaggag21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1