癫痫动物模型的制备及其应用
1.本发明涉及生物技术领域,更具体地涉及癫痫动物模型的制备及其应用。
背景技术:
2.癫痫是由神经元同步异常放电引起的,会导致短暂的大脑功能障碍。
3.为了更好地理解cdkl5综合症相关的癫痫发病机制,研究人员建立了多个转基因小鼠模型,这些模型鼠表现出了许多行为学异常,包括后肢抱团、活动量改变、眼球追踪异常、学习记忆受损以及自闭症样社交障碍等表型。但遗憾的是,这些模型小鼠均无自发性癫痫的发生。并且因此目前缺乏模拟cdkl5综合症患者难治性癫痫的动物模型。
4.并且目前临床上还没有治疗癫痫的有效药物,尤其是对该病的婴幼儿早发性癫痫症状,传统抗癫痫药疗效较差。并且在该领域由于缺乏可靠的动物模型进行体内药物筛选,因此大大降低了治疗该疾病药物开发的效率。
5.因此本领域迫切需要开发可大大提高药物研发效率和准确性,降低临床研究失败的风险的筛药动物模型。
技术实现要素:
6.本发明的目的在于提供一种大大提高药物研发效率和准确性,降低临床研究失败的风险的筛药动物模型。
7.在本发明的第一方面,提供了一种非人哺乳动物的难治性癫痫动物模型的制备方法,所述方法包括以下步骤:
8.(1)提供一非人哺乳动物a和同一物种的神经元细胞特异性cre重组酶表达的非人哺乳动物b;
9.其中所述的非人哺乳动物a的基因组具有:(e1)内源的cdkl5基因,和(e2)与cdkl5基因操作性连接的并用于条件敲除cdkl5基因的条件敲除元件,其中,所述的条件敲除元件在所述的cre重组酶存在下,条件敲除神经元细胞的基因组的cdkl5基因,从而使得cdkl5基因失活;
10.(2)将所述的动物a与动物b交配繁育,获得cdkl5基因在神经元细胞特异性敲除的子代非人哺乳动物c;
11.(3)培养所述的子代的非人哺乳动物c,从而得到所述的难治性癫痫动物模型。
12.在另一优选例中,所述的难治性癫痫动物模型具有如下特征:特征性的难治性癫痫脑电波。
13.在另一优选例中,本发明所述的癫痫脑电波具有高振幅和高频率的特点,通过eeg记录分析,容易与未发作期的低振幅的脑波区分,也可以与小鼠偶然痉挛时产生的单次高振幅脑波区分,该特征更有利于判断癫痫鼠模型癫痫发作的频率。
14.在另一优选例中,所述的难治性癫痫动物模型具有如下一种或多种特征:
15.单次癫痫发作的持续时间在30-90秒;
16.每天的发作次数在0-35次,随着癫痫的进展,发作次数逐渐增加;
17.本发明的动物模型相较于以往癫痫模型具有的特征是自发的,而且是高频的。
18.在另一优选例中,所述的非人哺乳动物a为雌性,并且两个x染色体上均具有所述的内源cdkl5基因和所述条件敲除元件,即所述非人哺乳动物a为纯合的雌性动物。
19.在另一优选例中,当所述的非人哺乳动物a为雌性时,所述的子代非人哺乳动物c为第一代子代动物,且所述子代动物为雄性。
20.在另一优选例中,所述的非人哺乳动物a为雄性,并且一个x染色体上具有所述的内源cdkl5基因和所述条件敲除元件。
21.在另一优选例中,当所述的非人哺乳动物a为雄性时,所述的子代非人哺乳动物c为第二代子代动物,且所述第二代子代动物为雄性或雌性。
22.在另一优选例中,根据孟德尔遗传定律,用来繁殖子代非人哺乳动物c的亲代动物a和动物b均可以是任意雌性和雄性的组合,在产生的后代中(第一代及以上后代),通过基因型鉴定选出具有自发癫痫表型的条件性敲除鼠。
23.在另一优选例中,所述难治性癫痫包括自发的难治性癫痫、婴幼儿早发性癫痫、cdkl5综合症癫痫。
24.在另一优选例中,所述的神经元细胞包括:兴奋性神经元细胞。
25.在另一优选例中,所述的条件敲除神经元细胞的基因组的cdkl5基因包括部分或全部敲除cdkl5基因。
26.在另一优选例中,所述的条件敲除元件包括loxp序列。
27.在另一优选例中,所述动物a基因组的cdkl5基因中的一个或多个外显子的两侧插入有loxp序列。
28.在另一优选例中,所述动物a的cdkl5基因中的6号外显子的两侧插入有loxp序列。
29.在另一优选例中,所述的loxp序列之间还插入有筛选标记。
30.在另一优选例中,所述筛选标记为neo基因。
31.在另一优选例中,所述动物b的基因组中包含一外源cre表达盒。
32.在另一优选例中,所述的外源cre表达盒包括:(a)神经元细胞特异性启动子;和(b)位于所述神经元细胞特异性启动子下游的cre基因。
33.在另一优选例中,所述cre基因包括cre重组酶或改进的cre重组酶(improved cre,icre)的基因。
34.在另一优选例中,所述的神经元细胞特异性启动子包括emx1基因或camk2α基因的启动子。
35.在另一优选例中,所述的动物c的cdkl5基因从特定的时间点(emx1-cre从胚胎12.5天,camk2α-icre从出生后)开始在神经元细胞中特异性敲除。
36.在另一优选例中,所述敲除包括cdkl5基因不表达,或表达没有活性的cdkl5蛋白,或表达致病性突变的cdkl5基因。
37.在另一优选例中,所述特异性敲除是通过敲除cdkl5基因的6号外显子实现的。
38.在另一优选例中,所述非人哺乳动物为啮齿动物或灵长目动物,较佳地包括小鼠、大鼠、兔、猴。
39.在另一优选例中,与同窝对照或野生型对照动物相比,所述的难治性癫痫动物模
型具有以下一个或多个特征:
40.(a)根据racine癫痫分级标准,癫痫由低级向高级发展;
41.(b)颗粒细胞轴突纤维在齿状回内分子层呈带状分布;
42.(c)癫痫发作频率增加;
43.(d)癫痫最终导致动物死亡;
44.(e)产生了特征性的癫痫脑电波;
45.(f)出现典型的癫痫大发作的行为;
46.(g)出现大脑的癫痫样放电。
47.本发明第二方面提供了一种本发明第一方面所述方法制备的非人哺乳动物模型的用途,所述的模型用于研究难治性癫痫发病机制的动物模型。
48.在另一优选例中,所述难治性癫痫包括自发的难治性癫痫、婴幼儿早发性癫痫、cdkl5综合症癫痫。
49.本发明第三方面提供了一种本发明第一方面所述方法制备的非人哺乳动物模型的用途,将该模型被用于筛选或鉴定可减轻或治疗难治性癫痫的物质(治疗剂)。
50.本发明第四方面提供了一种筛选或鉴定治疗或缓解难治性癫痫的潜在治疗剂的方法,包括以下步骤:
51.(a)在测试组中,在测试化合物的存在下,将测试化合物施用于本发明第一方面所述方法制备的非人哺乳动物模型,对测试组的所述动物模型的表型进行分析;并且在不施用所述测试化合物且其他条件相同的对照组中,对对照组的所述动物模型的表型进行分析;
52.(b)对测试组和对照组动物模型的行为进行比较,其中,与对照组相比,如果施用了测试化合物的动物模型中表征难治性癫痫的表型得到改善,则表明该测试化合物可作为难治性癫痫的潜在治疗剂。
53.在另一优选例中,所述难治性癫痫的表型选自下组:癫痫发作频率、颗粒细胞轴突纤维在齿状回内分子层的分布、典型的癫痫性脑电波。
54.在另一优选例中,所述颗粒细胞轴突纤维在齿状回内分子层的分布包括颗粒细胞轴突投射到临近颗粒细胞的树突、颗粒细胞轴突纤维末端在齿状回内分子层呈带状分布。
55.在另一优选例中,所述表型得到改善包括:癫痫发作频率降低、颗粒细胞轴突纤维未投射到齿状回内分子层、癫痫性脑电波消失。
56.在另一优选例中,所述的方法是非诊断性和非治疗性的。
57.在另一优选例中,所述方法包括步骤(c),将步骤(b)筛选或鉴定的潜在治疗剂施用于本发明第一方面所述方法制备的非人哺乳动物模型,从而测定其对所述动物模型的表型的影响。
58.在另一优选例中,所述改善是在统计学上具有显著性意义的改善。
59.本发明第五方面提供了一种非人哺乳动物模型,用本发明第一方面所述方法制备。
60.在另一优选例中,对于cdkl5基因敲除而言,所述的非人哺乳动物模型是杂合的或纯合的。
61.在另一优选例中,所述的cdkl5基因敲除是cdkl5基因在神经元细胞中特异性敲
除。
62.本发明第六方面提供了一种细胞的用途,所述细胞中的cdkl5基因发生条件性敲除,用于制备构建非人哺乳动物的难治性癫痫动物模型的生物制剂,并且所述细胞为神经元细胞。
63.在另一优选例中,所述条件性敲除指用cre-loxp重组酶系统对所述神经元细胞中的cdkl5基因进行特异性的敲除。
64.在另一优选例中,所述神经元细胞包括兴奋性神经元细胞。
65.在另一优选例中,所述生物制剂为液态制剂。
66.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
67.图1(a)癫痫小鼠不同等级的发作。(b)cdkl5条件性敲除小鼠和全身敲除小鼠癫痫发作的比例。(c)cdkl5条件性敲除小鼠的发作频率。
68.图2为在体电生理记录系统的示意图。
69.图3为记录的emx1-cko小鼠脑电图,图中显示了该小鼠在癫痫发作时脑电图的变化(下图),长时间监控可以容易的看出小鼠癫痫发作的次数(上图)。
70.图4为使用一种新型抗癫痫药可以降低癫痫小鼠发作的频率,而药物溶剂处理的对照组小鼠癫痫频率在给药前后无统计学差异。
71.图5为小鼠脑片timm染色结果显示emx1-cko小鼠颗粒细胞轴突纤维在齿状回内分子层呈带状分布(a-b,a
’-
b’),而vgat-cko小鼠(c-d,c
’-
d’)和knockout小鼠(e-f,e
’-
f’)与对照相比没有显著异常。统计结果显示emx1-cko小鼠中苔藓纤维出芽现象与对照小鼠有显著差异(g)。
具体实施方式
72.本发明人经过广泛而深入地研究,首次意外地开发了一种自发的难治性癫痫动物模型,具体地,本发明提供了一种cdkl5的神经元细胞(比如兴奋性神经元细胞)特异性敲除动物,其可以作为自发难治性癫痫动物模型。本发明的动物模型有癫痫表型,尤其是难治性癫痫表型,可用于抗癫痫(尤其是难治性癫痫)药物的筛选。在此基础上,本发明人完成了本发明。
73.术语
74.cdkl5基因
75.周期素依赖性激酶样蛋白5(cyclin-dependent kinase-like 5,cdkl5)基因位于x染色体短臂22号位点,编码一种在人类和小鼠脑中表达的丝氨酸/苏氨酸激酶,该激酶由n’端激酶催化区和c’端氨基酸序列构成。该基因是montini等在1998年研究疾病相关基因时发现的。2003年kalscheuer等在两名患有x连锁婴儿痉挛症(x-linked infantile spasms)和智力障碍的女婴中发现由于x染色体和常染色体易位导致cdkl5基因被破坏,这两名患儿完全相同的症状强烈提示cdkl5蛋白的缺失会导致神经系统功能障碍。据统计,致
病的cdkl5基因突变位点主要集中在其n’端激酶催化区,而且携带激酶区突变的患者症状比携带其他区域突变的患者症状更严重。
76.癫痫
77.癫痫是神经元突发性异常放电导致的短暂大脑功能障碍,是一种慢性疾病。流行病学资料显示,我国癫痫的总体发病率为7.0
‰
,1年内有发作的活动性癫痫患病率是4.6
‰
。在中国癫痫已成为神经科仅次于头痛的第二大常见病。癫痫的发病原因复杂多样,包括遗传因素、脑部疾病等,发病机制也非常复杂。
78.基因失活
79.对于功能未知基因的研究可采用许多方法,例如使有待研究的基因失活,分析所得的遗传修饰的表型变化,进而获得该基因的功能信息。这一研究方法的另一优点是可以将基因功能和疾病进行关联,从而在获得基因功能的同时也能获得该基因作为潜在药物或者药物靶点所能治疗的疾病信息和疾病动物模型。基因失活的方法可通过基因剔除、基因中断或基因插入的方式来完成。其中,基因剔除技术是研究人类基因在整体中的功能的非常强有力的手段。
80.如本文所用,术语“基因失活”、“基因敲除”可互换使用,指通过对某一目的基因进行中断、敲除等遗传操作,从而使得该目的基因的表达和/或活性大幅下降甚至完全丧失。
81.本发明利用“组织特异性cre-loxp系统”,将cdkl5条件敲除小鼠(cdkl5
flox/flox
)与兴奋性神经元细胞特异性cre表达小鼠(emx1-cre或者camk2α-icre鼠)杂交,获得cdkl5在兴奋性神经元细胞的特异性敲除小鼠(emx1-cre或者camk2α-icre/cdkl5
flox/flox
小鼠)。其中,cdkl5条件敲除小鼠的基因组中cdkl5基因的外显子6号的两侧插入有loxp标记;兴奋性神经元细胞特异性cre表达小鼠的基因组中包含一外源cre表达序列,所述的外源cre表达序列包括:(a)兴奋性神经元细胞特异性启动子(emx1基因或camk2α基因的启动子),和(b)位于所述兴奋性神经元细胞特异性启动子下游的cre基因。本发明在个体水平上,将上述两种小鼠的杂交,获得在兴奋性神经元细胞中特异性表达cre重组酶的子代小鼠,从而将兴奋性神经元细胞基因组中的loxp位点之间的cdkl5基因切除,实现cdkl5基因在兴奋性神经元细胞中的特异性失活。
82.cre重组酶是于1981年从p1噬菌体中发现,属于λint酶超基因家族。cre重组酶基因编码区序列全长1029bp(embl数据库登录号x03453),编码38kda蛋白质。cre重组酶是一种由343个氨基酸组成的单体蛋白。它不仅具有催化活性,而且与限制酶相似,能识别特异的dna序列,即loxp位点,使loxp位点间的基因序列被删除或重组。cre重组酶有70%的重组效率,不借助任何辅助因子,可作用于多种结构的dna底物,如线形、环状甚至超螺旋dna。它是一种位点特异性重组酶,能介导两个loxp位点(序列)之间的特异性重组,使loxp位点间的基因序列被删除或重组。
83.loxp(locus ofx-overp1)序列:来源于p1噬菌体,是有两个13bp反向重复序列和中间间隔的8bp序列共同组成,8bp的间隔序列同时也确定了loxp的方向。cre在催化dna链交换过程中与dna共价结合,13bp的反向重复序列是cre酶的结合域。
84.动物模型
85.人类疾病的动物模型(animal model of human disease)是指各种医学科学研究中建立的具有人类疾病模拟表现的动物,按产生原因分类自发性动物模型和诱发性或实验
性动物模型。
86.自发性动物模型(spontaneous animal models)是指实验动物未经任何有意识的人工处置,在自然情况下所发生的疾病。包括突变系的遗传疾病和近交系的肿瘤疾病模型。利用这类动物疾病模型来研究人类疾病的最大优点,在于疾病的发生、发展与人类相应的疾病很相似,均是在自然条件下发生的疾病,具有更高的应用价值,但是这类模型来源较困难。
87.在本发明中,提供了一种的非人哺乳动物的自发癫痫动物模型,所述动物模型如本发明第五方面所述。
88.具体地,本发明利用基因组具有:(e1)内源的cdkl5基因,和(e2)与cdkl5基因操作性连接的并用于条件敲除cdkl5基因的条件敲除元件(比如cre重组酶靶向序列loxp序列)的小鼠(cdkl5
flox/flox
)与兴奋性神经元细胞特异性cre重组酶表达小鼠(emx1-cre或者camk2α-icre鼠)杂交构建了一个cdkl5在兴奋性神经元细胞中的条件敲除小鼠,在小鼠兴奋性神经元细胞特异性的敲除了cdkl5的表达,使发明人可以在体内水平组织特异性的研究cdkl5在兴奋性神经元细胞中的功能。
89.本发明将具有难治性癫痫表型的cdkl5基因敲除的动物模型为研究对象,通过记录动物(比如小鼠)脑电图的方法判断小鼠癫痫发作的频率,研究小鼠脑病理形态,初步判断药物是否具有抗cdkl5相关的癫痫发作的效果。鉴于cdkl5条件性敲除动物模型的明确的表型优势,本发明的方法可以快速高效的对药物的有效性进行初步评价,进而推动药物的开发和上市。
90.本发明的主要优点包括:
91.(a)本发明首次发现,将兴奋性神经元细胞中的cdkl5进行条件性敲除,可用于制备难治性癫痫的动物模型。
92.(b)本发明的难治性癫痫动物模型可用于抗癫痫药物的筛选。
93.(c)本发明以具有自发难治性癫痫表型的cdkl5基因敲除小鼠为研究对象,通过记录小鼠脑电图的方法判断小鼠癫痫发作的频率,研究小鼠脑病理形态,初步判断药物是否具有抗cdkl5相关的癫痫发作的效果。鉴于cdkl5条件性敲除小鼠的明确的表型优势,此方法可以快速高效的对药物的有效性进行初步评价,进而推动药物的开发和上市。
94.(d)本发明首次发现,兴奋性神经元条件性敲除cdkl5基因的小鼠再现了cdkl5缺乏症患者的难治性癫痫表型,因此使用该方法构建的小鼠模型去开发和筛选疾病治疗药物,将大大提高药物研发效率和准确性,降低临床研究失败的风险。
95.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。本发明中所涉及的实验材料和试剂如无特殊说明均可从市售渠道获得。
96.通用方法
97.1.cdkl5基因相关的癫痫小鼠繁育方法
98.借助于cre-loxp技术,通过cdkl5
flox/flox
鼠(joe zhou实验室赠与)和emx1-cre鼠(购于美国杰克森实验室)或者camk2α-icre鼠(德国癌症研究中心赠与)交配繁殖得到本发
明的条件性敲除鼠。将适龄的雌性cdkl5
flox/flox
鼠与雄性特异性表达cre重组酶的雄鼠交配产生在兴奋性神经元中敲除cdkl5基因的条件性敲除小鼠,待其成年后可用于观察癫痫的发生和抗癫痫药物的筛选。
99.2.脑电图准确记录癫痫发作频率的方法
100.通过手术将自制电极安装于小鼠软脑膜上方,待小鼠恢复一周后,将其连接到长时间脑电记录系统,对小鼠的脑电活动情况进行24小时监控。根据脑电图判断小鼠癫痫的频率,比较给药前后小鼠发作的频率,判断药物对于难治性癫痫的治疗效果。
101.3.timm染色法判断小鼠发作过癫痫的方法
102.发生了癫痫的cdkl5条件性敲除小鼠的颗粒细胞轴突纤维在齿状回内分子层呈带状分布,通过该方法判断药物治疗是否能够阻止癫痫的发生过程。
103.实施例1制备癫痫发作小鼠
104.将适龄的雌性cdkl5
flox/flox
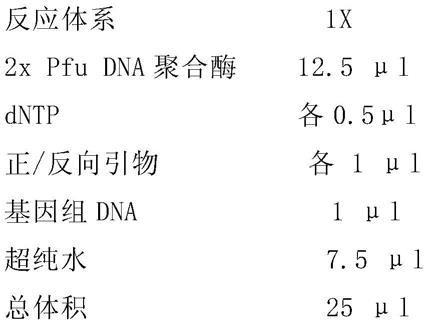
鼠与雄性特异性表达cre重组酶的雄鼠交配,待仔鼠出生七天后剪脚趾进行编号,取其尾巴约3毫米,进行基因型鉴定。将小鼠尾巴浸没于150ul的鼠尾裂解液(含2ul 5%的蛋白酶k溶液)中,55℃孵育过夜;将装裂解液的离心管置于95℃的金属浴上加热15min;待冷却至室温后,12000rpm/min离心5min;取上清用于pcr鉴定基因型。配制pcr反应体系,配方如下:
[0105][0106]
pcr循环条件为:
[0107]
95℃15s,60℃15s,72℃45s,进行35个循环。
[0108]
pcr产物和2x的上样缓冲液混匀后加到1.5%的琼脂糖凝胶中,120mv恒压电场中电泳35min,在凝胶成像仪中观察结果并拍照。根据凝胶电泳结果鉴定出在兴奋性神经元中敲除cdkl5基因的条件性敲除小鼠,待其成年后可用于观察癫痫的发生和抗癫痫药物的筛选。
[0109]
emx1-cre在小鼠胚胎12.5天时在前脑兴奋性神经元细胞中介导loxp的重组,而camk2α-icre从小鼠出生后开始在兴奋性神经元细胞中特异性敲除目的基因。
[0110]
通过长时间录像,观察到emx1-cre驱动的cdkl5条件性敲除小鼠从2个月开始陆续产生了自发癫痫的症状,根据racine癫痫分级标准,明显可见小鼠癫痫由低级向高级的发展(图1a)。进一步统计发现80%的emx1-cre介导的条件性敲除鼠(n=15)表现出癫痫大发作的症状(图1b),癫痫发作的频率在1-23次/天(图1c)。而由camk2α-icre驱动的cdkl5条件敲除鼠(n=15)中有66.7%产生了癫痫大发作(图1b),发作频率在0-3次/天(图1c),甚至直接导致小鼠死亡。说明通过兴奋性神经元敲除小鼠cdkl5基因的方法可以产生有难治性癫
痫发作的小鼠。
[0111]
但是,vgat-cre介导的抑制性神经元特异性敲除cdkl5基因的小鼠和cdkl5全身敲除小鼠在6个月之前并没有观察到癫痫的发生(图1b),说明在胚胎发育的早期很可能存在cdkl5的代偿机制。
[0112]
实施例2eeg记录的方式准确判断转基因小鼠癫痫发作频率
[0113]
通过手术将自制电极安装于小鼠软脑膜上,在手术中,用1.5%的异氟醚将小鼠麻醉,并放置在立体定位以上,使其颅骨处于水平的位置。自制电极由两个不锈钢螺钉(直径1mm)组成,作为脑电记录电极,根据小鼠脑图谱确定插入颅骨的位置(以前囟为原点的坐标:前后+1.0mm,中外侧+1.5mm和前后-3.2mm,中外侧+1.5mm)。两根绝缘银丝(coonerwire,#as633)作为肌电记录电极,分别放置于两侧的斜方肌中。电极连接于迷你的连接器上,并用牙科水泥固定在颅骨上。然后手术缝合线将小鼠的皮肤缝上,减少与外界的直接接触,然后将小鼠放到温暖的环境中,直到它们恢复正常活动。
[0114]
待小鼠恢复一周后,将其连接到长时间脑电记录系统(图2),先让小鼠连续适应两天,然后对小鼠的脑电活动情况进行24小时监控。同步记录自由运动小鼠脑电图和肌电图的时候对小鼠的活动进行录像。该套长时间脑电记录系统包括:双通道放大器(a-m systems,model 1800),数模转换器(ced ltd.,micro1401mkⅱ)和spike2软件(ced ltd.)。
[0115]
根据脑电图判断小鼠癫痫的频率,比较给药前后小鼠发作的频率,判断药物对于难治性癫痫的治疗效果。图3显示了癫痫发作时的脑电图,图4为某药物在给药前后小鼠癫痫频率的变化。
[0116]
实施例3timm染色的方法确定小鼠发生了cdkl5相关的癫痫
[0117]
海马齿状回的苔藓纤维出芽是边缘系统癫痫患者和小鼠的一个特征性的形态学改变。对发生了癫痫的cdkl5条件性敲除小鼠海马切片进行timm染色,发现其颗粒细胞轴突纤维在齿状回内分子层呈带状分布(图5,b-b’),而未发生癫痫的对照小鼠(图5,a-a’、c-c’、e-e’)和vgat-cre介导的cko小鼠(图5,d-d’)、cdkl5全身敲除小鼠(图5,f-f’)均未出现颗粒细胞轴突纤维投射到齿状回内分子层的现象。统计结果也显示emx1-cre介导的cdkl5条件敲除导致的颗粒细胞异位投射现象与对照组相比具有显著的统计学差异(图5g)。因此,可以通过该方法去判断药物治疗是否可以阻止兴奋性神经元细胞中敲除cdkl5的小鼠癫痫的发生过程。
[0118]
首先用8%水合氯醛通过腹腔注射麻醉小鼠,再依次用1xpbs缓冲液、硫化物溶液(1.2%(wt/vol)na2s
·
9h2o、1%(wt/vol)nah2po4蒸馏水)和4%多聚甲醛经心脏灌注小鼠。然后取出小鼠脑放入4%pfa中后固定过夜,15%和30%蔗糖梯度脱水后进行冰冻切片。将鼠脑进行水平切片,脑片厚度为30um。随后把脑片贴于载玻片上,晾干。经梯度乙醇复水后,用阿拉伯树胶(50%,wt/vol)、对苯二酚(5.67%,wt/vol)、柠檬酸-柠檬酸钠缓冲液(ph=3.6)和硝酸银(17%,wt/vol)以体积比为12:6:2:1的混合溶液处理脑片,在室温避光的条件下放置45分钟。待脑片明显着色后用梯度乙醇脱水,二甲苯透明后用中性树胶封片并晾干。使用奥林巴斯vs120显微镜拍摄明场图像,然后在image j软件中对染色进行量化,并使用timm指数(timm颗粒总面积除以齿状回长度)评估苔藓纤维出芽程度。对于每只动物,timm指数为至少三张邻近脑片计算值的平均值。
[0119]
对比例
[0120]
用本发明的实施例的方法,区别在于,借助于生殖细胞表达cre重组酶的雄鼠和雌性cdkl5
flox/flox
鼠交配产生了cdkl5全身性敲除小鼠。
[0121]
结果表明,该小鼠癫痫症状不明显,在六个月之前,没有出现典型的大发作的行为,也没有检测大脑的癫痫样放电。
[0122]
讨论
[0123]
根据已有研究报道和本实验室最近的研究结果,全身性敲除cdkl5的模型会出现明显的基因代偿作用,使cdkl5敲除小鼠无法表现出明显的癫痫症状。虽然有报道称在老年的雌性杂合子小鼠中可以记录到小鼠痉挛,但该模型小鼠缺乏高振幅和高频率的癫痫样放电,而且发作时间较晚,不适合用来筛选抗癫痫药物。而本发明中的兴奋性神经元细胞特异性敲除cdkl5后,小鼠能够从3个月开始产生典型的癫痫样行为和癫痫样脑电波,因此,比较适合用于难治性癫痫药物的筛选,这是本发明的一个重要应用方向。
[0124]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1