一种临床用NK细胞冻存液及冻存方法与流程
一种临床用nk细胞冻存液及冻存方法
技术领域
[0001]
本发明涉及细胞冻存技术领域,具体涉及一种临床用nk细胞冻存液及冻存方法。
背景技术:
[0002]
自然杀伤力细胞(natural killer cell,nk)是淋巴细胞的一种,来源于cd34
+
造血祖细胞,通过调节树突状细胞(dendritic cells,dcs)实现关键的免疫调节功能。nk细胞作为免疫细胞具有抵御病毒入侵及肿瘤杀伤的作用,是人体防御肿瘤的第一道防线,在过继免疫治疗恶性肿瘤中具有良好的应用前景。然而在外周血中占有很小比较,占淋巴细胞5%~15%,并且肿瘤患者体内nk细胞的功能存在不同程度的缺失,难以产生良好抗肿瘤效果。因此nk细胞成为常见的免疫细胞治疗种类之一。现阶段,nk细胞主要由外周单个核细胞通过体外诱导和扩增培养获得。在临床治疗肿瘤(如白血病,淋巴瘤和黑色素瘤)中取得很好的效果。然而关于nk细胞的长期有效储存始终是一个问题。
[0003]
低温贮藏技术是在超低温(-198℃的液氮中)冷冻保存活细胞,使控制细胞生长代谢的酶活性受到抑制,降低细胞的代谢速度,减缓细胞内在的生化反应,从而保持细胞活性延长细胞保存年限。根据冷冻保存的技术差异以及细胞冷冻保存的方式,细胞冷冻方法主要分为慢速冷冻和快速冷冻。慢速冷冻也称慢速程序化冷冻,是指将细胞置于冷冻保护剂中,利用程序冷冻仪或不同温差的冰箱实现分阶段降温。该技术的原理首先是利用细胞外溶液中的水分结冰使溶液的浓度升高,细胞内的水分透过细胞膜向外渗出,细胞体积收缩,细胞内液的浓度与渗透压增加,使冰点下降。快速冷冻法如常用的玻璃化冷冻技术,是指将高浓度的冷冻保护剂在超低温环境下迅速凝固,形成不规则的玻璃化样固体。保存了细胞在液态时正常分子和离子分子,对细胞结构及胞内组分起到保护作用,实现低细胞损伤冷冻保存。快速冷冻过程中添加的高浓度冷冻保护剂本身具有较大的细胞毒性作用,会造成一定的细胞损伤。
[0004]
无论是快速冷冻还是慢速冷冻,均需要冷冻保护剂。一般而言,冷冻保护剂分为渗透性和非渗透性两种。它们均可降低溶液冰点和电解质浓度,减少冰晶的形成。渗透性的冷冻保护剂一般是小分子物质,主要由二甲基亚砜(dmso)、甘油(gly)、甲醇(meth)、乙二醇(ge)、丙二醇(pg)、二甲基甲酰胺(dmf)和二甲基乙酰胺(dma)等。其渗透(平衡)到胞内的时间因冷冻材料和冷冻保护剂种类而不同。渗透性保护剂经常被用来增强膜流动性并使细胞部分脱水,导致凝固点降低,减少细胞内冰晶形成数量和大小。然而,渗透性的冷冻保护剂本身对细胞具有毒性作用,具体应用需要对特定保存对象进行技术优化。非渗透性冷冻保护剂也称膜外保护剂,如果糖(fructose)、蔗糖(sucrose,suc)、海藻糖(trehalose,tre)蜂蜜和一些高分子化合物,如聚乙烯吡咯酮(polyvinylpyrrolidone,pvp)、右旋糖酐(dextran)、卵黄(yolk)、白蛋白(alubumin)等。这类物质不能穿过细胞膜,其作用是通过维持细胞膜的稳定来保护细胞。非渗透性冷冻保护剂能够提高细胞外渗透压,在冷冻过程中使细胞内的水分快速向细胞外渗出,减少细胞内水分,从而减少细胞内冰晶形成,保护细胞免遭因冰晶形成而造成的机械损伤。另外,在冷冻细胞复温时,由于非渗透性保护剂在细胞
外液形成的高渗浓度,可以有效防止水分快速进入细胞引起的肿胀破坏细胞的冷冻保存。
[0005]
现有的细胞冻存保护剂一般采用渗透性保护剂(dmso、甘油、胎牛血清)或渗透保护剂联合非渗透保护剂(dmso、羟乙基淀粉、胎牛血清),一般而言冷冻保护剂都离不开胎牛血清。在临床治疗使用中,一般会采用患者自体血清来代替胎牛血清,或加上一些抗氧化剂(如vc)来增加细胞膜的抗氧化能力,以此达到保护细胞的目的。但是dmso剂量较大时对人体、对细胞均有害,若想要去除dmso只能对冻存复苏的细胞进行洗涤,不仅操作繁琐,而且在操作过程中将会损失大量的细胞。而人自体血清来源有限,无法满足大批量的生产所需,若以胎牛血清代替,将会增加动物源成分的引入,增加病毒感染的风险。
技术实现要素:
[0006]
本发明根据现有技术存在的问题提供一种临床安全性高,又能很好的保持冻存细胞活性和杀伤能力的临床用nk细胞冻存液及冻存方法。
[0007]
本发明采用的技术方案是:
[0008]
一种临床用nk细胞冻存液,按体积百分比包括以下组分:
[0009]
二甲基亚砜3%~10%、甘油2%~4%、右旋糖酐13%~20%、聚乙烯吡咯烷酮0.1%~0.2%、n-乙酰半胱氨酸5%~10%、葡萄糖溶液60%~70%;其中葡萄糖溶液为医用级葡萄糖与医用级纯水复配而成;葡萄糖溶液中葡萄糖的质量浓度为5wt%。
[0010]
进一步的,所述右旋糖酐为右旋糖酐40氯化钠注射液。
[0011]
进一步的,所述聚乙烯吡咯烷酮为医用级聚乙烯吡咯烷酮k15。
[0012]
进一步的,按体积百分比包括以下组分:
[0013]
二甲基亚砜5%、甘油3%、右旋糖酐15%、聚乙烯吡咯烷酮0.1%、n-乙酰半胱氨酸8%、葡萄糖溶液68.9%。
[0014]
一种临床用nk细胞冻存液的nk细胞冻存方法,包括以下步骤:
[0015]
步骤1:将甘油、右旋糖酐、聚乙烯吡咯烷酮、n-乙酰半胱氨酸、葡萄糖、部分水充分混合均匀配置为a液;
[0016]
步骤2:将二甲基亚砜加入与剩余水,配置为b液;
[0017]
步骤3:将步骤1、步骤2得到的a液和b液均避光置于2℃~8℃保存30min;
[0018]
步骤4:将步骤3得到的a液和b液混匀,加入nk细胞,细胞密度为1
×
106cells/ml~8
×
107cells/ml;
[0019]
步骤5:将步骤4得到的细胞悬液避光静置4℃~6℃条件下静置8min,然后降温,降温完成后转移至液氮中保存。
[0020]
进一步的,所述步骤4中细胞密度为8
×
107cells/ml。
[0021]
进一步的,所述步骤4中的nk细胞为处理后的细胞,处理过程如下:将nk细胞悬液离心后弃上清液得到所需nk细胞。
[0022]
进一步的,所述步骤5中降温程序可以采用程序降温盒置于-80℃进行,也可以采用程序降温仪进行。
[0023]
进一步的,所述步骤1和步骤2中水的体积比为1:1
[0024]
本发明的有益效果是:
[0025]
(1)本发明成分明确,不含动物源成分,不存在引入动物源抗原的风险;
[0026]
(2)本发明所使用成分含量均在各自临床不良反应浓度之下,在使用时,可直接用于静脉注射使用;
[0027]
(3)本发明中dmso含量较低,该含量无论对人体亦或冻存的细胞的毒性大大降低,更加安全;
[0028]
(4)本发明能够较好的保持冻存细胞活性和杀伤能力,减少了冻存过程中对细胞造成的损伤。
[0029]
(5)本发明渗透性保护剂和非渗透保护剂联合运用,在冻存时,可从内外兼顾的保护细胞,减少其冰晶的机械损伤,亦可保护细胞复苏过程所受机械损伤;
[0030]
(6)本发明制备方法中首先将甘油、右旋糖酐、聚乙烯吡咯烷酮、n-乙酰半胱氨酸、葡萄糖、部分水混合均匀,然后将dmso和剩余水混合;最后将两种溶液混合;这种制备方法,可以避免dmso和其他成分同时加入,形成沉淀继而影响冻存效果;
[0031]
(7)本发明冻存液中加入一定量的n-乙酰半胱氨酸可有效防止细胞内活性氧自由基过量,破坏细胞质膜和dna的完整性。此外,当复苏细胞出现氧化应激反应时,n-乙酰半胱氨酸可作为一种抗氧化剂,提供还原性谷胱甘肽,以达到保护细胞作用。n-乙酰半胱氨酸还具有很强的杀菌活性,可显著破坏常见临床的致病菌的菌膜,包括假单胞菌、金黄色葡萄球菌、肠球菌、肠杆菌等等;更有利于临床使用。
附图说明
[0032]
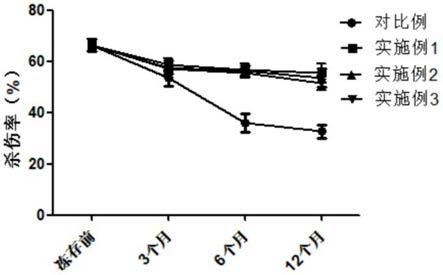
图1为本发明实施例和对比例得到的冻存液对细胞杀伤率图。
具体实施方式
[0033]
下面结合附图和具体实施例对本发明做进一步说明。
[0034]
一种临床用nk细胞冻存液,按体积百分比包括以下组分:
[0035]
二甲基亚砜3%~10%、甘油2%~4%、右旋糖酐13%~20%、聚乙烯吡咯烷酮0.1%~0.2%、n-乙酰半胱氨酸5%~10%、葡萄糖溶液60%~70%;其中葡萄糖溶液为医用级葡萄糖与医用级纯水复配而成;葡萄糖溶液中葡萄糖的质量浓度为5wt%。
[0036]
各组分优选为:
[0037]
二甲基亚砜5%、甘油3%、右旋糖酐15%、聚乙烯吡咯烷酮0.1%、n-乙酰半胱氨酸8%、葡萄糖溶液68.9%。
[0038]
右旋糖酐为右旋糖酐40氯化钠注射液。聚乙烯吡咯烷酮为医用级聚乙烯吡咯烷酮k15。
[0039]
一种临床用nk细胞冻存液的nk细胞冻存方法,包括以下步骤:
[0040]
步骤1:将甘油、右旋糖酐、聚乙烯吡咯烷酮、n-乙酰半胱氨酸、葡萄糖、部分水充分混合均匀配置为a液;
[0041]
步骤2:将二甲基亚砜加入与剩余水,配置为b液;
[0042]
步骤3:将步骤1、步骤2得到的a液和b液均避光置于2℃~8℃保存30min;
[0043]
步骤4:将步骤3得到的a液和b液混匀,加入nk细胞,细胞密度为1
×
106cells/ml~8
×
107cells/ml;细胞密度优选为8
×
107cells/ml。
[0044]
步骤5:将步骤4得到的细胞悬液避光静置4℃~6℃条件下8min,降温、降温完成后
转移至液氮中保存;降温程序可以采用程序降温盒置于-80℃进行,也可以采用程序降温仪进行。
[0045]
实施例1
[0046]
按照以下步骤制备临床用nk细胞冻存液:
[0047]
步骤1:按照体积比称取下述各组分:甘油3%、右旋糖酐15%、聚乙烯吡咯烷酮0.1%、n-乙酰半胱氨酸8%、葡萄糖溶液和一半水,充分混合均匀后得到a液;
[0048]
步骤2:将dmso和剩余水,充分混合均匀得到b液。
[0049]
步骤3:将步骤1、步骤2得到的a液和b液均避光置于2℃保存30min。
[0050]
步骤4:将步骤3得到的a液和b液混匀,加入nk细胞,轻轻吹打至细胞悬液密度为8
×
107cells/ml;nk细胞处理过程如下:将nk细胞悬液300g离心8min,弃上清。
[0051]
步骤5:将步骤4细胞悬液避光静置4℃条件下静置8min,然后进行降温,降温完成后转移至液氮中保存。
[0052]
转移至程序降温盒中,置于-80℃,按特定程序进行降温,降温完成后转移至液氮长期保存。
[0053]
实施例2
[0054]
按照以下步骤制备临床用nk细胞冻存液:
[0055]
步骤1:按照体积比称取下述各组分:甘油3%、右旋糖酐15%、聚乙烯吡咯烷酮0.1%、n-乙酰半胱氨酸8%、葡萄糖溶液和一半水,充分混合均匀后得到a液;
[0056]
步骤2:将dmso和剩余水,充分混合均匀得到b液。
[0057]
步骤3:将步骤1、步骤2得到的a液和b液均避光置于8℃保存30min。
[0058]
步骤4:将步骤3得到的a液和b液混匀,加入nk细胞,轻轻吹打至细胞悬液密度为1
×
107cells/ml;nk细胞处理过程如下:将nk细胞悬液300g离心8min,弃上清。
[0059]
步骤5:将步骤4细胞悬液避光静置6℃条件下静置8min,然后进行降温,降温完成后转移至液氮中保存。
[0060]
转移至程序降温盒中,置于-80℃,按特定程序进行降温,降温完成后转移至液氮长期保存。
[0061]
实施例3
[0062]
按照以下步骤制备临床用nk细胞冻存液:
[0063]
步骤1:按照体积比称取下述各组分:甘油3%、右旋糖酐15%、聚乙烯吡咯烷酮0.1%、n-乙酰半胱氨酸8%、葡萄糖溶液和一半水,充分混合均匀后得到a液;
[0064]
步骤2:将dmso和剩余水,充分混合均匀得到b液。
[0065]
步骤3:将步骤1、步骤2得到的a液和b液均避光置于6℃保存30min。
[0066]
步骤4:将步骤3得到的a液和b液混匀,加入nk细胞,轻轻吹打至细胞悬液密度为8
×
107cells/ml;nk细胞处理过程如下:将nk细胞悬液300g离心8min,弃上清。
[0067]
步骤5:将步骤4细胞悬液避光静置4℃条件下静置8min,然后进行降温,降温完成后转移至液氮中保存。
[0068]
转移至程序降温盒中,置于-80℃,按特定程序进行降温,降温完成后转移至液氮长期保存。
[0069]
对比例
[0070]
步骤1:按照体积比称取下述各组分并混合均匀:dmso 10%、fbs 20%、基础培养基70%,充分混合均匀得到冻存液。
[0071]
步骤2:配置完成后,将所配置好的保存剂避光置于冰箱中冷冻保存30min;,冰箱温度为2℃。
[0072]
步骤3:冷冻完成后,将冻存液加入处理好的nk细胞中,轻轻吹打至细胞悬液密度为8
×
107cells/ml;nk细胞处理过程如下:将nk细胞悬液300g离心8min,弃上清。
[0073]
步骤4:将步骤3得到的冻存液吹打均匀后避光静置冰箱内8min,冰箱温度设置为4℃。
[0074]
转移至程序降温盒中降温,按特定程序进行降温,降温完成后转移至液氮长期保存。
[0075]
一段时间后测试对比例和实施例1、实施例2、实施例3中nk细胞的存活率及对k562杀伤能力,结果如表1和表2所示。
[0076]
nk细胞冻存前后活率检测方法如下:
[0077]
将冻存前和复苏后的nk细胞进行染色后,用细胞计数仪进行细胞计数,计算出细胞活率。结果如表1所述。
[0078]
nk细胞冻存前后杀伤能力检测
[0079]
将冻存前后的培养后的nk细胞进行杀伤活性的检测,采用7aad/cfse标记法。以k562细胞为靶细胞,分别检测各组冻存前后的nk细胞,即效应细胞的杀伤活力(效靶比为20:1,设3个平行对照孔,在37℃,5%浓度co2培养箱3h后进行流式检测分析),结果见表2。
[0080]
表1.细胞活率对比表(%)
[0081][0082]
表2.细胞杀伤率对比表(%)(20:1)
[0083][0084]
从表1可以看出,各组细胞活率较之初始数据均有下降,单每时间段实验组细胞活率均高于对照组。随着时间推移,12月的数据显示,本发明冻存液冻存的细胞复苏后活率仍在94%左右,而对照组活率明显不如。本发明冻存液与对比例冻存保护剂相比,本发明冻存
液复苏的nk细胞明显具有更高的活率。
[0085]
从表2可以看出,在各组nk细胞对k562细胞的杀伤能力(效靶比20:1),本发明冻存液复苏的nk细胞与冻前的杀伤能力无明显差异。而对照组在同样的效靶比之下,杀伤能力较之冻存前降低了一倍左右。说明本发明冻存液复苏后对nk细胞杀伤活力影响较小。与对比例冻存液相比本发明冻存液复苏的nk细胞保留了较高的杀伤能力。
[0086]
本发明以dmso和甘油作为渗透性保护剂,以右旋糖酐40和聚乙烯吡咯烷酮作为非渗透性保护剂。渗透性保护剂可增强细胞膜流动性并使细胞部分脱水,导致凝固点降低,减少细胞内冰晶形成数量和大小,甘油和dmso联合使用可一定程度上减少dmso含量,而不影响冻存效果。因为dmso在常温对细胞毒性较大,对人体毒性较大。非渗透性保护剂,可有效提高细胞外渗透压,减少细胞内水分,从而减少细胞内冰晶形成,保护细胞免遭因冰晶形成造成的机械损伤。此外,在细胞复苏时,由于非渗透性保护剂在细胞外液形成的高渗浓度,还可有效防止水分快速进入细胞引起的肿胀破坏细胞的冷冻保存。渗透性保护剂和非渗透保护剂联合运用,在冻存时,可从内外兼顾的保护细胞,减少其冰晶的机械损伤,亦可保护细胞复苏过程所受机械损伤。冻存液中加入一定量的n-乙酰半胱氨酸可有效防止细胞内活性氧自由基过量,破坏细胞质膜和dna的完整性。此外,当复苏细胞出现氧化应激反应时,n-乙酰半胱氨酸可作为一种抗氧化剂,提供还原性谷胱甘肽,以达到保护细胞作用。同时,n-乙酰半胱氨酸还具有很强的杀菌活性,可显著破坏常见临床的致病菌的菌膜,包括假单胞菌、金黄色葡萄球菌、肠球菌、肠杆菌等等。葡萄糖溶液可为细胞在冻存和复苏过程中,由于外界变化所导致能量消耗提供养料,本发明成分简单、操作便捷,临床安全性高,同时又能很好的保持冻存细胞活性和杀伤能力,减少冻存过程中对细胞造成的损伤。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1