一种建立具有EMT特征的良性前列腺增生BPH犬模型的方法与流程
一种建立具有emt特征的良性前列腺增生bph犬模型的方法
技术领域
[0001]
本发明属于动物模型和医疗评价领域,具体地,涉及一种建立具有emt特征的良性前列腺增生bph犬模型的方法。
背景技术:
[0002]
良性前列腺增生(benign prostatic hyperplasia,bph)是前列腺的一种良性病变,常见于40岁以上的中老年男性,临床症状多见排尿障碍,男性随着年龄的不断增长,患病率呈明显上升趋势,大约有一半超过50岁的男性会出现临床症状。前列腺由于其特殊的生理位置,增生后会挤压尿道,引起排尿障碍等一系列的临床表现如:尿流细弱、尿频、尿急、尿滴沥、尿不尽、尿等待等,给患者的工作和生活带来了严重的影响,尤其是在不重视及时治疗的情况下还会引起一系列严重的并发症,严重影响生殖健康及生活质量。
[0003]
bph是一种由多因素参与的发病机制复杂的疾病,目前为止其病因及确切发病机制仍未完全阐明。关于bph的病因学假说有雌雄激素协同作用学说、衰老学说、胚胎再唤醒学说、上皮-间质相互作用学说、炎症因子和生长因子发病理论以及干细胞学说等
[1]
,这些学说尚不能完全阐明bph的发生机理。其原因在于缺乏和人类前列腺增生疾病相吻合的动物和体外模型。
[0004]
业已证实年龄的增长和正常功能睾丸的存在,是前列腺增生发病的必备条件。目前的研究表明只有犬、猩猩、狒狒和人类一样,随着年龄的增长可以自发前列腺增生,因此针对这些动物尤其是犬,建立和人类前列腺增生特征相似的bph模型十分重要。然而,目前缺少这方面的系统性研究。
技术实现要素:
[0005]
为了解决上述技术问题,发明人采用不同年龄段(青年、中年和老年)的beagle犬,系统性构建和人类前列腺增生相似的老年犬自发bph模型;采用成年beagle犬去势后给予1:100比例的雌/雄激素,在缩短诱导给药周期的同时建立与犬自发bph模型相同的bph模型从而完成本发明。
[0006]
本发明采用的技术方案如下:
[0007]
本发明提供一种建立具有emt特征的良性前列腺增生bph犬模型的方法,所述bph犬模型是指自发bph犬模型和诱导bph犬模型,其中,
[0008]
建立自发bph犬模型的步骤包括:
[0009]
(1)选择年龄大于9岁的犬;
[0010]
(2)测定所述犬的前列腺指数、外周血激素水平;
[0011]
当前列腺指数大于预设域值和/或外周血激素水平大于或小于预设域值,表示所述犬为自发bph犬模型,
[0012]
建立诱导bph犬模型的步骤包括:
[0013]
(1)选择年龄在12~15月龄的犬;
[0014]
(2)适应性饲养7天后,对所述犬进行去势手术;
[0015]
(3)去势手术第8天,肌肉注射给予比例为1:100的雌雄激素,给药体积为0.1ml/kg体重;
[0016]
(4)每天给药一次,10天后,即得到诱导bph犬模型。
[0017]
进一步地,建立诱导bph犬模型的步骤进一步包括测定所述犬的前列腺指数、外周血激素水平的步骤,当前列腺指数大于预设域值和/或外周血激素水平大于或小于预设域值,表示所述犬为诱导bph犬模型。
[0018]
进一步地,所述预设域值是根据正常犬群体的相应数据获得的。在本发明的一些实施方案中,所述预设域值为正常犬群体相应数据的平均值、中位值、1/4分位数、3/4分位数、众数等具有统计学意义的数值。
[0019]
进一步地,所述前列腺指数指前列腺体积。在本发明的一些实施方案中,利用高分辨率小动物超声系统对犬的前列腺上下径、左右径和前后径进行测量,计算前列腺体积,优选地,所述前列腺体积=上下径
×
左右径
×
前后径
×
π/6。
[0020]
在本发明的一些实施方案中,所述前列腺体积的域值为正常犬群体前列腺指数的3倍以上。在本发明的一些优选的实施方案中,所述前列腺体积的域值为正常犬群体前列腺指数的4倍以上。例如,正常犬群体前列腺体积为6cm3,则预设域值为24cm3。
[0021]
进一步地,所述外周血激素水平包括睾酮水平、双氢睾酮水平、雌二醇水平和/或睾酮/雌二醇比值。更近一步地,所述外周血激素水平是指睾酮/雌二醇比值。
[0022]
更进一步地,建立自发bph犬模型和诱导bph犬模型的步骤均包括检测了emt相关标志蛋白β-catenin和sma的表达情况的步骤。
[0023]
前列腺增生模型内对应的上皮细胞标志诸如上皮细胞钙粘蛋白(e-cadherin)、连环蛋白(β-catenin)和桥连蛋白(desmoplakin)的表达下调或缺失以及间质细胞标志蛋白n-cadherin、vimentin、fibronectin等表达上调涉及到一种生物学过程-emt,即上皮细胞-间充质转化,是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。emt可导致细胞间的粘附性降低,上皮细胞极性丧失,细胞外基质受到破坏进而造成细胞运动能力增强和细胞迁移的发生。正是由于emt的发生,导致上皮细胞向间质细胞转化,间质样细胞一定程度的堆积形成了以间质增生为主要特征的前列腺增生。
[0024]
在本发明中,所述犬为国际上公认的进行科学研究的纯种犬科动物beagle犬。
[0025]
本发明的有益效果
[0026]
相对于现有技术,本发明具有以下有益效果:
[0027]
在哺乳动物中,只有犬科动物以及部分非人灵长类动物可以和人一样在睾丸功能正常的情况下,随着年龄的增加而自发前列腺增生。犬自发bph模型作为一种不经过人工干预而自然发生的一种疾病模型,可以模拟人类自然生活状态下的前列腺增生疾病的发生、发展,同时由于其和人类的bph发病机制有一定的相似性,因此成为一种研究bph机制的理想模型。
[0028]
本发明利用国际公认的纯种beagle犬,首次系统性建立符合glp规范的,稳定的具有emt特征的犬自发bph模型和犬诱导bph模型,具有重要的研究和临床应用价值。
附图说明
[0029]
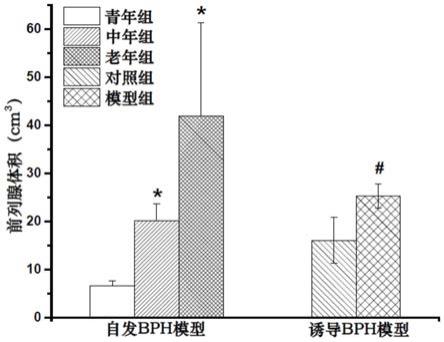
图1示出了自发bph和诱导bph模型beagle犬前列腺体积(n=3)。注:与青年组比较,*p<0.05;与对照组比较,#p<0.05。
[0030]
图2示出了自发bph和诱导bph模型beagle犬前列腺脏器重量结果(n=3)。
[0031]
图3示出了自发bph和诱导bph模型beagle犬前列腺脏体比结果(n=3)。注:与对照组比较,#p<0.05。
[0032]
图4示出了自发bph和诱导bph模型beagle犬前列腺脏脑比结果(n=3)。
[0033]
图5示出了自发bph和诱导bph模型beagle犬激素(外周血)睾酮含量(n=3)。
[0034]
图6示出了自发bph和诱导bph模型beagle犬激素(外周血)双氢睾酮含量(n=3)。
[0035]
图7示出了自发bph和诱导bph模型beagle犬激素(外周血)雌二醇含量(n=3)。
[0036]
图8示出了自发bph和诱导bph模型beagle犬激素(外周血)睾酮/雌二醇比值(n=3)。
[0037]
图9示出了自发bph和诱导bph模型beagle犬激素(组织)睾酮含量(n=3)。
[0038]
图10示出了自发bph和诱导bph模型beagle犬激素(组织)双氢睾酮含量(n=3)。
[0039]
图11示出了自发bph和诱导bph模型beagle犬激素(组织)雌二醇含量(n=3)。
[0040]
图12示出了自发bph和诱导bph模型beagle犬激素(组织)睾酮/雌二醇比值(n=3)。
[0041]
图13示出了自发bph和诱导bph模型beagle犬前列腺病理学检查结果。
[0042]
图14示出了自发bph和诱导bph模型beagle犬前列腺masson染色结果。
[0043]
图15示出了自发bph和诱导bph模型beagle犬前列腺上皮高度结果。
[0044]
图16示出了自发bph和诱导bph模型beagle犬前列腺上皮高度结果(n=3)。注:与青年组比较,
**
p<0.01;与对照组比较,
##
p<0.01。
[0045]
图17示出了自发bph模型beagle犬前列腺上皮间质面积结果(n=3)。注:与青年组比较,
*
p<0.05。
[0046]
图18示出了诱导bph模型beagle犬前列腺上皮间质面积结果(n=3)。注:与对照组比较,
#
p<0.05。
[0047]
图19示出了自发bph和诱导bph模型beagle犬免疫组化检测β-catenin结果(n=3)。
[0048]
图20示出了自发bph和诱导bph模型beagle犬免疫组化检测sma结果(n=3)。
[0049]
图21示出了自发bph和诱导bph模型beagle犬免疫组化检测firbronectin结果(n=3)。
[0050]
图22示出了自发bph和诱导bph模型beagle犬β-catenin免疫组化半定量分析(n=3)。。注:与青年组比较,
*
p<0.05,
**
p<0.01;与对照组比较,
#
p<0.05,
##
p<0.01。
[0051]
图23示出了自发bph和诱导bph模型beagle犬sma免疫组化半定量分析结果(n=3)。注:与青年组比较,
*
p<0.05,
**
p<0.01;与对照组比较,
#
p<0.05,
##
p<0.01。
[0052]
图24示出了自发bph和诱导bph模型beagle犬firbronectin免疫组化半定量分析结果(n=3)。注:与青年组比较,
*
p<0.05,
**
p<0.01;与对照组比较,
#
p<0.05,
##
p<0.01。
具体实施方式
[0053]
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
[0054]
实施例
[0055]
以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
[0056]
除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
[0057]
那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
[0058]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
[0059]
实施例1bph犬模型的建立方法
[0060]
1、待建模动物
[0061]
(1)种:犬;
[0062]
(2)系:beagle;
[0063]
(3)性别和数量
[0064]
①
自发bph模型:9~12月、5~7岁和9~11岁龄的beagle犬(分别代表青年、中年和老年犬)各3只;
[0065]
②
诱导bph模型:12~15月龄的beagle犬各3只(对照组和模型组)。
[0066]
(4)模型动物选择说明
[0067]
①
在哺乳动物中,只有犬科动物以及部分非人灵长类动物可以和人一样在睾丸功能正常的情况下,随着年龄的增加而自发前列腺增生。
[0068]
②
临床上前列腺增生多发于40岁以上的男性(相当于犬6岁龄),50岁时有临床症状的bph发病率为50%,年龄每增加10岁发病率递增10%。80岁的男性bph发病率可达90%以上。
[0069]
③
正常犬的前列腺随着年龄的增长不断发育,2岁龄(相当于人24岁)时达到最大,但2岁龄犬病理组织学检查可见40%自发前列腺增生,7岁龄(相当于人45岁)时前列腺增生的发病率接近100%。
[0070]
2、建模方法
[0071]
2.1分组
[0072]
采用高分辨率小动物超声系统对beagle犬的前列腺上下径、左右径和前后径进行
测量,计算前列腺体积。根据前列腺的体积和动物年龄选择15只合适的动物,分别为自发bph模型:青年组(9~12月)、中年组(5~7岁)和老年组(9~11岁);诱导bph模型:正常对照组和模型组(均为12~15月)。每组3只。
[0073]
2.2去势
[0074]
诱导bph模型的模型组3只动物在适应性饲养7天后,以3%戊巴比妥钠按1.0ml/kg体重麻醉,无菌条件下行阴囊途径对模型组动物进行去势手术:轻轻拉动睾丸周围的脂肪,暴露出睾丸和附睾,从输精管处结扎,完整地切除双侧睾丸和附睾,缝合。
[0075]
2.3给药
[0076]
针对诱导bph模型组的6只动物:模型组去势手术后第8天,肌肉注射给予比例为1:100的雌雄激素,给药体积为0.1ml/kg体重;正常对照组肌肉注射相同给药体积的药用级玉米油,每天给药一次,给药10天。
[0077]
2.4一般状况观察
[0078]
实验开始前动物检疫并适应性饲养7~14天,期间每天至少观察1次动物一般状况,并进行1次体重、血液学、血液生化学和血凝指标检查,以判断动物的健康状况,待动物主要体征指标稳定后可进行实验。
[0079]
2.5前列腺指数
[0080]
①
前列腺体积:采用高分辨率小动物超声系统对犬的前列腺上下径、左右径和前后径进行测量,计算前列腺的体积(体积=上下径
×
左右径
×
前后径
×
π/6);
[0081]
②
前列腺指数:麻醉后解剖,仔细分离前列腺,称湿重,并计算脏器指数(脏脑比和脏体比)。
[0082]
2.6病理组织学检查
[0083]
(1)解剖分离好的前列腺置于10%中性福尔马林中固定48h后包埋于蜡块(厚度约为0.2~0.3cm,大小为1.5
×
1.5
×
0.3cm)中,依次进行脱水、透明、浸蜡、包埋后切成4~7μm切片。苏木素-伊红染色后于显微镜下观察上皮细胞和间质细胞的形态学变化;
[0084]
(2)上皮高度:上述切片在100倍光学显微镜下随机选取10个视野,每个视野随机选取10个前列腺上皮细胞,用nikon nis-elements br 3.1显微图像分析系统自动测量上皮细胞高度。
[0085]
2.7masson染色
[0086]
(1)样本的切块、洗涤、脱水、透明、浸蜡、包埋以及切片同“2.6”项下“1~6”;
[0087]
(2)常规脱蜡、水化后,用配制好的weigert铁苏木素染色5~10min;
[0088]
(3)用酸性乙醇分化液分化,水洗;
[0089]
(4)用masson蓝化液返蓝,水洗;
[0090]
(5)蒸馏水洗1min;
[0091]
(6)丽春红品红染色液染色5~10min;
[0092]
(7)在上述操作过程中按2:1的蒸馏水:弱酸比例配制弱酸工作液,用弱酸工作液洗1min;
[0093]
(8)磷钼酸溶液洗1~2min;
[0094]
(9)用配制好的弱酸工作液洗1min;
[0095]
(10)直接入苯胺蓝染色液中染色1~2min;
[0096]
(11)用配制好的弱酸工作液洗1min;
[0097]
(12)95%乙醇快速脱水。无水乙醇脱水3次,每次5~10s;
[0098]
(13)二甲苯透明3次,每次1~2min。中性树胶封片。
[0099]
2.8免疫组化检测
[0100]
(1)免疫组化检测各年龄段犬前列腺中上皮细胞和间质细胞的细胞增殖核抗原、凋亡抑制基因bcl-2、雄激素受体(ar)和雌激素受体(erα)阳性表达率;
[0101]
(2)镜下观察到免疫组化切片出现棕黄色颗粒集聚即为阳性反应;每张切片观察10个视野,利用image-pro plus 6.0软件对制作好的切片的显色图像进行平均光密度测定分析,将其间接作为蛋白表达量。
[0102]
3、建模结果
[0103]
3.1前列腺指数
[0104]
上述自发bph模型青年组、中年组和老年组beagle犬经b超探测的前列腺平均体积分别为6、20和41cm3,诱导bph模型对照组和模型组去势前的前列腺平均体积分别为15
±
2cm3和16
±
0.8cm3。一般认为犬前列腺体积大于18cm3时判定为增生,说明本实验两种模型选定的动物年龄和对应的前列腺体积均符合bph模型构建的标准。
[0105]
建模后前列腺指数如图1~图4所示,自发bph模型可见年龄依赖性的前列腺体积明显增大、前列腺湿重以及前列腺脏体比和脏脑比明显升高趋势,表明年龄依赖性的beagle犬自发前列腺增生模型是成功的。同样,1:100比例的雌雄激素可以导致去势beagle犬前列腺体积明显增大,前列腺脏体比明显增加以及前列腺湿重有轻度升高趋势,表明诱导bph模型同样是成功的。
[0106]
本实验自发bph模型中年组和老年组动物前列腺体积分别为青年组平均体积的3倍和6倍,由于老年犬在其前列腺体积增大为正常体积的4倍时才会表现出和人类具有一致临床症状的bph的病理组织学特征,且本实验中的前列腺增生特征主要为腺体增生。因此5~7岁龄beagle犬尚不具备与人类临床症状相一致的bph病理组织学特征(间质增生为主),9~11岁龄的前列腺增生beagle犬具有和人类前列腺增生相似的特征。
[0107]
3.2激素检测
[0108]
如图5~图12所示,自发bph模型可见年龄依赖性的外周血睾酮(t)和双氢睾酮(dht)水平明显降低,外周血睾酮/雌二酮(t/e2)比值明显降低。
[0109]
去势前,诱导bph模型对照组和模型的犬外周血t分别为808.6
±
67.6和750.7
±
163.2pg/ml。去势手术后7d,模型组t迅速下降至8.7
±
2.8pg/ml。给予1:100的雌雄激素10d后,t水平虽有明显升高(411.2
±
241.2pg/ml),但仍低于去势前水平。与对照组(189.4
±
54.8pg/ml)相比,模型组对应前列腺组织内t水平在给予1:100的雌雄激素10d后明显升高(606.0
±
190.3pg/ml)。说明比例为1:100的雌/雄激素诱导的bph模型可以导致去势beagle犬外周血t和dht水平相比于给药前明显升高,且组织内dht和t与对照组相比明显升高,外周血和组织内平均e2与对照组相比明显升高,以及和自发bph模型一致地外周血t/e2比值明显降低。
[0110]
3.3病理组织学检查
[0111]
(1)自发bph模型:青年组动物前列腺可见前列腺腺泡未完全发育,腺上皮细胞呈小立方形或轻度扁平化,染色较深;间质中结缔组织丰富;前列腺呈轻度幼年化;中年组前
列腺腺体增生,腺腔扩大,腺腔内皱襞增加(乳头状突起向腔内折叠形成);少量腺泡呈囊性扩张,腔内充满嗜酸性分泌物,腺上皮细胞呈轻度立方状或扁平化;老年组与中年组相比腺泡囊性扩张数量明显增多,临近可见少量腺泡轻度萎缩,间质可见明显纤维化增生,详见图13;
[0112]
(2)诱导bph模型:模型组动物可见前列腺腺泡轻度萎缩,腺腔狭窄,多呈线性,腺泡上皮细胞轻度增生;多量腺泡囊性扩张,腺上皮细胞呈轻度立方状或扁平化,周边腺泡轻度萎缩;间质增生,纤维化,详见图13。
[0113]
3.4上皮高度和masson染色分析结果(图14~图18)
[0114]
自发bph和诱导bph模型均可导致前列腺上皮高度明显增加(图14、图16)、前列腺胶原纤维面积明显增加(图15、图17、图18)、以及间质/上皮比例明显升高(自发bph模型间质/上皮比例由1:1升高至约2:1,诱导bph模型间质/上皮比例由1:1升高至约4:1),且诱导bph模型可明显导致间质比例升高,上皮比例降低。
[0115]
3.5免疫组化检测
[0116]
前述对自发bph和诱导bph模型的前列腺指数、上皮高度、间质/上皮比例以及前列腺病理组织学检查均可证明bph模型构建成功。对于前列腺增生模型上皮部分比例的降低和间质部分比例的增加,进一步采用免疫组化方法分别检测自发bph模型青年组和老年组、诱导bph模型对照组和模型组对应上皮细胞生物标志(β-catenin);alpha-smooth muscle actin,sma;)等相关标志,以进一步验证模型的成功并初步探讨前列腺增生的原因。
[0117]
(1)β-catenin:作为前列腺上皮细胞的标志蛋白,增生组前列腺的β-catenin蛋白与对照组比较表达降低(p<0.05),但诱导模型组的降低幅度小于自发bph模型,如图19、图22所示。
[0118]
(2)sma:作为前列腺间质肌纤维化特征性标志蛋白,主要表达于间质细胞,与对照组比较,增生组前列腺sma表达明显升高(p<0.05),如图20、图23所示;
[0119]
(3)fibronectin:作为前列腺间质纤维化增生疾病的标志蛋白,fn1主要定位于间质细胞,与对照组比较,增生组前列腺fn1表达明显升高(p<0.05),如图21、图24所示。
[0120]
综合上述免疫组化结果,自发bph和诱导bph模型均可见上皮细胞生物标志β-catenin表达明显下调、间质细胞的标志物sma的明显表达上调,证明emt是两种bph模型间质部分纤维化的增生诱因。
[0121]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1