用于神经变性障碍的动物模型的制作方法
用于神经变性障碍的动物模型
1.本发明涉及动物模型,并且特别地涉及用于神经变性障碍,诸如阿尔茨海默病、帕金森病或者运动神经元病的新的体内动物模型,并且涉及用于提供这种模型的方法。本发明提供了动物模型本身以及用于研究在这种神经变性障碍,特别地阿尔茨海默病中出现的潜在机理的方法,并且延伸到用于试验药理学试验化合物以及用于药物筛选,以用于治疗神经变性疾病的模型、方法和测定法,该药理学试验化合物可以调节神经学过程。
2.阿尔茨海默病(ad)是痴呆的最常见形式,但促进这种障碍的主要事件仍旧未被解开。最流行的“淀粉样蛋白质假说”现在正在日益地受到挑战,因此需要与所有临床特征相容的替代性理论。这种不同的一种方法集中于ad中选择性地且主要地易受攻击的神经元的区别特性。它们构成邻近的细胞群的连续中枢,从基底前脑(bf)延伸至中脑和脑干,其将投影发送至几个脑区域,如皮质、海马和嗅球。尽管在易感细胞的这个核心内的递质的异质性,但令人感兴趣的共同特征是它们包含酶,乙酰胆碱酯酶,现已确定其发挥非胆碱能的功能。这种非酶促作用调节钙离子流入神经元,因此,它可以是有营养或者有毒的,这取决于剂量、可用性和神经元年龄。
3.乙酰胆碱酯酶(ache)在发育的不同阶段表达为各种形式,所有的形式都有相同的酶促活性,但是各种形式都具有非常不同的分子组分。“有尾”(t-ache)在突触处表达,并且发明人之前已经鉴定了两种肽,可以从c-末端切割这两种肽,一种肽称为“t14”(14聚体肽),其位于另一种肽内,另一种肽称为“t30”(30聚体肽),两者与β-淀粉样蛋白质的可比较区域都具有高度序列同源性。ache c-末端肽“t14”已经被鉴定为是ache分子的沉默部分,负责非水解作用的其范围。合成的14氨基酸肽类似物(即,“t14”)以及随后它被嵌入到其中的更大、更稳定、和更有效的氨基酸序列(即,“t30”)展示了与报道的“非胆碱能的”ache的作用相似的作用,其中t30序列内的惰性残基(即,“t15”)没有效应。
4.目前,没有广泛接受的体内动物模型,该动物模型复现神经变性障碍,诸如阿尔茨海默病(ad)的全部病理学轮廓,因为神经变性的基本机理仍然知之甚少。当前的系统不仅不能够复制疾病的全部临床轮廓,而且可用的系统的大多数依赖于转基因动物来反映仅小百分比的病例具有清楚的遗传基础的疾病。而且,转基因动物的生产非常昂贵,并且需要很长的等待周期使损伤变得明显。因此,迫切需要改进的动物模型或者测定法,其能够实现神经变性疾病的精确研究。
5.发明人已经研发了一种假说,他们认为该假说解释了表征阿尔茨海默病的异常过程,这是基于α7烟碱性乙酰胆碱受体(α7-nachr)与有毒的30-聚体肽之间的相互作用,从乙酰胆碱酯酶(ache)的c-端切割该有毒的30-聚体肽,即,t30。基于这个假说,它们已经使用体内(即,啮齿动物)模型建立了新的、非转基因的方法,该模型可以用于在比细胞培养物多得更多的生理学场景中研究神经变性障碍。
6.因此,发明人将单剂量的肽t30施用到大鼠的中间隔膜/基底前脑中,并且研究了在脑的四个不同部分,即,皮质、下皮质、海马和小脑中的有毒的肽(t14)上以及两个阿尔茨海默病标记(τ和aβ)上的t30介导的修饰。此外,它们还使用免疫组织化学法分析了脑的基底前脑和脑桥/髓质区域,该免疫组织化学法使用抗体进行定量分析。总体目标是首先确定
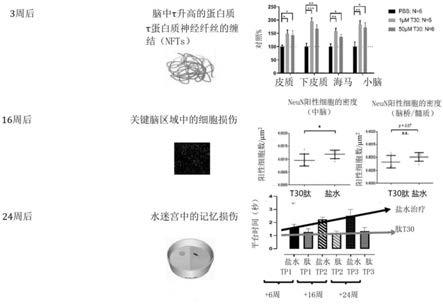
是否单一剂量的t30可以神经化学地诱导“阿尔茨海默样”的轮廓,该轮廓被定义为与对照比较,治疗组中ad相关的蛋白质的统计学地显著的增加,并且其次确定t30在何种浓度下引起这些变化。图2和3中所示的elisa结果惊奇地显示,在t30-肽施用时,总τ蛋白质水平在所有四个脑区域(皮质、下皮质、海马和小脑)中增加了。τ蛋白质是公知的阿尔茨海默病的主要病理学标记,因此在此描述的方法学清楚地证明了t30在四个脑区域中触发阿尔茨海默病样轮廓的作用。此外,如图15所示,与盐水处理的动物比较,在施用t30肽后的大鼠的中脑中观察到neun阳性(即,neun表达)细胞的密度的显著降低,neun阳性细胞是成熟神经元的标记。此外,图15还示出了使用莫里斯(morris)水迷宫试验,用t30处理的大鼠的行为的恶化。
7.当总体考虑数据时,发明人坚定地认为这是毒素(即,t30肽)触发在其他正常的野生型啮齿动物的脑中一致的阿尔茨海默样生物化学轮廓的第一证据。在此所述的方法建议用于以时间依赖性和位点特异性方式,监测和操作有助于神经变性的神经化学现象的高度新的体内方法。这种新方法清楚地允许探索在生理学背景下神经变性期间出现的早期阶段,维持研究区域的局部神经元回路,并且给出监测其急性应答的可能性。这种方法学的应用可以用于检查许多分子过程,试验药理学化合物,并且提供用于药物筛选的可靠工具,该药理学化合物可以调节这些过程。
8.因此,在本发明的第一方面中,提供了一种提供用于神经变性疾病的动物模型的方法,该方法包括将肽引入到非人类的动物的脑中,该肽包含表示为seq id no:3的氨基酸序列或者其片段的活性变体,或者由其它们组成,其中该肽引起在动物的脑中一个或者多个位点中的τ蛋白质的增加。
9.优选地,该方法包括将肽或者其变体或片段引入到野生型非人类的动物的脑中。有利地,发明人惊奇地观察到,在将有毒的t30肽施用到野生型(即,换言之,正常的)非人类的动物的脑中之后,在动物的皮质、下皮质、海马和小脑中总τ蛋白质水平增加了。有趣地,发明人在施用t30之后,在解剖的脑的任何区域中没有观察到β-淀粉样蛋白质水平的任何显著差异。然而,先前的研究(lin等人,2009,j.alzheimer’s dis,18(4):907-18)已经确定,csf中增加的总τ蛋白质,但不是β-淀粉样蛋白质与阿尔茨海默病的短期记忆损伤相关,并且因此,在此描述的结果与这些早期发现不一致。因此,有利地,本发明的方法优选地导致研发τ蛋白质病变的新的动物模型,该τ蛋白质病变表示神经变性障碍或者神经障碍。
10.因此,在本发明的第二方面中,提供了一种用于神经变性疾病的动物模型,该动物模型是用肽治疗的非人类的动物,该肽包含表示为seq id no:3的氨基酸序列或者其片段的活性变体,或者由它们组成。
11.图3显示了t30肽的施用如何惊奇地导致:(i)动物模型的皮质中τ蛋白质的约40%-50%增加,(ii)下皮质中τ蛋白质的约175%-200%增加,(iii)海马中τ蛋白质的约30%-60%增加;以及(iv)小脑中约160-180%的增加。发明人惊奇的是在施用如此低水平的t30肽(即,1μm或者50μm)时,实现了如此高水平的τ蛋白质。此外,图8显示了t30肽的施用如何惊奇地降低了在治疗的动物的中脑中neun阳性细胞的密度(即,其与成熟神经元相关)。如同τ蛋白质一样,本发明人惊奇的是在施用如此低水平的t30肽(即,1μm或者50μm)时,实现了如此低数量的neun细胞或者神经元。
12.因此,优选地,将肽引入到非人类的动物(优选地正常的野生型动物)的脑中,该肽
包含表示为seq id no:3的氨基酸序列或者其片段的活性变体,或者由它们组成,以创建第二方面的动物模型,该动物模型显示在动物的脑中一个或者多个位点中τ蛋白质的增加。此外,优选地,将肽引入到非人类的动物(优选地正常的野生型动物)的脑中,该肽包含表示为seq id no:3的氨基酸序列或者其片段的活性变体,或者由它们组成,以创建第二方面的动物模型,该动物模型显示在动物的脑中一个或者多个位点中神经元的减少。
13.优选地,在第一方面的方法或者第二方面的模型中向非人类的动物施用肽或者其变体或片段引起在动物的脑中一个或者多个位点中τ蛋白质的增加或者神经元的减少,这些位点选自下面组,该组由以下各项组成:皮质;下皮质;海马;小脑;基底前脑;以及脑桥/髓质区域。优选地,肽或者其变体或片段的施用引起在动物的脑中至少两个、三个、四个、五个或者所有六个位点中τ蛋白质的增加或者神经元的减少,这些位点选自下面组,该组由以下各项组成:皮质;下皮质;海马;和小脑;基底前脑;以及脑桥/髓质区域。
14.优选地,与未处理的对照比较,肽或者其变体或片段的施用引起在动物的脑中一个或者多个位点中τ蛋白质的统计学地显著的增加,优选地至少1%的增加,或者更多。优选地,与未处理的对照比较较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点中τ蛋白质增加至少3%。优选地,与未处理的对照比较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点中τ蛋白质增加至少5%、10%或者20%。更优选地,与未处理的对照比较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点中τ蛋白质增加至少30%、40%或者50%。
15.优选地,与未治疗的对照比较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点(并且优选地它的中脑)中神经元的统计学地显著的减少,优选地至少1%增加,或者更多。优选地,与未治疗的对照比较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点(并且优选地其中脑)中神经元减少至少3%。优选地,与未治疗的对照比较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点(并且优选地其中脑)中神经元减少至少5%、10%或者20%。更优选地,与未治疗的对照比较,肽或者其变体或片段的施用引起动物的脑中一个或者多个位点(并且优选其中脑)中神经元减少至少30%、40%或者50%。
16.乙酰胆碱酯酶是水解乙酰胆碱的丝氨酸蛋白酶,并且是本领域技术人员公知的。脑中发现的乙酰胆碱酯酶的主要形式称为有尾乙酰胆碱酯酶(t-ache)。并且,有尾乙酰胆碱酯酶(gen bank:aaa68151.1)的一个实施方式的蛋白质序列是614个氨基酸长度,并且在此被提供为seq id no:1,如下:
[0017][0018]
去除seq id no:1的前31个氨基酸残基,同时释放蛋白质,从而留下583个氨基酸序列。
[0019]
发明人已将β-淀粉样蛋白质(aβ)的序列与来源于ache的c-末端的三种肽(在此称为t30、t14和t15,并且在下文描述)进行比较。
[0020]
β-淀粉样蛋白质(aβ)的部分的氨基酸序列在此被提供为seq id no:2,如下:
[0021]
daefrhdsgyevhhqklvffaedvgsnkgaiiglmvggvvia
[0022]
[seq id no:2]
[0023]
t30的氨基酸序列(其对应于seq id no:1的最后30个氨基酸残基)在此被提供为seq id no:3,如下:
[0024]
kaefhrwssymvhwknqfdhyskqdrcsdl
[0025]
[seq id no:3]
[0026]
t14的氨基酸序列(其对应于朝向seq id no:1的末端定位的14个氨基酸残基,并且缺少在t30中发现的最后15个氨基酸)在此被提供为seq id no:4,如下:
[0027]
aefhrwssymvhwk
[0028]
[seq id no:4]
[0029]
t15的氨基酸序列(其对应于seq id no:1的最后15个氨基酸残基)在此被提供为seq id no:5,如下:
[0030]
nqfdhyskqdrcsdl
[0031]
[seq id no:5]
[0032]
用于制备本发明的动物模型的肽可以来源于乙酰胆碱酯酶本身(即,seq.id.no.1)或者其活性变体或片段,包括具有修饰的氨基酸残基的肽的修饰形式,例如生物素酰基化形式。seq id no:3的肽的变体包括与seq id no.3比较具有1、2或者3个氨基酸取代和/或1、2或者3个氨基酸缺失和/或1、2或者3个添加的氨基酸残基的肽。合适的变体可以例如,具有n-末端和/或者c-末端延伸。给定的seq id no:3作为比较的指导,制备变体肽,并且在根据本发明的方法和模型中试验它们的效力是简单明了的事情。例如,人们可以通过试验与seq id no:3相同的肽(除了一个或者两个保守取代的氨基酸残基外)来开始。可以基于很好地被表征的氨基酸的特性预测保守取代。也可能通过用于保留钙通道调节活性的肽的体外试验来确定根据本发明使用的seq id no:3的活性变体。为此目的,例如,豚
鼠的中脑切片可以用于如先前在wo 97/35962中所述的电生理学研究。可替代地,例如,可以使用例如,来自大鼠的海马切片的器官型组织培养物。
[0033]
优选地,向非人类的动物的脑施用的肽的活性变体或片段包含表示为seq id no:3的序列的至少15、16、17、18或者19个氨基酸或者由它们组成。更优选地,向非人类的动物的脑施用的肽的活性变体或片段包含表示为seq id no:3的序列的至少20、21、22、23或者24个氨基酸或者由它们组成。甚至更优选地,向非人类的动物的脑施用的肽的活性变体或片段包含表示为seq id no:3的序列的至少25、26、27、28或者29个氨基酸或者由它们组成。优选地,向非人类的动物的脑施用的肽的活性变体或片段包含表示为seq id no:3的序列的少于40、39、38、37、36或者35个氨基酸或者由它们组成。最优选地,向非人类的动物的脑施用的肽包含30个氨基酸或者由它们组成,即,是seq id no:3。用于本发明中的seq id no:3的适合变体可以是包含至少15个氨基酸残基,并且与seq id no:1的ache序列的部分或者全部具有至少70%的序列同一性的肽。优选地,用于本发明中的肽包含至少15、20、25或者30个氨基酸残基,并且与seq id no:3具有至少90%或者95%的序列同一性。
[0034]
可以由具有与乙酰基或者酰胺基团类似特性的n-和/或c-末端保护基团保护肽或者其变体或片段的末端。肽或者其变体或片段可以被生物素酰基化或者被氚化。肽可以是通过化学合成制备的合成肽,或者可以通过酶促消化从较大的肽或者多肽分子制备它们,或者可以通过重组技术产生它们。
[0035]
该方法(或者测定法)包括施用有效量的肽,该肽包含表示为seq id no:3的氨基酸序列或者其活性变体或片段,或者由它们组成,这样使得该肽在脑中导致升高的τ蛋白质水平。可以向动物施用肽或者其变体或片段的一个或者多个剂量。优选地,向动物施用的肽或者其变体或片段的浓度可以小于1mm、或者小于750μm、或者小于500μm、或者小于400μm、或者小于300μm、或者小于200μm、或者小于100μm、或者小于75μm、或者小于60μm。优选地,肽或者其变体或片段的浓度可以小于50μm、或者小于40μm、或者小于30μm、或者小于20μm、或者小于10μm、或者小于5μm、或者小于3μm。
[0036]
优选地,所施用的肽或者其变体或片段的浓度可以大于0.01μm、或者大于0.1μm、或者大于1μm、或者大于3μm、或者大于5μm、或者大于10μm。优选地,该肽或者其变体或片段的浓度可以大于20μm、或者大于30μm、或者大于40μm、或者大于50μm。优选地,肽或者其变体或片段的浓度可以大于60μm、或者大于70μm、或者大于80μm、或者大于90μm。
[0037]
将要意识到,可以通过任何组合来组合任何上述浓度的肽、其变体或片段。例如,所施用的肽或者其变体或片段的浓度可以在0.01μm与1000μm之间、或者在0.1μm与500μm之间、或者在1μm与100μm之间、或者在1μm与90μm之间。优选地,肽或者其变体或片段的浓度可以在0.1μm和80μm之间,或者在0.1μm和70μm之间,或者在0.1μm和60μm之间,或者在0.1μm和50μm之间。优选地,肽或者其变体或片段的浓度可以在0.1μm与40μm之间、或者在0.1μm与30μm之间、或者在0.1μm与20μm之间、或者在0.1μm与10μm之间。优选地,肽或者其变体或片段的浓度可以是在10μm与80μm之间、或者在20μm与80μm之间、或者在30μm与70μm之间、或者在40μm与60μm之间。在最优选的实施方式中,向非人类的动物的脑施用约1μm或者50μm的t30或者其变体或片段。因此,以上上限和下限中的任一个可以彼此组合。
[0038]
图8示出了t30肽的施用(50μm)如何惊奇地降低了在处理的动物的中脑中neun表达细胞(即,其与成熟神经元相关)的密度。如图2和3中所示,t30肽的施用诱导在所研究的
所有四个脑区域中τ蛋白质的高度显著的、剂量依赖性的增加。与pbs注射的对照比较,试验的最高剂量(即,100μm)显示τ蛋白质浓度无差异。尽管不希望束缚于任何假说,发明人认为这种剂量依赖性作用可能是由于钙通道在过度地被刺激时的关闭。然而,在较低剂量(即,小于100μm)中,其中增强的钙流入是有活力的,t30肽诱导糖原合酶激酶3(gsk3)的激活,这导致τ蛋白质的增加的磷酸化,这进而促进在大脑中τ蛋白质缠结的形成,τ蛋白质缠结是ad的主要标记。换言之,发明人已经惊奇地显示更低μm剂量的t30(即小于100μm)是清楚地受体介导的,而高剂量(即,高于100μm)不是受体介导的,这是完全出人意料的。因此,发明人认为0.1-99μm t30肽或者其片段或变体的剂量范围是最佳的,并且因此是优选的,在该剂量范围下它是受体介导的。
[0039]
可以将肽或者其变体或片段引入到脑的基底前脑区域。可以将肽或者其变体或片段引入到脑的broca(sid13)区域的中隔/斜角带。可以将肽或者其变体或片段引入到皮质胆碱能系统中。皮质的和海马中隔的胆碱能系统均有助于记忆,因此是施用肽的优选部位。然而,优选地,可以将肽或者其变体或片段引入到基底大细胞核(nbm)中。
[0040]
可以通过立体定位注射向麻醉的动物中施用肽,尽管通过植入的插管向有意识的动物施用肽有时可以是优选的,例如,以在没有麻醉的情况下检查急性效果(30分钟持续时间)。可替代地,压力显微注射或者通过(例如玻璃)微量移液管的电泳对于离子电泳记录可能是优选的。
[0041]
优选地,非人类的动物是正常的野生型非人类的动物。例如,动物可以是哺乳动物,其可以是灵长类动物,例如猴。非人类的动物可以是雄性或者雌性。然而,优选地,非人类的动物是啮齿动物,其可以是小鼠或者大鼠。优选地,啮齿动物是大鼠。大鼠可以是李斯特(lister)头巾大鼠或者长埃文斯(long evans)头巾大鼠。大鼠可以是雄性或者雌性,但优选是雄性。大鼠可以是成年大鼠,即,至少2或者3个月大。优选地,非人类的动物是正常的野生型啮齿动物。
[0042]
优选地,肽或者其变体或片段有助于或者引起神经变性。向动物模型施用的肽或者其变体或片段优选地引起细胞变性,并且由此引起可试验的脑功能的损伤,其中人类中相同脑功能的损伤表示神经障碍。
[0043]
例如,在此描述的模型或者方法可以用于研究通过τ蛋白质病变表征的任何神经变性疾病。例如,神经变性疾病可以选自下面的组,该组由以下项目组成:阿尔茨海默病;帕金森病;运动神经元病;脊髓小脑的类型1、类型2和类型3;肌萎缩性(脊髓)侧索硬化症(als);路易(lewy)体痴呆和额颞(骨)的痴呆。优选的是,该模型用于研究与乙酰胆碱酯酶的非酶促功能相关的任何神经障碍,特别地阿尔茨海默病、帕金森病和运动神经元病。
[0044]
然而,尤其地优选的是模型或者方法用于研究阿尔茨海默病。因此,可试验的大脑功能(其损伤可被试验)可以是认知功能。可替代地或者另外地,该损伤可以是注意力缺陷。优选地,该方法包括例如,通过给动物提供注意力任务以试验注意损伤,来试验动物模型的适当脑功能的损伤。
[0045]
可以试验肽处理的动物的记忆、学习、注意力和/或者解决问题的一种或者多种损伤。用于试验动物的认知功能的优选方法是进行空间记忆试验,如t型迷宫试验(rawlins等人,1982,beh,brain res,5,331-358)。可以使用的其他标准试验,包括莫里斯水迷宫(morris等,1982,nature,297,681-683)和径向臂迷宫(olton等,1976,animal beh,
proc.2,97-116)。
[0046]
优选地,该方法包括将脑(例如基底前脑)中肽病变的产生与使用设备试验注意力缺陷相结合,该设备提供系列的选择反应任务。可以训练大鼠来执行简单的注意力任务,例如当在其后面光闪时,用它们的鼻子推开面板以取回食物奖励。虽然对影响注意力的治疗敏感,但在这样的试验中应答失败也可能是由于对执行的影响。该治疗可以例如,引起镇静作用。系列的选择反应任务通过提供一个以上的刺激事件来解决这个问题,例如,大鼠的杠杆按压可以导致三个事件之一:来自左仓盒或者右仓盒的闪光或者没有光,在这种情况下正确的选择是中央仓盒。用于以此方式试验注意力损伤的合适装置已描述于higgs等,european j.neuroscience(2000)12,1781-1788。
[0047]
可以监测的其他行为功能包括但不限于社交行为、情绪反应性、情况的调节、惊吓反射的脉冲前抑制、双向厌恶调节和通过食物和水摄入或者蔗糖偏好测量的动机。
[0048]
如以上所指出的,已经发现引起注意力缺陷的大鼠脑中的微细损伤可以通过使用seq id no:3的肽来实现。然而,设想在nbm中的功能地等效的损伤可以通过使用如上文所讨论的其他肽来实现。
[0049]
在此描述的动物模型和方法可以用于检查许多与τ蛋白质病变和相关神经变性障碍相关的分子过程,试验药理学化合物,并且提供用于药物筛选的可靠工具,该药理学化合物可以调节这些过程。
[0050]
因此,优选地,该方法进一步包括在肽或者其变体或片段之前、同时或者之后施用试验试剂,并且确定是否该试剂可以抑制、预防或者增加可试验的脑功能的损伤和/或可以抑制、预防或者增加脑中的细胞损伤。优选地,选择试验试剂,其是能够抑制或者预防可试验的脑功能的损伤的化合物。优选地,该方法进一步包括合成该试验化合物。
[0051]
因此,在本发明的第三方面中,提供了根据第二方面或者根据第一方面的方法制备的非人类的动物模型用于下列的用途:(i)检查神经变性或者神经再生过程;(ii)试验药理学化合物,该药理学化合物可以调节神经变性或者神经再生过程;或者(iii)筛选神经变性或者神经再生药物。
[0052]
神经变性的调节可以包括抑制、预防或者增加神经变性。
[0053]
在第四方面中,提供了一种鉴定候选试剂的方法,该候选试剂用于治疗、预防或者改善神经变性障碍,该方法包括:
[0054]-向动物模型施用根据第二方面或者根据第一方面的方法制备的候选试剂;以及
[0055]-确定是否候选试剂抑制、预防或者增加可试验的脑功能的损伤和/或引起脑中的细胞损伤的改善或者恶化,
[0056]
其中抑制或者预防可试验的脑功能的损伤,或者改善脑中的细胞损伤表示该试验试剂是用于治疗、预防或者改善神经变性障碍的候选物,而增加可试验的脑功能的损伤或者恶化脑中的细胞损伤表示该试剂不是用于治疗、预防或者改善神经变性障碍的候选物。
[0057]
细胞损伤可以包括神经变性。可以通过测量以下中的一种或者多种来监测或者评估这种损伤:
[0058]
(i)神经元群体(即,集合)中活性的抑制;
[0059]
(ii)钙水平;
[0060]
(iii)乙酰胆碱酯酶的活性水平;
psychology:animal behaviour processes 2,97-116。
[0077]
t形迷宫
[0078]
rawlins,j.n.p.和oiton,d.s.(1982)海马中隔系统和认知映射(the septo-hippocampal system and cognitive mapping),behavioural brain research 5,331-358)。
[0079]
将要意识到,本发明延伸至任何核酸或者肽或者其变体、衍生物或类似物,其包含在此提及的任何序列的基本上的氨基酸或者核酸序列,包含其功能性变体或功能性片段。术语“基本上的氨基酸/核苷酸/肽序列”、“功能变体”和“功能片段”可以是与在此提及的序列中的任何一种序列的氨基酸/核苷酸/肽序列具有至少40%序列同一性,例如与在此确定的序列具有40%同一性的序列。
[0080]
还设想了与所提及的任何序列具有大于65%、更优选地大于70%、甚至更优选地大于75%、并且还更优选地大于80%序列同一性的序列同一性的氨基酸/多核苷酸/多肽序列。优选地,氨基酸/多核苷酸/多肽序列与提及的任何序列具有至少85%同一性,与提及的任何序列具有更优选地至少90%同一性,甚至更优选地至少92%同一性,甚至更优选地至少95%同一性,甚至更优选地至少97%同一性,甚至更优选地至少98%同一性,并且最优选地至少99%同一性,即,seq id no:1-5。
[0081]
技术人员将理解如何计算两个氨基酸/多核苷酸/多肽序列之间的百分比同一性。为了计算两个氨基酸/多核苷酸/多肽序列之间的百分比同一性,必须首先准备两个序列的比对,随后计算序列同一性值。两个序列的百分比同一性可以取不同的值,这取决于:(i)用于比对序列的方法,例如clustalw、blast、fasta、smith-waterman(在不同的程序中实施),或者来自3d比较的结构比对;和(ii)比对方法使用的参数,例如,局部对整体的比对,使用的对得分的矩阵(例如,blosum62、pam250、gonnet等),以及空位罚分,例如,函数形式和常数。
[0082]
在进行比对后,存在计算两个序列之间百分比同一性的许多不同方式。例如,人们可以将同一性的数量除以:(i)最短序列的长度;(ii)比对的长度;(iii)序列的平均长度;(iv)非空位位置的数量;或者(v)排除突出端的等效位置的数量。此外,将要意识到,百分比同一性也强烈依赖于长度。因此,一对序列越短,人们可以预期偶然发生的序列同一性越高。
[0083]
因此,将要意识到,蛋白质或者dna序列的准确比对是复杂的过程。流行的多重比对程序clustalw(thompson等,1994,nucleic acids research,22,4673-4680;thompson等,1997,nucleic acids research,24,4876-4882)是用于产生根据本发明的蛋白质或者dna的多重比对的优选方式。clustalw的适合的参数可以如下:对于dna比对:空位开放罚分=15.0,空位延伸罚分=6.66,并且矩阵=同一性。对于蛋白质比对:空位开放罚分=10.0,空位延伸罚分=0.2,并且矩阵=gonnet。对于dna和蛋白质比对:endgap=-1,并且gapdist=4。本领域技术人员将意识到,可能需要改变这些和其他参数以用于最佳序列比对。
[0084]
优选地,两个氨基酸/多核苷酸/多肽序列之间的百分比同一性的计算然后可以从如(n/t)*100的比对来计算,其中n是序列在此处共享相同残基的位置的数量,并且t是比较的位置的总数量,包括空位,并且包括或者排除突出端。优选地,在计算中包括突出端。因此,用于计算两个序列之间的百分比同一性的最优选的方法包括:(i)使用clustalw程序,
使用合适的参数集合准备序列比对,例如,如上所述;以及(ii)将n和t的值插入下式:-序列同一性=(n/t)*100。
[0085]
用于鉴定相似序列的替代方法将是本领域技术人员已知的。例如,实质上相似的核苷酸序列将由在严格条件下与dna序列或者它们的互补序列杂交的序列编码。通过严格条件,我们意指核苷酸在3x氯化钠/柠檬酸钠(ssc)中在约45℃杂交至过滤结合的dna或者rna,随后在0.2xssc/0.1%sds中在约20-65℃洗涤至少一次。可替代地,基本上相似的多肽可以与seq id no:1-5中所示的序列有至少1、但少于5、10、20、50或者100个氨基酸的不同。
[0086]
由于遗传密码的简并性,清楚地,可以变化或改变这里所述的任何核酸序列,而基本上不影响由此所编码的蛋白质序列,以提供其功能性变体。适合的核苷酸变体是具有不同密码子取代所改变的序列的变体,该不同的密码子编码序列内相同的氨基酸,因此产生沉默改变。其它适合的变体是具有同源核苷酸序列,但是包含序列的所有或部分的变体,通过不同密码子取代改变序列的所有或部分,该不同的密码子编码具有与它取代的氨基酸具有相似生物物理特性的侧链的氨基酸,以产生保守改变。例如,小的非极性的疏水性氨基酸包括甘氨酸、丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸和甲硫氨酸。大的非极性疏水性氨基酸包括苯丙氨酸、色氨酸和酪氨酸。极性中性氨基酸包括丝氨酸、苏氨酸、半胱氨酸、天冬酰胺和谷氨酰胺。正电荷(碱性)氨基酸包括赖氨酸、精氨酸和组氨酸。负电荷(酸性)氨基酸包括天冬氨酸和谷氨酸。因此,将意识到哪种氨基酸可以用具有相似生物物理特性的氨基酸取代,并且本领域技术人员将知道编码这些氨基酸的核苷酸序列。
[0087]
在此所述的所有特征(包括任何所附的权利要求、摘要和附图),和/或所公开的任何方法和工艺的所有步骤可以通过任何组合方式与任何上述方面组合,除了至少一些这种特征和/或步骤的组合是相互地排他的除外。
[0088]
为了更好地理解本发明,并且为了表示本发明的实施方式如何可以实施生效,现在将通过实施例方式参考附图,其中:
[0089]
图1示出了在将pbs(对照)或者1μm、50μm或者100μm t30(治疗)注射到基底前脑中之后,在解剖的大鼠脑(皮质、下皮质、海马和小脑)中的β-淀粉样蛋白质(42)水平;
[0090]
图2示出了在将pbs(对照)或者1μm、50μm或者100μm t30(治疗)注射到基底前脑中之后,在解剖的大鼠脑(皮质、下皮质、海马和小脑)中的总τ蛋白质水平;
[0091]
图3示出了在将pbs(对照)或者1μm、50μm或者100μm t30(治疗)注射到基底前脑中之后,在解剖的大鼠脑区域(皮质、下皮质、海马和小脑)中的τ蛋白质百分比;
[0092]
图4示出了在将pbs(对照)或者1μm、50μm或者100μm t30(治疗)注射到基底前脑中之后,在解剖的大鼠脑(皮质、下皮质和小脑)中的t14水平;
[0093]
图5示出了取自一篇论文的数据(garcia rates等人,2016年,“(i)α7烟碱性受体的新的调节剂的药理学轮廓:在阿尔茨海默病患者大脑中增加的有毒的乙酰胆碱酯酶衍生肽的阻断(pharmacological profiling of a novel modulator of theα7nicotinic receptor:blockade of a toxic acetylcholinesterase-derived peptide increased in alzheimer brains)”,neuropharmacology,2016,jun,105:487-499),该论文显示更低剂量的t30导致pc12细胞中的钙流入,这进而引起糖原合酶激酶3(gsk3)水平升高;
[0094]
图6示出了由细胞中的t30的效应导致的事件的级联;
[0095]
图7显示在sd(sprague-dawley)大鼠中ache衍生肽(t30)对阿尔茨海默病相关参
数(pτ,neun)的ihc影响。在用t30肽或者盐水急性处理之后来自wt sd大鼠的切片的免疫组织化学染色。在海马、皮质、中脑、基底前脑或者脑桥/髓质中没有检测到细胞内pτ(黄色)。neun(绿色)用于检测神经元,并且用dapi检测细胞核(蓝色);
[0096]
图8示出了在sd大鼠中ache衍生肽(t30)对阿尔茨海默病相关参数(pτ,neun)的影响的定量分析。在用t30肽或者盐水处理后,对wt sd大鼠的皮质、海马、中脑、脑桥/髓质和基底前脑中的neun阳性细胞的密度进行定量。使用未配对t检验进行统计学分析。*p《0.05;**p《0.01对比盐水;n=8,t30肽,n=8;每只动物6个切片;
[0097]
图9示出了在sd大鼠中ache衍生肽(t30)对阿尔茨海默病相关参数(6e10,iba1)的ihc影响。在用t30肽或者盐水处理后,来自wt sd大鼠的切片的免疫组织化学染色。在海马、皮质、中脑、基底前脑、以及脑桥/髓质中没有检测到细胞内aβ沉积物(黄色)。用ibal检测小神经胶质细胞(绿色),用dapi检测细胞核(蓝色);
[0098]
图10示出了在sd大鼠中ache衍生肽(t30)对阿尔茨海默病相关参数(pτ,neun)的影响的定量分析。在用t30肽或者盐水处理后,对wt sd大鼠的皮质、海马体、中脑、脑桥/髓质和基底前脑中的iba1阳性细胞的密度进行定量。使用未配对t检验进行统计学分析。*p《0.05;**p《0.01对比盐水;n=8,t30肽,n=8;每只动物6个切片;
[0099]
图11示出了莫里斯水迷宫(mwm)象限和平台时间点1实验的结果;
[0100]
图12示出了莫里斯水迷宫(mwm)象限和平台时间点2实验的结果;
[0101]
图13示出了莫里斯水迷宫(mwm)象限和平台时间点1、2和3实验的结果;
[0102]
图14示出了随着时间的推移t30诱导的水迷宫中记忆的慢性损伤;以及
[0103]
图15示出在施用单次脑内注射t30后3周、16周和24周对正常大鼠的影响。
具体实施例
[0104]
尽管针对神经变性中主要事件的增加数量的研究,但是没有紧密复现全部病理学轮廓(例如,阿尔茨海默病的病理学轮廓)的动物模型,因为神经变性的基本机理仍知之甚少。因此,发明人已经研发了一种新的体内动物模型,以阐明诱导神经变性的基本机理,并且重要地是,其中可以试验新的试验试剂以确定神经保护(或者神经中毒)的活性。
[0105]
本发明涉及从乙酰胆碱酯酶(ache)的c-末端切割的肽t30(seq id n:3)的用途,该肽由生物活性部分t14(seq id no:4)和与α7烟碱性乙酰胆碱受体(α7-nachr)相互作用的惰性片段t15(seq id no:5)组成。发明人先前已经示出了在细胞系上应用ache衍生肽促进ad样表型。这些效果被α7-nachr的新的候选调节剂nbp-14阻断,该nbp-14是t14的环化形式,并且因此具有环状seq id no:4的序列。如下所述,本发明人已经在来自体内的脑切片上应用t30或者nbp14,并且研究了它们在调节内源t14表达中的活性,以及是否它们有助于或者防止神经变性模式。
[0106]
发明人示出了该设备和模型可以用于研究更多生理学情况下的神经变性,即,来自体内的脑切片的α7-nachr上p-τ和aβ表达,尽管将要意识到,存在可以被测量以监测神经变性障碍的程度和进展的任何其他蛋白质。该模型利用了发明人的新假说,他们认为该新假说解释了表征ad的异常过程,这是基于α7烟碱性乙酰胆碱受体(α7-nachr)与从乙酰胆碱酯酶(ache)c-端切割的有毒的肽(即t30)之间的相互作用。设备和模型可以用于检查许多分子过程,试验药理学化合物,并且提供用于药物筛选的可靠工具,从而减少整个动物实
验,该药理学化合物可以调节这些过程。
[0107]
材料和方法
[0108]
脑提取和解剖
[0109]
麻醉(戊巴比妥)的致死注射后,提取新鲜的脑,并且解剖皮质、海马、小脑和下皮质区域,并且立即在液氮中快速冷冻。在-80℃储存脑以保存蛋白质。由于在实验开始之前一只大鼠死亡,这些组如下:
[0110]
pbs(对照):n=6
[0111]
1μm t30:n=5
[0112]
50μm t30:n=6
[0113]
100μm t30:n=6
[0114]
脑均质化
[0115]
将脑切片在冰上解冻,并且将冰冷裂解缓冲液(pbs+蛋白酶和磷酸酶抑制剂,以分别地1:100)添加至每个脑切片。使用研棒,在低速设置下使用超声波仪探头之前尽可能多地均质化组织,每次5秒钟,同时保持在冰上,直到组织全部地被均质化。将样品在冰上温育20分钟,之后在4℃在最大速度(13,000rpm)离心30分钟。除去上清液,并且用于分析。
[0116]
β-淀粉样elisa
[0117]
一起购买β-淀粉样蛋白质42的商品elisa(invitrogen,kmb3441)与β-淀粉样蛋白质肽(1-42)(abcam,ab120959)。将所有样品以6000μg/ml的总蛋白质(通过pierce蛋白质测定法确定)与从野生型全大鼠脑合成的阳性对照加上275ng(在ad的转基因动物模型中发现的公开浓度)的β-淀粉样肽(1-42)一起铺板。在每个板上还使用第二对照(不添加第一抗体)和色原空白。在每个板上使用范围从0-200pg/ml的β-淀粉样肽(1-42)的标准曲线,并且按照由试剂盒所描述的方案(除了随试剂盒供应的肽,其被以上列出的替代方案替代)。大致地,将标准品(一式两份)和样品(一式三份)铺板,并且在室温在平板振荡器上温育2小时。抽吸所有标准品和样品,并且在将随试剂盒提供的“检测”抗体添加至所有孔(除了第二对照和色原空白)之前洗涤板。在平板振荡器上,在室温,再温育1小时周期,然后抽吸抗体,并且再次洗涤平板。将igg hrp添加至每个孔(除了色原空白),并且在板振荡器上,在室温,再温育板30分钟。抽吸所有溶液并且洗涤板,之后将稳定的色原添加至每个孔中,并且在板振荡器上,在室温,在黑暗中温育板30分钟。最后,将终止溶液添加至每个孔中,并且在450nm下读取吸光度。
[0118]
总τ蛋白质elisa
[0119]
购买了用于总τ蛋白质检测(abcam,ab210972)的商品elisa。将所有样品以0.5μg/ml的总蛋白质(通过pierce蛋白质测定法确定)以及范围从0-2000pg/ml的全部标准曲线的τ蛋白质和第二对照(不添加第一抗体)铺板。按照由试剂盒所描述的方案,大致地,将标准品(一式两份)和样品(一式三份)铺板,随后立即添加抗体混合物(减去第二对照的捕获抗体),并且在板振荡器上在室温,温育1小时。抽吸所有溶液,并且洗涤板,然后将tmb底物添加至所有孔中,并且在平板振荡器上在室温,在黑暗中温育10分钟。最后,将终止溶液添加至所有孔中,并且在板振荡器上在室温,温育板1分钟,然后在450nm读取吸光度。
[0120]
t14 elisa
[0121]
发明人已经研发了用于检测t14的内部elisa。将剩余的所有样品(pbs:皮质n=6,
下皮质n=6,海马n=0,小脑n=4;1μm t30:皮质n=5,下皮质n=3,海马n=1,小脑n=4;50μm t30:皮质n=5,下皮质n=4,海马n=1,小脑n=4;100μm t30:皮质n=6,下皮质n=6,海马n=0,小脑n=6)稀释至1:10,并且用范围从0-40nm的全部t14标准曲线(一式二份铺板)和第二对照铺板(一式三份)。在振荡器上在4℃,温育板过夜,并且然后在添加bsa封闭溶液之前全部地抽吸,并且在板振荡器上在室温,进一步温育6小时。抽吸封闭溶液,并且将第一抗体(t14多克隆,genosphere)添加至所有孔中(除了第二对照之外),并且在板振荡器上在4℃,温育过夜。抽吸抗体溶液,并且洗涤该板,随后添加第二抗体,并且在板振荡器上在室温,温育2小时。抽吸所有溶液,并且洗涤该板,然后添加tmb底物,并且在板振荡器上,在室温,温育板15分钟。添加终止溶液,并且在450nm读取吸光度。
[0122]
组织制备和免疫组织化学
[0123]
从pbs移出鼠脑样品,并且通过在30%蔗糖溶液中温育72h或者直至饱和被低温保护。沿中线将全脑切成两半,并且将每一半包埋在tissuetek中,并且在-80℃下储存直到冰冻切片的时间。
[0124]
在中线开始,使用低温恒温器切割25μm的矢状切片。将切片收集在24孔板中,并且直接用于染色或者储存在-20℃的低温保护溶液(25mm磷酸钠缓冲液,ph 7.4,30%乙二醇,20%甘油)中直到使用时间。对安装在超粗糙的载玻片上的切片进行所有染色。
[0125]
用以下方式进行用于检测β淀粉样蛋白质(aβ)、磷酸化τ蛋白质(pτ)、神经元(neun)和小胶质细胞(iba1)的免疫染色。将切片预处理用于抗原修复,或者对于pτ,在柠檬酸缓冲液(ph 6.0)中在90℃持续30分钟,或者对于aβ,用70%甲酸持续10分钟。抗原修复切片在0.3%triton x-100/pbs中被渗透后,在10%正常山羊血清/pbs中封闭,并且在4℃,与在1%正常山羊血清、pbs中0.1%triton x-100中稀释的第一抗体温育过夜。
[0126]
将以下第一抗体用于免疫染色:抗β淀粉样蛋白质(aβ)单克隆小鼠,6e10,(1:1000;covance,cat#39320),单克隆小鼠抗磷酸化τ蛋白质,at180,(1:500;thermo,cat#mn1040),单克隆兔抗iba1(1:500;synaptic system,cat#234004),多克隆兔抗neun(1:500;millipore,cat#abn78)。
[0127]
用与iba1组合的6e10和与neun组合的at180进行共染色。将切片在pbs中洗涤三次持续15分钟,并且在室温,在适当的第二抗体(sigma)中温育2小时。将切片在pbs中再次洗涤三次,在pbs中持续15分钟,然后用dapi染色温育以检测细胞核。最后,将封片介质应用于染色的切片,并且将载玻片盖上盖玻片以用zeiss axioscan.z1系统(carl zeiss microscopy)成像。
[0128]
图像采集和定量分析
[0129]
使用配备有led-colibri7光源和axiocam 506单摄像机组的zeiss axioscan.z1载玻片扫描装置(leica biosystems)进行自动图像采集。以20x放大率(像素大小:0.22μm)以非共焦方式拍摄图像,并且使用zen软件可视化图像。将图像数据输入到图像分析软件(visiophoarm a/s)中,以进行区域选择。
[0130]
通过使用由allen developing mouse brain at1as(allen institute)出版的坐标作为指南,细分矢状脑切片的图像来进行皮质、海马、中脑、基底前脑和脑桥/髓质区域的手动分割。
[0131]
使用studio 5.1(perkinelmer inc.)和整合的分批分析作为系统的一部分,开发了用于细胞内和细胞外aβ、pτ、neun和iba1的表征和定量的图像分析脚本。对于所有分析,使用dapi信号和基于“细胞核检测b”算法的定制细胞核检测工作流程鉴定组织切片内的单个细胞。实施几个质量控制参数,以弃掉失焦细胞核和非细胞核的结构。这些包括例如,应用最小信号对比、细胞核面积和细胞核圆度的阈值。检测的细胞的细胞质被定义为围绕先前分割的细胞核(细胞核周区域)的4像素宽的同心环。在该细胞核周的环之外,产生了3像素宽的背景区域,用作细胞个体,并且在中值聚集之后,全脑区域参考区域用于确定neun-和iba1-阳性细胞群体。
[0132]
在所有细胞子区域中评估aβ、pτ、neun和iba1染色的信号强度。当细胞核区域中的平均信号强度分别地是脑区域中间背景的至少1.5或者2倍高时,细胞被鉴定为neun或者iba1阳性。
[0133]
通过对图像应于强度阈值来分割细胞外斑块:具有是中间细胞的淀粉样蛋白质背景至少2倍高的强度的信号被认为潜在地属于斑块。为了从分析中排除假阳性斑块,通过应用最小斑块尺寸(即》200px2)和轴向比(小轴长度/长轴长度》0.4)的阈值实现这些初始斑块样目标的进一步过滤。所有读数被计算为每个脑区域和组织学切片的平均值。然后将这些值用于计算每只动物的各自的平均值。
[0134]
数据处理和分析
[0135]
总共16只动物用于研究,每个治疗组n=8只动物。平均每只动物六个切片的定量结果以产生每只动物一个数据点。使用未配对t检验进行统计学分析。*p《0.05;**p《0.01t30肽对比盐水。
[0136]
用于sd大鼠的脑样品的免疫组织学分析的抗体
[0137]
ad相关的病理学检测的表型第一抗体aβ斑块β淀粉样蛋白质6e10τ蛋白质磷酸化τ蛋白质at8神经胶质增生活性的小胶质细胞iba1细胞损失神经元细胞计数neun
[0138]
分析
[0139]
首先,从吸光度值(a
450
)计算空白的标准偏差、检测限(lod)(空白的标准偏差x3.3)和定量限(loq)(空白的标准偏差x10)。如果适用,从所有标准曲线、样品和对照值中减去色原空白的平均值,然后减去空白的平均值,然后减去第二对照的平均值。使用graphpad prism软件,将高于loq的所有值用于绘制图表,并且内插数值(如果适用的话)为pg/ml。使用graphpad prism软件进行所有统计学分析。
[0140]
人类τ蛋白质的简单步骤的elisa试剂盒
–
abcam ab210972:
[0141]
方案如下:
[0142]-制备所有试剂、工作标准品和样品。
[0143]-从板框架中移出过量的微板条,将它们返回到包含干燥剂包装的箔片小袋中,重新密封并且返回到4℃储存。
[0144]-将50μl的所有样品或者标准品添加至适当的孔中。
[0145]-将50μl的抗体混合物添加至每个孔中。
[0146]-密封该板,并且在设定为400rpm的板振荡器上在室温,温育1小时。
[0147]-用3x350μl 1x洗涤缓冲液pt洗涤每个孔。通过从孔中抽吸或者倾析进行洗涤,然后将350μl 1x洗涤缓冲液pt分配到每个孔中。在每个步骤,液体的完全去除对于良好性能是重要的。在最后一次洗涤之后,倒置该板,并且将其放在干净的纸巾上吸干,以去除过量的液体。
[0148]-将100μl tmb底物添加至每个孔中,并且在设置为400rpm的板振荡器上在黑暗中温育10分钟。
[0149]-将100μl终止溶液添加至每个孔中。在板振荡器上振荡板1分钟,以混合。记录450nm处的od,并且这是
[0150]
此外,将第二对照添加至所有板,在归一化期间从所有a
450
值中减去这些第二对照。
[0151]-对于标准曲线的肽,在dh2o中的1x细胞提取缓冲液(试剂盒提供的5x细胞提取缓冲液ptr)加上1x细胞提取增强剂溶液(试剂盒提供的50x细胞提取增强剂溶液)中稀释标准品和所有样品的稀释。
[0152]-通过用dh2o稀释10x洗涤缓冲液pt(试剂盒提供的)制备的1x洗涤缓冲液。
[0153]-抗体混合物:
[0154]
ο1x人类τ蛋白质捕获抗体+1x人类τ蛋白质检测抗体(试剂盒提供的10x形式的两者)稀释中。
[0155]-用于第二对照的抗体:
[0156]
ο在抗体稀释剂cpi(试剂盒提供的)稀释的1x人类τ蛋白质检测抗体(试剂盒提供的10x形式的)。
[0157]
统计学分析:
[0158]-从所有标准品和样品a
450
值中减去空白的平均a
450
的平均值;
[0159]-从所有标准品和样品a
450
值中减去第二对照的a
450
的平均值;
[0160]-用dunnett多重事后比较检验,对每个脑区域对比该区域的对照进行普通单向anova。
[0161]
莫里斯水迷宫方法
[0162]
用22℃的水将2.1m直径的黑色水迷宫池填充到40cm的深度。这使得15cm直径的浸没平台在水平面下方1cm。然后将大鼠放置在一个基点(n,e,s,w)象限处的水中,并允许2分钟发现平台。如果大鼠在该时间内发现该平台,允许它在平台上15秒,轻轻地用毛巾包裹,并且放置在加热灯下。然后移除它。如果大鼠在2分钟内没有发现平台,则通过在大鼠前面的水中拖动手,而将其引导至平台。然后,允许它在平台上15秒,用毛巾包裹,并且放置在加热灯下,然后移除它。每天重复该例行程序4次(最多10天,尽管当前的引证允许6天的试验,其中4天的反向学习),直到大鼠已经清楚地学习迷宫,由连续3天后未发生显著改进来表示。在游泳之间的试验间的间隔时间是10分钟,在参考记忆试验和反向学习试验二者结束时进行探针试验,以探测工作记忆。
[0163]
实施例1
[0164]
主要目的是确定注射到wt大鼠的基底前脑中的单次剂量的t30是否能够神经化学
地诱导“阿尔茨海默样”轮廓,该轮廓被定义为与对照比较,治疗组中的ad相关蛋白质的统计学上显著的增加。其次,这项工作的目的是确定在哪个浓度t30引起这些变化。
[0165]
在诺丁汉大学进行将pbs(对照)或者3个剂量的t30(1μm、50μm和100μm)之一立体定位注射到成年雄性李斯特头巾大鼠的ms/vdb(斜角带的中隔/垂直支)中。注射后2-3周挑选大鼠,提取脑和解剖以分离皮质、海马、小脑和下皮质区域,用于在神经生物学的神经化学分析。分析每个脑区域的总τ蛋白质、β-淀粉样蛋白质42和t14的水平。
[0166]
结果
[0167]
实施例1:β-淀粉样蛋白质(42)
[0168]
参考图1,由于检测样品中的β-淀粉样蛋白质42的困难,高于定量限(loq)的数量较小,并且随后不是所有脑区域和剂量都能够被统计学地分析。从高于loq的那些,与pbs对照比较,以任何剂量,在任何脑区中不存在t30的统计学地显著的影响(1μm:皮质p=0.8843,下皮质p=0.8138,海马p=0.8494,小脑p=不足的数据点;50μm:皮质p=0.7794,下皮质p=2086,海马p=0.2253,小脑p=不足的数据点;100μm:皮质p》0.9999,下皮质p=0.7484,海马p=0.9975,小脑p=0.8069)(参见图1)。
[0169]
注意,显示β-淀粉样蛋白质42的所有数据归一化到阳性对照,而不是以pg/ml计。由于测定的困难,决定pg/ml会给出不准确的定量,并且因此给出不可靠的数据的表示。
[0170]
实施例2:总τ蛋白质
[0171]
参考图2,发现与pbs对照比较,在1μm和50μm浓度的t30,在所有脑区域中显著地增加了总τ蛋白质水平(1μm:皮质p=0.0186,下皮质p=0.0003,海马p=0.0015,小脑p=0.0052;50μm:皮质p=0.0339,下皮质p=0.0042,海马p=0.0409,小脑p=0.0104)。与pbs对照比较,在t30的最高剂量(100μm),在任何脑区域中的总τ蛋白质水平没有显著地差异(皮质p=0.8976,下皮质p=0.9824,海马p=0.6805,小脑p=0.5228)(图2)。
[0172]
参考图3,可以看到在解剖的大鼠脑区域中的τ蛋白质的百分比。
[0173]
(i)1μm t30:导致皮质中τ蛋白质增加50%、下皮质中τ蛋白质90%增加、海马中τ蛋白质60%增加和小脑中τ蛋白质80%增加。
[0174]
(ii)50μm t30:导致皮质中τ蛋白质增加45%、下皮质中τ蛋白质增加70%、海马中τ蛋白质增加40%以及小脑中τ蛋白质增加70%。
[0175]
实施例3-t14
[0176]
参照图4,与对照(pbs)比较,在所分析的脑的任何区域(皮质、下皮质、小脑)中,在t30的任何浓度(1μm、50μm或者100μm),t14的水平没有显著差异(1μm:皮质p=0.3670,下皮质p=0.7354,小脑p=0.1273;50μm:皮质p=0.9917,下皮质p=0.9996,小脑p=0.9952;100μm:皮质p=0.8740,下皮质p》0.9999,小脑p=0.6297)(图3)。值得注意的是,留下有限的样品用于t14分析。没有留下待试验的海马样品。
[0177]
实施例4-在sd大鼠中ache衍生肽(t30)对阿尔茨海默病相关参数(pτ,neun)的影响
[0178]
如这些方法中所述的,使用低温恒温器制备来自sd大鼠的矢状脑切片,该大鼠接受了t30肽或者盐水的急性施用。从中线开始收集每个第六切片,并且将每只动物的六个切片进行免疫染色,用于检测aβ(6e10)、pτ(ps202/pt205)、小胶质细胞(iba1)以及神经元(neun)。对于所有动物样品,将第一抗体组合在两个共染色组中。在5个不同的目的区域
(roi)中进行不同标记的定量分析,并且包括皮质、海马、基底前脑、中脑和脑桥/髓质。
[0179]
参考图7,在用t30肽或者盐水急性处理之后,来自wtsd大鼠的切片的免疫组织化学染色。在海马、皮质、中脑、基底前脑或者脑桥/髓质中没有检测到细胞内pτ(黄色)。neun(绿色)用于检测神经元,并且用dapi(蓝色)检测细胞核。因此,免疫组织化学结果显示在来自用t30肽或者盐水处理的sd大鼠的任何染色的脑切片中,在皮质、海马、中脑、基底前脑或者脑桥/髓质中不能检测到细胞内pτ(ps202/pt205)蛋白质(参见图7)。有趣的是,与盐水处理的动物比较,在施用t30肽之后在sd大鼠的中脑中观察到neun阳性细胞密度的显著的减少(参见图7)。
[0180]
参考图8,示出了在用t30肽或者盐水处理之后,在wt sprague dawley大鼠的皮质、海马、中脑、脑桥/髓质和基底前脑中neun阳性细胞的密度的定量。如可以看到的,在其他脑区域,包括皮质、海马、基底前脑中没有观察到neun阳性细胞的密度的差异,虽然在脑桥/髓质区域中观察趋于到减少的趋势(参见图8)。
[0181]
实施例5-在sd大鼠中ache衍生肽(t30)对阿尔茨海默病相关参数(6e10,iba1)的影响
[0182]
制备来自sd的矢状脑切片,并且在第二组共染色中进行ihc用于检测aβ和iba1。在盐水或者t30肽处理的大鼠的海马、皮质、中脑、基底前脑或者脑桥/髓质中未观察到特异性细胞内或者细胞外aβ免疫反应性(图8)。
[0183]
此外,在皮质、海马、皮质、中脑、基底前脑或者脑桥/髓质中未观察到iba1阳性细胞的总数或者密度的差异(参见图8)。
[0184]
实施例6-动物模型行为研究
[0185]
1)莫里斯水迷宫时间点1
[0186]
mwm 6天学习曲线和进一步的4天反向学习曲线两者都揭示在任何天的治疗组中没有显著差异。具有重复测量的双向anova(基因型x天)。探针试验(pt)和反向探针试验(rpt)在处理组之间用于花费在靶象限中或者访问靶象限的它们时间没有显著差异。双向anova(基因型x象限)。
[0187]
然而,参考图11,虽然在pt中在靶平台位置中花费的时间或者访问靶平台位置花费的时间没有显著差异;但是对于肽组,发现在rpt期间在靶平台位置中花费的时间显著减少p=0.011。双向anova(基因型x平台)。此外,在基因型与平台之间发现相互作用(p=0.014)。
[0188]
虽然探针试验揭示在两个治疗组中靶象限的良好区分;这在用于访问进入靶象限和靶平台区的反向探针试验期间,在肽组中不太明显。这通过对靶平台和象限区的访问与先前在探针试验中为靶的区之间没有显著差异来表示。
[0189]
2)莫里斯水迷宫时间点2
[0190]
mwm 4-天学习曲线和进一步的4-天反向学习曲线两者都表示在任何天的治疗组中没有显著差异。具有重复测量的双向anova(基因型x天)。在探针试验(pt)和反向探针试验(rpt)中,在处理组之间用于花费在靶象限中或者访问靶象限的它们时间没有显著差异。双向anova(基因型x象限)。
[0191]
参考图12,发现对于pt中花费在目标平台位置,但是不访问目标平台位置的时间存在显著差异。与盐水对照比较,肽组揭示在平台位置花费时间的减少(p=0.01)。此外,发
human transferative breast cancer cell line)”,biochimica et biophysica acta,1760(3):415-420)以及α7转染的卵母细胞(greenfield等,2004,“新的肽调节α7烟碱性受体应答:启示脑内可能的营养有毒的机理(a novel peptide modulates alpha 7nicotinic receptor responses:implications for a possible trophic-toxic mechanism within the brain).j neurochem 90,325-331)以及在脑切片中(bon et al.,2003,乙酰胆碱酯酶衍生的肽的生物活性:鸟嘌呤猪海马的电生理表征“bioactivity of apeptide derived from acetylacetylcholidase:electrophysiological characterization in guanine-pig hemapus”),eur j neurosci 17,1991-1995)和器官型海马神经元(day和greenfield 2004,体外乙酰胆碱酯酶对海马神经元的非胆碱能的营养作用:分子机理(a non-cholinergic,trophic action of acetylcholidase on hamamal neurones in vitro:molecular mechanisms),neuroscience 111,649-656)的高剂量的肽所见。
[0207]
然而,在更低剂量(小于100μm),其中增强的钙流入是有活力的,t30肽诱导gsk的活化(garcia rates等,2016年,“(i)α7烟碱性受体的新的调节剂的药理学轮廓:在阿尔茨海默病患者大脑中增加的有毒的乙酰胆碱酯酶衍生的肽的阻断(pharmacological profiling of a novel modulator of theα7nicotinic receptor:blockade of a toxic acetylcholine-derived peptide increased in alzheimer brain)”,neuropharmacology,105卷,487-499页),这进而引起增加的τ蛋白质的磷酸化(rankin等,2007,“通过gsk-3β的τ蛋白质磷酸化促进缠结样细丝形态学(tau phosphorylation by gsk-3βpromotes tangle-like filament morphology),mol neurodegener 2:12),进而促进缠结的形成,缠结是ad的主要标记(braak和braak 2011,“阿尔茨海默病中病理学过程的阶段:从1岁至100岁的年龄类别(stage of the pathological process in alzheimer disease:age category from 1to 100years),j.neuropathol expneurol.70(11):960-9)。换言之,发明人已经出惊奇地显示出低μm剂量的t30是受体介导的,而高剂量不是受体介导的,并且这是完全出人意料的。因此,本发明人认为,在其是受体介导的1-99μm t30的剂量范围是最佳和优选的。
[0208]
图6示出了由细胞中的t30的效应导致的事件的级联;
[0209]
(1)t30结合受体的变构位点,以增强ca
2+
流入细胞的通道的打开(greenfield等,2004,“新的肽调节α7烟碱性受体应答:启示脑内可能的营养有毒的机理(a novel peptide modulates alpha 7nicotinic receptor responses:implications for a possible trophic-toxic mechanism within the brain)).j neurochem90,325-331;
[0210]
(2)钙进入诱导电压依赖性(l-vocc)通道的去极化和打开,这允许更多的ca
2+
进入细胞(dickinson等,2007,“在pc12细胞中α7和非α7烟碱性乙酰胆碱受体与钙诱导的钙释放和电压操作的钙通道的差异偶联(dickinson et al.,2007,“differential coupling of alpha7 and non-alpha7nicotinic acetylcholine receptors to calcium-induced calcium release and voltage-operated calcium channels in pc 12cells.j.neurochem.2007年2月;100(4):1089-96);
[0211]
(3)这种升高的细胞内钙诱导包括t30的ache g4释放的增加(greenfield,2013,“发现和靶向神经变性的基本机理:乙酰胆碱酯酶c-末端的肽在化学-生物学相互作用中的
作用(discovering and targeting the basic mechanism of neurodegeneration:the role of peptides from the c-terminal of acetylcholidase chemico-biological interactions)”,203(3):543-6);
[0212]
(4)钙还诱导α7烟碱性受体的上调,这将允许更多的ca
2+
通过为t30提供更多靶而进入细胞(bond等,2009,“通过乙酰胆碱酯酶c-末端的肽上调α7烟碱性受体(upregulation of alpha 7nicotinic receptors by acetylcholinesterase c-terminal peptides).plos one,4);
[0213]
(5)钙激活酶(即,gsk-3)将(a)增加τ蛋白质,(b)激活γ-分泌酶/β-分泌酶,这将触发细胞外有毒的淀粉样蛋白质的裂解,(c)与t30一起将促进更进一步有毒的量的ca
2+
进入细胞。(hartigan和johnson(1999),“细胞内钙的瞬时增加导致通过糖原合酶激酶3β-依赖性路径的τ蛋白质磷酸化的延长的位点选择性增加”。j biol chem.23;274(30):21395-401),cai等(2012,“在阿尔茨海默病中糖原合酶激酶3的作用(roles of glycogen synthase kinase 3in alzheimer's disease),curr alzheimer res.9(7):864-79),garcia-rat
é
s等(2013,在体外,新的生物活性肽对β-淀粉样蛋白的加性毒性:阿尔茨海默病的可能的启示(additive toxicity ofβ-amyloid by anovel bioactive peptide in vitro:possible implications for alzheimer’s disease),plos one 8(2):e54864)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1