一种椰枣组培中抑制内生菌及材料褐化的培养基及应用
1.本发明涉及植物生物技术领域,更具体的说是涉及一种椰枣组培过程中抑制内生菌及材料褐化的培养基及制备方法和使用方法。
背景技术:
2.椰枣树是多年生热带棕榈植物,雌雄异株,是阿拉伯国家的重要木本粮食作物。椰枣可以采用种子繁殖后代,但由于其是雌雄异株的植物,处于高度杂合状态,这种繁殖方法在生产上会丧失亲本的目标性状,不能很好的保证母株的优良特性和果实特征。
3.目前在国际上,蘖苗分枝和组织培养是椰枣苗繁殖的主要方法,每株椰枣苗在其生长周期内,分蘖苗繁殖数量在15
‑
25株,繁殖数量严重受限,其中椰枣种苗商业化生产主要依靠组培苗,椰枣作为棕榈科作物,组培周期漫长,过程繁琐复杂,组培成本高,在国际市场上,每株椰枣组培苗平均售价达到50美金。在一个组培流程中,外植体接种的30天内是内生菌感染的高发期,70
‑
90天是材料褐化的高发期,这些问题都造成科研材料的极大浪费。椰枣作为外来引进物种,国内椰枣资源种类和数量相对匮乏,椰枣材料显得尤为珍贵,抑制内生菌、控制褐化率可以在最大程度上保存利用组培材料,应用于生产实践可以极大降低组培成本。
4.但是,目前国内外在椰枣组培工作方面,没有关于此项技术的使用和记载。
5.因此,如何提供一种能够在椰枣组培过程中抑制内生菌并防止材料褐化的培养基是本领域技术人员亟需解决的问题。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种椰枣组培中抑制内生菌及材料褐化的培养基及其制备方法和使用方法,本发明椰枣组培中抑制内生菌及材料褐化的培养基可以抑制组培过程中内生菌的污染率及材料褐化率。以椰枣茎尖生长组织为外植体,使外植体在保持高分化能力的前提下实现脱毒处理,在培养过程中,外植体内生菌污染率控制在9%以下,褐化率控制在13%以下,诱导率85%以上,组培材料利用率87%以上,最大程度的提高了科研材料的利用率,缩短了诱导周期,降低了组培成本。
7.为了实现上述目的,本发明采用如下技术方案:
8.一种椰枣组培中抑制内生菌及材料褐化的培养基,包括试剂a、试剂b和试剂c;
9.所述试剂a为含山农一号ⅰ型杀菌剂的1/2ms盐溶液;
10.所述试剂b为含山农一号ⅲ型杀菌剂、植物凝胶、蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆、萘乙酸、聚乙烯吡咯烷酮、乙烷磺酸一水和活性炭的ms盐溶液;
11.所述试剂c为含植物凝胶、蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、肌醇、6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、萘乙酸、聚乙烯吡咯烷酮、乙烷磺酸一水和活性炭的ms盐溶液;
12.且,试剂a中所述山农一号ⅰ型杀菌剂终浓度为1
‑
5%wt;
13.试剂b中所述山农一号ⅲ型杀菌剂终浓度为0.1
‑
0.2%wt,所述植物凝胶终浓度3.5g/l,所述蔗糖终浓度30g/l,所述谷氨酰胺终浓度100mg/l,所述盐酸吡哆醇终浓度1mg/l,所述烟酸终浓度0.5mg/l,所述6
‑
苄氨基腺嘌呤终浓度0.2
‑
0.8mg/l,所述异戊烯基腺嘌呤终浓度0.1
‑
0.5mg/l,所述2,4
‑
二氯苯氧乙酸终浓度0.02
‑
0.08mg/l,所述噻苯隆终浓度0.02
‑
0.08mg/l,所述萘乙酸终浓度0.08
‑
0.12mg/l,所述聚乙烯吡咯烷酮终浓度0.5
‑
1g/l,所述乙烷磺酸一水终浓度1g/l,所述活性炭终浓度0.25
‑
1g/l;
14.试剂c中所述植物凝胶终浓度3.5g/l,所述蔗糖终浓度30g/l,所述谷氨酰胺终浓度200mg/l,所述盐酸吡哆醇终浓度0.3mg/l,所述烟酸终浓度0.5mg/l,所述肌醇终浓度100mg/l,所述6
‑
苄氨基腺嘌呤终浓度1
‑
4mg/l,所述异戊烯基腺嘌呤终浓度1
‑
3mg/l,所述2,4
‑
二氯苯氧乙酸终浓度2
‑
6mg/l,所述萘乙酸终浓度3
‑
6mg/l,所述聚乙烯吡咯烷酮终浓度0.5
‑
1g/l,所述乙烷磺酸一水终浓度1g/l,所述活性炭终浓度0.5
‑
1g/l。
15.本发明的有益效果在于:山农一号杀菌剂是无色透明液体,无毒,ph为3.8,2
‑
6℃避光贮藏,是一种广谱生物杀灭剂,能够杀死各种细菌和真菌细胞,阻止孢子萌发,在较高浓度下,能够消除外植体的内生菌污染。试验证明其活性成分能够穿透菌类细胞壁,抑制部分参与主要新陈代谢循环的酶类活性,抑制柠檬酸循环和电子传递等,同时也能够阻断一些单糖和氨基酸从培养基到菌类细胞的运转。山农一号杀菌剂对真菌和细菌都十分有效,具有广谱性的杀灭作用,比抗生素稳定,耐高压灭菌,能与抗生素类配合使用。山农一号杀菌剂是针对抑制多种菌类代谢酶活性而设计的,因此在组培过程中,不会引起菌类的抗药性,可多代使用。具体的,山农一号i型杀菌剂是外植体剂型杀菌剂,杀菌能力强,渗透性强,主要用于外植体消毒;山农一号ⅲ型杀菌剂是共生菌专用剂型,更偏重于抑菌效果,对内生菌污染的防治更为有效。本发明将山农一号i型杀菌剂和山农一号ⅲ型杀菌剂复配,对组培苗有显著的抑菌效果,能有效地挽救污染组培苗,恢复率达70%以上;增加组培苗鲜重和株高,提高增殖倍数1
‑
3倍。
16.ms盐的特点是无机盐和离子浓度较高,是较稳定的离子平衡溶液,它的硝酸盐含量高,养分数量和比例合适,能满足植物细胞的营养和生理需要,因而适用范围比较广,多数植物组织培养快速繁殖用它作为培养的基本培养基。
17.植物凝胶具有无色、透亮和高韧性的特点,是配制植物组织培养基和微生物培养基的主要成分。由于其克服了传统琼脂在植物组织培养中的固有缺陷为植物学研究带来了一场新的革命,已经成为了国际公认的植物组培首选产品。
18.蔗糖除供能之外,还能诱导愈伤组织组织的再分化;培养基高温灭菌时,蔗糖更稳定,葡萄糖比蔗糖容易碳化;植物细胞中含有蔗糖转化酶,可以吸收和利用蔗糖,蔗糖又比葡萄糖便宜;植物组织培养大部分是应用到工业上,所以用蔗糖的比较多,减少成本利益;同样作为碳源和能源物质,蔗糖较葡萄糖能更好地维持培养基内的低渗环境,配制相同质量分数的培养基,蔗糖形成的渗透压要明显低于葡萄糖,若采用葡萄糖作为碳源,易使植物细胞脱水而生长不良,同时,植物细胞吸收蔗糖的速率要明显慢于吸收葡萄糖的速率,所以蔗糖形成的渗透压可较长时间地保持相对稳定;植物组织培养过程中,要特别注意防止培养基受到微生物的污染,微生物生长所需的碳源最适合的是葡萄糖,而较少利用蔗糖,因此采用蔗糖作为培养基的碳源,可在一定程度上减少微生物的污染;从能源供应来说,相同物
质的量浓度下,蔗糖比葡萄糖提供的能量多。
19.谷氨酰胺是细胞生长的必须氨基酸,为培养的细胞提供重要的能量来源。
20.盐酸吡哆醇即维生素b6,烟酸即维生素b3,两者常以辅酶形式参与酶系的活动,以及参与细胞的蛋白质代谢、脂肪代谢和糖代谢等重要生命活动。
21.肌醇本身不直接促进培养物的生长,可有助于活性物质作用的发挥,提高维生素的效果,参与碳水化合物代谢、磷脂代谢和离子平衡作用,从而促进培养物的生长和胚芽状体及芽的形成。
[0022]6‑
苄氨基腺嘌呤(6
‑
ba),英文名称:n
‑
(phenylmethyl)
‑
9h
‑
purin
‑6‑
amine,分子式:c
12
h
11
n5,分子量:225.25。该产品是第一个人工合成的细胞分裂素,能够抑制植物叶内叶绿素、核酸、蛋白质的分解,在促进发芽、促进花芽分化、提高坐果率、促进果实生长、提高果品品质等多方面表现良好。机理:属广谱性植物生长调节剂,可促进植物细胞生长,抑制植物叶绿素的降解,提高氨基酸的含量,延缓叶片衰老等,可用于发绿豆芽和黄豆芽,最大使用量为0.01g/kg,残留量小于0.2mg/kg,诱导芽的分化,促进侧芽生长,促进细胞分裂,还能减少植物体内叶绿素的分解,具有抑制衰老、保绿作用。
[0023]
异戊烯基腺嘌呤(2
‑
ip),英文名称:n6
‑
(2
‑
isopentenyl)adenosine,分子式:c
10
h
13
n5,分子量:203.25。该产品是为链霉素通过经深层发酵而制成的腺嘌呤细胞分裂素植物生长调节剂,作用特点是对蛋白质合成、酶活性及细胞代谢平衡具有调节作用,主要生理功能是促进细胞分裂和分化以及生长活跃部位的生长发育,适用于多种作物一般增产12%
‑
14%;刺激植物细胞分裂,促进叶绿素形成,加速植物新陈代谢和蛋白质的合成,从而达到有机体迅速增长,促使作物早熟丰产,提高植物抗病看衰抗寒能力,主要用于调节水稻、玉米、大豆等农作物的生长。主要用途:1.刺激愈伤组织分化,诱导生芽;2.促进苹果、梨、蔷薇的腋芽生枝;3.促进瓜果座果,提高坐果率,从而达到了增产效果;4.促进叶菜类保鲜。
[0024]6‑
苄氨基腺嘌呤(6
‑
ba)、异戊烯基腺嘌呤(2
‑
ip)和噻苯隆(tdz)都是细胞分裂素,作用主要有:促进细胞分裂和扩大,抑制茎的伸长,而使茎增粗,解除顶端优势,诱导芽的分化,促进侧芽萌发,增强蛋白质合成,延缓组织的衰老。
[0025]
2,4
‑
二氯苯氧乙酸(2,4
‑
d)和萘乙酸(naa)都是人工合成的生长素类调节剂,既稳定又廉价,用于初代培养,启动细胞分化。
[0026]
在进行组培中,将细胞分裂素和生长素配合使用,指导生长调节物质在生产中的应用,即,细胞分裂素与生长素的比例大时,促进芽的形成,这时细胞分裂素起到主导作用;比例小时,则有利于根的形成,这时生长素起主导作用。培养基中的细胞分裂素与生长素之间的比例是决定器官分化的关键。
[0027]
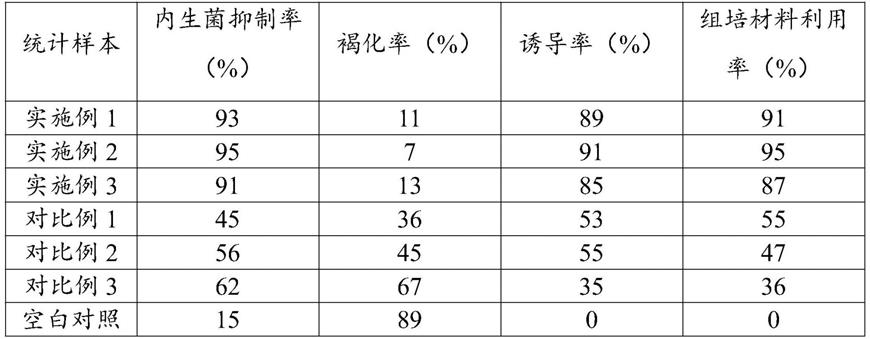
聚乙烯吡咯烷酮(pvp)是一种非离子型高分子化合物,作为高分子表面活性剂。
[0028]
乙烷磺酸一水(mes)用于稳定ph值,保证配制好的培养基在经历过高温灭菌后ph值不会改变。
[0029]
活性炭(ac)的目的主要是利用其吸附能力,减少有害物质的不利影响,同时也创造暗环境,对某些植物诱导生根有利。一般认为,活性炭之所以有强大的吸附能力,主要是通过氢键、范德华力等作用力,把有毒物质从外植体周围吸附掉。活性炭除了有吸附作用外,在一定程度上还降低光照强度,从而减轻褐变。
[0030]
进一步,试剂a中所述山农一号ⅰ型杀菌剂终浓度为4.5%wt;
[0031]
试剂b中所述山农一号ⅲ型杀菌剂终浓度为0.12%wt,所述6
‑
苄氨基腺嘌呤终浓度0.5mg/l,所述异戊烯基腺嘌呤终浓度0.2mg/l,所述2,4
‑
二氯苯氧乙酸终浓度0.05mg/l,所述噻苯隆终浓度0.05mg/l,所述萘乙酸终浓度0.1mg/l,所述聚乙烯吡咯烷酮终浓度0.5g/l,所述活性炭终浓度0.5g/l;
[0032]
试剂c中所述6
‑
苄氨基腺嘌呤终浓度2mg/l,所述异戊烯基腺嘌呤终浓度1.5mg/l,所述2,4
‑
二氯苯氧乙酸终浓度4mg/l,所述萘乙酸终浓度5mg/l,所述聚乙烯吡咯烷酮终浓度1g/l,所述活性炭终浓度1g/l。
[0033]
一种上述椰枣组培中抑制内生菌及材料褐化的培养基的制备方法,具体包括以下步骤:
[0034]
(1)按上述椰枣组培中抑制内生菌及材料褐化的培养基的配比称取各原料;
[0035]
(2)用无菌水溶解1/2ms盐,加入山农一号ⅰ型杀菌剂,无菌水定容,灭菌,得试剂a;
[0036]
(3)分别使用0.8
‑
1.2mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸分别溶解,备用;
[0037]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸,搅拌均匀,调节ph,再加入植物凝胶和活性炭,加热搅拌,再加入山农一号ⅲ型杀菌剂,无菌水定容,灭菌,得试剂b;
[0038]
(4)分别使用0.8
‑
1.2mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸分别溶解,备用;
[0039]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、肌醇、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸,搅拌均匀,调节ph,再加入植物凝胶和活性炭,加热搅拌,无菌水定容,灭菌,得试剂c。
[0040]
进一步,上述步骤(3)和(4)中,所述ph值为5.5
‑
6.0,优选5.6;上述步骤(2)
‑
(4)中,灭菌的压强为100kpa,温度为121℃,时间为15min。
[0041]
本发明试剂配制过程中,部分成分先采用氢氧化钠进行溶解,再加入试剂中,作用在于分析纯状态的6
‑
苄氨基腺嘌呤和异戊烯基腺嘌呤等是粉末状,通常使用甲醇或者乙醇来溶解从而配制成所需要的溶液浓度,但是发明人在长期的实验中发现,使用甲醇或者乙醇溶解的6
‑
苄氨基腺嘌呤和异戊烯基腺嘌呤等放置后容易出现析出现象,在溶液中有雪花状物质析出,而使用氢氧化钠溶解后的溶液性质稳定,存放期没有出现药品析出现象。
[0042]
一种上述椰枣组培中抑制内生菌及材料褐化的培养基的使用方法,具体包括以下步骤:
[0043]
具体包括以下步骤:
[0044]
(1)制备椰枣外植体;
[0045]
(2)将切好的椰枣外植体放入试剂a中,保证外植体与试剂a的充分接触,摇床上摇8
‑
10小时,取出,得椰枣外植体ⅰ;
[0046]
(3)将椰枣外植体ⅰ放入试剂b中进行启动培养30
‑
45天,启动培养结束后,将外植体在超净工作台上取出,清理外植体表面的褐化细胞,得椰枣外植体ⅱ;
[0047]
(4)将椰枣外植体ⅱ放入试剂c中进行继代培养,直至度过90天褐化的高发期,得到椰枣外植体ⅲ;
[0048]
(5)将椰枣外植体ⅲ继代转接至胚性愈伤组织诱导培养基中,诱导出愈伤组织。
[0049]
进一步,上述步骤(2)摇床温度28℃,无光照;步骤(3)启动培养、步骤(4)继代培养、步骤(5)诱导培养时,培养室条件均为温度28℃,湿度60%,暗培养。
[0050]
进一步,上述步骤(4)中,继代培养过程中,每20
‑
30天继代一次。
[0051]
进一步,上述步骤(5)中,诱导培养基为,诱导培养时温度、光照、湿度
[0052]
进一步,上述步骤(1)中,制备椰枣外植体的具体操作步骤为:将使用消毒剂处理过的椰枣树连根部一起砍伐,切掉根部,留下基部,外部叶片层层环剥,去掉木质部,直到裸露出白色幼嫩叶片包裹的茎尖分生组织,然后将其放进抗褐化剂中浸泡2
‑
3h,取出后放到超净工作台上继续环剥2层叶片后放进75%酒精中浸泡30s,然后用无菌水冲洗干净,放进2%的次氯酸钠中浸泡20min,期间不停摇晃消毒缸,保证外植体充分接触消毒液,取出后用无菌水冲洗干净,放置于干净的滤纸上,用手术刀将包裹茎尖生长组织的最后两层叶片剥开,露出金字塔形状的生长组织,根据生长组织的大小,纵切呈4
‑
6块,得到椰枣外植体,备用。
[0053]
经由上述的技术方案可知,与现有技术相比,本发明的有益效果如下:
[0054]
1、本发明椰枣组培中抑制内生菌及材料褐化的培养基用于处理脱毒后的外植体以及对外植体进行启动培养,经过处理的外植体,不仅可以减轻消毒剂对幼嫩外植体的伤害,而且在接种30
‑
45天的启动培养阶段,可以将外植体内生菌的污染率控制在9%以下,在培养的70
‑
90天褐化高发期,将褐化率控制在13%以下,诱导率85%以上,组培材料利用率87%以上,提高科研材料利用率,为后期胚性愈伤组织的诱导提供健康、分化能力强的体细胞,缩短培养周期,降低组培成本。
[0055]
2、常规发明是将外植体经过消毒剂脱毒后直接接种至高浓度激素含量的诱导培养基中,会导致在前期的培养中内生菌污染损失一批材料,继代培养后,外植体褐化,大片细胞死亡,造成材料损失。
[0056]
而本发明在使用消毒剂对外植体脱毒后,继续用广谱型生物杀灭剂山农一号ⅰ型杀菌剂浸泡,此杀灭剂采用先进的化学合成工艺将抑菌基团密集连接而成,能够杀死各种细菌和真菌细胞,阻止孢子萌发,转接进启动培养基,启动培养基内含山农一号ⅲ型杀菌剂,可以在培养过程有效抑制内生菌滋生,内含低剂量生长素和细胞分裂素,可以给脱离母体后的外植体一个充分适应外源激素的过程,在后期诱导阶段,即使增加激素浓度仍然可以有效的控制褐化,保护85%以上的健康体细胞,为后期诱导胚性愈伤组织提供活力充足的外植体。在我国椰枣树极度匮乏的形势下,本发明通过控制内生菌瓶内滋生和褐化问题,可以将外植体的综合利用率提高至85%
‑
95%,在材料方面大大降低了科研成本。
附图说明
[0057]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
[0058]
图1附图为本发明实施例1椰枣外植体示意图;
[0059]
图2附图为本发明实施例1椰枣外植体ⅱ示意图;
[0060]
图3附图为本发明实施例1椰枣外植体ⅲ示意图;
[0061]
图4附图为本发明实施例1椰枣愈伤组织示意图。
具体实施方式
[0062]
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0063]
实施例1
[0064]
椰枣组培中抑制内生菌及材料褐化的培养基,包括试剂a、试剂b和试剂c;
[0065]
所述试剂a为含山农一号ⅰ型杀菌剂(终浓度1%wt)的1/2ms盐溶液;
[0066]
所述试剂b为含山农一号ⅲ型杀菌剂(终浓度0.1%wt)、植物凝胶(终浓度3.5g/l)、蔗糖(终浓度30g/l)、谷氨酰胺(终浓度100mg/l)、盐酸吡哆醇(终浓度1mg/l)、烟酸(终浓度0.5mg/l)、6
‑
苄氨基腺嘌呤(终浓度0.2mg/l)、异戊烯基腺嘌呤(终浓度0.1mg/l)、2,4
‑
二氯苯氧乙酸(终浓度0.02mg/l)、噻苯隆(终浓度0.02mg/l)、萘乙酸(终浓度0.08mg/l)、聚乙烯吡咯烷酮(终浓度0.5g/l)、乙烷磺酸一水(终浓度1g/l)和活性炭(终浓度0.25g/l)的ms盐溶液;
[0067]
所述试剂c为含植物凝胶(终浓度3.5g/l)、蔗糖(终浓度30g/l)、谷氨酰胺(终浓度200mg/l)、盐酸吡哆醇(终浓度0.3mg/l)、烟酸(终浓度0.5mg/l)、肌醇(终浓度100mg/l)、6
‑
苄氨基腺嘌呤(终浓度1mg/l)、异戊烯基腺嘌呤(终浓度1mg/l)、2,4
‑
二氯苯氧乙酸(终浓度2mg/l)、萘乙酸(终浓度3mg/l)、聚乙烯吡咯烷酮(终浓度0.5g/l)、乙烷磺酸一水(终浓度1g/l)和活性炭(终浓度0.5g/l)的ms盐溶液;
[0068]
上述椰枣组培中抑制内生菌及材料褐化的培养基的制备方法,具体包括以下步骤:
[0069]
(1)按上述椰枣组培中抑制内生菌及材料褐化的培养基的配比称取各原料;
[0070]
(2)用无菌水溶解1/2ms盐,加入山农一号ⅰ型杀菌剂,无菌水定容,121℃灭菌15min,得试剂a;
[0071]
(3)分别使用0.8mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸分别溶解,备用;
[0072]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸,搅拌均匀,调节ph至5.6,再加入植物凝胶和活性炭,加热搅拌,再加入山农一号ⅲ型杀菌剂,无菌水定容,121℃灭菌15min,得试剂b;
[0073]
(4)分别使用0.8mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸分别溶解,备用;
[0074]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、肌醇、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二
氯苯氧乙酸和萘乙酸,搅拌均匀,调节ph至5.6,再加入植物凝胶和活性炭,加热搅拌,无菌水定容,121℃灭菌15min,得试剂c。
[0075]
上述椰枣组培中抑制内生菌及材料褐化的培养基的使用方法,其特征在于,具体包括以下步骤:
[0076]
(1)制备椰枣外植体:将使用消毒剂处理过的椰枣树连根部一起砍伐,切掉根部,留下基部,外部叶片层层环剥,去掉木质部,直到裸露出白色幼嫩叶片包裹的茎尖分生组织,然后将其放进抗褐化剂(150mg/l抗坏血酸+75mg/l柠檬酸)中浸泡2h,取出后放到超净工作台上继续环剥2层叶片后放进75%酒精中浸泡30s,然后用无菌水冲洗干净,放进2%的次氯酸钠中浸泡20min,期间不停摇晃消毒缸,保证外植体充分接触消毒液,取出后用无菌水冲洗干净,放置于干净的滤纸上,用手术刀将包裹茎尖生长组织的最后两层叶片剥开,露出金字塔形状的生长组织,根据生长组织的大小,纵切呈4
‑
6块,得到椰枣外植体(参见附图1),备用;
[0077]
(2)将切好的椰枣外植体放入试剂a中,保证外植体与试剂a的充分接触,避光,温度设置为28度,摇床上摇8h,取出,得椰枣外植体ⅰ;
[0078]
(3)将椰枣外植体ⅰ放入试剂b中进行启动培养30天,避光培养,温度设置为28度,湿度设置为60%,启动培养结束后,将外植体在超净工作台上取出,清理外植体表面的褐化细胞,得椰枣外植体ⅱ,(参见附图2);
[0079]
(4)将椰枣外植体ⅱ放入试剂c中进行继代培养,避光培养,温度设置为28度,湿度设置为60%,每20天继代一次,直至度过90天褐化的高发期,得到椰枣外植体ⅲ(参见附图3);
[0080]
(5)将椰枣外植体ⅲ继代转接至胚性愈伤组织诱导培养基中,避光培养,温度设置为28度,湿度设置为60%,诱导出愈伤组织。(参见附图4)。
[0081]
实施例2
[0082]
椰枣组培中抑制内生菌及材料褐化的培养基,包括试剂a、试剂b和试剂c;
[0083]
所述试剂a为含山农一号ⅰ型杀菌剂(终浓度4.5%wt)的1/2ms盐溶液;
[0084]
所述试剂b为含山农一号ⅲ型杀菌剂(终浓度0.12%wt)、植物凝胶(终浓度3.5g/l)、蔗糖(终浓度30g/l)、谷氨酰胺(终浓度100mg/l)、盐酸吡哆醇(终浓度1mg/l)、烟酸(终浓度0.5mg/l)、6
‑
苄氨基腺嘌呤(终浓度0.5mg/l)、异戊烯基腺嘌呤(终浓度0.2mg/l)、2,4
‑
二氯苯氧乙酸(终浓度0.05mg/l)、噻苯隆(终浓度0.05mg/l)、萘乙酸(终浓度0.1mg/l)、聚乙烯吡咯烷酮(终浓度0.5g/l)、乙烷磺酸一水(终浓度1g/l)和活性炭(终浓度0.5g/l)的ms盐溶液;
[0085]
所述试剂c为含植物凝胶(终浓度3.5g/l)、蔗糖(终浓度30g/l)、谷氨酰胺(终浓度200mg/l)、盐酸吡哆醇(终浓度0.3mg/l)、烟酸(终浓度0.5mg/l)、肌醇(终浓度100mg/l)、6
‑
苄氨基腺嘌呤(终浓度2mg/l)、异戊烯基腺嘌呤(终浓度1.5mg/l)、2,4
‑
二氯苯氧乙酸(终浓度4mg/l)、萘乙酸(终浓度5mg/l)、聚乙烯吡咯烷酮(终浓度1g/l)、乙烷磺酸一水(终浓度1g/l)和活性炭(终浓度1g/l)的ms盐溶液;
[0086]
上述椰枣组培中抑制内生菌及材料褐化的培养基的制备方法,具体包括以下步骤:
[0087]
(1)按上述椰枣组培中抑制内生菌及材料褐化的培养基的配比称取各原料;
[0088]
(2)用无菌水溶解1/2ms盐,加入山农一号ⅰ型杀菌剂,无菌水定容,121℃灭菌15min,得试剂a;
[0089]
(3)分别使用1mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸分别溶解,备用;
[0090]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸,搅拌均匀,调节ph至5.6,再加入植物凝胶和活性炭,加热搅拌,再加入山农一号ⅲ型杀菌剂,无菌水定容,121℃灭菌15min,得试剂b;
[0091]
(4)分别使用1mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸分别溶解,备用;
[0092]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、肌醇、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸,搅拌均匀,调节ph至5.6,再加入植物凝胶和活性炭,加热搅拌,无菌水定容,121℃灭菌15min,得试剂c。
[0093]
上述椰枣组培中抑制内生菌及材料褐化的培养基的使用方法,其特征在于,具体包括以下步骤:
[0094]
(1)制备椰枣外植体:将使用消毒剂处理过的椰枣树连根部一起砍伐,切掉根部,留下基部,外部叶片层层环剥,去掉木质部,直到裸露出白色幼嫩叶片包裹的茎尖分生组织,然后将其放进抗褐化剂(150mg/l抗坏血酸+75mg/l柠檬酸)中浸泡2.5h,取出后放到超净工作台上继续环剥2层叶片后放进75%酒精中浸泡30s,然后用无菌水冲洗干净,放进2%的次氯酸钠中浸泡20min,期间不停摇晃消毒缸,保证外植体充分接触消毒液,取出后用无菌水冲洗干净,放置于干净的滤纸上,用手术刀将包裹茎尖生长组织的最后两层叶片剥开,露出金字塔形状的生长组织,根据生长组织的大小,纵切呈4
‑
6块,得到椰枣外植体,备用;
[0095]
(2)将切好的椰枣外植体放入试剂a中,保证外植体与试剂a的充分接触,避光,温度设置为28度,摇床上摇9h,取出,得椰枣外植体ⅰ;
[0096]
(3)将椰枣外植体ⅰ放入试剂b中进行启动培养40天,避光培养,温度设置为28度,湿度设置为60%,启动培养结束后,将外植体在超净工作台上取出,清理外植体表面的褐化细胞,得椰枣外植体ⅱ;
[0097]
(4)将椰枣外植体ⅱ放入试剂c中进行继代培养,避光培养,温度设置为28度,湿度设置为60%,每25天继代一次,直至度过90天褐化的高发期,得到椰枣外植体ⅲ;
[0098]
(5)将椰枣外植体ⅲ继代转接至胚性愈伤组织诱导培养基中,避光培养,温度设置为28度,湿度设置为60%,诱导出愈伤组织。
[0099]
实施例3
[0100]
椰枣组培中抑制内生菌及材料褐化的培养基,包括试剂a、试剂b和试剂c;
[0101]
所述试剂a为含山农一号ⅰ型杀菌剂(终浓度5%wt)的1/2ms盐溶液;
[0102]
所述试剂b为含山农一号ⅲ型杀菌剂(终浓度0.2%wt)、植物凝胶(终浓度3.5g/l)、蔗糖(终浓度30g/l)、谷氨酰胺(终浓度100mg/l)、盐酸吡哆醇(终浓度1mg/l)、烟酸(终浓度0.5mg/l)、6
‑
苄氨基腺嘌呤(终浓度0.8mg/l)、异戊烯基腺嘌呤(终浓度0.5mg/l)、2,4
‑
二氯苯氧乙酸(终浓度0.08mg/l)、噻苯隆(终浓度0.08mg/l)、萘乙酸(终浓度0.12mg/l)、聚
乙烯吡咯烷酮(终浓度1g/l)、乙烷磺酸一水(终浓度1g/l)和活性炭(终浓度1g/l)的ms盐溶液;
[0103]
所述试剂c为含植物凝胶(终浓度3.5g/l)、蔗糖(终浓度30g/l)、谷氨酰胺(终浓度200mg/l)、盐酸吡哆醇(终浓度0.3mg/l)、烟酸(终浓度0.5mg/l)、肌醇(终浓度100mg/l)、6
‑
苄氨基腺嘌呤(终浓度4mg/l)、异戊烯基腺嘌呤(终浓度3mg/l)、2,4
‑
二氯苯氧乙酸(终浓度6mg/l)、萘乙酸(终浓度6mg/l)、聚乙烯吡咯烷酮(终浓度1g/l)、乙烷磺酸一水(终浓度1g/l)和活性炭(终浓度1g/l)的ms盐溶液;
[0104]
上述椰枣组培中抑制内生菌及材料褐化的培养基的制备方法,具体包括以下步骤:
[0105]
(1)按上述椰枣组培中抑制内生菌及材料褐化的培养基的配比称取各原料;
[0106]
(2)用无菌水溶解1/2ms盐,加入山农一号ⅰ型杀菌剂,无菌水定容,121℃灭菌15min,得试剂a;
[0107]
(3)分别使用1.2mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸分别溶解,备用;
[0108]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸、噻苯隆和萘乙酸,搅拌均匀,调节ph至5.6,再加入植物凝胶和活性炭,加热搅拌,再加入山农一号ⅲ型杀菌剂,无菌水定容,121℃灭菌15min,得试剂b;
[0109]
(4)分别使用1.2mol/l的氢氧化钠溶液将6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸分别溶解,备用;
[0110]
用无菌水溶解ms盐,加热搅拌,然后加入蔗糖、谷氨酰胺、盐酸吡哆醇、烟酸、肌醇、聚乙烯吡咯烷酮和乙烷磺酸一水,以及溶解后的6
‑
苄氨基腺嘌呤、异戊烯基腺嘌呤、2,4
‑
二氯苯氧乙酸和萘乙酸,搅拌均匀,调节ph至5.6,再加入植物凝胶和活性炭,加热搅拌,无菌水定容,121℃灭菌15min,得试剂c。
[0111]
上述椰枣组培中抑制内生菌及材料褐化的培养基的使用方法,其特征在于,具体包括以下步骤:
[0112]
(1)制备椰枣外植体:将使用消毒剂处理过的椰枣树连根部一起砍伐,切掉根部,留下基部,外部叶片层层环剥,去掉木质部,直到裸露出白色幼嫩叶片包裹的茎尖分生组织,然后将其放进抗褐化剂(150mg/l抗坏血酸+75mg/l柠檬酸)中浸泡3h,取出后放到超净工作台上继续环剥2层叶片后放进75%酒精中浸泡30s,然后用无菌水冲洗干净,放进2%的次氯酸钠中浸泡20min,期间不停摇晃消毒缸,保证外植体充分接触消毒液,取出后用无菌水冲洗干净,放置于干净的滤纸上,用手术刀将包裹茎尖生长组织的最后两层叶片剥开,露出金字塔形状的生长组织,根据生长组织的大小,纵切呈4
‑
6块,得到椰枣外植体,备用;
[0113]
(2)将切好的椰枣外植体放入试剂a中,保证外植体与试剂a的充分接触,避光,温度设置为28度,摇床上摇10h,取出,得椰枣外植体ⅰ;
[0114]
(3)将椰枣外植体ⅰ放入试剂b中进行启动培养45天,避光培养,温度设置为28度,湿度设置为60%,启动培养结束后,将外植体在超净工作台上取出,清理外植体表面的褐化细胞,得椰枣外植体ⅱ;
[0115]
(4)将椰枣外植体ⅱ放入试剂c中进行继代培养,避光培养,温度设置为28度,湿度
设置为60%,每30天继代一次,直至度过90天褐化的高发期,得到椰枣外植体ⅲ;
[0116]
(5)将椰枣外植体ⅲ继代转接至胚性愈伤组织诱导培养基中,避光培养,温度设置为28度,湿度设置为60%,诱导出愈伤组织。
[0117]
对比例1
[0118]
椰枣组培中抑制内生菌及材料褐化的培养基,与实施例2的区别仅在于,试剂a不含山农一号ⅰ型杀菌剂。
[0119]
对比例2
[0120]
椰枣组培中抑制内生菌及材料褐化的培养基,与实施例2的区别仅在于,试剂b不含山农一号ⅲ型杀菌剂。
[0121]
对比例3
[0122]
椰枣组培中抑制内生菌及材料褐化的培养基,与实施例2的区别仅在于,外植体不经过试剂b的启动培养,直接放入试剂c中继代培养。
[0123]
性能测试
[0124]
各取实施例1
‑
3和对比例1
‑
3制得的椰枣组培中抑制内生菌及材料褐化的培养基,并以ms盐作为空白对照,然后分别按照实施例2记载的使用方法进行组培,然后分别记录并统计其内生菌抑制率、褐化率、诱导率和组培材料利用率。统计结果如表1所示。
[0125]
表1实施例1
‑
3和对比例1
‑
3组培统计结果
[0126][0127]
由表1可知,相对于空白对照组和对比例1
‑
3,经过实施例1
‑
3椰枣组培中抑制内生菌及材料褐化的培养基处理后的褐化率有显著的降低,内生菌抑制率和组培材料利用率都有显著的提高。
[0128]
以上试验证明,本发明椰枣组培中抑制内生菌及材料褐化的培养基用于处理脱毒后的外植体以及对外植体进行启动培养,经过处理的外植体,不仅可以减轻消毒剂对幼嫩外植体的伤害,而且在接种30
‑
45天的启动培养阶段,可以将内生菌的污染率控制在9%以下,在培养的70
‑
90天褐化高发期,将褐化率控制在13%以下,诱导率85%以上,组培材料利用率87%以上,提高科研材料利用率,为后期胚性愈伤组织的诱导提供健康、分化能力强的体细胞,缩短培养周期,降低组培成本。
[0129]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一
致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1