一种使用ES打靶技术获得的嵌合体鼠生殖遗传的挽救方法与流程
一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法
技术领域
1.本技术涉及基因修饰模型鼠的生殖遗传比率分析方法及保种应用,属于生物技术领域,特别涉及一种es多次打靶获得的低嵌合率首建鼠生殖遗传的挽救方法。
背景技术:
2.现有的基因修饰技术:传统的转基因(tg)技术和近几年火热的crispr/cas9 技术都是通过原核显微注射的方式将外源dna注入核区,但tg方式获得的小鼠基因组是随机整合了外源dna,表达水平也不一致;crispr/cas9技术是通过cas9 核酸酶通过sgrna靶向切割dna双链,诱导外源dna与切口上下游的同源序列发生同源重组,该方法获得的小鼠基因组是定点修饰了外源dna,但是sgrna靶序列只有~20bp,cas9核酸酶容易发生脱靶切割。es(全能干细胞)打靶是建立在 dna同源重组与胚胎干细胞等技术基础上的分子生物学技术,目前是模式动物制备的黄金标准。es打靶技术成功避开了转基因的随机整合和crispr/cas9无法避免的脱靶效应。
3.近几年,人源化动物模型已经被证明在解码人类疾病奥秘中具有巨大的优势和广泛的应用前景。由于人类生理与动物生理的差异,好多在动物模型上得到的实验数据在人体上无法复现。例如,新冠病毒依赖于ace2蛋白感染人类,但是它不能识别小鼠细胞的ace2蛋白,所以小鼠不会感染新冠肺炎,因此需要将小鼠的ace2基因人源化。要在小鼠体内全部模拟人的ace2基因表达,最好的方式是将小鼠的ace2基因组全部替换为人的ace2基因组。这涉及到近50kb外源dna 序列的定点插入,但常规的打靶技术无法一次性定点插入几百kb的大片段,因此需要用到es细胞多次打靶编辑的操作。
4.现有技术问题:
5.1.传统的tg技术和crispr/cas9技术无法实现几百kb~1mb的基因定点修饰,受精卵脆弱,无法通过电转方式导入大片段dna,只能显微注射,操作要求极高,受精卵数量也有限,且大片段dna整合效率很低。如有些人源化方案中,使用人源基因组序列可能很大,需要多个bac拼接才能囊括全,这种情况可以拆分外源dna片段通过es细胞多次打靶来实现。
6.2.但经过多次电转筛选的es细胞全能性会受到影响,多次电击对es细胞极大的损伤包括染色体数量及形态异常,染色体dna断裂丢失等;如果电转次数大于5次,即便筛选核型正常的es克隆用于注射囊胚腔,产生的嵌合体小鼠嵌合比例会很低,而且生殖遗传比例不确定。
7.3.现有的关于鉴定动物胚胎方法,都是通过取胚胎部分细胞确定有外源 dna基因型后再移植到供体,且要保证胚胎损伤小,存活率高。常用的方法有三种:
①
经典的胚胎取细胞方法是显微切割法,但该方法破坏了胚胎透明带的完整性,可能造成取细胞后的胚胎碎裂。
②
通过将显微注射针刺入胚胎内,用负压吸取细胞,该方法由于使用负压操作,可能造成取细胞后的胚胎负压损伤。
③
采用“打洞压迫法”使用正压从动物胚胎中取出部分细胞,该方法对胚胎还是有损伤。以上三种方法对胚胎发育都有损伤,而且工作量和操作性要求极高,个人实验数据差异也难以避免;并且采取的细胞量极少,必须结合细胞培养和多轮
pcr 富集检验的方法鉴定基因型,鉴定周期长,pcr假阳性或假阴性概率也高。
技术实现要素:
8.本发明的目的是解决多步es技术打靶的克隆所得到的首建鼠嵌合率低生殖遗传不确定的问题。
9.通过结合打靶载体的特殊方案设计(加上egfp表达框)、精子冷冻技术(为了保种阳性精子)、精子基因型鉴定技术、体外受精技术及受精卵荧光观察来精确分析首建鼠的生殖遗传比例,并将带有荧光的囊胚移植代孕鼠产生阳性后代,没有对胚胎造成任何损伤的情况下,减少了筛选周期和代孕鼠以及鉴定成本浪费。
10.本发明的技术方案如下:
11.一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,包括以下步骤:
12.s1多轮电转的es克隆注射囊胚,获得低嵌合率小鼠;所述es克隆加上 egfp表达;
13.s2对低嵌合率小鼠进行毛色比例分析和鼠尾基因鉴定;
14.s3小鼠精子冷冻;
15.s4精子基因型鉴定;
16.s5阳性比例高的精子进行体外受精ivf实验;
17.s6受精卵培养到2细胞后进行荧光观察;
18.s7筛选绿色荧光胚胎移植;
19.s8出生小鼠dna鉴定。
20.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述步骤s1中,所述所述es克隆加上egfp表达具体为在外源dna序列上增加egfp表达框,同时两端加上重组酶位点以便后期删除。
21.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述egfp表达框序列为seq id no:1。
22.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述egfp表达框两端设计有loxp序列,具体为seq id no:2。
23.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述步骤s3中小鼠精子冷冻包括如下步骤:
24.a.挑选黑色毛发嵌合率高的12周龄f0小鼠,准备好冷冻保护试剂和器材;
25.b.将雄鼠颈椎脱臼处死,剪下双侧附睾尾置于滤纸上,去除多余组织、血迹等;
26.c.吸取500μl cpa于四孔板;
27.d.用系线镊挤压附睾尾呈饱满状态,剪开顶部取出精子团,放入冷冻液 cpa中,摇晃混匀、置于co2培养箱内10min;
28.e.分装60μl/管规格存放冻存管中,放入液氮盒10min,留一管质检,剩余全部放入液氮罐保存。
29.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述步骤s4精子基因型鉴定具体步骤为:
30.1)精子dna提取:每个line取一管精子样品提取dna,使用sds配方的裂解液裂解精子样品,再用酚氯仿抽提去掉杂质,用乙醇沉淀dna后,加75%乙醇清洗两遍,最后用超纯水
溶解dna;
31.2)基因型鉴定:
32.a.引物序列,f:5
’‑
acgtaaacggccacaagttc
‑3’
=seq id no.3
33.r:5
’‑
gatcttgaagttcaccttgatgc
‑3’
=seq id no.4,进行pcr,目的条带440bp。
34.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述s5阳性比例高的精子进行体外受精ivf实验包括如下步骤:
35.1)从液氮罐中取出精子样品的冻存管,放入37.0℃水浴锅,10min;
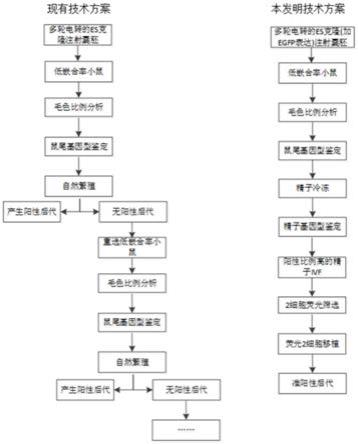
36.2)从水浴锅中取出冻存管,吸取上层20μl精子冷冻液吹入获能皿,放入培养箱;
37.3)期间将超排后的雌鼠进行脱颈椎处死,采集壶腹部放置于m2培养基中;
38.4)将壶腹部转移至受精皿的石蜡油空白区域,收集卵丘团培养;
39.5)吸取10μl精子液加入受精皿中,转移至培养箱中培养3h;
40.6)之后再培养到m16培养基,至2细胞后荧光观察。
41.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法,所述s8出生小鼠dna鉴定,包括如下步骤:
42.1)鼠尾dna提取:根据扩增产物的长度来选择提取基因组的方法
43.a.向装了鼠尾组织的ep管中加如100μl triton x
‑
100裂解液(98μl 裂解液+2μl蛋白酶k);
44.b.56℃烘箱过夜裂解;
45.c.第二天放置pcr仪中98℃变性15min,目的是为了灭火蛋白酶k;
46.d.灭活处理后放入离心机,10000rpm离心5min,上清即为粗裂的dna,备用;
47.2)取上清作为模板扩增,采用权利要求5所述精子dna鉴定的鉴定方案进行pcr扩增,pcr扩增产物进行电泳检测。
48.进一步的,上述一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法在嵌合体小鼠实验中的应用。
49.根据以上技术方案可知,本发明公开的一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法至少有以下有益效果:
50.相比较现有技术,本发明具有如下进步方面:
51.a.提前qc:加了精子基因型筛选步骤,提前确认首建鼠是否有生殖遗传;
52.b.保种保障:采用精子冻存,不是鲜精直接ivf,对于阳性保种有保障;
53.c.分析方法:1)在外源dna片段上加了egfp荧光表达框,方便es细胞和后期受精卵的荧光筛选;2)光观察相比传统的囊胚取细胞鉴定阳性方法,对胚胎发育没有任何损伤,且操作方便,只需要观察荧光,筛选带有荧光的二细胞进行移植。
54.d.成本节约:不用所有受精卵都移植,造成供体代孕鼠物料和鉴定资源以及人工场地等的浪费;
55.e.结果保障:精准的筛选出阳性受精卵再进行移植,避免了基因修饰的受精卵发育被野生型受精卵竞争淘汰。
附图说明
56.附图1为本发明与现有技术流程上的区别;
57.附图2多次打靶的es克隆注射出生的f0小鼠;
58.附图3精子dna的pcr电泳图片和marker规格;
59.附图4受精卵发育2细胞以后的绿色荧光观察;
60.附图5鼠尾dna的pcr电泳图片和marker规格。
具体实施方式
61.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
62.本发明的总体流程如附图1所示,在外源dna序列上增加egfp表达框,同时两端加上重组酶位点以便后期删除;获得的雄性f0首建鼠12周龄时冷冻精子,取一管精子用于鉴定基因型;选取出有阳性基因型的精子复苏进行体外受精,受精卵培养到2细胞,荧光显微镜下观察;将有荧光的2细胞筛选出来移植到代孕鼠;最终获得稳定遗传的阳性后代。
63.实施例1
64.载体构建
65.(1)在外源dna片段上额外加上egfp表达框序列:
66.因为要在受精卵阶段观察荧光表达情况,所以egfp的调控元件中包含了广泛性强表达的启动子cag promoter,具体序列seq id no:1如下(小写字母是cag promoter,大写序列是egfp编码框,划线小写序列是sv40 polya):
67.attgattattgactagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgc gttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgac gtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccact tggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggc attatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatggt cgaggtgagccccacgttctgcttcactctccccatctcccccccctccccacccccaattttgtatttatttatttttt aattattttgtgcagcgatgggggcggggggggggggggggcgcgcgccaggcggggcggggcggggc gaggggcggggcggggcgaggcggagaggtgcggcggcagccaatcagagcggcgcgctccgaaagttt ccttttatggcgaggcggcggcggcggcggccctataaaaagcgaagcgcgcggcgggcgggagtcgctg cgcgctgccttcgccccgtgccccgctccgccgccgcctcgcgccgcccgccccggctctgactgaccgcgt tactcccacaggtgagcgggcgggacggcccttctcctccgggctgtaattagcgcttggtttaatgacggcttg tttcttttctgtggctgcgtgaaagccttgaggggctccgggagggccctttgtgcggggggagcggctcgggg ggtgcgtgcgtgtgtgtgtgcgtggggagcgccgcgtgcggctccgcgctgcccggcggctgtgagcgctgc gggcgcggcgcggggctttgtgcgctccgcagtgtgcgcgaggggagcgcggccgggggcggtgccccg cggtgcggggggggctgcgaggggaacaaaggctgcgtgcggggtgtgtgcgtgggggggtgagcaggg ggtgtgggcgcgtcggtcgggctgcaaccccccctgcacccccctccccgagttgctgagcacggcccggct tcgggtgcggggctccgtacggggcgtggcgcggggctcgccgtgccgggcggggggtggcggcaggtg ggggtgccgggcggggcggggccgcctcgggccggggagggctcgggggaggggcgcggcggccccc ggagcgccggcggctgtcgaggcgcggcgagccgcagccattgccttttatggtaatcgtgcgagagggcg cagggacttcctttgtcccaaatctgtgcggagccgaaatc
tgggaggcgccgccgcaccccctctagcgggc gcggggcgaagcggtgcggcgccggcaggaaggaaatgggcggggagggccttcgtgcgtcgccgcgcc gccgtccccttctccctctccagcctcggggctgtccgcggggggacggctgccttcgggggggacggggca gggcggggttcggcttctggcgtgtgaccggcggctctagagcctctgctaaccatgttcatgccttcttctttttc ctacagctcctgggcaacgtgctggttattgtgctgtctcatcattttggcaaagaattcgaagctagcttcgcgat cgcgccaccatggtgagcaagggcgaggagctgttcaccggggtggtg cccatcctggtcgagctggacggcgacgtaaacggccacaagttc agcgtgtccggcgagggcgagggcgatgccacctacggcaagctg accctgaagttcatctgcaccaccggcaagctgcccgtgccctggc ccaccctcgtgaccaccctgacctacggcgtgcagtgcttcagccg ctaccccgaccacatgaagcagcacgacttcttcaagtccgccatg cccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacg gcaactacaagacccgcgccgaggtgaagttcgagggcgacaccc tggtgaaccgcatcgagctgaagggcatcgacttcaaggaggacg gcaacatcctggggcacaagctggagtacaactacaacagccaca acgtctatatcatggccgacaagcagaagaacggcatcaaggtga acttcaagatccgccacaacatcgaggacggcagcgtgcagctcg ccgaccactaccagcagaacacccccatcggcgacggccccgtgct gctgcccgacaaccactacctgagcacccagtccgccctgagcaaa gaccccaacgagaagcgcgatcacatggtcctgctggagttcgtg accgccgccgggatcactctcggcatggacgagctgtacaagtaacagacatgataagatacattgatgagtttggacaaaccacaactagaatgcagtgaaaaaaatgctttatttgtgaaatttgtgatgctattgctttatttgtaaccattataagctgcaataaacaagttaacaacaacaattgcattcattttatgtttcaggttcagggggaggtgtgggaggttttttaaagcaagtaaaacctctacaaatgtggta
68.2)使用的重组酶位点:
69.因为荧光表达元件只是便于在es电转后的细胞克隆荧光筛选,以及后期受精卵发育过程中的二细胞到囊胚期的荧光观察,实际分析使用的小鼠成品模型中,除了必要的外源dna序列,尽量不要有其他多余序列干扰研究背景,因此需要把荧光表达框删除掉。目前使用的工具鼠中cre居多,且cre重组酶效率较 flp更高,所以选用loxp位点放在egfp表达框两端,序列如下:
70.loxp序列=seq id no:2:ataacttcgtatagcatacattatacgaagttat
71.实施例2
72.精子冷冻
73.(1)f0小鼠的获得:实验使用的es细胞株为赛业生物有限公司自主研发的细胞株,品系是c57bl/6n(black),性别是雄性。将经过多次电转整合了大量外源dna片段(包含了egfp表达框)的es克隆,显微注射至白化的c57bl/6 (agouti)囊胚,再移植到icr代孕鼠子宫等小鼠出生。
74.(2)小鼠毛色分析:由于移植的囊胚内细胞团一部分来自于原始的白化 c57bl/6n(agouti),一部分来自于经过外源dna修饰的c57bl/6n(black)细胞,因此获得f0嵌合体从毛色上就可以大致分析比例,如下黑白相间的毛色,一般黑色毛发比例越多,外源dna阳性嵌合比例就越高,越容易生殖遗传。如附图2 所示,8次打靶的es克隆获得的f0小鼠,嵌合率非常低:
75.(3)12周龄小鼠精子冷冻:
76.a.挑选黑色毛发嵌合率高的12周龄f0小鼠,准备好冷冻保护试剂和器材;
77.b.将雄鼠颈椎脱臼处死,剪下双侧附睾尾置于滤纸上,去除多余组织、血迹等;
78.c.吸取500μl cpa于四孔板;
79.d.用系线镊挤压附睾尾呈饱满状态,剪开顶部取出精子团,放入冷冻液 cpa中,摇晃混匀、置于co2培养箱内10min;
80.e.分装60μl/管规格存放冻存管中,放入液氮盒10min。留一管质检,剩余全部放入液氮罐保存。
81.实施例3
82.精子基因型分析
83.1)精子dna提取:每个line取一管精子样品提取dna,使用sds配方的裂解液裂解精子样品,再用酚氯仿抽提去掉杂质,用乙醇沉淀dna后,加75%乙醇清洗两遍,最后用超纯水溶解dna。
84.2)基因型鉴定:
85.a.引物序列,f=seq id no:3:5
’‑
acgtaaacggccacaagttc
‑3’
, r seq id no:4:5
’‑
gatcttgaagttcaccttgatgc
‑3’
,目的条带440bp。
86.b.扩增体系以及pcr反应程序,如表1所示。
87.表1:pcr反应体系与程序
[0088][0089][0090]
c.扩增结果:
[0091]
如附图3所示,8管精子样品中,样品1、3、4都没有检测出阳性条带,因此将该样品对应的冷冻精子全部淘汰处理。
[0092]
实施例4
[0093]
体外受精ivf实验:
[0094]
1)从液氮罐中取出精子样品的冻存管,放入37.0℃水浴锅,10min;
[0095]
2)从水浴锅中取出冻存管,吸取上层20μl精子冷冻液吹入获能皿,放入培养箱;
[0096]
3)期间将超排后的雌鼠进行脱颈椎处死,采集壶腹部放置于m2培养基中;
[0097]
4)将壶腹部转移至受精皿的石蜡油空白区域,收集卵丘团培养;
[0098]
5)吸取10μl精子液加入受精皿中,转移至培养箱中培养3h;
[0099]
6)之后再培养到m16培养基,至2细胞后荧光观察。
[0100]
实施例5
[0101]
受精卵培养到2细胞后安排荧光观察,如附图4白色箭头所指的胚胎即为绿色荧光胚胎,收集这样的荧光胚胎安排移植。
[0102]
实施例6
[0103]
1)鼠尾dna提取:根据扩增产物的长度来选择提取基因组的方法
[0104]
a.向装了鼠尾组织的ep管中加如100μl triton x
‑
100裂解液(98μl裂解液+2μl蛋白酶k);
[0105]
b.56℃烘箱过夜裂解;
[0106]
c.第二天放置pcr仪中98℃变性15min,目的是为了灭火蛋白酶k;
[0107]
d.灭活处理后放入离心机,10000rpm离心5min,上清即为粗裂的dna,备用。
[0108]
2)取上清作为模板扩增,采用上述精子dna鉴定的鉴定方案进行pcr扩增, pcr扩增产物进行电泳检测。
[0109]
3)pcr图片,如附图5所示
[0110]
出生的6只f1均为阳性,与荧光观察的结果一致。
[0111]
根据上述实施例1
‑
6可知,本发明公开了一种一种使用es打靶技术获得的嵌合体鼠生殖遗传的挽救方法让大片段定点修饰的es技术无生殖遗传的顾虑,哪怕生殖遗传概率极低,也可以尽早的筛选出来,减少了周期和物料成本。优点如下:
[0112]
1)提前qc:加了精子基因型筛选步骤,提前确认首建鼠是否有生殖遗传;
[0113]
2)保种保障:采用精子冻存,不是鲜精直接ivf,对于阳性保种有保障;
[0114]
3)分析方法:1)在外源dna片段上加了egfp荧光表达框,方便es细胞和后期受精卵的荧光筛选;2)光观察相比传统的囊胚取细胞鉴定阳性方法,对胚胎发育没有任何损伤,且操作方便,只需要观察荧光,筛选带有荧光的二细胞进行移植。
[0115]
4)成本节约:不用所有受精卵都移植,造成供体代孕鼠物料和鉴定资源以及人工场地等的浪费;如下表2为本方法和现有常规方法的比较。
[0116]
表2:本方法和现有常规方法的比较
[0117][0118]
5)结果保障:精准的筛选出阳性受精卵再进行移植,避免了基因修饰的受精卵发
育被野生型受精卵竞争淘汰。
[0119]
以上仅为本发明的较佳实施例而已,不能以此限定本发明的保护范围,即大凡依本发明权利要求书及发明内容所做的简单的等效变化与修改,皆仍属于本发明专利申请的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1