一种胚胎干细胞无血清保存液及其制备方法和应用与流程
1.本发明属于生物技术领域。更具体地,涉及一种胚胎干细胞无血清保存液及其制备方法和应用。
背景技术:
2.人胚胎干细胞(human embryonic stem cell,hes细胞)是从早期的胚胎内细胞团(inner cell mass,icm)分离培养成的多能干细胞,其在体外培养过程中可以维持干细胞的未分化状态,正常的二倍体核型及无线的增殖能力,具有内分化能力和种系的嵌合能力,并可在体外进行各种基因操作,因此,hes细胞具有广阔的临床应用前景。
3.目前,hes细胞常用的冷冻保存方法包括慢速冷冻法和玻璃化冷冻法,两种方法在冷冻过程中需要结合冷冻保护剂使用。其中,慢速冻存法的复苏率约为16%,并且复苏后大量细胞会分化;国际上报导的玻璃化冻存法冻存hes细胞的存活率在75%左右。
4.现有的冷冻保护剂主要分为渗透性冷冻保护剂和非渗透性冷冻保护剂,其中,渗透性冷冻保护剂多为小分子中性物质,其能够弱化水结晶过程以及减少对细胞结构和功能的破坏,常用的有甘油、dmso、丙二醇、乙二醇、乙酰胺、甲醇等。其中,dmso是临床常用的冷冻保护剂,常以10%dmso配合90%fbs来冷冻保存干细胞,但是一系列的研究表明,dmso可能会改变染色体的稳定性,并导致细胞端粒长度的变化,从而导致肿瘤的形成,并且dmso本身也具有一定的毒性,dmso对组织和细胞的毒性取决于暴露时间、温度和浓度;另外,fbs作为异源动物成分,存在引入病毒的风险,同时受血清生产批次、来源及组分的影响,对冷冻保存的干细胞可能存在不良的影响。因此,尤其需要低毒性,无血清的冷冻保存液。
5.人血小板裂解物来源于人类血小板,不容易引起异种蛋白的免疫,且包含种细胞生长因子,在中国专利申请cn108617638a中,发明人提出了一种细胞冻存保护液,其包括血小板裂解物、渗透性保护剂、非渗透性保护剂和血清,发明人证实了,该保存液相比不含血小板裂解物的冻存保护液能够更好的保护冻存的细胞,冻存的细胞活力和活率明显提高,且对原代培养后的细胞活率无影响。但是该保存液仍然需要加入4~70%体积分数的血清。wang等通过使用97%人类血小板裂解物+3%dmso来冻存hadsc,复苏后发现细胞的存活率高于80%,与95%fbs+5%dmso冻存存活率无明显差异,且可以减少dmso的浓度,同时可释放多种生长因子促进hadsc体外增殖,对于血小板裂解物促进细胞的生长基质及其在其他干细胞中的冻存效果还需进一步了解
1.。但是该冻存液中仍然需要添加3%的dmso。
6.目前未见采用人血小板裂解物来培养hescs的例子。
7.[1]wang c,xiao r,cao yl,etal.evaluation of human plateletlysate an d dimethyl sulfoxide as cryoprotectants for the cryopreservation of human adip ose-derived stem cells[j].biochem biophys res commun,2017,491(1):198-203.
技术实现要素:
[0008]
本发明要解决的技术问题是克服现有冻存液的缺陷和不足,提供一种胚胎干细胞
无血清保存液,其特点在于不含有血清和dmso。该冻存液可以提高细胞的冷冻存活率,与玻璃化冷冻结合冷冻保存胚胎干细胞复苏率可以达到95%以上,且细胞复苏后维持不分化的状态。
[0009]
本发明的目的是提供一种胚胎干细胞无血清保存液,包括以下体积百分比的组分:
[0010]
血小板裂解物
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10~30%
[0011]
低分子量γ-聚谷氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1~5%
[0012]
缓冲液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0013]
进一步地,所述胚胎干细胞无血清保存液包括以下体积百分比的组分:
[0014]
血小板裂解物
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10~25%
[0015]
低分子量γ-聚谷氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1~3%
[0016]
缓冲液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0017]
进一步地,所述胚胎干细胞无血清保存液包括以下体积百分比的组分:
[0018]
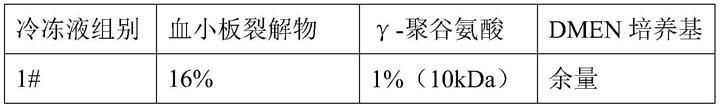
血小板裂解物
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
16%
[0019]
低分子量γ-聚谷氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1%
[0020]
缓冲液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量。
[0021]
上述方案中,血小板裂解物是从人血液中提取分离得到的,其含有血小板衍生生长因子、转化生长因子、胰岛素样生长因子等,这些生长因子对细胞的生存是有利的,目前血小板裂解物有被应用于冷冻保存hadsc、间充质干细胞、脂肪干细胞等,但是不知其用于冻存胚胎干细胞的效果如何。
[0022]
γ-聚谷氨酸属于非渗透性冷冻保护剂,其具有强大的水分子络合能力,能够减少冷冻过程中细胞内冰晶的形成,目前有发明人采用人血白蛋白、干细胞生长因子、γ-聚谷氨酸结合甘油来冻存干细胞,冻存12个月后干细胞的存活率仍然高达97%以上。但不知将其与血小板裂解物结合用于冻存胚胎干细胞的效果如何。
[0023]
通常地,不同分子量的γ-聚谷氨酸表现出不同的生理活性,发明人意外发现,不同分子量的γ-聚谷氨酸与血小板裂解物结合冷冻胚胎干细胞表现出差异较大的效果。通过摸索试验发现,低分子量的γ-聚谷氨酸与血小板裂解物组合对于提高细胞存活率及维持细胞不分化的状态是更有利的。
[0024]
进一步地,本文中所述低分子量的γ-聚谷氨酸是指γ-聚谷氨酸的分子量最好在5~70kda之间;更进一步地,所述γ-聚谷氨酸的分子量最好在10~70kda、20~70kda、30~70kda、40~70kda、50~70kda、60~70kda之间;更进一步地,所述γ-聚谷氨酸的分子量为10kda、20kda、30kda、40kda、50kda、60kda或70kda;更进一步地,所述γ-聚谷氨酸的分子量为10kda;更进一步地,所述γ-聚谷氨酸的分子量为70kda。
[0025]
本领域的技术人员知晓,低分子量的γ-聚谷氨酸可通过枯草芽孢杆菌发酵获得(参考中国专利申请cn104805143a)。
[0026]
进一步地,所述基础培养基为dmen-12、低糖dmen、高糖dmen或rpmi-1640中的一种。
[0027]
本发明另一目的在于提供一种胚胎干细胞冷冻保存方法,本发明冻存液可以与常规的胚胎干细胞冷冻保存法结合使用,包括但不限于:-80℃冻存法、常规液氮冻存法、玻璃
化冻存法。更优选地,所述冷冻保存方法为玻璃化冷冻法。
[0028]
上文中“玻璃化冷冻法”为现有技术中常规的玻璃化冷冻法,其具体步骤可以包括:
[0029]
①
将胚胎干细胞在37-40℃的玻璃化平衡液中平衡5~10min;
[0030]
②
将胚胎干细胞转移至37-40℃的冷冻保存液中,平衡10~30s后,转移至玻璃化冷冻载体上,并且迅速将玻璃化载体浸入液氮中。
[0031]
进一步地,所述玻璃化平衡液为常规的玻璃化平衡液,其可以来源于市购,购于武汉汉协泰科技有限公司,其包含dmso、乙二醇和10mg/ml的hsa,使用w/hepes缓冲液。
[0032]
进一步地,由于现有冷冻保存液含有dmso,对细胞存在毒性,因此步骤
②
中将胚胎干细胞转移至玻璃化载体上的时间必须控制在1min内完成,而本发明冷冻保存液不含有dmso,在此步骤对操作时间没有过分严格要求。
[0033]
进一步地,玻璃化冷冻过程中采用的载体可以为ops或者cryotop。
[0034]
试验表明,采用本发明冷冻保存液结合玻璃化冷冻法冻存人胚胎干细胞,干细胞的平均存活率大大提高,冻存效果与经典血清+dmso组合相当。
[0035]
本文中所述“胚胎干细胞”包括但不限于:人胚胎干细胞、牛胚胎干细胞、猪胚胎干细胞、鼠胚胎干细胞或羊胚胎干细胞等。
[0036]
本发明另一目的在于提供一种胚胎干细胞冷冻试剂盒,所述试剂盒包含所述保存液。
[0037]
本发明具有以下有益效果:
[0038]
(1)本发明提供了一种冷冻保存液,其特别适用于冻存胚胎干细胞,特别是人胚胎干细胞,经多批次试验表明,采用本发明冷冻保存液结合玻璃化冷冻法保存胚胎干细胞,冻存效果与经典血清+dmso组合相当,与现有技术相比取得了显著的进步。
[0039]
(2)本发明提供的冷冻保存液不含有血清和dmso,毒性更低,更适用于临床。
具体实施方式
[0040]
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
[0041]
玻璃化平衡液:包含dmso、乙二醇和10mg/ml的hsa,使用w/hepes缓冲液,购自武汉汉协泰科技有限公司
[0042]
实施例一、用于胚胎干细胞的冷冻液的制备(体积百分比)
[0043]
[0044][0045]
各组冷冻液制备方法:在室温下将各组分混合均匀,得到冷冻液。
[0046]
实施例二、不同冷冻液配方冷冻复苏效果比较
[0047]
2.1试验方法:
[0048]
2.1.1胚胎干细胞冷冻:将人胚胎干细胞置于39℃的玻璃化平衡液中平衡10min;将胚胎干细胞分别移至冷冻液中,平衡30s,用吸管吸取胚胎干细胞转移至cryotop玻璃化载体上,迅速将载体浸入液氮中,分别冻存1个月、3个月和6个月。
[0049]
2.1.2胚胎干细胞复苏:将载体从液氮罐中取出,将载体插入装有37℃预热的玻璃化解冻液(ws1,0.2mol/蔗糖+体积分数为20%的fbs)的培养皿中,确定胚胎干细胞从载体落到培养皿中后,停留1min;用吸管将其转移到37℃预热的玻璃化解冻液(ws2,0.1mol/蔗糖+体积分数为20%的fbs)中,放置4min;之后将胚胎干细胞转移至37℃预热的复苏液1(含20v/v%fbs的hepes缓冲液)中停留5min;将其转移至37℃预热的复苏液2(含20v/v%fbs的hepes缓冲液)中停留5min;最后将其转移至细胞培养液(pzm-3)中,置于培养箱继续培养,镜下观察并计数。
[0050]
按照上述方法将10批次生长状态良好的胚胎干细胞分别采用冷冻液1#~12#进行冷冻,并采用常规冷冻液(1mol/lhepes缓冲液配制的,包含20%体积分数的fbs、10%体积分数的dmso、10%的体积分数乙二醇)替换本发明冷冻液作为对照组,每批次设置3个平行试验,计算每组别10批次保存不同时间后的细胞平均存活率。
[0051]
2.2试验结果
[0052]
表1 10批次保存不同时间后细胞平均存活率(每批次冻存细胞个数为20个)
[0053][0054]
注:与对照组相比,
*
p<0.05,
**
p<0.05。
[0055]
由上表可看出,采用本发明冷冻液(1#~9#)结合玻璃化冷冻法冻存胚胎干细胞1个月复苏后细胞平均存活率在85%以上,冻存3个月细胞平均活率在75%以上,与经典冷冻液血清+dmso组合(对照组)冻存效果相当;同时分析其他组别结果可知,较高分子量的γ-聚谷氨酸(120kda、200kda、500kda)与血小板裂解物组合冻存效果与血清+dmso组合(对照组)相比均存在显著的差异(p<0.05),但是三组之间效果变化无规律性。
[0056]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1