舞茸灵芝茶及其制备方法与流程
本发明涉及一种保健茶的制备方法,特别是一种舞茸灵芝茶及其制备方法。
背景技术:
红茶是中国六大茶类中最具影响力的茶类之一,中国是世界上最早生产和饮用红茶的国家,早在明代初期(1368-1375年)中国就有生产红茶的记载。大量的研究报道证实了红茶色素的抗肿瘤、抗突变、抑制病原菌、抗病毒的作用,以及对心脑血管疾病等多方面的预防和治疗作用。红茶中含有的儿茶素和茶黄素的抗氧化活性甚至优于谷胱甘肽、抗坏血酸和生育酚。有研究表明,红茶中所含的茶黄素的抗氧化活性不亚于绿茶中所含儿茶素,而且红茶加工发酵过程中儿茶素向茶黄素的转化并未显著改变其清除自由基的活性。另有文献报道,红茶多酚具有抑制主动脉内皮细胞增殖的作用,具有抗肿瘤、防癌的功效。随着红茶保健功能的医学证明和人们对健康意识的提高,加之其具有独特的品质特征,红茶也越来越受到世人的青睐。
灵芝为多孔菌科(polyporaceae)真菌赤芝(leyss.exfr.)karst.或紫芝g.sinensezhao,xuetzhang的干燥子实体。灵芝是祖国中医药宝库中的珍品,素有“仙草”之誉。灵芝的子实体具有强烈的药理学活性,有止痛、镇静、解毒的作用,可以抗肿瘤、调节免疫力、降低血糖,具有滋补强身、延年益寿的功效。灵芝的药理成分非常丰富,其中有效成分包括灵芝多糖、三萜类化合物、氨基酸、蛋白质、生物碱以及微量元素等,各有效成分之间具有协同作用。
灰树花(grifolafrondosa)隶属担子菌亚门,层菌纲,无隔担子菌亚纲,非褶菌目,多孔菌科,树花菌属,又名贝叶多孔菌、栗子蘑、莲花菌,日本俗称舞茸。灰树花是亚热带至温带森林中的大型真菌,具有独特的芳香味,营养丰富,口味鲜美,且含有丰富的生物活性物质。近年来,国内外深入开展了作为生物反应调节剂的真菌多糖的研究,灰树花多糖显著的疗效也逐渐被人们所认识。经过大量的化学和药理分析发现,灰树花多糖具有明显的抗肿瘤,抗hiv病毒,改善免疫系统功能,调节血糖、血脂及胆固醇水平,降血压作用,对防止癌细胞的生成和转移、艾滋病、高血压、肥胖症、糖尿病以及免疫系统功能的紊乱都有一定的疗效,且无任何毒副作用。因此,灰树花是一种极具开发价值的珍贵食、药用真菌。
保健茶是以茶为主,配有适量中药,既有茶味,又有轻微药味,并有保健治疗作用的饮料。保健茶因富含茶叶营养成分、药效成分,加以配佐原料特定成分相结合,又同现今国际上回归大自然的思潮吻合,因而受到相当人群的欢迎。保健茶的研制,随着社会的发展,科技的进步,不断提高,各种保健茶如雨后春笋般涌现。但是目前的保健茶制造,不少都停留在照搬古方,或以某一茶类为原料,简单用药拼成,缺乏科学实验、检测分析,致使保健茶的声誉受到影响。而且,市场上的保健茶种类繁多,功效各有侧重,口味也大不相同。为满足不同消费人群的需求,多一些保健茶的品种会更方便人们的选择。
技术实现要素:
本发明的目的,是提供一种舞茸灵芝茶及其制备方法。本发明具有食用方便、口感合适,有效活性成分更容易被人体所吸收,能增强免疫力的特点,为保健茶提供了更多品种,便于消费者选用。
本发明是这样实现的。舞茸灵芝茶,它是以下述重量配比的原料制成,
红茶150份、
灰树花提取物20-80份、
灵芝提取物80-20份。
前述的舞茸灵芝茶,其特征在于:它是以下述重量配比的原料制成,
红茶150份、
灰树花提取物25-80份、
灵芝提取物80-25份。
前述的舞茸灵芝茶,其特征在于:它是以下述重量配比的原料制成,
红茶150份、
灰树花提取物25-75份、
灵芝提取物75-25份。
前述舞茸灵芝茶的制备方法,按下述步骤制备;
a、红茶灭菌、粉碎,得a品;
b、灰树花提取物过筛,得b品;
c、灵芝提取物过筛,得c品;
d、将a品、b品和c品置于混合机中,混合后得d品;
e、将d品制粒得成品。
前述的舞茸灵芝茶制备方法中,所述的步骤a为,将红茶采用co60辐照灭菌,辐照剂量6kgy,粉碎过80目筛,得a品;所述的步骤d为,将a品、b品和c品置于混合机中,混合28~35分钟,得d品;所述的步骤e为,向d品中加入适量80%乙醇,混合均匀,通过14目筛制粒,再通过65℃烘干,控制水分≤10%,14目筛整粒,得e品。
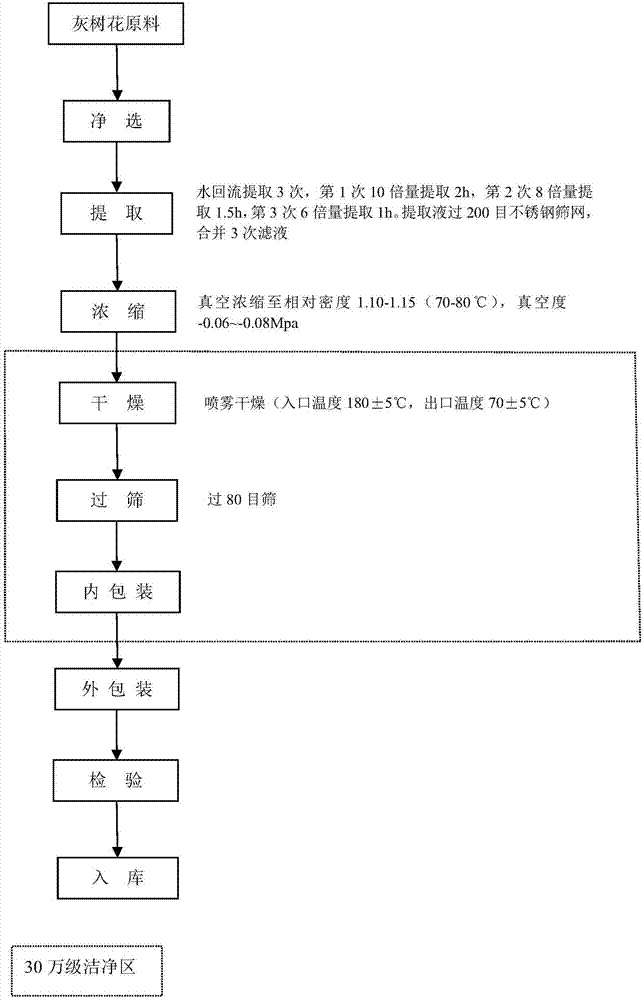
前述的舞茸灵芝茶制备方法中,所述的步骤b中的灰树花提取物,按下述步骤制备:
b1、将灰树花原料回流提取多次,提取液过筛合并,得b1品;
b2、将b1品浓缩得b2品;
b3、将b2品干燥过筛,得灰树花提取物。
前述的舞茸灵芝茶制备方法中,所述的步骤b1为,将灰树花原料净选后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液过200目不锈钢筛网,合并3次滤液,得b1品;所述的步骤b2为,将b1品真空浓缩至70℃-80℃下的相对密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;所述的步骤b3为,将b2品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灰树花提取物。
前述的舞茸灵芝茶制备方法中,所述的步骤c中的灵芝提取物,按下述步骤制备:
c1、将灵芝子实体进行粉碎,得c1品;
c2、将c1品回流提取多次,提取液过筛合并,得c2品;
c3、将c2品浓缩,得c3品;
c4、将c3品干燥过筛,得灵芝提取物。
前述的舞茸灵芝茶制备方法中,所述的步骤c2为,将c1品通过水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目筛过滤,合并滤液,得合并滤液c2品;所述的步骤c3为,将c2品减压浓缩,真空度-0.06~-0.08mpa,浓缩至70℃-80℃下的相对密度1.05-1.15,得浓缩液c3品;所述的步骤c4为,将c3品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灵芝提取物。
与现有技术比较,本发明在红茶中加入灵芝与灰树花的提取物,使灵芝、灰树花和茶叶的有效活性成分充分的结合在一起,并且使产品中的有效活性成分更容易被人体所吸收,更加丰富茶的保健功能;本发明的灵芝养生红茶不仅具有红茶的口感和保健的优点,还结合了灵芝和灰树花的药用功能,具有护肝、养胃、宁心安神、明目、降血压、降血脂、降血糖,提高人体免疫力,延缓衰老、保健美容等功效,冲泡时茶汤清澈明亮,茶香中夹杂灵芝的清香,口感苦后回甘;此外,本发明所述的舞茸灵芝茶,具有灵芝和茶叶清香,汤色红艳,滋味甘醇,叶底鲜红明亮,显著的提升了红茶的品质和附加值,具有显著的经济效率和社会效率,也为保健茶提供更多品种,便于消费者选用。
治疗功效:本发明的舞茸灵芝茶具有护肝养胃、安神明目、调节血脂、提高人体免疫力的作用。
本发明还提供了一种检测增强免疫力的动物试验方法,采用mtt法检测cona诱导的小鼠淋巴细胞增殖转化功能,耳肿胀法检测小鼠的迟发型变态反应,jerne改良玻片法检测小鼠抗体生成细胞数,血凝法检测小鼠血清溶血素水平,半体内法检测小鼠腹腔巨噬细胞吞噬红细胞能力,内
附图说明
图1是舞茸灵芝茶工艺简图;
图2是灰树花提取物工艺流程图;
图3是灵芝提取物工艺流程图。
具体实施方式
实施例1:舞茸灵芝茶,以下述重量的原料制成,
红茶150份、
灰树花提取物75份、
灵芝提取物25份。
灰树花提取物的具体制备步骤如下:
b1、将灰树花原料净选后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液过200目不锈钢筛网,合并3次滤液,得b1品;
b2、将b1品真空浓缩至70℃-80℃下的相对密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;
b3、将b2品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灰树花提取物。
灵芝提取物的具体制备步骤如下:
c1、将灵芝子实体进行粉碎,得c1品;
c2、将c1品通过水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目筛过滤,合并滤液,得合并滤液c2品;
c3、将c2品减压浓缩,真空度-0.06~-0.08mpa,浓缩至70℃-80℃下的相对密度1.05-1.15,得浓缩液c3品;
c4、将c3品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灵芝提取物。
舞茸灵芝茶的具体制备步骤如下:
a、将红茶采用co60辐照灭菌,辐照剂量6kgy,粉碎过80目筛,得a品;
b、灰树花提取物过筛,得b品;
c、灵芝提取物过筛,得c品;
d、将a品、b品和c品置于混合机中,混合28~35分钟,得d品;
e、向d品中加入适量80%乙醇,混合均匀,通过14目筛制粒,再通过65℃烘干,控制水分≤10%,14目筛整粒,得成品;最后将成品颗粒按2.5g/袋进行分装得舞茸灵芝茶袋,控制装量差异在±5%,然后装盒、检验、入库。
实施例2:舞茸灵芝茶,以下述重量的原料制成,
红茶150份、
灰树花提取物50份、
灵芝提取物50份。
灰树花提取物的具体制备步骤如下:
b1、将灰树花原料净选后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液过200目不锈钢筛网,合并3次滤液,得b1品;
b2、将b1品真空浓缩至70℃-80℃下的相对密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;
b3、将b2品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灰树花提取物。
灵芝提取物的具体制备步骤如下:
c1、将灵芝子实体进行粉碎,得c1品;
c2、将c1品通过水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目筛过滤,合并滤液,得合并滤液c2品;
c3、将c2品减压浓缩,真空度-0.06~-0.08mpa,浓缩至70℃-80℃下的相对密度1.05-1.15,得浓缩液c3品;
c4、将c3品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灵芝提取物。
舞茸灵芝茶的具体制备步骤如下:
a、将红茶采用co60辐照灭菌,辐照剂量6kgy,粉碎过80目筛,得a品;
b、灰树花提取物过筛,得b品;
c、灵芝提取物过筛,得c品;
d、将a品、b品和c品置于混合机中,混合28~35分钟,得d品;
e、向d品中加入适量80%乙醇,混合均匀,通过14目筛制粒,再通过65℃烘干,控制水分≤10%,14目筛整粒,得成品;最后将成品颗粒按2.5g/袋进行分装得舞茸灵芝茶袋,控制装量差异在±5%,然后装盒、检验、入库。
实施例3:舞茸灵芝茶,以下述重量的原料制成,
红茶150份、
灰树花提取物25份、
灵芝提取物75份。
灰树花提取物的具体制备步骤如下:
b1、将灰树花原料净选后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液过200目不锈钢筛网,合并3次滤液,得b1品;
b2、将b1品真空浓缩至70℃-80℃下的相对密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;
b3、将b2品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灰树花提取物。
灵芝提取物的具体制备步骤如下:
c1、将灵芝子实体进行粉碎,得c1品;
c2、将c1品通过水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目筛过滤,合并滤液,得合并滤液c2品;
c3、将c2品减压浓缩,真空度-0.06~-0.08mpa,浓缩至70℃-80℃下的相对密度1.05-1.15,得浓缩液c3品;
c4、将c3品喷雾干燥,入口温度180±5℃,出口温度70±5℃,过80目筛,得灵芝提取物。
舞茸灵芝茶的具体制备步骤如下:
a、将红茶采用co60辐照灭菌,辐照剂量6kgy,粉碎过80目筛,得a品;
b、灰树花提取物过筛,得b品;
c、灵芝提取物过筛,得c品;
d、将a品、b品和c品置于混合机中,混合28~35分钟,得d品;
e、向d品中加入适量80%乙醇,混合均匀,通过14目筛制粒,再通过65℃烘干,控制水分≤10%,14目筛整粒,得成品;最后将成品颗粒按2.5g/袋进行分装得舞茸灵芝茶袋,控制装量差异在±5%,然后装盒、检验、入库。
实施例4:增强免疫力动物实验
用近交系雄性小鼠c57bl/6j,6~8周龄,体重18~22g。根据受试物的人口服推荐量设样品低、中、高剂量组分别为250、500、1000mg/kgbw,同时设1个阴性对照组,实验每组15只小鼠。将实施例1中制备的舞茸灵芝茶袋用开水冲泡10分钟,取出舞茸灵芝茶袋后,分别加水配置成1.25、2.50、5.00mg/ml浓度溶液(按样品总重量配置),给予相应剂量组动物灌胃,灌胃体积为0.2ml/10gbw,阴性对照组给予等体积的纯水,每天灌胃1次,给予时间30天。
1.mtt法cona诱导的小鼠脾淋巴细胞转化实验
1.1仪器和材料
rpmi1640细胞培养液、小牛血清、2-巯基乙醇(2-me)、青霉素、链霉素、刀豆蛋白a(cona)、盐酸、异丙醇、mtt、hank's液、pbs缓冲液(ph7.2-7.4)
纱布、200目筛网、24孔培养板,96孔培养板(平底),手术器械、大号注射器内芯、二氧化碳培养箱、酶标仪、分光光度计、超净工作台、高压灭菌器、无菌滤器。
1.2实验步骤
1.2.1试剂配制
完全培养液rpmi1640培养液过滤除菌,用前加入10%小牛血清,1%谷氨酰胺(200mmol/l),青霉素(100u/ml),链霉素(100ug/l)及5×10-5mol/l的2-巯基乙醇,用无菌的1mol/l的hcl或1mol/l的naoh调ph至7.0-7.2,即完全培养液。
cona液用双蒸水配制成100ug/ml的溶液,过滤除菌,在低温冰箱(-20℃)保存。
无菌hank's液用前以3.5%的无菌nahco3调ph7.2-7.4。
mtt液将5mgmtt溶于1mlph7.2的pbs中,现配现用。
酸性异丙醇溶液96ml异丙醇中加入4ml1mol/l的hcl,临用前配制。
1.2.2脾细胞悬液制备
无菌取脾,置于盛有适量(3-5ml)无菌hank's液平皿中,并在脾上面放置一块纱布,用大号注射器内芯轻轻将脾磨碎,制成单个细胞悬液。经200目筛网过滤,用hank's液洗2次,每次离心10min(1000r/min)。然后将细胞悬浮于2ml的完全培养液中,用全自动细胞计数仪计数脾细胞,或用台酚兰染色计数活细胞数(应在95%以上),调整细胞浓度为3×106个/ml。
1.2.3淋巴细胞增殖反应
将细胞悬液分两孔加入24孔培养板中,每孔1ml,一孔加75μlcona液(相当于7.5μg/ml),另一孔作为对照,置5%co2,37℃co2孵箱中培养72h。培养结束前4h,每孔轻轻吸去上清液0.7ml,加入0.7ml不含小牛血清的rpmi1640培养液,同时加入mtt(5mg/ml)50μl/孔,继续培养4h。培养结束后,每孔加入1ml酸性异丙醇,超声震荡(2秒)或人工吹打混匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔分装3孔作为平行样,用酶联免疫检测仪,以570nm波长测定光密度值。也可将溶解液直接移入2ml比色杯中,分光光度计上在波长570nm测定od值。
1.3数据处理及结果
cona诱导的小鼠淋巴细胞转化试验结果(见表1)表明,样品3个剂量组小鼠的淋巴细胞转化能力均高于阴性对照组(f=3.514,p=0.025),其中高剂量组与阴性对照组比较差异有统计学意义。
表1小鼠免疫功能相关试验结果
2二硝基氟苯诱导小鼠迟发型变态反应(耳肿胀法)
2.1材料
dnfb、丙酮、麻油、硫化钡、打孔器。
2.2实验步骤
2.2.1试剂配制
dnfb溶液dnfb溶液应新鲜配制,称取dnfb50mg,置清洁干燥小瓶中,将预先配好的5ml丙酮麻油溶液(丙酮:麻油=1:1),倒入小瓶,盖好瓶塞并用胶布密封。混匀后,用250μl注射器通过瓶盖取用。
2.2.2致敏
每鼠腹部皮肤用硫化钡脱毛,范围约3cm×3cm、用dnfb溶液50μl均匀涂抹致敏。
2.2.3迟发型变态反应(dth)的产生与测定
5天后,用dnfb溶液10μl均匀涂抹于小鼠右耳(两面)进行攻击。攻击后24h颈椎脱臼处死小鼠,剪下左右耳壳。用打孔器取下直径8mm的耳片,称重。
2.2.4数据处理与结果
迟发型变态反应试验结果如表1所示,表明样品三个剂量组小鼠的左右耳片重量差值均高于阴性对照组,其中高剂量组与阴性对照组相比差异有统计学意义。
从cona诱导的小鼠淋巴细胞转化试验和迟发型变态反应试验结果,可以判定细胞免疫试验结果阳性。
3.抗体生成细胞检测
3.1仪器和材料
溶血空斑自动图象分析仪、二氧化碳培养箱、恒温水浴、离心机、手术器械、200目筛网、srbc、补体(豚鼠血清)、hank's液、rpmi1640培养液、sa缓冲液(c4h4n2o30.46g,mgcl20.1g,cacl2.2h2o0.2g,nacl8.38g,nahco30.252gandc8h11n2nao30.3g,加蒸馏水至1000ml)、灭菌生理盐水、琼脂糖。
3.2实验步骤:
3.2.1srbc
绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,生理盐水2500rpm/min,15min,洗涤3次,制备压积srbc,放入4℃冰箱保存备用。
3.2.2完全培养基的制备:新生小牛血清经绵羊红细胞(v/v,5:1)吸收,4℃,30-60min后,加入不完全培养基rpmi1640中,制备成含20%小牛血清的完全培养基。
3.2.3补体制备
股动脉取血,静置30-60min,2500rpm/min,15min分离血清,将5-10只豚鼠血清混合后,与压积srbc以5:1(v/v)比例混合,4℃冰箱放置30-60min,间或震荡,2500rpm/min,15min分离血清,分装,-80℃冰箱保存。用时以完全培养基1:10(v/v)比例稀释。
3.2.4免疫动物
压积srbc以生理盐水制成2%(v/v)的细胞悬液(约1×108个srbc),每只鼠腹腔注射0.2ml。
3.2.5脾细胞悬液制备
将srbc免疫4-5天后的小鼠颈椎脱臼处死,无菌取脾脏,并在脾上面放置一块纱布,用大号注射器内芯轻轻将脾磨碎,制成单个细胞悬液,200目筛网过滤,1000rpm/min,10min,去上清,hank’液洗2遍,以完全培养基rpmi1640制备成5×106~1×107个细胞/ml的脾细胞悬液。
3.2.6空斑的测定
3.2.6.1底层培养基制备0.5g琼脂糖加入100ml灭菌生理盐水中,加热溶解,待温度于50℃左右时,以1ml/孔的量加至六孔培养板中,琼脂凝固后备用。
3.2.6.2顶层培养基制备0.5g琼脂糖加入100mlhank’s液中(ph7.2-7.4),加热溶解,以0.5ml/试管的量加至46-50℃恒温的试管中。
3.2.6.3铺板50μl20%srbc(生理盐水配制,v/v)、200μl脾细胞悬液先后加入含有0.5ml顶层的试管中,迅速混匀,倒入六孔板中并铺平顶层混合液,每个样本做两个平行孔。
3.2.6.4空斑测定:已制备好培养板放入37℃、5%co2培养箱中孵育1h,然后每孔加入500μl以完全培养基稀释的补体(v/v,1:10),继续孵育2h,自动图象分析仪读取溶血空斑图象分析软件计数溶血空斑数。取平行孔空斑数的平均值为样本的溶血空斑数值,以空斑数/106脾细胞表示。
3.3数据处理及结果
抗体生成细胞测定结果如表1所示,其结果表明样品各剂量组小鼠的抗体生成细胞数均高于阴性对照组。
4.血清溶血素的测定(血凝法)
4.1仪器和材料
srbc、生理盐水、微量血凝实验板、离心机
4.2实验步骤
4.2.1srbc绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,放入4℃冰箱保存备用,可保存2周。
4.2.2免疫动物及血清分离取羊血,用生理盐水洗涤3次,每次离心(2000r/min)10min。将压积srbc用生理盐水配成2%(v/v)的细胞悬液,每只鼠腹腔注射0.2ml进行免疫。4~5d后,摘除眼球取血于离心管内,放置约1h,将凝固血与管壁剥离,使血清充分析出,2000r/min离心10min,收集血清。
4.2.3凝集反应用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100μl,再加入100μl0.5%(v/v)的srbc悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3h,观察血球凝集程度。
4.3数据处理及结果
血清溶血素测定结果(如表1所示),表明样品各剂量小鼠的抗体积数均高于阴性对照组。
5.小鼠碳廓清实验
5.1仪器和试剂
分光光度计、全自动酶标仪、计时器、血色素吸管、印度墨汁、na2co3
5.2实验步骤
5.2.1溶液配制
注射用墨汁将印度墨汁原液用生理盐水稀释3~4倍。
na2co3溶液取0.1gna2co3,加蒸馏水至100ml。
5.2.2注射墨汁称体重,从小鼠尾静脉注入稀释的印度墨汁,按每10g体重0.1ml计算。待墨汁注入,立即计时。
5.2.3测定
注入墨汁2分钟和10分钟后,分别从内眦静脉丛取血20μl,并立即将其加到2ml0.1%na2co3溶液中。用分光光度计或全自动酶标仪在600nm波长处测光密度值(od),以na2co3溶液作空白对照。
将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,称重。
以吞噬指数表示小鼠碳廓清的能力。按下式计算吞噬指数a:
k=(lgod1-lgod2)/(t2-t1)
吞噬指数a=体重/(肝重+脾重)×
5.2.4数据处理及结果
小鼠碳廓清实验结果如表2所示,其结果表明样品各剂量组小鼠的小鼠碳廓清能力均高于阴性对照组。
表2小鼠免疫功能相关试验结果
6.小鼠腹腔巨噬细胞吞噬荧光微球试验方法
6.1仪器和材料
hank's液,小牛血清,pbs缓冲液,生理盐水,荧光微球(φ2μm),1%小牛血清白蛋白(bsa)。
流式细胞仪,超声清洗仪,二氧化碳细胞培养箱,离心机,6孔培养板,细胞刮,过滤器(75m),流式上样管,流式细胞仪专用鞘液,移液枪及吸头,白细胞计数板,手术器械一套,注射器,滴管,胶头吸管。
6.2实验步骤
6.2.1试剂配制
6.2.1.1含5%小牛血清的hank's液:取10ml小牛血清加入200mlhank's液中,混匀,临用前配。
6.2.1.2pbs缓冲液的配制方法:kh2po46.66g,na2hpo4·12h2o6.38g,将上述试剂溶于1000ml蒸馏水中调ph值至7.2即成。
6.2.1.32%绵羊红细胞悬液的配制方法:实验前取绵羊颈静脉血,置于盛有玻璃珠(20个左右)的三角瓶内,连续顺一个方向充分摇动5~10分钟,除去纤维蛋白,用生理盐水洗涤3次,每次1500rpm,离心10分钟,4℃冰箱保存。实验前弃去上清,按血球压积用生理盐水配制成2%的红细胞悬液。
6.2.1.41%bsa的配制:0.5gbsa溶于50mlpbs缓冲液中,临用前配较好。
6.2.1.5荧光微球预调理:100μl荧光微球与10ml1%bsa37℃避光孵育30min,超声处理5min,临用前配。
6.2.2腹腔巨噬细胞吞噬荧光微球过程
实验前4天给每只小鼠腹腔注射0.2ml2%绵羊血红细胞激活小鼠巨噬细胞,实验当天用颈椎脱臼法处死小鼠,腹腔注射加小牛血清的hank's液3ml/只,轻轻按揉腹部20次,以充分洗出腹腔巨噬细胞,然后将腹壁剪开一个小口,吸取腹腔洗液2ml用75μm过滤器过滤至试管内,调整巨噬细胞数为4~6×105/ml。用移液枪吸取1ml腹腔洗液于6孔培养板中,加入已经预调理过的荧光微球(1×107/板),37℃二氧化碳细胞培养箱(或室温)避光孵育90~120分钟,孵育结束后弃上清(含未贴壁细胞和多余荧光微球),每次使用1.0mlpbs缓冲液轻轻洗涤2次,去上清后再加入4℃pbs缓冲液0.3ml,用细胞刮刮下贴壁细胞,轻轻吹打均匀后经75μm过滤器过滤后上机分析。
6.2.3流式细胞仪检测分析
6.2.3.1设门:首先设立fsc-ssc二维散点图,通过调节fsc和ssc电压值,以巨噬细胞设门界定分析的巨噬细胞群,最大限度地排除其它有核细胞、细胞碎片等的干扰;
6.2.3.2获取:在荧光微球发射光的荧光通路检测巨噬细胞的荧光强度,每份样本获取5000个巨噬细胞,数据可显示于二维散点图和直方图中。在二维散点图中可通过设门圈定未吞噬荧光微球的巨噬细胞群和吞噬荧光微球的巨噬细胞群;在直方图中可通过标尺标定未吞噬荧光微球的巨噬细胞群和吞噬荧光微球的巨噬细胞群,全部数据经相关软件分析未吞噬荧光微球的巨噬细胞和吞噬不同数量荧光微球的巨噬细胞的比例。
6.3数据处理及结果
吞噬百分率(%)=吞噬荧光微球的巨噬细胞数/计数的巨噬细胞数×100
吞噬指数=被吞噬的荧光微球总数/计数的巨噬细胞数
以吞噬百分率或吞噬指数表示小鼠巨噬细胞的吞噬能力。吞噬百分率需进行数据转换,x=sin-1
其结果如表2所示,结果表明样品各剂量组小鼠的腹腔巨噬细胞的吞噬指数及吞噬率均高于阴性对照组。
7.nk细胞活性测定(乳酸脱氢酶测定法)
7.1仪器和材料
酶标仪、全自动细胞计数仪、yac-1细胞、hank's液(ph7.2~7.4)、rpmi1640完全培养液、乳酸锂或乳酸钠、硝基氯化四氮唑(int)、吩嗪二甲酯硫酸盐(pms)、nad、0.2mol/l的tris-hcl缓冲液(ph8.2)、1%np40或2.5%triton
7.2实验步骤
7.2.1ldh基质液的配制
乳酸锂5×10-2mol/l
硝基氯化四氮唑(int)6.6×10-4mol/l
吩嗪二甲酯硫酸盐(pms)2.8×10-4mol/l
氧化型辅酶ⅰ(nad)1.3×10-3mol/l
将上述试剂溶于0.2mol/l的tris-hcl缓冲液中(ph8.2)
7.2.2靶细胞的传代(yac-1细胞)
实验前24h将靶细胞进行传代培养。应用前以hank's液洗3次,用rpmi1640完全培养液调整细胞浓度为4×105个/ml。
7.2.3脾细胞悬液的制备(效应细胞)
无菌取脾,置于盛有适量无菌hank's液的小平皿中,并在脾上面放置一块纱布,用大号注射器内芯轻轻将脾磨碎,制成单个细胞悬液。经200目筛网过滤,用hank's液洗2次,每次离心10min(1000r/min)。弃上清将细胞浆弹起,加入0.5ml灭菌水20秒,裂解红细胞后再加入0.5ml2倍hank’s液及8mlhank’s液,1000rpm,10min离心,然后将细胞悬浮于2ml的完全培养液中,用全自动细胞计数仪计数脾细胞;或用1ml含10%小牛血清的rpmi1640完全培养液重悬,用1%冰醋酸稀释后计数(活细胞数应在95%以上),用台酚兰染色计数活细胞数(应在95%以上),最后用rpmi1640完全培养液调整细胞浓度为2×107个/ml。
7.3nk细胞活性检测
取靶细胞和效应细胞各100μl(效靶比50:1),加入u型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100μl,靶细胞最大释放孔加靶细胞和1%np40或2.5%triton各100μl;上述各项均设三个复孔,于37℃、5%co2培养箱中培养4h,然后将96孔培养板以1500r/min离心5min,每孔吸取上清100μl置平底96孔培养板中,同时加入ldh基质液100μl,反应3min,每孔加入1mol/l的hcl30μl,在酶标仪490nm处测定光密度值(od)。
按下式计算nk细胞活性:
nk细胞活性%=(反应孔od-自然释放孔od)/(最大释放孔od-自然释放孔od)×100%
7.4数据处理及结果
nk细胞活性需进行数据转换,x=sin-1
其结果如表2所示,结果表明样品各剂量组小鼠的nk细胞活性均高于阴性对照组。
8.结论
通过cona诱导的小鼠淋巴细胞增殖转化功能检测,迟发型变态反应检测,小鼠抗体生成细胞数检测,小鼠血清溶血素水平检测,小鼠腹腔巨噬细胞吞噬红细胞能力检测,碳廓清能力检测,nk细胞活性测定,结果表明本发明所述的组合物具有增强免疫力的功能。
- 还没有人留言评论。精彩留言会获得点赞!