使用腺病毒的治疗方法与流程
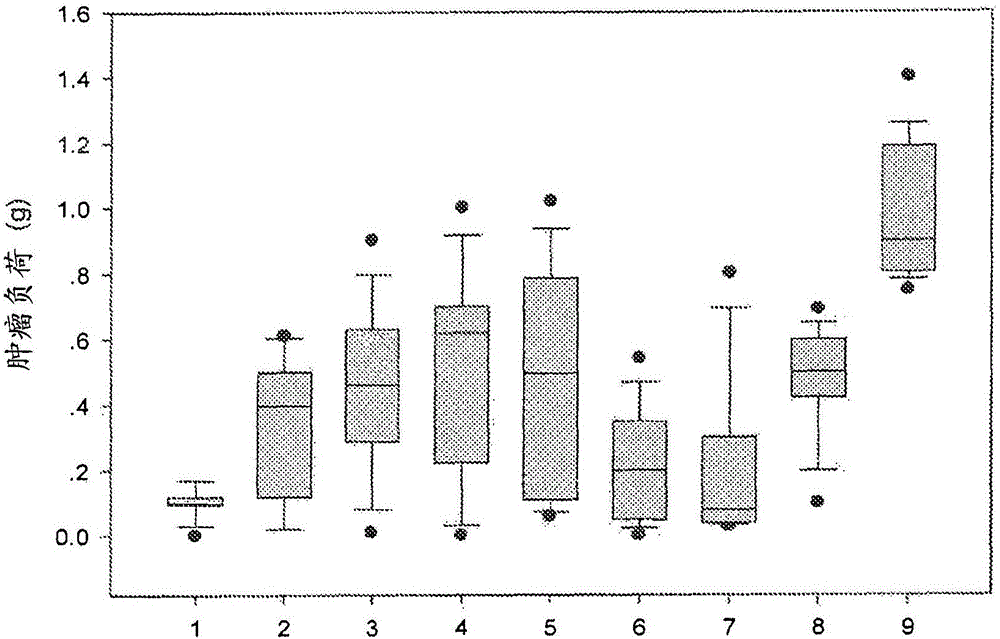
使用腺病毒的治疗方法发明领域本公开内容涉及癌症生物学、免疫学和药理学。更具体地,它涉及通过施用表达Fas嵌合转基因产物的核酸构建体或所述核酸构建体的均一群体治疗妇科癌症有关的疾病或紊乱的方法。发明背景妇科癌症在临床上具有侵袭性,通常在女性生殖道的组织中发展,并与不良结果相关。这些癌症包括卵巢癌、子宫癌、输卵管癌和宫颈癌,并且还包括恶性米勒管混合瘤(malignantmixed米勒管tumors,MMMT)。在极少数情况下,MMMT也能够在女性腹膜(腹壁内膜)中发展。妇科癌症可能难于检测并往往在它们处于晚期时才得到诊断。卵巢癌大约占女性癌症的百分之三。作为女性中第九位最常见的癌症,卵巢癌是女性癌症相关死亡的第五大原因,并且是最致命的妇科癌症(2012年)。卵巢癌以对基于铂和紫杉烷的疗法的高反应率而对化疗敏感。但是,尽管在治疗的设计和递送中的进步,癌症复发和化疗抗性仍然是治疗这些类型的癌症的障碍。尽管积极的主要治疗和高的初始反应率,大多数患有晚期卵巢癌的女性会复发并发展抗性疾病。在这些晚期疾病状态中,对后续化疗的反应率大大减少了,突出表明迫切需要开发改进的治疗剂和策略。发明概述本发明涉及降低或减少患者中肿瘤的尺寸或者消除或减缓肿瘤的生长的方法,该方法包括给所述患者施用有效量的核酸构建体,所述核酸构建体包含被可操作地连接至内皮细胞特异性启动子的Fas嵌合基因,其中在所述患者中,由所述核酸构建体编码的Fas嵌合基因产物降低或减少所述肿瘤的尺寸或消除所述肿瘤,并且其中所述肿瘤与女性妇科癌症或其转移有关。本发明还提供抑制、降低或减少肿瘤中新生血管形成或血管发生的方法,该方法包括给患有所述肿瘤的患者施用有效量的核酸构建体,所述核酸构建体包含被可操作地连接至内皮细胞特异性启动子的Fas嵌合基因,其中由所述核酸构建体编码的Fas嵌合基因产物抑制、降低或减少所述肿瘤中新生血管形成或血管生成,并且其中所述肿瘤与女性妇科癌症或其转移有关。此外,本发明包括治疗或预防患者中与以下癌症有关或源自以下癌症的肿瘤的方法:米勒管癌症(Mülleriancancer)、卵巢癌、腹膜癌、输卵管癌或子宫乳头状浆液性癌,该方法包括施用有效量的核酸构建体,所述核酸构建体包含被可操作地连接至内皮细胞特异性启动子的Fas嵌合基因,其中由所述核酸构建体编码的Fas嵌合基因产物治疗或预防女性妇科癌症或其转移。在一个实施方案中,所述肿瘤或其转移在所述施用之后被降低尺寸或被消除或降低所述肿瘤的生长。在另一个实施方案中,所述肿瘤或其转移被降低,使得与所述施用之前所述肿瘤的最大直径(LD)相比,其LD被降低至少大约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在其它实施方案中,所述女性妇科癌症与以下癌症有关或源自所述癌症:米勒管癌症、卵巢癌、腹膜癌、输卵管癌、子宫乳头状浆液性癌、其任意组合或其转移。在一些实施方案中,所述患者之前已经接受基于铂的疗法。在一个实例中,所述患者患有复发性铂抗性癌症。在另一个实例中,患有复发性铂抗性癌症或复发性紫杉烷抗性癌症的患者在完成或接受基于铂的疗法或基于紫杉烷的疗法的六个月内具有进展性(progressive)肿瘤。在某些实施方案中,所述患者没有针对腺病毒的已有抗体或没有发展针对腺病毒的抗体。在其它实施方案中,本发明的方法还包括施用有效量的一种或更多种化疗剂。所述一种或更多种化疗剂可以在施用所述核酸构建体之前、同时或之后进行施用。在一个具体的实施方案中,所述化疗剂是紫杉醇。在某些实施方案中,用于本发明方法的核酸构建体是腺病毒。在一个实例中,所述腺病毒表达Fas嵌合基因产物,所述Fas嵌合基因产物包含融合至Fas多肽的跨膜结构域和胞内结构域的TNF受体1(TNFR1)多肽的胞外结构域。编码Fas嵌合基因产物的多核苷酸被可操作地连接至内皮细胞特异性启动子,例如PPE-1-3X启动子。在一个具体的实施方案中,所述腺病毒包含与SEQIDNO:19至少70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列。本发明的一个方面包括包含SEQIDNO:18的核酸构建体。在另一个方面,所述核酸构建体还包含编码Fas嵌合蛋白的核苷酸序列。在其它实施方案中,本发明是包含SEQIDNO:19的载体。所述载体可以是腺病毒。在又一些其它实施方案中,本发明是具有欧洲细胞培养物保藏中心(ECACC)保藏号13021201的腺病毒。所述腺病毒可以为至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%纯。在一个实例中,本发明包含药物组合物,所述药物组合物包含所述腺病毒和药学可接受的载体,其中所述组合物不含有另一类型的腺病毒,例如包含SEQIDNO:20或SEQIDNO:21的腺病毒。本发明还包括在需要其的受试者的组织中抑制、降低或减少血管发生或新生血管形成的方法,该方法包括向所述受试者施用所述核酸构建体、所述载体、所述腺病毒或所述组合物。在一个实施方案中,所述组织包含肿瘤。在另一个实施方案中,在所述施用之后肿瘤的尺寸被减少或降低或者在所述施用之后所述肿瘤的生长被减缓。在其它实施方案中,所述肿瘤源自以下癌症或与以下癌症有关:甲状腺癌、神经内分泌癌、胶质母细胞瘤、女性妇科癌症、其任意组合或其转移。附图简要说明图1显示了在施用媒介物(vehicle)、VB1111E9(109个病毒颗粒(VP)的VB-111)、VB1111E11(1011个VP的VB-111)、低Com(ComLow)(20mg/kg卡铂+10mg/kg爱宁达(Alimta))、高Com(ComHigh)(50mg/kg卡铂+30mg/kg爱宁达)、VB1111E9+低Com(VB-111109个VP+20mg/kg卡铂+10mg/kg爱宁达)、VB1111E9+高Com(VB-111109个VP+50mg/kg卡铂+30mg/kg爱宁达)、VB1111E11+低Com(VB-1111011个VP+20mg/kg卡铂+10mg/kg爱宁达)和VB1111E11+高Com(VB-1111011个VP+50mg/kg卡铂+30mg/kg爱宁达)(x轴)的Lewis肺癌小鼠中的平均肿瘤负荷(y轴)。图2显示了在施用媒介物(1)、VB1111E9(109个病毒颗粒(VP)的VB-111)(2)、VB1111E11(1011个VP的VB-111)(3)、低Com(20mg/kg卡铂+10mg/kg爱宁达)(4)、高Com(50mg/kg卡铂+30mg/kg爱宁达)(5)、VB1111E9+低Com(VB-111109个VP+20mg/kg卡铂+10mg/kg爱宁达)(6)、VB1111E9+高Com(VB-111109个VP+50mg/kg卡铂+30mg/kg爱宁达)(7)、VB1111E11+低Com(VB-1111011个VP+20mg/kg卡铂+10mg/kg爱宁达)(8)和VB1111E11+高Com(VB-1111011个VP+50mg/kg卡铂+30mg/kg爱宁达)(9)(x轴)的Lewis肺癌小鼠中的平均肿瘤负荷(y轴)的盒型图(boxplot)。图3显示了包含被可操作地连接至内皮细胞特异性启动子(例如VB-111)的FAS嵌合基因的腺病毒和紫杉醇的组合治疗方案。每八周施用大约3x1012个VP或1x1013个VP的VB-111,并且每周施用紫杉醇一次。发明详述一、定义除非另有定义,否则本文使用的所有技术和科学术语具有如本发明所属技术领域的普通技术人员通常理解的相同的含义。在有冲突的情况下,以本发明(包括定义)为准。除非上下文另有要求,否则单数术语应包括复数,且复数术语应包括单数。本文所提到的所有出版物、专利和其它文献通过引用整体并入本文用于所有目的,如同每篇出版物或专利申请被具体地且个别地指明通过引用并入本文一样。虽然与本文所述的那些类似或等同的方法和材料能够被用于实践或测试本发明,合适的方法和材料被描述如下。所述材料、方法和实例仅仅是说明性的而非旨在限制。可以从详细的说明书和从权利要求书容易地看到本发明的其它特征和优点。为了进一步定义本发明,提供以下术语和定义。在本文中所使用的“抗体”是指完整的免疫球蛋白或其抗原结合片段。本发明的抗体可以是任何同种型(isotype)或类(例如M、D、G、E和A)或任何亚类(例如G1-4、A1-2),并且可以具有或者kappa(κ)或者lambda(λ)轻链。在本文中所使用的术语“有效量”是指在剂量上和针对必需的时间段有效实现所需结果的量。所需结果可以是例如体外或体内减少或抑制新生血管形成或血管生成。有效量不需要是完全去除新生血管形成或血管生成。在本文中所使用的“治疗有效量”是指在剂量上和针对必需的时间段有效实现所需治疗结果的量。治疗结果可以是例如症状减轻、在放射成像中肿瘤尺寸的消退或稳定化、延长的存活期、改善的运动性等。治疗结果不需要是“治愈”。在本文中所使用的“预防有效量”是指在剂量上和针对必需的时间段有效实现所需预防结果的量。典型地,由于预防剂量是在疾病的很早期之前或在疾病的早期被用于受试者,所述预防有效量将小于所述治疗有效量。术语“多核苷酸”或“核苷酸”涵盖单数核酸以及复数核酸,并且指分离的核酸分子或构建体,例如信使RNA(mRNA)或质粒DNA(pDNA)。在某些实施方案中,多核苷酸包含常规磷酸二酯键或非常规的键(例如酰胺键,如发现于肽核酸(PNA)中的键)。在本文中所使用的“多核苷酸”、“核苷酸”、“核酸”可以互换使用并含有全长cDNA序列的核苷酸序列,包括非翻译5'和3'序列、编码序列以及所述核酸序列的片段、表位、结构域和变体。所述多核苷酸可以由任意多核糖核苷酸或多脱氧核糖核苷酸组成,其可以是未修饰的RNA或DNA或者修饰的RNA或DNA。例如,多核苷酸可以由单链和双链DNA、单链和双链区域混合的DNA、单链和双链RNA、单链和双链区域混合的RNA、包含可以是单链或更典型地双链或单链和双链区域混合的DNA和RNA的杂合分子组成。此外,所述多核苷酸可以由包含RNA或DNA或RNA和DNA二者的三链区域组成。多核苷酸还可以含有一个或更多个修饰的碱基或因为稳定性或因为其它原因被修饰的DNA或RNA骨架。“修饰的”碱基包括例如三苯甲基化碱基和稀有碱基(如肌苷)。可以对DNA和RNA进行各种修饰;因此,“多核苷酸”包括化学、酶法或代谢修饰的形式。在本发明中,多肽可以由通过肽键或修饰的肽键(即肽电子等排物)互相结合的氨基酸组成,并可以含有除20种基因编码的氨基酸之外的氨基酸(例如非天然存在的氨基酸)。本发明的多肽可以或者通过天然的过程(如翻译后加工)或者通过本领域公知的化学修饰技术进行修饰。这样的修饰被充分描述于基础教科书和更详细的专著以及大量的研究文献中。修饰可以在多肽的任何地方发生,包括肽骨架、氨基酸侧链和氨基或羧基末端。应当理解的是,相同类型的修饰可以相同或不同的程度存在于给定多肽的几个位点。而且,给定多肽可以含有许多类型的修饰。多肽可以是分支的,例如作为泛素化的结果,并且它们可以是环状的,有或者没有分支。环状的、分支的和分支环状多肽可以由翻译后天然过程导致或者可以由合成方法进行制备。修饰包括乙酰化、酰化、ADP-核糖基化、酰胺化、黄素的共价连接、血红素部分的共价连接、核苷酸或核苷酸衍生物的共价连接、脂质或脂质衍生物的共价连接、磷脂酰肌醇的共价连接、交联、环化、二硫键形成、脱甲基化、共价交联的形成、半胱氨酸的形成、焦谷氨酸的的形成、甲酰化、γ-羧化、糖基化、GPI锚的形成、羟基化、碘化、甲基化、豆蔻酰化、氧化、聚乙二醇化、蛋白质水解加工、磷酸化、异戊二烯化、外消旋化、硒化、硫酸化、转移RNA介导氨基酸添加到蛋白质(如精氨酰化)和泛素化。(参见,例如Proteins-StructureAndMolecularProperties,2ndEd.,T.E.Creighton,W.H.FreemanandCompany,NewYork(1993);PosttranslationalCovalentModificationofProteins,B.C.Johnson,Ed.,AcademicPress,NewYork,pgs.1-12(1983);Seifteretal.,MethEnzymol182:626-646(1990);Rattanetal.,AnnNYAcadSci663:48-62(1992)。)当涉及本发明的任意多肽或多核苷酸时,术语“片段”、“变体”、“衍生物”和“类似物”包括保留至少一些活性(即作为所述多肽或多核苷酸的任意天然存在的功能发挥作用的能力)的任意多肽或多核苷酸。例如肿瘤坏死因子受体1(TNFR1)的“片段”、“变体”、“衍生物”和“类似物”具有天然存在的全长TNFR1的一些活性,例如,结合TNFR1配体(即TNF-α或淋巴毒素)的能力。在另一个实例中,FAS多肽的“片段”、“变体”、“衍生物”和“类似物”具有天然存在的全长FAS多肽的一些活性,例如,诱导细胞凋亡的能力。在其它实例中,内皮细胞特异性启动子的“片段”、“变体”、“衍生物”和“类似物”能够诱导被可操作地连接至所述启动子的基因的内皮细胞特异性表达。TNFR1、FAS多肽和内皮细胞特异性启动子的各种片段、变体、类似物或衍生物的另外的非限制性的实例描述如下。在本发明中,“多肽片段”或“蛋白质片段”是指多肽的短氨基酸序列。蛋白质或多肽片段可以是“独立式的”,或包含于更大的多肽内,其中所述片段形成区域的一部分。本发明的多肽片段的代表性实例包括例如包含大约5个氨基酸、大约10个氨基酸、大约15个氨基酸、大约20个氨基酸、大约30个氨基酸、大约40个氨基酸、大约50个氨基酸、大约60个氨基酸、大约70个氨基酸、大约80个氨基酸、大约90个氨基酸和大约100个氨基酸的片段。“保守性氨基酸置换”是这样的,其中所述氨基酸残基被替换为具有类似侧链的氨基酸残基。在本领域已经定义了具有类似侧链的氨基酸残基的家族,包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,如果多肽中的氨基酸被替换成来自相同侧链家族的另一氨基酸,则该置换被认为是保守的。在另一个实施方案中,一串氨基酸可以被保守替换成侧链家族成员的顺序和/或组成不同的结构类似的一串氨基酸。两个多核苷酸或多肽序列之间的术语“序列同一性百分比”是指,考虑到针对这两个序列的最佳比对必须被引入的添加或缺失(即缺口),在比较窗口上由所述序列共有的相同匹配位置的数量。匹配位置是靶序列和参考序列中均表现相同的核苷酸或氨基酸的任意位置。不计算在靶序列中表现的缺口,因为缺口不是核苷酸或氨基酸。同样,不计算在参考序列中表现的缺口,因为计算的是靶序列的核苷酸或氨基酸,而不是来自参考序列的核苷酸或氨基酸。通过以下方法计算序列同一性的百分比:确定在两个序列中均存在相同的氨基酸残基或核酸碱基的位置的数量以得到匹配位置的数量,将匹配位置的数量除以比较窗口中位置的总数并将结果乘以100,得到序列同一性的百分比。两个序列之间的序列比较和序列同一性百分比的确定可以使用对于在线使用和下载均容易获得的软件来完成。合适的软件程序可以从各种来源获得,并且可用于蛋白质和核苷酸序列的比对。适于确定序列同一性百分比的一个程序是bl2seq,该程序为可从美国政府的国家生物技术信息中心BLAST网站(blast.ncbi.nlm.nih.gov)获得的BLAST程序套件的部分。Bl2seq使用或者BLASTN或者BLASTP算法进行两个序列之间的比较。BLASTN是用于比较核酸序列,而BLASTP是用于比较氨基酸序列。其它合适的程序有例如Needle、Stretcher、Water或Matcher,其为EMBOSS生物信息程序套件的部分,并且也可从欧洲生物信息研究所(EBI)在www.ebi.ac.uk/Tools/psa获得。与多核苷酸或多肽参考序列比对的单个多核苷酸或多肽靶序列内的不同区域可以各自具有它们自己的序列同一性百分比。应注意的是,序列同一性百分比的值舍入至最接近的十分之一。例如,80.11、80.12、80.13和80.14向下舍入至80.1,而80.15、80.16、80.17、80.18和80.19向上舍入至80.2。还应注意的是,长度的值将始终是整数。本领域技术人员将理解的是,用于计算序列同一性百分比的序列比对的产生并不仅仅局限于完全由原始序列数据所驱动的二元序列-序列比较。序列比对可以源自多重序列比对。适于产生多个序列比对的一个程序是ClustalW2,其可从www.clustal.org获得。另一个合适的程序是MUSCLE,其可从www.drive5.com/muscle/获得。ClustalW2和MUSCLE备选地可从例如EBI获得。还将理解的是,可以通过将序列数据与异质来源(如结构数据(例如晶体学蛋白质结构)、功能数据(例如突变的位置)或系统发生数据)整合来产生序列比对。整合异质数据以产生多重序列比对的合适的程序是T-Coffee,其可从www.tcoffee.org获得,并且备选地可从例如EBI获得。还将理解的是,用于计算序列同一性百分比的最终比对可以被或者自动或者手工辅助。在本文中所使用的术语“连接的”、“融合的(fused)”、“融合/融合体(fusion)”、“嵌合的”和“嵌合”可以互换使用。这些术语是指两个或更多个的元件或成分以任何方式(包括化学缀合或重组方式)连接在一起。“框内融合”是指两个或更多个开放阅读框(ORF)以保持原始ORF的正确阅读框的方式连接而形成连续的更长ORF。因此,所得到的重组融合体或嵌合蛋白质是含有对应于由原始ORF编码的多肽的两个或更多个区段的单个蛋白质(所述区段在自然界中正常情况下是不会这样连接的)。尽管由此所制得的阅读框在整个融合区段上是连续的,但是这些区段可以由例如框内接头序列在物理上或空间上分隔开。术语“异源的”和“异源部分”是指源自与其要比较的实体不同的实体的多核苷酸、多肽或其它部分。例如,异源多肽可以是合成的或源自不同物种、个体的不同细胞类型或不同个体的相同或不同类型的细胞。在一个方面,异源部分可以是被融合至另一个多肽以产生融合多肽或蛋白质的多肽。在另一个方面,异源部分可以是被缀合至多肽或蛋白质的非多肽(如PEG)。在多肽的上下文中,“线性序列”或“序列”是多肽中以从氨基到羧基末端方向的氨基酸的顺序,其中所述序列中彼此相邻的残基在所述多肽的一级结构中是连续的。在本文中所使用的术语“表达”是指基因通过其产生生化产品(例如RNA或多肽)的过程。所述过程包括细胞内所述基因的功能性存在的任何表现,包括但不限于基因敲低以及瞬时表达和稳定表达。它包括但不限于基因转录成信使RNA(mRNA)、转运RNA(tRNA)、小发夹RNA(shRNA)、小干扰RNA(siRNA)或任何其它RNA产物和这样的mRNA翻译成一个或多个多肽。如果最终所需产物是生化产品,表达包括创造该生化产品和任何前体。二、包含FAS嵌合基因和内皮细胞特异性启动子的核酸构建体本发明涉及通过抑制、降低或减少肿瘤中血管生成或新生血管形成来减少或降低女性妇科癌症中肿瘤的尺寸的方法,该方法包括施用表达FAS嵌合蛋白的核酸构建体。编码FAS嵌合蛋白(或基因产物)的基因在本发明中可被连接至指导所述FAS嵌合基因产物在内皮细胞中表达的内皮细胞特异性启动子。这样的细胞毒性基因产物的表达在不期望有过量的新生血管形成或血管生长的情况下(例如在肿瘤中)是有用的。本发明还提供包含被可操作地连接至内皮细胞特异性启动子的FAS嵌合基因的核酸构建体的均质群体。A.FAS嵌合由本发明的核酸构建体表达的FAS嵌合蛋白包含至少两个“死亡受体”多肽,所述多肽的每一个源自不同的蛋白质。FAS嵌合蛋白的第一多肽包含肿瘤坏死因子受体1(TNFR1)的配体结合结构域。FAS嵌合蛋白的第二多肽包含FAS多肽的效应子结构域。TNFR1的配体结合结构域可以是结合TNFR1配体的任何结构域。在一个实施方案中,TNFR1配体是TNF-α。在另一个实施方案中,TNFR1配体是淋巴毒素-α。TNFR1的配体结合结构域可以是TNFR1的胞外结构域或其任意片段、变体、衍生物或类似物。TNFR1配体结合结构域的非限制性的实例描述如下。可用于本发明的FAS多肽的效应子结构域包含形成死亡诱导性信号传导复合物(death-inducingsignalingcomplex,DISC)的任何FAS结构域,从而诱导细胞凋亡。在一个实施方案中,FAS多肽的效应子结构域包含胞内结构域、跨膜结构域或二者均包含。FAS多肽效应子结构域的非限制性的实例描述如下。TNFR1和FAS多肽可以通过肽键或通过接头进行连接。将TNFR1配体结合结构域与FAS效应子结构域连接的接头可以是多肽接头或非肽接头。例如,用于FAS嵌合蛋白的接头可以包含一个或更多个甘氨酸、丝氨酸、亮氨酸或其任意组合。在一个实施方案中,可用于本发明的接头包含Ser-Leu。在另一个实施方案中,可用于本发明的接头包含(GGGS)n,(Deniseetal.J.Biol.Chem.277:35035-35043(2002)),其中n可以是0、1、2、3、4、5、6、7、8、9或10或更大(SEQIDNO:27)。1.肿瘤坏死因子受体1全长的人TNFR1多肽长455个氨基酸并且也被称为TNF-R1、I型肿瘤坏死因子受体(TNFRI)、TNFR-I、TNFRSF1A、TNFAR、p55、P60或CD120a。已知天然存在的人TNFR1多肽结合TNF-α或同源三聚体淋巴毒素-α。TNF-α与胞外结构域的结合导致TNFR1的同源三聚化,然后其与1型肿瘤坏死因子受体相关死亡结构域蛋白(TRADD)的死亡结构域发生特异性相互作用。各种TRADD相互作用蛋白(如TNF受体相关因子(TRAFS)、受体相互作用性丝氨酸/苏氨酸蛋白激酶1(RIPK1)和具有死亡结构域的Fas相关蛋白(FADD))通过它们与TRADD的缔合被募集至复合物。该复合物活化至少两个不同的信号级联,细胞凋亡和NF-κ-B信号传导。作为人TNFR1多肽序列报道的455个氨基酸的多肽序列在UniProtKB数据库中具有识别号P19438-1。在本文中该人TNFR1多肽序列被命名为同工型(isoform)A和SEQIDNO:2。SEQIDNO:1是编码SEQIDNO:2的核苷酸序列。108aa的多肽序列被报道为人TNFR1多肽序列的同工型并且在UniProtKB数据库中具有识别号P19438-2。该108aa的多肽对应于同工型A(SEQIDNO:2)的第1至108位氨基酸并且在本文中被命名为同工型B。具有232aa的人TNFR1多肽的另一个变体被报道为在UniProtKB数据库中具有识别号P19438-3。该232aa的多肽对应于同工型A(SEQIDNO:2)的第1至232位氨基酸并且在本文中被命名为同工型C。人TNFR1的另外的天然变体包括但不限于包含选自由以下突变组成的组的一个或更多个突变的同工型A、B和C的TNFR1多肽:H51Q、C59R、C59S、C62G、C62Y、P75L、T79M、C81F、C99S、S115G、C117R、C117Y、R121P、R121Q、P305T及其任意组合。其它已知TNFR1变体包括包含L13LILPQ、K255E、S286G、R394L、412:缺失、GPAA443-446APP或其任意组合的同工型A、B和C的TNFR1多肽。表1显示了人野生型TNFR1氨基酸序列和编码所述野生型TNFR1的核苷酸序列。表1.TNFR1序列本发明还报道了小鼠TNFR1多肽序列及其变体。454aa的小鼠TNFR1多肽在UniProtKB数据库中具有识别号P25118。在其它动物中已知的TNFR1多肽包括但不限于大鼠(例如UniProtKB数据库中的P22934)、牛(例如UniProtKB数据库中的O19131)、猪(例如UniProtKB数据库中的P50555)或马(例如UniProtKB数据库中的D1MH71)。全长的TNFR1能够被裂解成两条链,(1)TNF受体超家族成员1A、膜形式(即对应于全长TNFR1的第22至455位氨基酸)和(2)TNF结合蛋白1(TBPI)(即对应于全长TNFR1的第41至291位氨基酸)。全长的人TNFR1多肽由信号序列(SEQIDNO:2的第1至21位氨基酸)、胞外结构域(SEQIDNO:2的第22至211位氨基酸)、跨膜结构域(SEQIDNO:2的第212至234位氨基酸)和胞质结构域(SEQIDNO:2的第235至455位氨基酸)组成。TNFR1的胞外结构域包含四个半胱氨酸重复区域,TNFR-Cys1(对应于SEQIDNO:2的第43至82位氨基酸)、TNFR-Cys2(对应于SEQIDNO:2的第83至125位氨基酸)、TNFR-Cys3(对应于SEQIDNO:2的第126至166位氨基酸)和TNFR-Cys4(对应于SEQIDNO:2的第167至196位氨基酸)。如本领域技术人员将理解的,以上所列的结构域的开始和结束的残基可以改变,这取决于所使用的计算机建模程序或用于确定该结构域的方法。因此,TNFR1的各种功能结构域可以与上述定义的那些不同。在一个实施方案中,可用于FAS嵌合蛋白的TNFR1的配体结合结构域包含、TNFR1的胞外结构域或其任何片段、变体、衍生物或类似物基本上由其组成或者由其组成,其中所述TNFR1的胞外结构域或其任何片段、变体、衍生物或类似物结合TNF-α。在另一个实施方案中,TNFR1的配体结合结构域包含TNFR-Cys1;TNFR-Cys2;TNFR-Cys3;TNFR-Cys4;TNFR-Cys1和TNFR-Cys2;TNFR-Cys1和TNFR-Cys3;TNFR-Cys1和TNFR-Cys4;TNFR-Cys2和TNFR-Cys3;TNFR-Cys2和TNFR-Cys4;TNFR-Cys3和TNFR-Cys4;TNFR-Cys1,TNFR-Cys2和TNFR-Cys3;TNFR-Cys1,TNFR-Cys2和TNFR-Cys4;TNFR-Cys2,TNFR-Cys3和TNFR-Cys4;或TNFR-Cys1,TNFR-Cys2,TNFR-Cys3和TNFR-Cys4。在其它实施方案中,FAS嵌合蛋白中的TNFR1配体结合结构域包含TNF结合蛋白I。在又一些其它实施方案中,FAS嵌合蛋白的TNFR1配体结合结构域包含与SEQIDNO:2的第22至190位氨基酸、第22至191位氨基酸、第22至192位氨基酸、第22至193位氨基酸、第22至194位氨基酸、第22至195位氨基酸、第22至196位氨基酸、第22至197位氨基酸、第22至198位氨基酸、第22至199位氨基酸、第22至200位氨基酸、第22至201位氨基酸、第22至202位氨基酸、第22至203位氨基酸、第22至204位氨基酸、第22至205位氨基酸、第22至206位氨基酸、第22至207位氨基酸、第22至208位氨基酸、第22至209位氨基酸、第22至210位氨基酸或第22至211位氨基酸至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成,其中所述配体结合结构域结合TNFR1配体,例如TNF-α。在其它实施方案中,所述TNFR1的配体结合结构域还包含信号肽。合适的信号肽的一个实例是TNFR1的信号肽,例如SEQIDNO:2的第1至21位氨基酸。在又一些其它实施方案中,FAS嵌合基因产物的配体结合结构域包含与SEQIDNO:2的第1至190位氨基酸、第1至191位氨基酸、第1至192位氨基酸、第1至193位氨基酸、第1至194位氨基酸、第1至195位氨基酸、第1至196位氨基酸、第1至197位氨基酸、第1至198位氨基酸、第1至199位氨基酸、第1至200位氨基酸、第1至201位氨基酸、第1至202位氨基酸、第1至203位氨基酸、第1至204位氨基酸、第1至205位氨基酸、第1至206位氨基酸、第1至207位氨基酸、第1至208位氨基酸、第1至209位氨基酸、第1至210位氨基酸或第1至211位氨基酸至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成,其中所述配体结合结构域结合TNFR1配体,例如TNF-α。在一个具体的实施方案中,FAS嵌合蛋白的TNFR1配体结合结构域包含与SEQIDNO:4至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成,其中所述配体结合结构域结合TNFR1配体,例如TNF-α。在又一些其它实施方案中,TNFR1的配体结合结构域由与SEQIDNO:3至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列编码。在又一些其它实施方案中,FAS嵌合蛋白的TNFR1配体结合结构域包含与SEQIDNO:2的第22至108位氨基酸(TNFR1同工型B)、SEQIDNO:2的第22至232位氨基酸(TNFR1同工型C)或SEQIDNO:2的第44至291位氨基酸(TBP1)至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成,其中所述配体结合结构域结合TNFR1配体,例如TNF-α。2.FAS多肽全长的人FAS多肽长335个氨基酸,并且也被称为肿瘤坏死因子受体超家族成员6、Apo-1抗原、细胞凋亡介导的表面抗原FAS、FASLG受体或CD95。天然存在的FAS多肽是针对TNFSF6/FASLG的受体。当FAS多肽结合FAS配体(FasL)时,FAS和FasL之间的相互作用导致形成死亡诱导性信号传导复合物(DISC),其含有FADD、胱天蛋白酶-8和胱天蛋白酶-10。在一些细胞类型(I型)中,加工的胱天蛋白酶-8直接活化胱天蛋白酶家族的其它成员,并触发细胞凋亡的执行。在其它细胞类型(II型)中,FAS-DISC启动反馈环路,其螺旋形提高来自线粒体的促凋亡因子的释放和胱天蛋白酶-8的放大的活化。FAS介导的细胞凋亡可能在外周耐受性的诱导中、在成熟细胞的抗原刺激的自杀中或者二者中发挥作用。作为人FAS多肽序列报道的335aa的多肽序列在UniProtKB数据库中具有识别号P25445-1。该人FAS多肽序列被命名为SEQIDNO:6。SEQIDNO:5是编码SEQIDNO:6的核苷酸序列。编码FAS多肽的核苷酸序列也被称为APT1、FAS1或TNFRSF6。全长FAS多肽含有信号肽(对应于SEQIDNO:6的第1至25位氨基酸)、胞外结构域(对应于SEQIDNO:6的第26至173位氨基酸)、跨膜结构域(对应于SEQIDNO:6的第174至190位氨基酸)和胞内(或胞质)结构域(对应于SEQIDNO:6的第191至335位氨基酸)。胞内结构域含有死亡结构域(例如对应于SEQIDNO:6的第230至314位氨基酸)。如本领域技术人员将理解的,以上所列的结构域的开始和结束的残基可以因所使用的计算机建模程序或用于确定该结构域的方法而有所变化。因此,FAS的各种功能结构域可以由上述定义那些而变化。表2显示了野生型人FAS氨基酸序列和编码所述FAS的核苷酸序列。表2.FAS序列本发明还报道了小鼠FAS的多肽序列及其变体。327aa的小鼠FAS多肽在UniProtKB数据库中具有识别号P25446。在其它动物中已知的FAS多肽包括但不限于旧大陆猴(例如UniProtKB数据库中的Q9BDN4)、恒河猴(例如UniProtKB数据库中的Q9BDP2)、大鼠(例如UniProtKB数据库中的Q63199)或牛(例如UniProtKB数据库中的P51867)。基于FAS多肽中的序列变化,本领域技术人员能够鉴定FAS多肽的效应子结构域中的序列变化。例如,FAS效应子结构域的天然变体可以包括C178R、L180F、P183L、I184V、T198I、Y232C、T241K、T241P、V249L、R250P、R250Q、G253D、G253S、N255D、A257D、I259R、D260G、D260V、D260Y、I262S、N264K、T270I、T270K、E272G、E272K、L278F、K299N、T305I、I310S或其任意组合的一个或更多个置换或突变。在一个实施方案中,可用于本发明的FAS多肽的效应子结构域包含FAS多肽的死亡结构域。在另一个实施方案中,FAS多肽的效应子结构域包含与SEQIDNO:6的第230至314位氨基酸至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成。在其它实施方案中,FAS多肽的效应子结构域包含FAS多肽的胞内结构域。在又一些其它实施方案中,FAS多肽的效应子结构域包含与SEQIDNO:6的第185至335位氨基酸、第186至335位氨基酸、第187至335位氨基酸、第188至335位氨基酸、第189至335位氨基酸、第190至335位氨基酸、第191至335位氨基酸、第192至335位氨基酸、第193至335位氨基酸、第194至335位氨基酸、第195至335位氨基酸、第196至335位氨基酸、第197至335位氨基酸、第198至335位氨基酸、第199至335位氨基酸至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在又一些其它实施方案中,FAS多肽的效应子结构域还包含FAS多肽的跨膜结构域。在又一些其它实施方案中,FAS多肽的效应子结构域包含与SEQIDNO:6的第174至335位氨基酸至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一些实施方案中,FAS多肽的效应子结构域还包含来自FAS胞外结构域的C末端部分的大约十个、大约九个、大约八个、大约七个、大约六个、大约五个、大约四个、大约三个、大约两个或大约一个氨基酸。在某些实施方案中,FAS多肽的效应子结构域包含与SEQIDNO:6的第179至335位氨基酸、第178至335位氨基酸、第177至335位氨基酸、第176至335位氨基酸、第175至335位氨基酸、第174至335位氨基酸、第173至335位氨基酸、第172至335位氨基酸、第171至335位氨基酸、第170至335位氨基酸、第169至335位氨基酸、第168至335位氨基酸、第167至335位氨基酸、第166至335位氨基酸、第165至335位氨基酸、第164至335位氨基酸或第163至335位氨基酸至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,其中所述效应子结构域形成死亡诱导性信号传导复合物(DISC)、活化胱天蛋白酶8或诱导细胞凋亡。在一个实施方案中,FAS多肽的效应子结构域包含与SEQIDNO:8至少70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成,其中所述效应子结构域形成死亡诱导性信号传导复合物(DISC)、活化胱天蛋白酶8或诱导细胞凋亡。在其它实施方案中,FAS多肽的效应子结构域由与SEQIDNO:7至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列编码。在一个实施方案中,用于本发明的FAS嵌合基因产物包含与SEQIDNO:10至少70%、80%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列、基本上由其组成或者由其组成,其中所述FAS嵌合基因产物诱导细胞凋亡。在另一个实施方案中,所述FAS嵌合基因产物由与SEQIDNO:9至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列编码,其中所述FAS嵌合基因产物诱导细胞凋亡。B.内皮细胞特异性启动子包含FAS嵌合基因的核酸构建体还包含一个或更多个可用于调控可操作地连接的FAS嵌合基因的表达的表达控制元件。所述表达控制元件包括但不限于启动子、分泌信号和其它调控元件。可用于本发明的核酸构建体利用内皮细胞特异性启动子指导FAS嵌合蛋白在内皮细胞中表达,从而诱导所述内皮细胞的细胞凋亡。为了本发明的目的,内皮细胞特异性启动子可含有一个或更多个顺式调控元件,其与不具有所述顺式调控元件的启动子相比改善启动子的内皮细胞特异性。在一个实例中,所述顺式调控元件包含增强子。在另一个方面,所述顺式调控元件包含缺氧反应元件。在其它实例中,所述顺式调控元件既包含增强子又包含缺氧反应元件。在一个实施方案中,可用于本发明的增强子包含与SEQIDNO:11或SEQIDNO:12(SEQIDNO:11的互补序列)至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列,其中,与不具有所述增强子的启动子相比,所述增强子改善启动子的内皮细胞特异性。所述增强子还可以包含与SEQIDNO:13或SEQIDNO:14(SEQIDNO:13的互补序列)至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的另外的核苷酸序列。在另一个实施方案中,用于本发明的增强子包含与SEQIDNO:13或SEQIDNO:14(SEQIDNO:13的互补序列)至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列,其中,与不具有所述增强子的启动子相比,所述增强子改善启动子的内皮细胞特异性。所述增强子还可以包含与SEQIDNO:11或SEQIDNO:12(SEQIDNO:11的互补序列)至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的另外的核苷酸序列。在其它实施方案中,用于本发明的增强子包含与SEQIDNO:15或SEQIDNO:16(SEQIDNO:15互补序列)至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列,其中,与不具有所述增强子的启动子相比,所述增强子改善启动子的内皮细胞特异性。在又一些其它实施方案中,用于所述核酸构建体的增强子包含SEQIDNO:15或SEQIDNO:16或其任何片段、变体、衍生物或类似物,其中,与不具有所述增强子的启动子相比,所述片段、变体、衍生物或类似物改善启动子的内皮细胞特异性。在一些实施方案中,用于本发明的增强子包含与SEQIDNO:22或SEQIDNO:23至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列,其中,与不具有所述增强子的启动子相比,所述增强子改善启动子的内皮细胞特异性。在又一些其它实施方案中,用于所述核酸构建体的增强子包含SEQIDNO:22或SEQIDNO:23或其任何片段、变体、衍生物或类似物,其中,与不具有所述增强子的启动子相比,所述片段、变体、衍生物或类似物改善启动子的内皮细胞特异性。在其它实施方案中,用于本发明的增强子包含与SEQIDNO:24或SEQIDNO:25至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%相同的核苷酸序列,其中,与不具有所述增强子的启动子相比,所述增强子改善启动子的内皮细胞特异性。在又一些其它实施方案中,用于所述核酸构建体的增强子包含SEQIDNO:24或SEQIDNO:25或其任何片段、变体、衍生物或类似物,其中,与不具有所述增强子的启动子相比,所述片段、变体、衍生物或类似物改善启动子的内皮细胞特异性。表3显示了可用于本发明的各种增强子序列。表3.内皮细胞特异性增强子元件和启动子用于本发明的增强子可以被连接至启动子上游或启动子下游或插入启动子中的两个核苷酸之间。用于本发明的内皮细胞特异性启动子可以利用现有技术已知的任何启动子。例如,能够用于本发明的合适的启动子包括内皮特异性启动子:前内皮素原-1(preproendothelin-1,PPE-1启动子)(US2010/0282634,公开于2010年11月11日;和WO2011/083464,公开于2011年7月14日);PPE-1-3X启动子(美国专利号7,579,327,美国专利号8,071,740,US8,039,261,US2010/0282634,US2007/0286845,WO2011/083464和WO2011/083466);TIE-1(S79347,S79346)和TIE-2(U53603)启动子[SatoTN,ProcNatlAcadSciUSA1993Oct15;90(20):9355-8],内皮糖蛋白(Endoglin)启动子[Y11653;RiusC,Blood1998Dec15;92(12):4677-90],vonWillerbrand因子[AF152417;CollinsCJProcNatlAcadSciUSA1987Jul;84(13):4393-7],KDR/flk-1启动子[X89777,X89776;RonickeV,CircRes1996Aug;79(2):277-85],FLT-1启动子[D64016AJ224863;MorishitaK,:JBiolChem1995Nov17;270(46):27948-53],Egr-1启动子[AJ245926;SukhatmeVP,OncogeneRes1987Sep-Oct;l(4):343-55],E-选择素启动子[Y12462;CollinsTJBiolChem1991Feb5;266(4):2466-73],内皮粘附分子启动子:ICAM-1[X84737;HorleyKJEMBOJ1989Oct;8(10):2889-96]、VCAM-1[M92431;IademarcoMF,JBiolChem1992Aug15;267(23):16323-9]、PECAM-1[AJ313330X96849;CD31,NewmanPJ,Science1990Mar9;247(4947):1219-22],血管平滑肌特异性元件:CArG盒X53154和主动脉羧肽酶样蛋白(ACLP)启动子[AF332596;LayneMD,CircRes.2002;90:728-736]和主动脉优先表达基因-1[Yen-HsuChenJ.Biol.Chem,Vol.276,Issue50,47658-47663,December14,2001],其全部内容通过引用整体并入本文。在一个实施方案中,被连接至内皮细胞特异性增强子的启动子包含SEQIDNO:17的至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%的核苷酸序列,其中所述被连接至增强子的启动子诱导被可操作地连接至所述启动子的基因的内皮细胞特异性。在另一个实施方案中,被连接至内皮细胞特异性增强子的启动子包含野生型PPE-1启动子的片段、变体、衍生物或类似物,其中其所述片段、变体、衍生物或类似物诱导被可操作地连接至所述启动子的基因的内皮细胞特异性。在一个实例中,该内皮细胞特异性增强子能够被插入对应于SEQIDNO:17的第442位和第449位核苷酸残基之间。在进一步的实施方案中,内皮细胞特异性启动子包含缺氧反应元件。缺氧反应元件(HRE)位于内皮素(endothelin)-1启动子的反义链上。该元件是缺氧诱导性因子-1的结合位点,该位点是缺氧对(人、大鼠和小鼠基因的)内皮素-1启动子的正向调控所必需的。缺氧是强效信号,其诱导几种基因的表达,包括促红细胞生成素(Epo)、VEGF和各种糖酵解酶。在所有基因中响应缺氧条件的核心序列(8个碱基对)是保守的,侧翼区与其它基因不同。ET-I缺氧反应元件位于GATA-2和AP-1结合位点之间。在一个实例中,缺氧反应元件包含SEQIDNO:26、其片段、变体、衍生物或类似物。在其它实施方案中,可用于本发明的内皮细胞特异性启动子包含SEQIDNO:18的至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%的核苷酸序列、基本上由其组成或者由其组成,其中被连接至增强子的启动子诱导被可操作地连接至所述启动子的基因的内皮细胞特异性。在另一个实施方案中,内皮细胞特异性启动子包含SEQIDNO:18的片段、变体、衍生物或类似物,其中所述片段、变体、衍生物或类似物诱导被可操作地连接至所述启动子的基因的内皮细胞特异性。内皮细胞特异性启动子的另外的变化可以被发现于WO2011/083464、WO2011/083466和WO2012/052423,其通过引用整体并入本文。本发明还提供包含核苷酸序列SEQIDNO:17的新的启动子序列。在一个实例中,所述启动子还包含内皮细胞特异性增强子。在一个实例中,所述内皮细胞特异性增强子包含SEQIDNO:11,SEQIDNO:12,SEQIDNO:13,SEQIDNO:14,SEQIDNO:15,SEQIDNO:16,SEQIDNO:22,SEQIDNO:23,SEQIDNO:24,SEQIDNO:25,SEQIDNO:26或其任意片段、变体、衍生物或类似物,其中,与不具有所述增强子的启动子相比,所述片段、变体、衍生物或类似物改善启动子的内皮细胞特异性。在另一个实例中,所述启动子包含SEQIDNO:18的核苷酸序列。本发明包括包含该新的启动子和异源核苷酸序列的核酸构建体。在一个实施方案中,所述异源核酸序列包含编码本文所述的FAS嵌合蛋白的核苷酸序列。在另一个实施方案中,所述异源核酸序列包含腺病毒序列。C.载体本发明还提供包含所述核酸构建体的载体,其包含被可操作地连接至内皮细胞特异性启动子的FAS嵌合基因。为了本发明的目的,可以采用众多载体系统。例如,可以用于本发明该方面的实施的各种病毒基因递送系统包括但不限于腺病毒载体、α病毒载体、肠病毒载体、瘟病毒载体、慢病毒载体、杆状病毒载体、疱疹病毒载体、EB病毒载体、乳多空病毒载体、痘病毒载体、痘苗病毒载体、腺相关病毒载体和单纯疱疹病毒载体。在另一个实施方案中,包含被可操作地连接至内皮细胞特异性启动子的FAS嵌合基因的载体是腺病毒。例如,所述腺病毒可以是人腺病毒A种(血清型12、18和31)、B种(血清型3、7、11、14、16、21、34、35、50和55)、C种(血清型1、2、5、6和57)、D种(血清型8、9、10、13、15、17、19、20、22-30、32、33、36-39、42-49、51、53、54和56)、E种(血清型4)、F种(血清型40和41)或G种(血清型52)中的任意一个或更多个。在一个具体的实施方案中,用于本发明的腺病毒是人腺病毒血清型5。在一些实施方案中,可用于基因疗法的腺病毒是重组非复制型腺病毒,其不含有E1区域和E3区域。在某些实施方案中,用于本发明的腺病毒是条件复制型腺病毒,其不含有E3区域,但是含有E1区域。D.生物保藏根据布达佩斯条约并根据37C.F.R.§1.808由位于HealthProtectionAgencyCultureCollections,HealthProtectionAgency,MicrobiologyServices,PortonDown,Salisbury,SP40JG,UK的欧洲细胞培养物保藏中心(ECACC)进行生物保藏。一旦授予专利权,保藏材料的样品将成为公众可以获得的样品。因为所保藏的实施方案仅仅旨在举例说明本发明,所以在本文中所述和所要求保护的发明并不限于所保藏的株的范围。株ECACC登录号藏日期VB-111130212012013年2月12日三、使用表达FAS嵌合蛋白的腺病毒的治疗方法本发明的一个实施方案提供用于使用表达FAS嵌合蛋白的核酸构建体或包含所述核酸构建体的腺病毒的方法。在一个方面,表达FAS嵌合蛋白的核酸构建体或包含所述核酸构建体的腺病毒可用于在受试者中减少或降低肿瘤的尺寸或消除肿瘤,其中由所述核酸构建体编码的FAS嵌合蛋白在所述受试者中减少或降低所述肿瘤的尺寸或减缓肿瘤生长速率或防止出现新的肿瘤转移灶或消除所述肿瘤,并且其中所述肿瘤与女性妇科癌症或其转移有关或源自所述女性妇科癌症或其转移。可以基于放射诊断测试(如CT扫描)和/或肿瘤标志物(如CA-125的血液水平)来评估这些效果。在另一个方面,表达FAS嵌合蛋白的核酸构建体或包含所述核酸构建体的腺病毒可用于抑制、降低或减少肿瘤中新生血管形成或血管生成,其中由所述核酸构建体编码的FAS嵌合蛋白抑制、降低或减少肿瘤中新生血管形成或血管生成,并且其中所述肿瘤与女性妇科癌症或其转移有关或源自所述女性妇科癌症或其转移。在其它方面,表达FAS嵌合蛋白的核酸构建体或包含所述构建体的腺病毒能够治疗或预防受试者中与女性妇科癌症或其转移有关或源自所述女性妇科癌症或其转移的肿瘤,其中由所述核酸构建体编码的FAS嵌合蛋白治疗或预防所述受试者中的女性妇科癌症或其转移。因此,在一个方面,本发明提供在受试者中减少或降低肿瘤或其转移的尺寸、消除肿瘤或其转移或者减缓肿瘤或其转移的生长的方法,该方法包括给患者施用有效量的核酸构建体(其包含被可操作地连接至内皮细胞特异性启动子的Fas嵌合蛋白)或包含所述核酸构建体的腺病毒,其中由所述核酸构建体编码的Fas嵌合基因产物在受试者中减少或降低所述肿瘤或其转移的尺寸或者消除所述肿瘤或其转移,并且其中所述肿瘤或其转移与女性妇科癌症有关或源自所述女性妇科癌症。在另一个方面,本发明提供抑制、降低或减少肿瘤或其转移中新生血管形成或血管生成的方法,该方法包括给患有所述肿瘤或其转移的受试者施用有效量的核酸构建体或包含所述核酸构建体的腺病毒,其包含被可操作地连接至内皮细胞特异性启动子的Fas嵌合基因,其中由所述核酸构建体编码的Fas嵌合基因产物抑制、减少或降低所述肿瘤或其转移中新生血管形成或血管生成,并且其中所述肿瘤或其转移与女性妇科癌症有关或源自所述女性妇科癌症。在其它方面,本发明提供治疗或预防受试者中与女性妇科癌症有关或源自所述女性妇科癌症的肿瘤或其转移的方法,该方法包括施用有效量的核酸构建体,其包含被可操作地连接至内皮细胞特异性启动子的Fas嵌合基因,其中由所述核酸构建体编码的Fas嵌合基因产物治疗或预防患者中的女性妇科癌症。仍在一些其它实施方案中,所述女性妇科癌症或其转移的肿瘤在所述施用之后被降低尺寸或被消除。在某些实施方案中,所述肿瘤或其转移的尺寸被降低,从而与所述施用之前所述肿瘤的最大直径(LD)相比,所述LD被降低至少大约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本发明包括稳定与女性妇科癌症有关的疾病或紊乱的方法。例如,本发明包括阻止或减缓与女性妇科癌症有关的肿瘤的进一步生长的方法。在进一步的实施方案中,本发明减少恶性腹膜液(例如腹水)的体积、减少受试者的疼痛、延长受试者的存活期或其任意组合。在其它实施方案中,本发明的腺病毒当被施用给受试者时延长该受试者的总体存活期。在进一步的实施方案中,本发明的腺病毒当被施用给受试者时延长该受试者的无进展存活期。在一个实施方案中,所述女性妇科癌症可以是米勒管癌、卵巢癌、腹膜癌、输卵管癌、子宫乳头状浆液性癌、或其转移、或其任意组合。在另一个实施方案中,所述女性妇科癌症可以是子宫颈癌、子宫内膜癌、妊娠滋养细胞疾病、子宫癌、外阴癌、或其转移、或其任意组合。在其它实施方案中,所述女性妇科癌症包括从妇科组织(子宫、卵巢、输卵管、子宫颈、卵细胞、支持细胞或其任意组合)所产生的任何癌性生长。在某些实施方案中,所述与女性妇科癌症有关或源自所述女性妇科癌症的肿瘤可以选自由以下组成的组:表面上皮间质瘤(腺癌)、乳头状浆液性囊腺癌、子宫内膜样瘤、浆液性囊腺癌、乳头状瘤、粘液性囊腺癌、透明细胞卵巢瘤、粘液腺癌、囊腺癌、癌、性索间质瘤、生殖细胞瘤、畸胎瘤、无性细胞瘤、表皮样瘤(鳞状细胞癌)、布莱纳瘤、或其转移或其任意组合。用于本发明的目的的米勒管癌症包括恶性米勒管混合瘤,也被称为恶性混合性中胚叶肿瘤、MMMT和癌肉瘤。MMMT是发现于子宫、卵巢、输卵管以及身体其它部位的恶性肿瘤,其含有癌性(上皮组织)和肉瘤性(结缔组织)成分。它被分成两种类型,同源的(其中肉瘤性成分由发现于子宫中的组织(如子宫内膜、纤维和/或平滑肌组织)组成)和异源的类型(由不在子宫发现的组织(如软骨、骨骼肌和/或骨)组成)。MMMT占源自子宫体的所有肿瘤的百分之二至五之间,并且主要发现于平均年龄66岁的绝经后女性。卵巢癌包含从卵巢所产生的任何癌性生长。大多数(超过90%)卵巢癌被分类为“上皮”并且被认为从卵巢的表面产生。但是,输卵管也可以是一些卵巢癌的来源。由于卵巢和输卵管彼此密切相关,据认为这些输卵管癌细胞能够模仿卵巢癌。其它类型可以从卵细胞(生殖细胞瘤)或支持细胞产生。在一些实施方案汇总,卵巢癌是继发性癌症,其为体内其它地方的原发癌症转移的结果。大约7%的卵巢癌是由于转移,而其余的都是原发癌症。常见的原发癌症是乳腺癌和胃肠癌。腹膜癌(cancer)或癌(carcinoma)也被称为:浆液性表面乳头状癌、原发腹膜癌、卵巢外浆液性癌、原发浆液性乳头状癌或沙样癌。它在历史上被分类至“不明原发癌”(CUP)之下。原发腹膜癌(PPC或PPCa)是腹膜或腹腔内膜细胞的癌。组织学和分子生物学特征表明浆液性癌(其包括卵巢浆液性癌、子宫浆液性癌、输卵管浆液性癌、宫颈浆液性癌和原发腹膜浆液性癌)事实上代表一个实体。原发输卵管癌(PFTC)(往往只是输卵管癌)是起源于输卵管的恶性肿瘤。输卵管癌被认为是女性中占所有妇科癌症的1至2%的相对罕见的原发癌症。子宫浆液性癌(USC)(也被称为子宫乳头状浆液性癌(UPSC)和子宫浆液性腺癌)是不常见的子宫内膜癌,其通常发生于绝经后女性。它通常在由绝经后出血提示的子宫内膜活检中被诊断出。不同于更常见的低级子宫内膜样子宫内膜腺癌,USC不会从子宫内膜增生发展并且不是激素敏感性的。它产生于子宫内膜萎缩的情况下并且被分类为II型子宫内膜癌。术语“受试者”或“个体”或“动物”或“患者”或“哺乳动物”是指任何受试者,特别是哺乳动物受试者,其患有或者预计发展与腹膜癌或女性妇科癌症有关或源自腹膜癌或女性妇科癌症的至少一种肿瘤。在一个实施方案中,所述受试者是人。在另一个实施方案中,所述受试者是癌症患者。在本发明的一个实施方案中,所述受试者是之前已经接受基于铂的疗法的患者。这样的之前基于铂的疗法包括但不限于顺铂、卡铂、奥沙利铂、奈达铂、沙铂、吡铂、四硝酸三铂或aroplatin。基于铂的抗肿瘤剂引起DNA的交联如monadduct、链间交联、链内交联或DNA蛋白质交联。多数情况下,它们作用于相邻的鸟嘌呤的N-7位置,形成1,2链内交联。所得到的交联抑制癌细胞中的DNA修复和/或DNA合成。由于与烷基化抗肿瘤剂类似的效果,尽管它们不具有烷基基团,但是基于铂的抗肿瘤剂有时被描述为“烷基化样”。在某些实施方案中,之前的基于铂的疗法是使用顺铂(cisplatin)(其也被称为顺铂(cisplatinum)或顺-二胺二氯络铂(II)(CDDP)(由CadilaHealthcare根据FDA橙皮书销售的商品名Cisplatin、商标名Platin))的疗法。顺铂作为短期输注以生理盐水的形式进行静脉内施用用于治疗实体恶性肿瘤。它被用于治疗各种类型的癌症,包括肉瘤、一些癌(例如小细胞肺癌和卵巢癌)、淋巴瘤和生殖细胞瘤。在其它实施方案中,所述受试者之前已经接受基于紫杉烷类的疗法。紫杉烷类是由紫杉属(紫杉)的植物产生的双萜,并且被广泛地用作化疗剂。紫杉烷现在能够人工合成。紫杉烷剂包括但不限于紫杉醇和多西他赛在一个方面,紫杉烷能够被融合至或结合至异源部分。这样的异源部分能够改善紫杉烷制剂的溶解性或减少紫杉烷的毒性。例如,紫杉烷能够被融合至或结合至白蛋白:白蛋白结合型紫杉醇(Abraxane,也被称为nab-paclitaxel)是备选的制剂,其中紫杉醇结合至白蛋白纳米颗粒。紫杉醇生产的合成方法导致多西他赛的开发。多西他赛与紫杉醇具有一套类似的临床用途并且以的名称进行销售。在另一个方面,可用于本发明的紫杉烷包括但不限于榛植物的壳和叶中的紫杉醇、10-脱乙酰基巴苦亭III、巴苦亭III、紫杉醇C和7-表紫杉醇。在其它实施方案中,所述受试者之前已经接受高达三、高达二或高达一线的化疗。前一线的化疗可以是基于铂的疗法或基于紫杉烷的疗法。在又一些其它实施方案中,所述受试者之前没有接受超过3线的针对复发癌症的化疗。在某些实施方案中,所述受试者是患有复发性铂抗性癌症或对铂无效(platinumrefractory)的疾病的患者。在一些实施方案中,所述受试者是患有复发性紫杉烷抗性癌症的患者。在一个方面,复发性铂抗性癌症或复发性紫杉烷抗性癌症在铂或紫杉烷治疗期间,在完成或接受基于铂的疗法或基于紫杉烷的疗法的大约一个月内、大约两个月内、大约三个月、大约四个月、大约五个月、大约六个月、大约七个月、大约八个月、大约九个月、大约十个月、大约11个月或大约12个月内具有进展性肿瘤。在一个具体的实施方案中,所述复发性铂抗性癌症或所述复发性紫杉烷抗性癌症在完成或接受基于铂的疗法或基于紫杉烷的疗法的大约六个月内具有进展性肿瘤。所述复发性铂抗性癌症或所述复发性紫杉烷抗性癌症可以由实体瘤响应评价标准(RECIST)、一个或更多个肿瘤标志物(例如CA-125)的测定、体检、重新评估或二探剖腹检查和/或一种或更多种成像研究(例如X射线、CT或MRI)来确定。RECIST是一套出版的规则,其定义在治疗期间什么时候癌症患者改善(“响应”)、保持相同(“稳定”)或恶化(“进展”)。最初标准由包括欧洲癌症研究与治疗组织(EORTC)、美国国家癌症研究所(NCI)和加拿大临床试验组的国家癌症研究所的国际合作组织于2000年2月出版。于2009年1月出版的RECIST1.1是最初标准的更新版。大多数评估癌症治疗在实体瘤中的目标响应的临床试验正在使用RECIST。在一些实施方案中,受试者能够表现出肿瘤标志物,例如CA-125。在一个方面,与施用之前的CA-125水平相比,施用之后所述受试者中CA-125的表达水平被减少至少大约10%、至少大约20%、至少大约30%、至少大约40%、至少大约50%、至少大约55%、至少大约60%、至少大约65%、至少大约70%、至少大约75%、至少大约80%、至少大约85%、至少大约90%或至少大约100%。在一些实施方案中,受试者仅已经接受过一次针对复发性铂敏感性疾病的基于铂的治疗,后续无铂间隔不到六个月。在其它实施方案中,受试者具有美国东部肿瘤协作组(ECOG)体能状况(performancestatus)0-1级。ECOG是用于评估患者的疾病进展、在患者的日常生活中疾病的作用和确定合适的治疗和预后的量表或标准。表4显示ECOG体能状况:*如在Am.J.Clin.Oncol.:Oken,M.M.,Creech,R.H.,Tormey,D.C.,Horton,J.,Davis,T.E.,McFadden,E.T.,Carbone,P.P.:ToxicityAndResponseCriteriaOfTheEasternCooperativeOncologyGroup.AmJClinOncol5:649-655,1982中所出版的。在一些实施方案中,受试者具有与未患癌症的受试者可比的骨髓功能。与未患癌症的受试者可比的骨髓功能包括但不限于其作为主要造血器官和初级淋巴组织并且负责产生血细胞(例如红细胞、粒细胞、单核细胞、淋巴细胞和血小板)的作用。骨髓结构和功能的详细描述见于Jain,C.,1986b,Schalm’sVeterinaryHematology,Thehematopoieticsystem(LeaandFebiger,Philadelphia,PA),4,pp350–387;WeissandGeduldig,1991,Blood78:975–90;Wickramasinghe,1992,inHistologyforPathologists,Bonemarrow,edSternbergSS(RavenPress,NewYork),pp1–31;PickerandSiegelman,1999,inFundamentalImmunology,Lymphoidtissuesandorgans,edPaulWE(Lippincott-Raven,Philadelphia,PA),4,pp479–531;Hoffmanetal.,2000,HematologyBasicPrincipalsandPractice(ChurchillLivingstone,NewYork),3;AbboudandLichtman,2001,inWilliams’Hematology,Structureofthemarrowandthehematopoieticmicroenvironment,edsBeutlerE,LichtmanMA,CollerBS,KippsTJ,SeligsohnU(McGraw-Hill,NewYork),6,pp29–58,其每一篇通过引用整体并入本文。在进一步的实施方案中,受试者具有与未患癌症的受试者可比的血液学功能,其中血液学功能的指标选自由以下组成的组:a.中性粒细胞绝对计数(ANC)等于或高于1000/mm3;b.血小板(PLT)计数等于或高于100,000个/mm3;c.凝血酶原时间(PT)小于1.2x正常上限(ULN)秒;d.凝血活酶时间(PTT)小于1.2xULN秒,其中如果PTT高于ULN,则该患者狼疮性抗凝集物质(LAC)为阴性;以及e.其任意组合。在其它实施方案中,受试者具有与未患癌症的受试者可比的器官功能,其中所述器官功能使用常见毒性标准进行分析,所述标准选自由以下组成的组:a.小于或等于1级常见毒性标准(CTC)的神经病;b.之前不超过30%的含有骨髓的主要区域已经接受过放射;c.小于2.5x正常上限(ULN)或小于5xULN的血清谷草转氨酶(SGOT)、血清谷丙转氨酶(SGPT)或碱性磷酸酶;d.小于或等于1.5xULN水平的胆红素;e.小于或等于1.5xULN水平的肌酐;f.在筛选时蛋白尿试纸小于2+或尿蛋白肌酐的比小于1.0;以及g.其任意组合。在又一些其它实施方案中,受试者已经从来自之前的治疗(例如任何化疗、放疗或生物疗法)的急性毒性中恢复。但是,所述受试者可能需要从1级神经病理、任意级的贫血或脱发中恢复。在某些实施方案中,受试者之前已经接受过抗血管生成剂。在一些实施方案中,所述受试者之前没有胃肠(GI)穿孔、GI梗阻或参与肠影像学研究。在又一些其它实施方案中,所述受试者没有需要治疗的活动的、未经治疗的精神疾病或神经学症状(允许有I级感觉性神经病理),不存在未经治疗的中枢神经系统或脑转移,没有任何会阻止理解和/或给予知情同意的痴呆或显著改变的精神状况,没有任何已知对聚氧乙烯蓖麻油(CremophorEL)的超敏反应,没有不受控制的细菌、病毒或真菌感染的迹象,或其任意组合。在又一些其它实施方案中,如果所述受试者之前已经有紫杉醇反应,但随后在重新攻击时耐受该药物,那么所述受试者是适合本发明的。适合于本发明的受试者可以通过针对抗血管生成疗法的血浆生物标志物或细胞表面生物标志物的测定进行鉴定。在一个实施方案中,适合于本发明的受试者表现出血浆生物标志物,其包括但不限于血管内皮生长因子(VEGF)、磷脂酰肌醇聚糖生物合成F类蛋白(PIGF)、可溶性血管内皮生长因子受体-1(sVEGFR-1)、sVEGFR-2、sVEGFR-3、碱性成纤维细胞生长因子(bFGF)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、vonWillerbrand因子(vWF)、可溶性c-kit(c-kit)、基质衍生因子1α(SDF1α)、甲胎蛋白(AFP)及其任意组合。在另一个实施方案中,适合于本发明的受试者表现出细胞表面生物标志物,其包括但不限于CD31、CD34、CD45、CD133、血管内皮生长因子受体-1(VEGFR)、VEGFR-2或其任意组合。已知中和抗体的存在或形成在病毒的二次施用时可以阻碍有效基因转移。在一个实施方案中,受试者没有针对腺病毒的预先存在的抗体应答。在另一个实施方案中,在施用腺病毒时受试者没有发展针对腺病毒的抗体应答。在本发明的一些方面,受试者没有表现出狼疮细胞抗凝集物质(LAC,也被称为狼疮细胞抗体、LA或狼疮细胞抑制剂)。LAC的存在能够通过任何已知的方法确定,例如通过由LAC测试或APLA测试测定所述LAC。LAC是结合与细胞膜有关的磷脂和蛋白质的免疫球蛋白。Joussen,J.,etal.,inDocumentaOphthalmologica,2008,Volume117,Number3,Pages263-265,RetinalVascularDisease,S.J.Ryan(eds),Springer,2007,780p,1040,ISBN:978-3-540-29541-9。LAC是促血栓形成剂;即,体内LAC抗体的存在沉淀血栓的形成。在实验室试验中这些抗体的存在引起aPTT的提高。据推测,所述抗体的存在干扰了用来诱导体外凝聚的磷脂。据认为,体内与血小板膜磷脂发生相互作用,增加血小板的粘附和聚集;从而发挥其体内促血栓形成特征。因此,LAC在体内充当凝血剂。四、表达FAS嵌合的腺病毒的均质群体本发明还提供包含SEQIDNO:19的腺病毒或具有ECACC保藏号13021201的腺病毒的均质群体。在本文中所使用的术语“均质”是指没有污染具有不同序列的异源腺病毒的腺病毒单个群体。异源腺病毒的实例包括但不限于包含含有SEQIDNO:20或SEQIDNO:21的核苷酸序列的腺病毒。包含含有SEQIDNO:20的核苷酸序列的腺病毒和包含含有SEQIDNO:21的核苷酸序列的腺病毒之前被公开于国际申请号PCT/IL2011/00007和PCT/IL2011/00009,其于2011年7月14日分别作为WO2011/083464和WO2011/083466出版,其通过引用整体并入本文。。本发明提供包含SEQIDNO:19(35207bp)的腺病毒,其包括不同于SEQIDNO:20(35203bp)和SEQIDNO:21的两个核苷酸残基。在SEQIDNO:20和SEQIDNO:21中的这两个错配(即Gly→Ala)位于核苷酸残基第501位和第1255位。此外,SEQIDNO:19在3'端含有四个额外的碱基对。另外,SEQIDNO:21含有编码额外的E1区域的氨基酸。SEQIDNO:19包含在核苷酸残基第458至1444位对应于SEQIDNO:18的内皮细胞特异性启动子(即PPE-1-3x启动子)的核苷酸序列,和在核苷酸残基第1469至2569位对应于SEQIDNO:9的编码FAS嵌合蛋白的核苷酸序列。在一个实施方案中,本发明是包含腺病毒的组合物,所述腺病毒包含被可操作地连接至内皮细胞特异性启动子的FAS嵌合基因,其中所述腺病毒不含有SEQIDNO:20并且不含有SEQIDNO:21。在另一个实施方案中,本发明是包含含有SEQIDNO:19的腺病毒或具有ECACC保藏号13021201的腺病毒的组合物,其中所述组合物不含有包含SEQIDNO:20的腺病毒并且不含有包含SEQIDNO:21的腺病毒。在另一个实施方案中,组合物包含含有SEQIDNO:19的第458至2569位核苷酸残基的腺病毒,其中所述组合物不包含含有SEQIDNO:20或SEQIDNO:21的第458至2569位核苷酸残基的腺病毒。在其它实施方案中,本发明的组合物包含腺病毒,所述腺病毒包含与SEQIDNO:19至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的核酸序列,其中所述核酸序列不是SEQIDNO:20并且不是SEQIDNO:21,并且其中所述组合物不含有包含SEQIDNO:20的腺病毒并且不含有包含SEQIDNO:21的腺病毒。仍在一些其它实施方案中,本发明的组合物包含含有SEQIDNO:19的腺病毒或具有ECACC保藏号13021201的腺病毒,其中所述腺病毒是至少大约51%纯的、至少55%纯的、至少大约60%纯的、至少大约70%纯的、至少大约80%纯的、至少大约90%纯的、至少大约95%纯的、至少大约96%纯的、至少大约97%纯的、至少大约98%纯的、至少大约99%纯的或大约100%纯的。在本文中所使用的术语“纯”是指均质性的程度,即没有异源腺病毒。例如,包括包含SEQIDNO:19的腺病毒的大约51%纯的组合物含有大约51%的包含SEQIDNO:19的腺病毒和大约49%的包含异源序列(例如SEQIDNO:20或SEQIDNO:21)的腺病毒。本发明的组合物可以含有其它成分,包括但不限于药学可接受的载体、赋形剂、张力改性剂或用于制剂的任何必要成分。在一些实施方案中,本发明包括分离或纯化所述核酸构建体的均质群体的方法。在其它实施方案中,本发明提供从包括包含SEQIDNO:19的腺病毒或具有ECACC保藏号13021201的组合物中去除腺病毒的异质群体(例如SEQIDNO:20、SEQIDNO:21)的方法。本发明还提供了在受试者中减少或降低肿瘤的尺寸或减缓肿瘤生长的速率、消除肿瘤的方法,该方法包括向所述受试者施用有效量的腺病毒的均质群体或包含腺病毒的均质群体的组合物。本发明还包括抑制、降低或减少肿瘤中新生血管形成或血管生成的方法,该方法包括向患有所述肿瘤的受试者施用有效量的腺病毒的均质群体或包含腺病毒的均质群体的组合物。另外,本发明包括在受试者中治疗或预防与癌症有关或源自癌症的肿瘤的方法,该方法包括施用有效量的腺病毒的均质群体或包含腺病毒的均质群体的组合物。本发明还包括在受试者中减少或降低肿瘤的尺寸或减缓肿瘤生长的速率、消除肿瘤的方法,该方法包括向所述受试者重复施用有效量的腺病毒的均质群体或包含腺病毒的均质群体的组合物而不施用包含SEQIDNO:20或SEQIDNO:21的腺病毒的异质群体或包含腺病毒的异质群体的组合物。本发明还包括抑制、降低或减少肿瘤中新生血管形成或血管生成的方法,该方法包括向患有所述肿瘤的受试者重复施用有效量的腺病毒的均质群体或包含腺病毒的均质群体的组合物而不施用包含SEQIDNO:20或SEQIDNO:21的腺病毒的异质群体或包含腺病毒的异质群体的组合物。此外,本发明包括在受试者中治疗或预防与癌症有关或源自癌症的肿瘤的方法,该方法包括重复施用有效量的腺病毒的均质群体或包含腺病毒的均质群体的组合物而不施用包含SEQIDNO:20或SEQIDNO:21的腺病毒的异质群体或包含腺病毒的异质群体的组合物。可以被用腺病毒的均质群体或组合物减少、抑制或治疗的肿瘤可以是实体瘤、原发瘤或转移。术语“转移的”或“转移”是指能够在另一部位或器官建立继发性肿瘤病灶的肿瘤细胞。在其它实施方案中,本发明的均质群体当被施用给需要其的受试者时延长该受试者的总体存活期。在进一步的实施方案中,本发明的均质群体当被施用给需要其的受试者时延长该受试者的无进展存活期。“实体瘤”包括但不限于肉瘤、黑色素瘤、癌或其它实体瘤癌症。“肉瘤”是指由像胚胎结缔组织的物质组成并且通常由包埋于纤维状或同源物质中的紧密堆积的细胞组成的肿瘤。肉瘤包括但不限于软骨肉瘤、纤维肉瘤、淋巴肉瘤、黑色素肉瘤、黏液肉瘤、骨肉瘤、Abemethy's肉瘤、脂肉瘤、脂肪肉瘤、肺泡状软组织肉瘤、成釉细胞肉瘤、葡萄状肉瘤、绿色瘤肉瘤、绒毛膜癌、胚胎性肉瘤、维尔姆斯瘤肉瘤、子宫内膜肉瘤、间质肉瘤、尤文肉瘤、筋膜肉瘤、成纤维细胞肉瘤、巨细胞肉瘤、粒细胞肉瘤、霍奇金肉瘤、特发性多发性色素沉着出血性肉瘤、B细胞的免疫母细胞肉瘤、淋巴瘤、T细胞的免疫母细胞肉瘤、Jensen's肉瘤、卡波西肉瘤、库普弗细胞肉瘤、血管肉瘤、白色肉瘤、恶性间质瘤肉瘤、骨旁肉瘤、网状细胞肉瘤、劳斯肉瘤、浆液囊性肉瘤、滑膜肉瘤和毛细管扩张性肉瘤。术语“黑色素瘤”是指由皮肤和其它器官的黑色素细胞系统产生的肿瘤。黑色素瘤包括例如肢端雀斑状黑色素瘤、无黑色素性黑色素瘤、良性青少年性黑色素瘤、Cloudman's黑色素瘤、S91黑色素瘤、Harding-Passey黑色素瘤、青少年性黑色素瘤、恶性雀斑样痣黑色素瘤、转移性黑色素瘤、结节性黑色素瘤、甲下黑色素瘤(subungalmelanoma)和浅表扩散性黑色素瘤。术语“癌(carcinoma)”是指由倾向于渗透周围组织且引起转移的上皮细胞构成的恶性新生长。示例性的癌包括例如腺泡癌、腺泡状癌、腺囊癌、腺样囊性癌、癌性腺瘤(carcinomaadenomatosum)、肾上腺皮质癌、肺泡癌、肺泡细胞癌、基底细胞癌(basalcellcarcinoma)、基底细胞性癌(carcinomabasocellulare)、基底细胞样癌、基底鳞状细胞癌、细支气管肺泡癌、细支气管癌、支气管癌、支气管源性癌、脑形癌、胆管细胞癌、绒毛膜癌、胶样癌、粉剌癌、子宫体癌、筛状癌、encuirasse癌、皮肤癌、圆柱细胞癌(cylindricalcarcinoma)、柱状细胞癌(cylindricalcellcarcinoma)、导管癌、硬癌、胚胎性癌、髓样癌(encephaloidcarcinoma)、表皮样癌(epiermoidcarcinoma)、腺样上皮细胞癌、外植癌、exulcere癌、纤维癌、胶状癌(gelatiniformcarcinoma)、胶质癌(gelatinouscarcinoma)、巨大细胞癌(giantcellcarcinoma)、巨细胞癌(carcinomagigantocellulare)、腺癌、粒层细胞癌、发基质癌(hair-matrixcarcinoma)、血样癌、肝细胞癌、Hurthle细胞癌、胶样癌(hyalinecarcinoma)、hypemephroid癌、幼稚型胚胎性癌、原位癌、表皮内癌、上皮内癌、Krompecher's癌、Kulchitzky细胞癌、大细胞癌、豆状癌(lenticularcarcinoma)、豆状癌(carcinomalenticulare)、脂肪瘤样癌、淋巴上皮癌、髓样癌(carcinomamedullare)、髓样癌(medullarycarcinoma)、黑色素癌、软癌(carcinomamolle)、粘液性癌(mucinouscarcinoma)、粘液癌(carcinomamuciparum)、粘液细胞癌(carcinomamucocellulare)、粘液表皮样癌、粘液癌(carcinomamucosum)、粘液癌(mucouscarcinoma)、粘液瘤样癌、鼻咽癌、燕麦细胞癌、骨化性癌(carcinomaossificans)、骨样癌(osteoidcarcinoma)、乳头状癌、门脉周癌、浸润前癌(preinvasivecarcinoma)、棘细胞癌、软糊状癌(pultaceouscarcinoma)、肾脏的肾细胞癌、备细胞癌(reservecellcarcinoma)、肉瘤样癌、schneiderian癌、硬癌(scirrhouscarcinoma)、阴囊癌、印戒细胞癌、单纯癌、小细胞癌、马铃薯状癌、球状细胞癌、梭形细胞癌、软癌(carcinomaspongiosum)、鳞状癌、鳞状细胞癌、绳捆癌、血管扩张性癌(carcinomatelangiectaticum)、血管扩张性癌(carcinomatelangiectodes)、移行细胞癌、结节性皮癌(carcinomatuberosum)、结节性皮癌(tuberouscarcinoma)、疣状癌和viflosum癌。可被抑制或治疗的另外的癌(cancer)包括例如白血病、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、神经母细胞瘤、乳腺癌、卵巢癌、肺癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、小细胞肺肿瘤、原发性脑瘤、胃癌、结肠癌、恶性胰腺胰岛瘤、恶性类癌、膀胱癌、恶变前皮肤病变、睾丸癌、淋巴瘤、甲状腺癌、乳头状甲状腺癌、神经母细胞瘤、神经内分泌癌、食管癌、泌尿生殖道癌、恶性高钙血症、宫颈癌、子宫内膜癌、肾上腺皮质癌、前列腺癌、米勒管癌、卵巢癌、腹膜癌、输卵管癌或子宫乳头状浆液性癌。五、药物组合物本发明中还提供了药物组合物,其包含表达在本发明的方法中所使用的FAS嵌合体蛋白的核酸构建体,还提供了包含所述核酸构建体的腺病毒或所述腺病毒的均质群体。可以配制所述药物组合物用于施用给哺乳动物,包括人类。在本发明的方法中所使用的药物组合物包含药学可接受的载体,包括例如离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(如人血清白蛋白)、缓冲物质(如磷酸盐)、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质、如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、基于纤维素的物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇和羊毛脂。在一个实施方案中,所述组合物通过加入盐水进行配制。本发明的组合物可以通过任何合适的方法进行施用,例如肠胃外(例如包括皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内和颅内注射或输注技术)、心室内、口服、通过喷雾吸入、局部地、经直肠地、经鼻地、经颊地、经阴道地或经植入的贮库。如之前所述,包括包含FAS嵌合体基因的核酸构建体或所述腺病毒的均质群体的组合物在内皮细胞中表达FAS嵌合体基因产物,并从而诱导该内皮细胞的细胞凋亡。因此,所述组合物能够通过抑制肿瘤内皮细胞的新生血管形成和/或血管生成而抑制、减少或降低肿瘤或其转移的尺寸。因此,在一个实施方案中,全身或局部递送所述组合物。为了全身或局部递送,含有所述核酸构建体、腺病毒或腺病毒的均质群体的药物组合物可以利用机械装置,如针、套管或手术器械。在本发明的方法中所使用的无菌可注射形式的组合物可以是水性或油性悬浮液。这些悬浮液可以根据本领域已知的技术使用合适的分散剂或湿润剂和悬浮剂进行配制。该无菌可注射制剂还可以是在无毒肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如在1,3-丁二醇中的悬浮液。可以使用的可接受的媒介物和溶剂包括水、林格氏溶液和等张氯化钠溶液。此外,无菌的不挥发性油通常用作溶剂或悬浮介质。为了这个目的,任何温和的不挥发性油都可以使用,包括合成的甘油单酸酯或甘油二酸酯。脂肪酸(如油酸及其甘油酯衍生物)可用于注射剂的制备,天然的药学可接受的油如橄榄油或蓖麻油(尤其是它们的聚氧乙烯化的形式)也可以。这些油溶液或悬浮液也可以含有长链醇稀释剂或分散剂,如羧甲基纤维素或在配制药学可接受的剂型(包括乳剂和悬浮液)中常用的类似的分散剂。其它常用表面活性剂(如吐温、司盘和在制备药物可接受的固体、液体或其它剂型中常用的其它乳化剂或生物利用度增强剂)也可以用于配制的目的。肠胃外制剂可以是单次大丸药剂量、输注或负荷丸药剂量接着维持剂量。这些组合物可以特定的固定或可变的时间间隔进行施用,例如每天一次或“按需”施用。在本发明的方法中所使用的某些药物组合物可以可接受的剂型(例如胶囊、片剂、水性悬浮液或溶液)进行口服施用。某些药物组合物还可通过鼻气雾剂或吸入进行施用。这样的组合物可以制备成在盐水中的溶液,其中使用苄醇或其它合适的防腐剂、提高生物利用度的吸收促进剂和/或其它常规增溶剂或分散剂。可与载体材料组合以生产单个剂型的表达FAS嵌合体蛋白的核酸构建体、包含所述核酸构建体的腺病毒或所述腺病毒的均质群体的量将根据所治疗的宿主、所使用的多肽类型和具体的施用模式而变化。组合物可以作为单个剂量、多个剂量或在所确立的时间段以输注的形式进行施用。还可以调整剂量方案以提供所需最佳应答(例如治疗性或预防性应答)。在一个实施方案中,包含表达FAS嵌合体蛋白的核酸构建体、腺病毒或所述腺病毒的均质群体的组合物在第1天进行输注(即第一次剂量),并且接着一次或更多次后续剂量,例如,每一周的周期、每两周的周期、每三周的周期、每四周的周期、每五周的周期、每六周的周期、每七周的周期、每八周的周期、每九周的周期、每十周的周期、每11周的周期或每12周的周期。在另一个实施方案中,包含表达FAS嵌合体蛋白的核酸构建体、腺病毒或所述腺病毒的均质群体的组合物在第1天进行输注(即第一次剂量),并且接着一次或更多次后续剂量,例如,每两周的周期、每个月的周期、每两个月的周期、每三个月的周期、每四个月的周期、每五个月的周期或每六个月的周期。本发明的方法使用“有效量”或“治疗有效量”的包含表达FAS嵌合体蛋白的核酸构建体、包含所述核酸构建体的腺病毒或所述腺病毒的均质群体的组合物。这样的有效量或治疗有效量可以根据如个体的疾病状态、年龄、性别和体重的因素而变化。有效量或治疗有效量可以是这样的:其中治疗有益效果胜过任何有毒或有害作用。针对任何具体患者的特定剂量和治疗方案将取决于各种因素,包括所使用的具体组合物、所述患者的年龄、体重、一般健康状况、性别和饮食、以及施用时间、排泄速率、药物组合和要治疗的具体疾病的严重程度。医疗护理人员对这样的因素的判断是在本领域普通技术范围内的。量也将取决于要治疗的个体、施用途径、制剂类型、所使用的化合物的特征、疾病的严重程度和所需效果。所用的量可通过本领域中公知的药理学和药代动力学原理来确定。包含编码FAS嵌合体的核酸构建体的腺病毒或包含所述编码FAS嵌合体的核酸构建体的腺病毒的均质群体的有效量可以是任何合适的剂量。在一个实施方案中,所述腺病毒或所述腺病毒均质群体的有效量是每个受试者至少大约109个VP、至少大约1010个VP、大约1011个VP、至少大约1012个VP或至少大约1013个VP。在另一个实施方案中,所述腺病毒或所述腺病毒均质群体的有效量是每个受试者至少大约1x1012个VP、至少大约2x1012个VP、大约3x1012个VP、至少大约4x1012个VP、至少大约5x1012个VP、至少大约6x1012个VP、大约7x1012个VP、至少大约8x1012个VP、至少大约9x1012个VP或至少大约1013个VP。在其它实施方案中,所述腺病毒或所述腺病毒均质群体的有效量是每个受试者大约109至大约1015个VP、大约1010至大约1014个VP、大约1011至大约1013个VP或大约1012至大约1013个VP或大约3x1012至大约1013个VP。在其它方面,如果第一次剂量没有诱导任何毒性,则升高表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的有效量。例如,所述表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的第一次剂量可以是每个受试者至少大约1x109、大约1x1010个VP、至少大约1x1011个VP、至少大约1x1012个VP、至少大约2x1012个VP、至少大约3x1012个VP、至少大约4x1012个VP、至少大约5x1012个VP、至少大约6x1012个VP、至少大约7x1012个VP、至少大约8x1012个VP或至少大约9x1012个VP,并且所述表达FAS嵌合体蛋白的腺病毒的第二次剂量或后续剂量可以是每个受试者至少大约5x1012个VP、至少大约6x1012个VP、至少大约7x1012个VP、至少大约8x1012个VP或至少大约9x1012个VP、至少大约1x1013个VP、至少大约2x1013个VP、至少大约3x1013个VP、至少大约4x1013个VP、至少大约5x1013个VP、至少大约6x1013个VP、至少大约7x1013个VP、至少大约8x1013个VP、至少大约9x1013个VP、至少大约1x1014个VP。在一个具体的实例中,所述表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的第一次剂量是每个受试者大约3x1012个VP,并且所述表达FAS嵌合体蛋白的腺病毒的第二次剂量是每个受试者大约1x1013个VP。但是,如果一个特定的剂量诱导了剂量限制性毒性,则可以减少所述表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的有效量。包含所述腺病毒或所述腺病毒的均质群体的组合物可以向所述受试者输注大约10分钟、大约20分钟、大约30分钟、大约40分钟、大约50分钟、大约60分钟、大约70分钟、大约80分钟、大约90分钟、大约100分钟、大约110分钟或大约120分钟。在一个实施方案中,本发明的所述核酸构建体被静脉内输注不超过60分钟。在另一个实施方案中,包含所述腺病毒或所述腺病毒的均质群体的组合物以1mL/分钟的速率、剂量为等于或小于3x1012个VP/受试者进行输注。如果剂量大于3x1012个VP/受试者,则包含所述腺病毒或所述腺病毒的均质群体的组合物以1mL/分钟的速率输注第一个10mL,然后以3mL/分钟的速率输注剩余的组合物。还可以将补充的活性化合物掺入本发明的方法中所使用的组合物。例如,编码FAS嵌合体基因产物的核酸构建体或所述核酸构建体的均质群体可以与一种或更多种另外的治疗剂共同配制和/或共同施用。本发明包括用于将编码FAS嵌合体基因产物的核酸构建体或所述核酸构建体的均质群体递送至选定靶组织的任何合适的递送方法,包括推注水性溶液或植入控释系统。控释植入物的使用减少了重复注射的需要。编码FAS嵌合体基因产物的核酸构建体、包含所述核酸构建体的腺病毒或所述腺病毒的均质群体可以被直接输注进入肿瘤。用于化合物的直接肿瘤输注的各种植入物是已知的,并且在治疗化合物向患有女性妇科癌症的人类患者的递送中是有效的。组合物还可以包含分散于作为化合物的合适递送或支持系统起作用的生物相容性载体材料中的编码FAS嵌合体基因产物的核酸构建体、包含所述核酸构建体的腺病毒或所述腺病毒的均质群体。缓释载体的合适的实例包括成型颗粒形式(如栓剂或胶囊)的半透聚合物基质。可植入的或微胶囊的缓释基质包括聚丙交酯(美国专利号3,773,319;EP58,481)、L-谷氨酸和γ-乙基-L-谷氨酸酯的共聚物(Sidmanetal.,Biopolymers22:547-56(1985));聚(2-羟乙基-甲基丙烯酸酯)、乙烯-乙酸乙烯酯(Langeretal.,J.Biomed.Mater.Res.15:167-277(1981);Langer,Chem.Tech.12:98-105(1982))或聚-D-(-)-3羟基丁酸(EP133,988)。根据本发明的方法,所述核酸构建体、所述腺病毒或所述腺病毒的均质群体的施用可以与一种或更多种化疗剂的施用组合进行。该化疗剂可以在表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的施用之前、同时或之后进行施用。可以与本发明的所述腺病毒共同施用的一种或更多种化疗剂包括但不限于阿西维辛、阿柔比星、盐酸阿考达唑、阿克罗宁、阿霉素、阿多来新、阿地白介素、爱宁达、六甲蜜胺、安波霉素、醋酸阿美蒽醌、氨鲁米特、安吖啶、阿那曲唑、安特拉霉素、天冬酰胺酶、曲林菌素、阿扎胞苷、阿扎替派、阿佐霉素、巴马司他、苯佐替派、比卡鲁胺、盐酸比生群、二甲磺酸双奈法德、贝伐单抗、比折来新、硫酸博来霉素、布喹那钠、溴匹立明、白消安、放线菌素C、卡鲁睾酮、卡醋胺、卡贝替姆、卡铂、卡莫司汀、盐酸卡柔比星、卡折来新、西地芬戈、苯丁酸氮芥、西罗霉素、顺铂、克拉屈平、甲磺酸克立那托、环磷酰胺、阿糖胞苷、达卡巴嗪、放线菌素D、盐酸柔红霉素、地西他滨、右奥马铂、地扎呱宁、甲磺酸地扎呱宁、地吖醌、多西他赛、多柔比星、盐酸多柔比星、屈洛昔芬、柠檬酸屈洛昔芬、丙酸甲雄烷酮、达佐霉素、依达曲沙、盐酸依氟鸟氨酸、依沙芦星、恩洛铂、恩普氨酯、依匹哌啶、盐酸表柔比星、厄布洛唑、盐酸依索比星、雌莫司汀、雌莫司汀磷酸钠、依他硝唑、依托泊苷、磷酸依托泊苷、氯苯乙嘧胺、盐酸法倔唑、法扎拉滨、芬维A胺、氟尿苷、磷酸氟达拉滨、氟尿嘧啶、氟西他滨、磷喹酮、磷曲星钠、吉西他滨、盐酸吉西他滨、羟基脲、盐酸伊达比星、异环磷酰胺、伊莫福新、干扰素α-2a、干扰素α-2b、干扰素α-nl、干扰素α-n3、干扰素β-Ia、干扰素γ-Ib、羟丙氨铂、盐酸伊立替康、醋酸兰瑞肽、来曲唑、醋酸亮丙瑞林、盐酸利阿唑、洛美曲索钠、洛莫司汀、盐酸洛索蒽醌、马索丙考、美登素、盐酸氮芥、醋酸甲地孕酮、醋酸美仑孕酮、美法仑、美诺立尔、巯嘌呤、甲氨喋呤、甲氨喋呤钠、氯苯氨啶、美妥替哌、米丁度胺、米托凯星、丝裂红素、米托菌素、米托马星、丝裂霉素、米托司培、米托坦、盐酸米托蒽醌、麦考酚酸、诺考达唑、诺拉霉素、奥马铂、奥昔舒仑、帕唑帕尼(pazotinib)、紫杉醇、培门冬酶、培利霉素、溴新斯的明、硫酸培洛霉素、过磷酰胺、哌泊溴烷、哌泊舒凡、盐酸吡罗蒽醌、普卡霉素、普洛美坦、卟吩姆钠、泊非霉素、泼尼莫司汀、盐酸丙卡巴肼、嘌罗霉素、盐酸嘌罗霉素、吡唑呋林、利波腺苷、罗谷亚胺、沙芬戈、盐酸沙芬戈、司莫司汀、辛曲秦、索拉非尼(Sorafinib)、司巴膦酸钠、司帕霉素、盐酸锗螺胺、螺莫斯汀、螺铂、绛色霉素、链佐星、磺氯苯脲、舒尼替尼(Sunitinib)、他利霉索、紫杉酚、替可加兰钠(tecogalansodium)、替加氟、盐酸替洛蒽醌、替莫泊芬、替尼泊苷、替罗昔隆、睾内酯、硫咪嘌呤、硫鸟嘌呤、噻替派、噻唑呋林(Tiazofuirin)、替拉扎明、盐酸拓扑替康、柠檬酸托瑞米芬、醋酸曲托龙、磷酸曲西立滨、三甲曲沙、三甲曲沙葡萄糖醛酯、曲普瑞林、盐酸妥布氯唑、尿嘧啶氮芥、乌瑞替派、伐普肽、维替泊芬、硫酸长春碱、硫酸长春新碱、长春地辛、硫酸长春地辛、硫酸长春匹定、硫酸长春甘酯、硫酸环氧长春碱、长春瑞滨、硫酸异长春碱、硫酸长春利定、伏氯唑、折尼铂(Zeniplatin)、净司他丁或盐酸佐柔比星。另外的抗肿瘤剂包括在抗肿瘤剂(PaulCalabresi和BruceA.Chabner)第52章及其引言、Goodman和Gilman的"ThePharmacologicalBasisofTherapeutics",EighthEdition,1990,McGraw-Hill,Inc.的第1202-1263页中所公开的那些。在一些实施方案中,施用表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的受试者同时进行放疗治疗。在其它实施方案中,施用表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的受试者用两种或更多种化疗剂同时进行治疗。在某些实施方案中,施用表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的受试者同时用化疗剂和放疗进行治疗。在本发明的组合疗法方面,化疗剂可以是紫杉醇。在一个方面,表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体可以与紫杉醇同时施用。在另一个方面,表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体可以在紫杉醇的施用之前或之后施用。在其它实施方案中,紫杉醇在施用表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体之前至少30分钟、至少大约一小时、至少大约两小时、至少大约三小时、至少大约四小时、至少大约五小时、至少大约六小时、至少大约七小时、至少大约八小时、至少大约九小时、至少大约十小时、至少大约11小时、至少大约12小时、至少大约13小时、至少大约14小时、至少大约19小时、至少大约20小时、至少大约21小时、至少大约22小时、至少大约23小时、至少大约24小时、至少大约一天、至少大约36小时、至少大约2天、至少大约60小时或至少大约3天进行施用。化疗剂还可以任何合适的方法进行施用,例如胃肠外、心室内、口服、通过吸入喷雾、局部地、经直肠地、经鼻地、经颊地、经阴道地或经植入的贮库。在本文中所使用的术语“肠胃外”包括皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内、腹膜内、颅内注射或输注技术。化疗剂的有效量可由本领域获得。在一个方面,例如,紫杉醇的有效量可以是至少大约10mg/m2、至少大约20mg/m2、至少大约30mg/m2、至少大约40mg/m2、大约50mg/m2、至少大约60mg/m2、至少大约70mg/m2、至少大约80mg/m2、大约90mg/m2、至少大约100mg/m2或至少大约110mg/m2。在另一个方面,紫杉醇的有效量是从大约10mg/m2至大约200mg/m2、从大约20mg/m2至大约150mg/m2、从大约30mg/m2至大约100mg/m2或从大约40mg/m2至大约80mg/m2。在其它方面,紫杉醇的有效量是大约10mg/m2、大约20mg/m2、大约30mg/m2、大约40mg/m2、大约50mg/m2、大约60mg/m2、大约70mg/m2、大约80mg/m2、大约90mg/m2或大约100mg/m2。在紫杉醇施用的某些方面,紫杉醇被输注至少10分钟、至少20分钟、至少30分钟、至少40分钟、至少50分钟、至少60分钟、至少70分钟、至少80分钟、至少90分钟、至少100分钟、至少110分钟、至少120分钟、至少150分钟、至少180分钟、至少210分钟、至少240分钟、至少270分钟或至少300分钟。在特定的实例中,紫杉醇至少进行一小时输注。可以使用本领域已知的任何方法用于紫杉醇的输注方法。例如,可以通过具有不大于0.22微米的微孔膜的管线滤器(inlinefilter)施用紫杉醇超过三小时。在一些方面,紫杉醇在第1天(施用表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体的同一天)进行输注(即第一次剂量),并且接着一次或更多次后续剂量,例如,每三天、每四天、每五天、每六天、每七天、每八天、每九天、每十天、每11天、每12天、每13天或每14天输注。在一个特定的实例中,在每一个28天中,紫杉醇在第1天施用(即第一次剂量)并且接着在第8天(即第二次剂量)、第15天(即第三次剂量)和第22天(即第四次剂量)施用。在又一些其它方面,如果第一次剂量没有诱导任何毒性,则升高要与表达FAS嵌合体蛋白的腺病毒或所述腺病毒的均质群体共同施用的化疗剂的有效量。例如,紫杉醇的第一次剂量可以是大约10至大约70mg/m2、大约20至大约60mg/m2、大约30至大约50mg/m2或大约40mg/m2,并且第二次剂量或任何后续剂量可以提高大约10mg/m2、大约20mg/m2、大约30mg/m2、大约40mg/m2、大约50mg/m2、大约60mg/m2、大约70mg/m2或大约80mg/m2。在一个实施方案中,紫杉醇的第一次剂量是大约40mg/m2,紫杉醇的第二次剂量是大约80mg/m2。在另一个实施方案中,紫杉醇的第一次剂量是大约40mg/m2,紫杉醇的第二次剂量是大约80mg/m2,紫杉醇的第三次剂量是大约80mg/m2。在其它实施方案中,紫杉醇的第一次剂量是大约40mg/m2,紫杉醇的第二次剂量是大约80mg/m2,紫杉醇的第三次剂量是大约80mg/m2,紫杉醇的第四次剂量是大约80mg/m2。但是,如果第一次剂量对受试者诱导剂量限制性毒性,则可以减少紫杉醇的有效量。可以通过任何已知方法确定该剂量限制性毒性:例如,(1)中性粒细胞绝对计数(ANC)<0.5x109/L持续≥4天或者中性粒细胞绝对计数<0.5x109/L伴有败血症,或不易用解热药控制的3-4级发烧(>100.2°F);(2)持续任意时间的血小板计数<10x109/L;(3)任何其它药物有关的非肝和非血液学≥3级的毒性,或其任意组合。这不包括可被医学控制的≥3级的恶心或呕吐(如果恶心和/或呕吐不能被医学控制并且在第一周期期间发生,这将被认为是DLT)或≥3级的低钾血症、低钠血症、低磷血症、低镁血症、低钙血症,如果能被很容易地校正,在临床上是无症状的,并且没有伴随医学显著并发症(例如EGC变化)。在一个实施方案中,在第1天的紫杉醇的第一次剂量是40mg/m2,且如果受试者没有表现出剂量限制性毒性,则第8天的第二次剂量和后续第15天、第22天和第28天的剂量提升至80mg/m2。在另一个实施方案中,如果受试者中ANC/药物≥1,000/mm3,则对所述受试者施用完全剂量的紫杉醇,例如80mg/m2。如果受试者中ANC/药物<1,000/mm3,则停止紫杉醇的施用。如果进一步发生ANC<1,000/mm3,则紫杉醇的剂量可以减少至60mg/m2。在其它实施方案中,如果受试者具有血小板/药物≥100,000/mm3或第一次发生<100,000/mm3和>75,000/mm3,则所述受试者施用完全剂量的紫杉醇,例如80mg/m2。如果受试者显示<75,000/mm3的血小板/药物,则停止紫杉醇的施用。如果受试者显示重复发生血小板/药物<100,000/mm3并且>75,000/mm3,则紫杉醇的剂量降至69mg/m2。在一些实施方式中,如果受试者表现出第一次发生神经病等级>2,则紫杉醇的剂量从全剂量(例如大约80mg/m2)减少至大约60mg/m2。如果受试者表现出第二次发生神经病等级>2(或尽管剂量减少仍显示该病顽固存在),则紫杉醇剂量减少至40mg/m2。如果受试者表现出第三次发生(或尽管剂量减少但该病仍保持),则中止施用紫杉醇。尚不清楚紫杉醇会引起肝毒性;但是,它在具有严重肝功能障碍的患者中的清除被延迟。因此,具有肝功能障碍的受试者中的紫杉醇剂量可以根据下表进行修改。表5.针对具有肝功能障碍的受试者的紫杉醇剂量修改血清AST或ALT紫杉醇<3xULN80mg/m2≥3xULN60mg/m2≥5xULN保持用药(holddrug)具有升高的胆红素>1.5mg/dl的受试者直到该异常实验室值改善至≤1级才可以接受紫杉醇。按照以上表格,在恢复后治疗可以重新开始,紫杉醇为低于一个剂量水平。表现出紫杉醇毒性持续超过2周的受试者可以中止该药物。在某些实施方案中,受试者在施用一种或更多种化疗剂(例如紫杉醇)之前、同时或之后施用免疫抑制剂。在一个实施方案中,可用于施用给受试者的免疫抑制剂选自由以下组成的组:H2-受体拮抗剂、西咪替丁、雷尼替丁、法莫替丁、皮质类固醇、地塞米松、环孢霉素、苯海拉明及其任意组合。在进一步的实施方案中,本发明的方法还包括在施用表达FAS嵌合体蛋白的核酸构建体之前、同时或之后施用一种或更多种抗血管生成剂。在一些实施方案中,本发明的受试者被施用止吐剂。合适的止吐剂的实例包括但不限于5-HT3受体拮抗剂(例如多拉司琼、格拉司琼、昂丹司琼、托烷司琼、帕洛诺司琼或米塔扎平)、多巴胺拮抗剂(例如多潘立酮、奥氮平、氟哌啶、氟哌啶醇、氯丙嗪、异丙嗪、丙氯拉嗪、甲氧氯普胺、阿立必利或丙氯拉嗪(compazine、stemzine、buccastem、stemetil或phenotil)、NK1受体拮抗剂(例如阿瑞吡坦(aprepitant)或卡索吡坦(casopitant))、抗组胺剂(H1组胺受体拮抗剂)(例如赛克利嗪、苯海拉明、茶苯海明、多西拉敏、美克洛嗪、异丙嗪或羟嗪)、大麻类物质(例如大麻、屈大麻酚、大麻隆、JWH系列或四氢大麻酚(Sativex))、苯二氮类(例如咪达唑仑或劳拉西泮)、抗胆碱药(例如东莨菪碱)、类固醇(例如地塞米松)、曲美苄胺、姜、愈吐宁锭(emetrol)、异丙酚、薄荷、蝇蕈醇或ajwain、或其任意组合。在其它实施方案中,合适的止吐剂是地塞米松、PRN劳拉西泮(Ativan)、格拉司琼(kytril)、丙氯拉嗪(compazine)、奋乃静、昂丹司琼(zofran)、奋乃静或其任意组合。在其它实施方案中,在施用编码FAS嵌合体蛋白的核酸构建体之前、同时或之后施用解热药。解热药的实例包括但不限于NSAIDs(例如布洛芬、萘普生、酮洛芬和尼美舒利)、阿司匹林、对乙酰氨基酚、安乃近、萘丁美酮、安替比林、奎宁或其任意组合。本发明的方法还包括在接受表达FAS嵌合体蛋白的核酸构建体或所述化疗剂之前或之后确定受试者中的疾病进展。在一个实施方案中,通过测定肿瘤的尺寸确定疾病进展。在另一个实施方案中,通过测定肿瘤抗原(例如CA-125)的表达确定疾病进展。为了确定所述疾病进展,在表达FAS嵌合体基因产物的核酸构建体的输注之前、在所述输注结束时、所述输注之后大约三小时和/或所述输注之后大约六小时收集受试者的血液和尿液。在其它实施方案中,在0分钟-15分钟(就在给药之前)、给药开始之后30分钟±15分钟、给药开始之后60分钟±15分钟、给药开始之后四小时±15分钟、给药开始之后六小时±15分钟和/或在任何不良事件发生时记录受试者的生命体征。要测定的生命体征包括但不限于收缩和舒张压、外周心率、体温、呼吸率或其任意组合。在又一些其它实施方案中,测定受试者的血液学(例如全血细胞分类计数、INR和活化的PTT)、凝固(例如PTT水平)、表达FAS嵌合体的核酸构建体的生物分布、血管生成性和炎症性生物标志物的表达(例如VEGF、PlGF、sVEGFR1、bFGF、IL-1β、IL-6、IL-8、TNF-α、sVEGFR2、SDF1α、CD31、CD34、VEGFR2、vWF、其任意组合)、肿瘤标志物(例如CA-125)的表达或其任意组合。对于发热和嗜中性粒细胞减少症,以常规方式管理适合于本发明方法的受试者。在重新开始疗法之前,受试者需要从发热和活跃性感染问题中恢复。在一些实施方式中,不使用生长因子的受试者在其下一个周期中将添加Neupogen或Neulasta。接受Neupogen5μg/kg/天的受试者可以在同一方案内将他们的剂量升高至10μg/kg。实施例实施例1病毒载体的构建和克隆所述载体使用含有大部分5型腺病毒基因组的骨架构建,并与衔接质粒部分同源,从而能够进行重组。从骨架质粒上去除E1早期转录单位,并且缺失pWE25和Amp抗性选择标记位点而对其进一步修饰。衔接质粒(含有Ad5、CMV启动子、MCS和SV40polyA序列)通过限制性消化去除其中的CMV启动子,并插入PPE-1启动子和Fas-c片段对其进行修饰。修饰的PPE-1启动子(PPE-1-3X,SEQIDNO:18)和Fas嵌合转基因(Fas-c,SEQIDNO:9)被用来构建腺病毒载体。PPE-1-(3X)-Fas-c元件(2115bp)由PPE-1-(3X)-luc元件构建而来。该元件含有1.4kb的小鼠前内皮素原PPE-1-(3X)启动子、荧光素酶基因、SV40polyA位点和小鼠ET-1基因的第一个内含子,其来自Harats等人使用的pEL8质粒(8848bp)(HaratsD.等,JCI,1995)(HaratsD.etal.,JCI,1995)。使用BamHI限制性酶从pEL8质粒中获取PPE-3-Luc盒。荧光素酶基因被Fas-c基因[由人TNF-R1(肿瘤坏死因子受体1,SEQIDNO:4)的胞外和膜内结构域以及Fas(p55)胞内结构域(SEQIDNO:8)组成(Boldin等,JBC,1995)]取代而获得PPE-l-3x-Fas-c盒。PPE-1(3x)-Fas-c质粒–所述盒通过限制性消化被进一步引入到骨架质粒中,得到PPE-1(3x)-Fas-c质粒。衔接子-PPE-l(3x)-Fas-c质粒–从第一代构建体PPE-1-3x-Fas-c质粒中提取PPE-l-3x-Fas-c元件,并使用选定的PCR引物进行扩增,分别在5’-和3’-末端引入SnaB1和EcoR1限制性位点。利用这些位点将PPE-Fas-c片段克隆进经SnaB1和EcoR1消化的衔接质粒,获得衔接子-PPE-l-3x-Fas-c质粒,用于宿主细胞的转染(例如,PER.C6细胞)。实施例2VB-111在具有转移性Lewis肺癌(LLC)的小鼠中的效力和安全性总结在本研究中,使用VB-111(109或1011个病毒颗粒(VPs))、卡铂(Carboplatin)(20或50mg/kg)和爱宁达(Alimta)(10或30mg/kg)或这些小分子和腺病毒载体的组合处理LLC模型小鼠。使用两个剂量的VB-111的处理都获得了100%存活。施用低剂量的化疗剂获得轻微降低的存活率(94.1%),其与施用媒介物看到的相似(93.8%)。但是,施用高剂量的化疗剂导致最低的存活百分比(50%)。与单独施用VB-111相比,组合治疗降低了存活率(64%-93%)。在不同组中器官重量(心脏、肾脏和脑)基本相同。不同组之间在肝、脾和睾丸重量上发现一些不同,主要是单独高剂量VB-111或与该剂量的任何组合的重量较高。与媒介物处理相比,在肝功能上没有发现显著差异。通常,组合疗法没有比组成其的单一疗法引起更高的毒性。VB-111109+高化疗剂的组合比单独的高化疗剂处理明显更有效。另外,组合处理提高了VB-111109单独处理的平均和中值肿瘤负荷(分别是1.5倍平均值和5倍的中值),虽然统计学上不显著。如果在更大组上应用该处理,这种效果可能会呈现统计学上的显著性。VB-111109+高化疗剂的组合获得了与VB-1111011类似的高肿瘤负荷减轻,因为在这两组之间没有明显的差异。单独VB-111109的处理没有获得这种与VB-1111011的明显相似性。VB111109+高化疗剂组合疗法可能会降低VB-111的剂量,却保持其高效力,并改善卡铂和爱宁达单独化疗的低效力。介绍Lewis肺癌(LLC)是一种广泛应用于转移的小鼠模型(Varda-Bloom等,2001)。本研究将要确定VB-111与已经明确的化疗法(例如卡铂和爱宁达)组合治疗时的可能的协同性:评价单一剂量VB-111(109或1011VPs/小鼠)在单独处理或与卡铂(20或50mg/kg)和爱宁达(10或30mg/kg)重复腹膜内处理组合时的效力,并评价和鉴定VB-111单独处理和与上述的化疗剂组合时的安全性和耐受性。表6显示了本研究设计。表6.研究设计材料和方法测试和参考材料名称:VB-111(PPE-fas).化学名称:未说明活性组分:5型腺病毒,E1缺失,E3部分缺失,具有PPE-1(3x)启动子,含有fas嵌合转基因媒介物:PBS和甘油提供:VBL物理状态:液体保存条件:≤-65℃,低温瓶中物品准备:处理当天融化药瓶并颠倒混合名称:卡铂化学名称:Ebewe媒介物:注射用水提供:Ebewe物理状态:液体(450mg/45ml)保存条件:RT名称:爱宁达化学名称:Pemetrexed媒介物:注射用水提供:Lilly物理状态:粉末保存条件:RT对照品:名称:PBS10%甘油提供:VBL物理状态:液体保存条件:≤-65℃,低温瓶中.物品准备:处理当天融化药瓶并置于冰上不超过30分钟。融化D122Lewis肺癌细胞。在细胞注射的第一天,收集细胞并悬浮至终浓度5x105/50μl,注射至左足垫。在注射后5天用卡尺测量肿瘤的直径。接下来每周测量直至其达到5mm,然后每天测量直至7mm时切除(定义为第-5天)。处死后,收集脑、心脏、肝脏、脾脏、肾脏和睾丸,称重并根据下列参数评估:整个器官的颜色和质地结构、病灶的存在或器官内转移的任何证据(切片后)。肝功能实验室分析(血液中GOT和GPT水平)包括在第5±1天和研究结束时(第16天)取自每组5只小鼠的样品。所有的动物程序都经过Tel-Hashomer的Sheba医学中心的“动物护理与使用委员会”(“AnimalCareandUseCommittee”ofShebaMedicalCenter,Tel-Hashomer)的批准。本研究为有安慰剂对照的盲研究。C57Bl6小鼠通过左足垫皮下注射接受Lewis肺癌细胞(D122)。当肿瘤组织达到直径7mm时(大约细胞注射后3周),在麻醉下将具有原发肿瘤的足垫切除。将这一天定义为第-5天。原发肿瘤切除后5天、第一次施用日为第0天。在第0天将小鼠随机分为如下表所述的不同处理组。将测试的腺病毒载体或对照物质进行尾静脉注射,每只小鼠的总体积为100μl。IP施用卡铂和爱宁达,每只小鼠每天剂量为总体积100μl。在整个研究过程中直至处死时,针对安全性和效力对动物进行跟踪(如下面评估规划表所列)。记录研究中每只动物的死亡,并试图确定死亡原因。对每只动物的处死日设定如下:当第5只对照小鼠(PBS10%甘油–组9)死于转移时,确定从第0天(对该小鼠第一次IV施用媒介物)开始经过的天数。该天数设定为所有仍存活小鼠的处死日(即如果第5只对照小鼠在其第16天死亡,那么每只小鼠都在到达其自己的第16天时被处死)。效力评估规划示于表7中。表7.评估规划*皮肤、皮毛、眼睛、粘膜、呼吸、神经控制、震颤、流涎、腹泻、活动、昏睡、抽搐、异常行为模式、睡眠、昏迷。**来自每组5只小鼠结果在单独用109和1011VPsVB-111处理的小鼠组中,至第16天时所有动物都存活。组合治疗的存活率降低,而最低的存活率见于用高剂量的化疗剂处理的小鼠中,如表8所示。表8.第16天的死亡率。为了评估效力,在处死日称重肺。正常肺质量为~0.2g。肿瘤负荷定义为肺质量减去0.2g。平均和中值肿瘤负荷示于表9中。表9.平均和中值肿瘤负荷与媒介物处理相比导致降低的肿瘤负荷的所有处理示于图1中。图1显示,使用E11、E9+高化疗剂和E11+高化疗剂的处理比其它处理组显示更低的平均肿瘤负荷。对效力进行了几种统计学比较。当使用单因素方差分析时,媒介物处理比除了VBE9+低化疗剂组合外的所有其它处理具有更高的肿瘤负荷,这具有统计学上的显著性(p=<0.001)。与两种化疗剂处理和两种具有低化疗剂的组合处理相比,VB-1111E11处理的肿瘤负荷明显更低。当使用Mann-Whitney两组之间的单独比较时,VB-111E11中的肿瘤负荷明显低于除了E9+高化疗剂之外的所有组。E9+高化疗剂明显低于除了E11、E9和E11+高化疗剂之外的所有组。图2显示了数据的盒型图。结论两种剂量的VB-111处理都得到了100%的存活率。施用低剂量的化疗剂产生了稍微降低的存活率(94.1%),其与施用媒介物看到的存活率相似(93.8%)。但是施用高剂量的化疗剂导致了最低的存活百分比(50%)。与单独施用VB-111相比,组合处理降低了存活率(64%-93%)。在不同组间器官重量(心脏、肾脏和脑)基本上没有不同。不同组之间在肝脏、脾脏和睾丸重量上存在一些差异,主要是单独VB-111高剂量或与此剂量的组合组中的重量较高。与媒介物处理相比在肝功能上没有观察到明显的差异。一般来讲,组合疗法没有导致比组成该疗法的单一疗法更高的毒性。与高化疗剂单独处理相比,VB111109+高化疗剂组合处理明显改善了效果。另外,与VB111109单独处理相比,其也改善了平均和中值肿瘤负荷(分别为1.5倍平均值和5倍中值),尽管没有统计学显著性。如果对较大的组应用该处理,这种效果可能会呈现出统计学显著性。VB111109+高化疗剂组合处理得到了与E11类似的肿瘤负荷降低效果,因为在这两组中没有明显的差异(参见盒式图和Mann-Whitney统计学比较)。VB111109单独处理没有得到与VB1111011明显的相似性。VB111109+高化疗剂组合疗法可能会降低VB-111的剂量而保持其高效力,并改善卡铂和爱宁达单独化疗时的低效力。VB111109+高化疗剂处理组的存活率和重量减少都比高化疗剂单独处理要好:分别为存活率–64%和50%,重量减少–9.7%和11.6%。对于任何所检测的器官重量在这两组之间没有发现差异。实施例3Ad5PPE-l-3X-Fas嵌合体与紫杉醇组合施用这将是一个前瞻性、开放性、剂量逐步升高的、多中心(两个中心)、阶段I/II的研究,来确定AD5PPE-1-3X-Fas-嵌合(VB-111)在临床使用情况下的安全性和效力,将要监测具有实体原发性和转移肿瘤(比如复发性卵巢上皮癌、输卵管癌、原发腹膜癌、MMMT和乳头状浆液米勒管肿瘤)的受试者接受静脉内输注一定剂量范围的Ad5PPE-l-3X-Fas嵌合腺病毒载体与紫杉醇组合后的结果,比如毒性、副作用、抗体效价、生物学分布、疾病进展和疾病复发以及存活。VB-111对形成针对腺病毒载体的抗体、肿瘤应答和血管生成生物标志物的效果也将得到评估。材料和实验方法研究目的本研究假设VB-111加上每周的紫杉醇将产生可接受的毒性和应答率或足以确保将来评价的临床效益。主要目的1.明确有限数量的VB-111和每周紫杉醇组合的剂量的毒性,跨越预期有效剂量。2.探索在扩大的组群中最佳耐受剂量的VB-111和每周的紫杉醇组合的效力(RECIST应答、CA-125应答和无进展存活(PFS))。次要目的探索毒性和应答的预测性标志物研究设计和评价的概述该开放性、单中心、I/II期试验将VB-111与每周一次的紫杉醇组合,用以确定与这个预处理群体中的历史对照比较,这种组合是否能改善应答率,其中VB-111在每第二个28天周期的第一天输注,而每周一次的紫杉醇在每28天的第1、8、15和22天输注紫杉醇40-80mg/m2用时超过1小时。患者可继续有益处和改变的治疗,并且紫杉醇施用有计划的间断,以避免过度的神经病,但不中断VB-111的输注。该试验设计为2-步骤(2-stage)Simon’s设计,基于10个患者中≥2个应答,并将继续加入。受试者群:将列入具有复发性卵巢上皮癌、输卵管癌、原发腹膜癌、MMMT和乳头状浆液性米勒管肿瘤的受试者。计划列入的患者数基于研究设计,估计需要2到42名具有晚期癌症的患者(在剂量升高过程中每个群组最多6名(=18名患者),在MTD剂量水平最多29名患者,从而能够进行相关性/特异性研究的评价以及确保安全性。患者的选择I/II期设计为了评价RECIST标准和CA-125限定的应答率(GynecologicalCancerIntergroup(GCIG)标准)以及为了描述安全性和表征不良事件以及毒性的特点。阶段I研究将加入3+3设计至3个剂量水平。阶段II研究在第一阶段将列入多至10名患者,包括接受全剂量化疗的剂量水平2和3的参与者。如果有至少2名应答,在扩展群组中将继续列入另外19名患者至最多29名参与者。效力分析将用来估计应答率。将进行持续的安全性审查,如果在第一阶段有2或多名等级≥3的GI穿孔或在任何时候有3名,研究则终止。受试者列入处理组的标准是:1.患者年龄>18.2.组织学上确定的卵巢上皮、腹膜或输卵管癌症,以及子宫乳头状浆液性癌(UPSC)和妇科MMMT。3.允许多达3条以前的转移性疾病化疗线。4.患者必须之前进行过铂或基于铂的化疗。5.EasternCooperativeOncologyGroup(ECOG)状态0-1.6.在完成或正在接受含有铂和紫杉烷的疗法的6个内,根据成像或CA-125定义铂抗性或难治疗性疾病为进展性疾病(原发或继发-即对于复发性铂敏感性疾病,患者可能只接受一次基于铂的治疗,接下来无铂间隔<6个月)。7.需要使用RECIST或CA-125可测量的或可评估的疾病(对于标准化资格,如果一些患者根据RECIST和CA-125都符合,则RECIST优先)。8.适当的骨髓功能。9.适当的血液学功能:i.ANC≥1000/mm3ii.PLT≥100,000/mm3iii.PT和PTT(秒数)<1.2XULN(PTT>ULN的受试者必须具有阴性的LAC)10.适当的器官功能:a.CTC神经病学低于或等于1级。b.之前的放射必须没有包括≥30%的含有主要骨髓的区域(骨盆、腰椎)c.SGOT/SGPT/碱性磷酸酶≤2.5xULN或<5xULN(对于记载的肝转移)d.胆红素≤1.5xULNe.肌酸酐≤1.5xULNf.筛选时浸棒的蛋白尿<2+或UPC(尿蛋白肌酸酐比<1.0).11.必须已经从之前治疗的急性毒性中恢复,所述治疗包括放疗、化疗、生物疗法,其中1级的神经病或任何等级的贫血症和秃头症除外。12.事先经过抗血管生成剂治疗不是排除标准。13.之前没有GI穿孔或GI梗阻或成像时肠的参与。14.没有活跃的、未治疗的精神疾病或需要治疗的神经病症状(允许I级的感觉神经病)。不存在未经治疗的中枢神经系统或脑转移。没有痴呆症或精神状态的显著改变,其会阻止理解和/或给予知情同意。15.没有患者对EL具有已知的过敏性。但是如果参与者之前具有紫杉醇反应性,而接下来对药物的再刺激耐受,那么他们是合格的。16.没有不可控的细菌、病毒或真菌感染的迹象。17.没有患者在施用前过去的30天接受其它的研究性疗法18.必须有能力给予知情同意。受试者从处理组排除的标准将为:1.对复发性癌症有超过3条之前的化疗线。2.在过去的2年内,除了浅表基底细胞和浅表鳞状细胞外,没有活跃的恶性肿瘤或宫颈原位癌。诊断为共存的米勒管肿瘤(通常是子宫内膜癌)的患者不被排除。在2年内诊断出并经治疗意图的处理的具有低危险性(局部的非炎性)的乳腺癌患者不被排除。3.不能遵守研究和/或后续程序。4.预期寿命少于3个月。5.常见毒性标准(CTC)等级1或更高的神经病(运动或感觉),其来自除了事先的紫杉烷接触外的共病,比如糖尿病。6.尽管很少适用,具有生育能力的性活跃妇女在研究过程中必须使用有效的生育控制方法,以将失败的风险最小化。在研究招收前,具有生育能力的妇女必需被告知在试验参与过程中避免怀孕的重要性,以及非故意怀孕的潜在危险因素。在接受研究产物前的14天内所有具有生育能力的妇女必须是怀孕测试阴性。如果怀孕检查阳性,患者一定不能接受研究产物,并不能被列入到本研究中。7.不适当控制的高血压。8.之前的高血压危象或高血压脑病的病史。9.纽约心脏协会(NYHA)等级II或更高等级的充血性心脏衰竭。10.研究第一天前6个月内心肌梗死或不稳定型心绞痛的病史。11.研究第一天前6个月内中风或短暂性脑缺血发作的病史。12.已知的CNS疾病,除了治疗过的脑转移:治疗过的脑转移定义为通过在筛选期间临床检验和脑部成像(MRI或CT),确定治疗后没有发展或出血的迹象并对地塞米松无持续需求。允许抗痉挛剂(稳定剂量)。脑转移的治疗可包括全脑放疗(WBRT)、放射外科(RS:仂吗刀、LINAC或等同法)或治疗医生认为合适的组合。具有CNS转移的患者中,若经过神经外科切除治疗或在第一天之前的3个月内进行过脑部活检的将被排除。13.在第一天前的6个月内有明显的血管疾病(例如主动脉瘤、需要手术修复或近期外周动脉血栓)。14.在第一天之前的一个月内的咳血病史(每次发作>1/2茶勺的鲜红的血)。15.出血素质或凝血功能明显异常的迹象(没有抗凝治疗)。16.在第一天前的28天内有大的手术操作、开放性活检或重大创伤性病变,或者预计在研究过程中需要大的手术操作。17.在第一天之前的7天内进行了中心活检或其它小的外科手术操作,不包括放置血管通路装置。18.在第一天前的6个月内腹壁瘘或胃肠穿孔病史。19.当前的肠梗阻指征和症状。20.当前的对IV水合或肠道外全营养(TPN)的依赖性。21.严重的不愈合的伤口、活跃的溃疡或未治疗的骨折。22.对于TKI在前面4周内或对于抗体或基于肽抗体(peptibody)的治疗6周内接受抗血管生成治疗的患者。23.持续需要免疫抑制治疗的患者,包括使用环孢菌素,或具有在列入前最后4周内长期使用任何此类药物的历史的患者。允许稳定剂量的皮质类固醇(例如在施用前至少2周开始的)。组成:AD5-PPE-L-3X-FAS-嵌合体Ad5-PPE-l-3X-fas-嵌合体(SEQIDNO:19)是一种血管破坏性基因治疗剂,由含有修饰的小鼠前内皮素原启动子(PPE-l-3x,SEQIDNO:18)和fas-嵌合转基因[Fas和人肿瘤坏死因子(TNF)受体](SEQIDNO:9)的非复制性腺病毒载体(Ad5,E1缺失的)组成。其配制成无菌载体溶液,并在一次性使用的小瓶中以冷冻形式提供(低于-65℃)。每个小瓶含有1.1mL的具有特定病毒滴度的载体溶液。效力和药效学研究目的:治疗计划用Ad5-PPE-l-3X-fas-嵌合体与每周一次的紫杉醇组合处理患者。周期长度为28天。患者将每周(第1、8、15和22天)接受60分钟IV输注的紫杉醇。在周期1开始的奇数周期的第一天经IV输注施用Ad5-PPE-l-3X-fas-嵌合体,之后每两个周期进行一次。处理计划示于图3。阶段I的剂量水平示于下列表10。表10:阶段I1部分的剂量水平:脚注:1.在确定最大耐受剂量(MTD)之后或剂量水平3已经完成后转换到阶段II。2.请注意,对于<50kg的受试者,在各个剂量水平时总VB-111病毒颗粒剂量与所示的不同。3.对于剂量水平1计划在受试者内进行剂量逐渐升高。在周期2第一天,对列入到剂量水平1的参与者,紫杉醇的剂量可能被升高至80mg/m2,考虑到这是临床使用的标准剂量。如果两名参与者在剂量水平1经历剂量限制性毒性(DLT),则终止该研究,不确定MTD。4.这些数字可反应包括有:(a)直接列入到剂量水平2的参与者,以及(b)剂量水平1参与者,其已在周期2的第一天升高剂量至剂量水平2,用于评价周期3过程中的DLT。阶段I组群的参与者将因此通过修饰的3+3设计被列入,如表11所示和如下所述。从剂量水平1升高剂量至剂量水平2:如果2名参与者在剂量水平1经历DLT,研究将终止,不确定MTD。在剂量水平1中,计划在周期2的第一天,在受试者内将参与者剂量升高至80mg/m2的紫杉醇,然后这些参与者可以被算作评价列入剂量水平2的参与者,尽管VB-111和紫杉醇同时施用发生在剂量水平1的周期3(即列入剂量水平2的参与者和具有紫杉醇的剂量升高至80mg/m2的周期3剂量水平1的参与者都将被评价,所以在剂量水平2可有2-12名参与者,其中多至6名起始列入剂量水平1,然后剂量被升高)。如果在评价了3名受试者后在剂量水平2没有DLT(或者作为剂量水平2的新参与者或者由于剂量水平1中的紫杉醇剂量升高),该研究将列入剂量水平3。该计划只适用于在受试者内紫杉醇的剂量升高(以使进行40mg/m2剂量的参与者数最小化),没有VB-111的受试者内剂量升高。从剂量水平2到剂量水平3的剂量升高:一旦3名受试者列入剂量水平2,在起始施用VB-111后观察14天,没有DLT,则受试者可列入剂量水平3(1x1013VPs),因为至少6名参与者将已经在剂量水平1和2被施用3x1012VPs。只有当至少2名患者接受一剂施用3x1012VPs而没有DLT,才可在剂量水平3第二次施用VB-111。另外,将在平行的VB-111I/II期研究的同时进行DLT监测。从这些研究得到的安全性发现将在该团队中分享。如果在剂量水平3发生任何DLT,参与者可继续研究,并将接受进一步施用剂量水平2的VB-111(3x1012VPs)。表11:剂量升高决定规则鉴于药物的新颖性,将在开始研究的每名新人之间至少间隔2天按顺序列入新参与者。多个新研究的参与者不会在同一天施用。一个28天的处理周期的完成将作为确定每一施用组群的MTD和DLT的基础。将根据CommonTerminologyCriteriaforAdverseEvents(CTCAE)第4版(在国际互联网:http://ctep.info.nih.gov有可下载文件)来评价毒性等级。定义剂量限制性毒性(DLT)对于DL1参与者,将在第一周期(周期1)和第三周期评估潜在的DLT。将通过CTCAE4.0版来评估毒性。剂量限制性毒性定义如下:1.中性粒细胞绝对计数<0.5x109/L持续≥4天,或者中性粒细胞绝对计数<0.5x109/L伴有败血症,或等级3-4的发热(>100.2°F),其不容易用解热药控制。2.血小板计数<10x109/L持续任何时间。3.任何其它药物有关的非肝和非血液系统等级≥3的毒性。这不包括等级≥3的可以被药物控制的恶心或呕吐(如果恶心和/或呕吐不能被药物控制并发生在第一周期,它将被认为DLT)或等级≥3的可以被容易矫正的、临床无症状的、并不伴有医学上严重并发症(例如ECG改变)的低钾血症、低钠血症、低磷血症、低镁血症和低钙血症。发生在施用VB-111后24小时内的等级3-4的发热事件,如果他们对有症状的治疗有反应,则不被认为是DLT。在任何时间点,如果患者有不可接受的毒性和/或进展,其将被移出研究。研究过程预处理评估:临床医师(MD或NP)将评估患者是否满足合格标准。在开始第一个处理周期处理之前的14天内将进行病史、身体检查,并记录重量和生命指征以及记录ECG。建立基线测量值的调查(如果适用)应该在开始第一个处理周期前28内完成。在任何研究施用前,在每一周期的第一天,必须重新确定受试者的合格性。下列评估应该在D1的3天内完成(除了周期1,血液检验可以在第一天的14天内检查):1.临床评估:医学史、身体检查、生命指征(VS),并检查出血的风险。在其它时候可以按护理的机构标准进行VS评估。2.血液学:全血计数及分类、INR和活化的PTT。3.凝血:如果部分凝血酶原时间(PTT)延长超过正常上限(ULN),需要抽血检查狼疮抗凝物(lupusanticoagulant,LAC)。具有延长的aPTT的患者不应该接受VB-111,直至aPTT正常。在检查狼疮抗凝物(LAC)阳性的患者中,在重复施用VB-111之前需要阴性测试。对于一直阳性的LAC或抗磷脂抗体(APLA)检验,必须在初始阳性检验开始的12周内重复所述的检验。4.综合代谢方面:包括电解质、肝功能检验(LETS)、血尿氮(BUN)/肌酸酐(Cr)、钙和镁。5.尿:收集用于常规分析。6.VB-111特异实验室:抽血用于:(i)生物学分布:VB-111腺病毒DNA水平和转基因表达定量。(ii)生物标志物:将检验所有列入本研究的患者的外周血样品中抗血管生成疗法的生物标志物。分析血浆中循环血管生成性和炎症性生物标志物:VEGF、PlGF、sVEGFR1、bFGF、IL-1β、IL-6、IL-8、和TNF-α(使用Meso-ScaleDiscovery的多重ELISA平板)以及sVEGFR2和SDF1α(使用R&DSystems试剂盒)。将使用标准流式细胞术计数新鲜样品中的血液循环细胞。对存档的组织评估CD31、CD34、VEGFR2和vWF。(iii)肿瘤标志物:CA-125(iv)抗体:针对AD-5病毒的抗体水平(包括中和抗体)。研究处理输注:在研究处理输注前ANC必须≥1,000/mm3并且血小板计数≥100,000/mm3。紫杉醇输注:抗呕吐疗法:抗呕吐疗法可包括地塞米松10mgi.v.prn、氯羟安定(Ativan)0.5-2.0mgi.v.、和/或康帕嗪10mgp.o.或羟哌氯丙嗪4mgp.o.,基于学院标准。施用顺序是紫杉醇然后VB-111。经过具有不大于0.22微米的微孔膜的管路过滤器,以起始剂量40–80mg/m2每周施用紫杉醇,用时超过60分钟。所有患者在施用紫杉醇之前必须接受术前治疗(premedication)以防止严重的过敏性反应。患者将口服地塞米松,在处理前一天晚上20mg,在第一次施用处理的早晨20mg,然后如果紫杉醇耐受,则第二周不用口服,只是IV术前治疗,剂量逐渐减少,第三周后不再使用。典型的术前治疗方案组成如下:在紫杉醇之前30-60分钟给予10-20mg静脉内(IV)地塞米松、50mgIV苯海拉明(或其等价物),以及300mg西咪替丁或50mgIV雷尼替丁。根据当地处方,法莫替丁20mgIV可以作为替代物。如果在施用紫杉醇时患者发生了过敏反应,研究人员可以自行决定提高地塞米松剂量。奇数周期的第一天:除了上述操作,将在奇数周期的第一天进行下列程序。肿瘤测量:在周期1的第一天之前(允许长达一个月之前)以及在每个奇数周期(例如周期1、3、5等=每8周)直至病情发展,利用CT进行胸部、腹部和骨盆的肿瘤测量。在施用前、长达施用前3天,进行评估。研究处理输注:VB-111将在每个奇数周期的第一天施用VB-111直至病情发展。应该在紫杉醇之后施用VB-111。这是基于以下考虑,作为安全防范,研究性药剂应该在最后施用。没有预期两种药剂会有顺序依赖的药理学改变。虽然预料这会在紫杉醇之后立即施用(1小时之内)的情况下发生,如果有临床指示,可以晚些施用(24小时内)。具有延长的aPTT的患者不应该接受VB-111直至aPTT正常。LAC和/或APLA检验阳性的患者,需要在重复施用VB-111之前进行阴性检验。如果检验仍然阳性,则不应该进一步施用VB-111。对于一直阳性的LAC或APLA检验,从最初检验阳性起12周内必须重复检验。退热治疗:施用VB-111之前应该施用1000mg的醋氨酚,VB-111之后施用PRN醋氨酚。对于发展了3级发热的患者或者根据研究人员的自行判断,可以在接下来施用VB-111之前10分钟i.v.施用10mg地塞米松。VB-111的准备和输注:完成紫杉醇输注后,将对正在禁食或只进食了清淡饮食的患者施用单剂量VB-1113x1012VPs(剂量水平1-2)或1x1013VPs(剂量水平3)。请注意:如果患者具有明显的发冷,而不是通常的低级和自限性发热,则建议禁食以避免呕吐。这不是绝对要求。施用的最终溶液应该在制备后不超过60分钟内施用。施用后0.5小时允许正常饮食。必须以下列速度施用稀释的VB-111单一静脉内输注:1.对于剂量3x1012VPs:1mL/分钟2.对于剂量1x1013VPs:最初的10mL为1mL/分钟,然后剩余的输注为3mL/分钟。VB-111施用后的观察在第一次施用研究药物后的最初8小时,研究参与者应该在门诊部或输注区进行观察,接下来根据临床指示而定。VB-111分布实验在下列时间点收集血液和尿液样品用于VB-111腺病毒DNA表达水平定量:血液:1.0(施用前)2.输注结束时3.3±0.5小时4.6±0.5小时生命指征:记录生命指征(收缩压和舒张压、外周心率、体温、呼吸率):1.0分钟(就在施用前)(-15分钟的范围)2.开始施用后30分钟(+/-15分钟的范围)3.开始施用后60分钟(+/-15分钟的范围)4.开始施用后4小时(+/-15分钟的范围)5.开始施用后6小时(+/-15分钟的范围)6.在任何不良事件发生的时候每个周期的第8、15和22天每名患者被要求在禁食状态下回到门诊部,进行下列评估:1.生命指征:收缩压和舒张压、外周心率、体温、呼吸率。2.血液学:全血计数并分类、INR和活化的PTT。3.凝血:如果需要,跟踪异常PTT水平。4.尿液:收集用于常规分析血液实验将在周期1-6的第8天抽血。抽血用于:1.生物学分布:VB-111腺病毒DNA水平以及转基因表达定量(VB-111输注后的每个第二周期)2.生物标志物:分析血浆中循环性血管生成性和炎症性生物标志物VEGF、PlGF、sVEGFR1、bFGF、IL-1β、IL-6、IL-8、和TNF-α(使用Meso-ScaleDiscovery的多重ELISA平板)以及sVEGFR2和SDF1α(使用R&DSystems试剂盒)。将使用标准流式细胞术计数新鲜样品中的血液循环细胞。对存档的组织评价CD31、CD34、VEGFR2和vWF。3.肿瘤标志物:CA-1254.抗体:针对病毒的抗体水平(包括中和抗体)注意:综合代谢方面包括电解质、LETS、BUN/Cr、钙和镁分析只需要在第一天进行,以及只需要在第1、8、15、22天进行LFTs。如上详述施用紫杉醇。ANC必须>1,000/mm3并且血小板计数>100,000/mm3抗呕吐疗法:抗呕吐疗法包括凯特瑞(Kytril)750μgi.v.或1mgp.o或枢复宁(Zofran)10mgi.v.或8mgp.o.,和地塞米松10mgi.v.,以及prn氯羟安定(Ativan)0.5-2.0mgi.v.,和/或甲哌氯丙嗪(Compazine)10mgp.o.或奋乃静(Perphenazine)4mgp.o.,遵照学院标准。研究完成回访受试者将按上述周期规划给予组合疗法(紫杉醇和VB-111)直至疾病发展。最后一次施用VB-111后,要求每名患者回到门诊进行最后的跟踪访问,进行相同的临床评估和常规实验室样品采集,对于临床重要事件,其将被记录作为未规划的实验室评估。不良事件以及相关治疗应以在前的研究相同的方式记录。治疗医师(MD或NP)将对受试者进行体检。将进行ECG。将对没能继续研究或发生疾病发展的患者,进行临床跟踪或电话联系以评估存活。但是疾病发展后,描述CA125和RECIST的数据将被保存在临床研究文件中。另外的程序不良事件对于具有任何不良事件的患者应进行完全的支持性措施。在施用后发生的所有不良事件将以病历报告形式(CRF)被记录,并记录强度、应用的治疗措施、结果和与研究药物相关性的评价。对相关的不良事件进行跟踪,直至消退。对不相关的不良事件进行跟踪,直至消退或研究结束时。常见副作用包括恶心、呕吐以及食欲减退。患者也可能会遇到便秘、拉肚子和腹泻。如果发生腹泻,增加液体摄入非常重要。如果症状变得严重,患者可能需要住院治疗和接受静脉输液。施用任何研究性产品都涉及一般的副作用风险。因为VB-111是研究性产品,并不知道其所有的在人体中的潜在副作用。VB-111可能会引起下列副作用的全部、一些或不引起这些副作用。副作用是指你在一项研究中可能发生的不良医学状况或预先存在的医学状况的恶化。除了下列可能的不良反应,不可预见的或不常见的副作用(可能会比较严重或威胁生命)可能会在VB-111单独给予或与其它治疗组合时发生。本研究目的之一是研究VB-111可能的副作用。在该研究过程中,研究医生会密切监测患者,并与患者讨论有关风险、不适和不良反应的任何问题。与VB-111相关的危险很可能的(高于50%的机率会发生)·流感样症状,比如发热、肌肉疼痛、疲劳、发冷,·恶心·呕吐偶尔的(1-10%的机率会发生)·便秘·肝脏产生了异常高水平的酶,意味着你的肝脏功能不正常,并有可能引起疲劳和黄疸(皮肤和眼睛颜色发黄)。尽管这通常比较轻微而且可逆,但是这也可能严重或威胁生命。·脾脏大小的增加通常不引起任何症状,但是如果脾脏破裂,则可能引起胃痛,并可能威胁生命。·骨髓中新血细胞生成的增加,可能导致增加的血细胞数目,但是白血病风险不会增加。·在给予注射位置的过敏反应,其可能引起一些红肿。·出血·异常延长的凝血检验(PTT)和某些类型的抗体的产生(抗磷脂抗体),其可能干扰正常血液凝固。这可能引起血栓(血凝块)或出血,其可能需要治疗,并可能比较严重或威胁生命。·你的伤口愈合能力可能会受到影响。这可以导致感染,并可能需要住院治疗。·高血压·尿中过多的蛋白。这通常是无症状的实验室发现,但是,如果过多,可能会引起体液滞留,如腿肿。·头痛·食欲减退和体重减轻(厌食)·血液中钠水平降低,其可以引起混乱、癫痫、疲劳和低水平意识。·血液中过多的糖分,如果严重,则可能需要住院治疗以及紧急治疗。·出汗增加(多汗症)罕见的(低于1%的机率会发生)·红细胞数量低,可引起疲劳和呼吸急促。这有可能需要输血。·血小板数量低,这可能引起出血和淤青。出血可能会很严重或威胁生命,并有可能需要输血。·白细胞数量轻微升高(可能增加感染危险)·严重出血·肾功能可能恶化(急性肾衰竭),这可能需要治疗,并且可能很严重或威胁生命·在具有涉及脑部的肿瘤的患者中,可能产生脑水肿(例如脑转移)·腹泻·心血管并发症:心脏病、心绞痛(胸痛)或血凝块(血栓),其可能堵塞重要器官的血液供应,并引起中风或对其它器官的病变。·充血性心力衰竭-心脏不能正常泵血,其可导致虚弱和疲劳、流体滞留和流体集于肺中,这可能导致呼吸急促。可能很严重或威胁生命。与紫杉醇相关的危险很可能的(高于50%的机率会发生)·轻微至严重的过敏反应,可能威胁生命·手足麻木和疼痛,有时恶化需要另外的治疗,并且在停药后可能不会消失·脱发·肌肉和关节疼痛·疲劳经常(10-50%的机率会发生)·恶心和/或呕吐·腹泻·口或喉酸痛·头昏目眩·头痛·肝病变·如果药物从注射的静脉泄漏到其周围的皮肤中,则有皮肤刺激和肿胀。·味觉改变·先前的放射位点处的皮肤刺激·皮疹偶尔的(1-10%的机率会发生)·结肠炎症,可能会引起你的肠部运动改变·胰腺炎症,可能会引起短时的腹部疼痛·闪烁的灯光或斑点的感觉·肾脏病变·一种叫作甘油三酯的脂肪形式在血液中水平升高(高甘油三酯血症)·心率减慢·心跳不规则罕见(低于1%的机率会发生)·肝衰竭·癫痫·混乱;情绪变化与活检相关的危险:活检通常在成像技术的指导下进行。每个操作在活检前需要独立的同意书。该危险可能包括:·疼痛和不舒服。疼痛和不舒服的程度会不同,取决于活检位点的位置。可以和研究医生讨论这些风险。·在活检位点少量出血。·在活检位点触痛。·在活检位点结疤。·罕见的在活检位点的感染。非常少见地,活检引起的并发症可以威胁生命。对于任何介入性操作,可能发生其它由于出血或器官病变导致的潜在的严重并发症。这些可能需要进一步的外科干预。与放射扫描和X-射线相关的危险:可能会应用CT扫描评估该研究中患者的疾病。这些检验的频率是标准治疗。从长期来看,经过很多年,由于对癌症的放射学评估和治疗导致形成新的癌症的风险非常低。某些类型的药物或这些药物与放射治疗的组合,可能会进一步轻微增加形成新癌症的风险。在扫描过程中注射到血管中的造影剂的使用存在很小的风险。它可能使肾功能已经降低的人的肾功能恶化。因此,在参与该研究的过程中将密切监测肾功能。如果患者的肾功能发生任何变化,该患者可能会被移出该研究。非常少见地,一些人会对造影剂有过敏反应(比如荨麻疹和瘙痒)。严重的反应(例如,血压下降、呼吸困难或严重的过敏反应和死亡)非常罕见。生殖性风险:该研究使用的药物可能会影响胎儿。当参与本研究时,患者不应该怀孕,并且不应该给婴儿喂奶。患者如果怀孕应立即告知医生。将对男性或女性研究参与者提供有关预防怀孕的咨询。合并用药除了在排除标准中列出的药物,对合并用药没有限制。但是,VB-111不应该与其它药物混合。从基线直到最后一次施用后1个月的跟踪回访,所有在研究中给予的合并用药将被记录。将记录常规药物的产品名称、说明、剂量、单位、频率、起始和停止日期。任何持续的合并用药将如此记录,不必重复出现,除非在研究结束前记录停止用药日期。止吐方案预计恶心应该是轻微的副作用。建议下列代表性的止吐方案:地塞米松4-8mgPO,或劳拉西泮(Lorazepam)0.5-1.0mg,或丙氯拉嗪(Prochlorperazine)10mgPO,或甲氧氯普胺(Metoclopramide)10-20mg,化疗前30分钟。阿司匹林对于具有高风险动脉血栓栓塞性疾病的受试者,可以开始或持续施用低剂量的阿司匹林(≤325mg/d)。在研究中出现动脉缺血症状或出血的受试者,应该对停止药物进行评估。退热治疗VB-111施用通常与在施用后持续24小时的自限性发热有关,一些病例中,低级发热可能延长至施用后2-3天。在VB-111施用前1-2小时应该施用1000mg的醋氨酚,VB-111施用后施用PRN醋氨酚。在发展了3级发热的患者或者根据研究人员的自行判断,在接下来施用VB-111之前10分钟,IV施用10mg地塞米松。其它实验室分析因为临床重要事件抽取的实验室样品,将记录为未计划的实验室评估。对于具有临床相关的异常实验室数值时,将跟踪检验,直至该数值回到正常范围内和/或发现所述异常的充分解释。所有该类实验室研究都将在该研究地进行,除了分布评估,其将被送到独立中心实验室(IndependentCentralLaboratory)。如果任何这些结果需要证实,如果可能,将在同一医院实验室进行重新检验。必须为每个医院实验室提供认证证书和正常参考范围。如果从当地实验室抽取安全性实验室,应该尽力为这些实验室获得实验室认证证书和正常参考范围。在筛选访问和每6个月或早期撤出的访问中将进行ECG。研究持续时间每个患者将每周施用紫杉醇和每第二个周期施用VB-111。患者将参加该研究直至病情发展,然后只有他们的文件可供CA125和RECIST详细信息的收集。患者可以决定在任何时间撤出研究。应该仍然联系撤出的患者并询问有关不良反应(AE)。所有AE,不管是否与药物或疾病相关,都将记录在患者的记录和CRF中。基于到目前为止完成的临床前研究得到的毒性特征,以及转基因表达的特异性,认为一年时间足以确定治疗后产生的任何长期毒性。应该大约每2个月联系已经撤出的或发生病情发展的患者,调查存活率。剂量限制性毒性(只是周期#1,2和3)在研究计划的第一个周期确定剂量限制性毒性(DLT),在这些周期中产生DLT的所有患者将被移出研究计划。在周期1中不允许剂量降低。DLT被定义为>4天的IV级中性粒细胞减少症(ANC<500/mm3)、发热和中性粒细胞减少症(定义为温度>100.2°F和ANC<500/mm3)、IV级血小板减少症(血小板<25,000/mm3)以及等级≥III的非血液学毒性,不包括恶心和III级呕吐。如果他们对对症疗法有反应,在VB-111施用后24小时内发生的3-4级发热不应被视为DLT。对于每周的计划,如果80mg/m2的紫杉醇是临床可接受的剂量,则没有计划升高超过该剂量。剂量调整–紫杉醇在本研究剂量升高阶段的第一周期不会进行剂量调整。在与研究PI讨论之后,可以允许具有神经病变症状的患者有“一周休息”。预计允许4周中有3周的施用计划,或者如果是交替周期,8周中有7周的施用计划。如果在这些计划之一中不能保持施用密度,该患者应被移出研究。如果对紫杉醇的计划进行了剂量调整,则无需因此对VB-111施用进行调整来遵循紫杉醇的周期。由于毒性恢复或社会义务而中断施用最长达3周的参与者可允许保持在研究中。注意:28天以后,一旦患者剂量降低,则不允许剂量升高,在接下来的所有周期中该患者应该继续该剂量。应该根据按照CommonTerminologyCriteriaforAdverseEvents(CTCAE-4)分级显示最大毒性的体系进行剂量调整。除非特别说明,否则针对血液学毒性的通常剂量调整将基于再处理时间72小时内获得的血液计数。将基于ANC(表12)、血小板计数(表13)和神经病(表14)确定紫杉醇的施用剂量。表12:每周一次给药前的中性粒细胞减少症表13:每周一次给药前的血小板减少症表14:感觉神经病剂量降低图表一旦紫杉醇剂量被降低,其不应该被重新升高。延长的骨髓抑制的管理到28天时,如果血小板或中性粒细胞不能恢复,可以允许另外7天进行血液学恢复。在第35天未完全恢复(ANC<1,000/mm3或血小板<100,000/mm3)的患者将被移出研究计划。发热和中性粒细胞减少症的管理对于发热和中性粒细胞减少症的患者将以通常方式进行管理。患者需要在重新进行疗法前从发热和活跃的感染问题中恢复。没有用生长因子的患者将在他们的下一周期中加入Neupogen或Neulasta。使用Neupogen5ug/kg/天的患者将在同一计划内将剂量升高至10ug/kg。另外的毒性和剂量调整在本试验中不预见其它毒性,但也有可能出现。发生药物相关的III或IV级非血液学或非粘膜毒性的患者如果在下一周期的7天内没有消除或改善到I级,其将被移出研究计划。发生严重III或IV级非血液学/非粘膜毒性的患者如果在下一周期开始的一周内消除或改善到I级,患者对治疗有反应并且主要研究人员已经复阅了患者的毒性,其可继续留在试验中。对于异常肝功能检验的剂量降低如下:未发现紫杉醇引起肝毒性;但是,在严重肝功能障碍的患者中其消除延迟。因此,应该根据表15对肝功能障碍的患者的紫杉醇剂量进行调整。表15:基于血清天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)水平的紫杉醇施用剂量血清AST,或ALT紫杉醇<3xULN80mg/m2≥3xULN60mg/m2≥5xULN保持药物具有>1.5mg/dl的升高胆红素的患者不应接受紫杉醇,直至该异常实验室数值改善到<1级。在恢复后重新开始治疗对应根据上表将紫杉醇降低一个剂量水平,如果毒性持续超过2周,患者将被移出研究。一旦患者的剂量降低,不允许剂量升高,在接下来的所有周期中患者应该继续该剂量。具有延长的aPTT的患者不应接受VB-111直到aPTT恢复正常。在狼疮抗凝物(LAC)和/或抗磷脂抗体(APLA)检验阳性的患者中,在重复施用VB-111之前需要检验阴性。如果检验保持阳性,不应进一步施用VB-111。对于一直阳性的LAC或抗磷脂抗体(APLA)检验,必须在初始阳性检验开始的12周内重复所述的检验。如果患者形成被认为是继发于其卵巢癌的严重毒性(例如肠梗阻),也将被移出研究计划。在可逆的3-4级毒性继发于癌症并且患者感觉从化疗中获益这种不寻常的情况下,治疗医师应该与研究PI一起复阅在毒性消除时患者继续进行研究计划的可能性。只有当所有的非血液学毒性消除至I级或更好才可以进行下一个治疗周期。允许最多两次施用延迟,每次一周。如果存在持续的毒性,患者将被移出研究。参与者的安全性将采取很多措施来确保参与试验的患者的安全性。这些措施将通过排除标准进行,常规监测如下。列入研究的患者,在该研究前和在其参与研究的过程中以一定的间隔进行临床评估和标准实验室检验。安全性评估组成如下:医学审查、记录不良事件、体检、血压和实验室测量值(由当地实验室完成)。在参加研究的整个过程中,在每次研究访问时,都将评估患者的不良事件(所有等级)、严重不良事件和需要研究药物中断或停顿的不良事件。将对因为任何原因停止研究治疗阶段的患者在停止治疗决定后评估~30天(28–42天)。如果治疗中的患者需要择期手术,建议在手术操作前停止治疗2-4周。重新治疗标准在周期开始时的剂量调整应该基于当时的非血液学毒性或血液计数。患者不应开始新的治疗周期,除非中性粒细胞绝对计数>1,000个细胞/mm3、血小板计数>100,000个细胞/mm3、以及非血液学毒性改善到1级(轻微)或消除。患者在开始重新治疗前可延迟多至3周。如果需要多于3周进行毒性恢复,他们应该被移出研究。如果毒性:利益权衡是有益于参与者和临床医生,那么在2级疲劳、腹泻、脱发和恶心的情况下可以继续治疗。紫杉醇配制、提供、保存和稳定性紫杉醇(NSC#673089)在28天一个周期的第1、8、15和22天IV输注紫杉醇40-80mg/m2,用时超过1小时。将按最大体表面积(BSA)2.0m2确定药物给药剂量,并根据当天的体重计算BSA。配制紫杉醇以6mg/mL非水溶液提供在多种剂量样品瓶中:其中包含30mg/5mL、100mg/16.7mL或300mg/50mL紫杉醇。除了6mg的紫杉醇外,每mL的无菌无热源性溶液中含有527mg纯化的EL(聚氧乙烯蓖麻油)和49.7%(v/v)无水醇,USP。保存当于20至25℃(68至77°F)下保存时,未打开的紫杉醇药瓶可以稳定至包装上指示的日期。避光。制剂紫杉醇在输注前稀释。可以将紫杉醇稀释于注射用0.9%的氯化钠,USP;5%葡萄糖注射液,USP;5%葡萄糖和0.9%氯化钠注射液,USP;或者5%葡萄糖Ringer’s注射液,至终浓度0.3至1.2mg/mL。该溶液在室温(大约25℃/77°F)和室内光线条件下保持物理和化学稳定长达27小时。为了尽量减少患者暴露于增塑剂DEHP(其可能从PVC输液袋或组件中浸出),稀释的紫杉醇应该保存于瓶子(玻璃、聚丙烯)中或塑料(聚丙烯、聚烯烃)中,并通过聚乙烯内衬的施用组件施用。施用将通过具有不大于0.22微米的微孔膜的管路过滤器(inlinefilter)施用紫杉醇。过滤器比如或(结合短进口和出口PVC涂层的管道)的使用不会引起DEHP的明显浸出。术前治疗所有患者将在第一次紫杉醇施用之前使用糖皮质激素、苯海拉明和H2拮抗剂进行术前治疗(premedication)以防止严重的过敏性反应。对药物发生严重过敏反应的患者可能需要重复术前治疗和用稀溶液重复刺激以及慢速输注。对于紫杉醇严重过敏性反应无需进行重复刺激。当对药物很好耐受后或建立了对樟脑的耐受,口服地塞米松可逐步取消。多西紫杉醇不能被替代。不良反应:有关最新和完整的信息,查阅包装内说明书。供应者:可从Bristol-MyersSquibbOncology以及常规生产商商售获得。查阅AmericanHospitalFormularyServiceDrugInformationguide、FactsandComparisons或包装内说明书获得更多信息。VB-111说明研究药物将以每受试者剂量提供在标注的1.8ml冷冻管(聚丙烯)中。每一冷冻管含有1.1ml(1012vp/ml)的体积。配制VB-112被配制为无菌载体溶液。溶液以冷冻形式(低于65℃)提供在一次性使用的塑料旋口瓶中。每瓶含有病毒滴度为1012vp/ml的1.1mL载体和媒介物(10%甘油的磷酸缓冲液)。融化载体溶液,并在稀释和操作过程中,将载体溶液保持在2-8℃。稳定性和保存VB-111的稳定性研究仍在进行中,到目前为止认为在65℃以下保质期为30个月。打开和/或稀释的药瓶不应被重复使用。VB-111药瓶应在封闭、冷冻(低于65℃)、避光下保存。制剂将如表16所示准备VB-111。表16.VB-111制剂*配药时可以使用无菌空袋并分别向袋中加入40mlNS+10mlVB-111,或者配药时可以使用50ml的NS袋,去除多出的体积然后加入VB-111。任一方式都是配药实践中可接受的。整个药物配制过程应在BSCII型室中室温下进行。融化后,在准备过程中,药物可在冰水中保持长达3小时。药物稀释于室温盐水中。在尽可能短的时间内完成药物的准备和药物注射,不要超过1小时。准备药物的药剂师应该验证容器上的信息适宜该研究和受试者:产品名称、浓度、批号。在无菌塑料管中放置需要体积的盐水(至室温)。在戴着手套的手之间摩擦融化VB-111溶液药瓶。立即从每个意欲用于特定受试者的冷冻药瓶中取出1mlVB-111。每个1mlVB-111都使用新的注射器。将VB-111加入含有事先准备的盐水溶液的塑料管中。用手涡旋内容物来混合稀释的药品。根据患者的重量确定将要使用的体积,抽出注射所需的体积到用于施用的注射器中(参见表16)。准备完成之后进行核对过程:检查使用的原料药瓶的正确编号,以及管中剩余的体积大约如预期一致,并完成药物计量日志。药物溶液准备后,根据药学程序清洁药房中的药物配制区。输注1.应该根据下列指示通过注射器泵进行稀释的VB-111单次静脉内输注施用:a.剂量水平1-2:应该以1ml/分钟的速率施用3x1012VPs(15或10.5ml,取决于受试者重量)b.剂量水平3:1x1013VPs(50或35ml,取决于受试者重量)i.以下列速率进行输注:1.在第一个10分钟为1ml/分钟2.剩余的输注体积为3ml/分钟完成施用后30分钟可为受试者提供常规的饮食。受试者中止满足下列标准的受试者应该中止研究治疗:1.3级神经病持续>7天2.4级高血压或药物不能控制的3级高血压3.肾病综合征4.等级≥2的肺或CNS出血;任何4级出血5.任何等级的动脉血栓栓塞事件6.4级充血性心脏衰竭7.胃肠道穿孔8.任何等级的瘘9.任何等级的肠梗阻10.需要药物或手术干预的伤口裂开11.受试者不愿意或不能遵守研究要求12.研究者确定受试者继续疗法不再安全13.研究者认为的与研究治疗相关的所有4级事件禁忌症在具有已知的先前严重的(NCICTC3级/4级)对在EL(聚氧乙烯蓖麻油)中配制的药物有过敏反应史的患者中禁忌研究药物治疗。临床检验和程序根据表17,在整个研究过程中,以指定的间隔进行一系列的临床检验和操作。表17:临床检验和操作*在VB-111施用日(每两个周期)在施用前、输注结束、施用后6小时,以及那个周期(奇数周期)的第8天收集样品。^施用前收集样品#将在VB-111施用当天在施用前和施用后30分钟、60分钟、4小时和6小时监测生命指征a:所有体检、血液检验和尿分析必须在登记前14天内进行。肿瘤的放射评估应该在登记前4周内进行。b:在所有接下来的周期的第1、8、15和22天的3天内抽血。CBC分类:CBC并分类和血小板;综合代谢包括电解质、LFT、BUN/Cr、钙和镁。在第8、15和22天只要求LFT和CBC分类。c:预计肿瘤应答将被评估2个周期。d:如果出现新的或增加的蛋白尿,需要24小时尿液。+2浸尿棒需要24小时收集,但是+3浸尿棒需要保持研究药物并24小时收集。因为蛋白尿不是VB-111施用的特征,尿分析将在第1、8、15、22天获得。e:可以在每个周期的第一天的三天内抽血检查PT、PTT。在PTT延长超过ULN的情况下,应该抽血检查狼疮抗凝物(LAC)和抗磷脂抗体(针对β2-GP-1和抗心磷脂的IgG和IgM)。f:可根据学院标准进行肿瘤评估,比如肿瘤应答评估:CT,MRI等。注意:可以计划以规则的间隔进行肿瘤评估(每8周),这通常与每2个周期一致,但是以固定的间隔以便比较彻底的评估PFS、原发终点。g:在周期1的第1天施用前和周期1的第8、15、22天、周期2的第1天、周期3的第1天施用前和每2个周期直至病情进展,收集特异的生物标志物。h:组织探查不是本研究的必须部分,但是可选的,有预算涵盖非临床指示的活检或穿刺获得样品。完成其没有特定的时间。参见下面组织收集部分。i.研究完成数据应该在研究治疗最后施用起30天的一周内完成。存活数据可以电话收集。效力和安全性评估RECIST标准使用ECIST1.1标准在基线和之后每两个周期(即周期2、4、6等之后)进行肿瘤应答评估。如果患者持续使用紫杉醇,将继续正式的评估。使用TumorMetrics进行独立的成像评估。肿瘤测量可测量的疾病:存在至少一种可测量的病灶。如果可测量的疾病限于单独病灶,应该通过细胞学/组织学证实其肿瘤性。可测量病灶至少可以在一个维度准确测量的最大直径>2.0cm的病灶。使用螺旋CT扫描,病灶必须在至少一个维度上>1.0cm,并且对于淋巴结,最小直径必须>1.5cm。不可测量的病灶所有其它病灶,包括小的病灶(使用常规技术最大直径<2.0cm或使用螺旋CT扫描<1.0cm),以及其它不可测量的病灶。其包括:骨病变;软脑膜疾病;腹水;胸腔/心包积液;炎性乳腺疾病;皮肤淋巴管炎/肺炎;未证实的、接着进行成像技术的腹部肿块,和囊性病变。使用尺子或卡尺,以公制表示法记录所有的测量值。在尽可能接近治疗起始时进行所有基线评估,绝不能超过开始治疗前4周。在基线和跟踪过程中应该使用相同的评估方法和相同的技术来鉴定每个确定的和报告的病变。只有当临床病变位于浅表时(例如皮肤结节、可触知的淋巴结)才能被认为是可测量的。对于皮肤病变的情况,建议使用包括使用尺子估计病变大小的彩色摄影术记录。目标和非目标病变的基线记录代表每个所涉及的器官最多5个病变的所有可测量病变应该确定为目标病变,并在基线记录和测量。应该基于病变的大小(具有较大直径的病变)以及可准确反复测量的适宜性(通过成像技术或临床上)选择目标病变。将计算所有目标病变的最大直径(LD)的总和并报告为基线总计LD。该基线总计LD将被用作参考,进一步鉴定疾病的可测量维度的目的肿瘤应答。所有其它病变(或疾病位点)应该被确定为非目标病变,也应该在基线记录。无需测量值,这些病变应该跟踪为“有”或“无”。应答标准目标病变的评估:完全应答(CR)-所有目标病变消失。部分应答(PR)-以基线总计LD作为参考,目标病变的总计LD至少减少30%。进展(PD)-以从开始治疗或一个或多个新病变出现开始记录的最小总计LD作为参考,目标病变的总计LD至少增加20%。稳定病情(SD)-以开始治疗以来最小的总计LD作为参考,既没有充分的缩减而符合PR,也没有足够的增加而符合PD。非目标病变的评估:完全应答(CR)-所有非目标病变消失,并且肿瘤标志物水平正常。不完全应答(非-CR)/非进展(非-PD)-一直存在一个或多个非目标病变或/和维持肿瘤标志物水平在正常限定值之上。病情发展(PD)-出现一个或多个新的病变。存在的非目标病变的明确发展。尽管仅有明确的非目标病变的发展属例外,但是在这种情况下,治疗医生的意见起决定作用,之后复阅小组(或研究的首席/主要研究者)应该对该进展状态进行确认。评估最佳总体应答最佳总体应答是指从开始治疗直至病情进展/复发以来记录的最好的应答(对于进展性疾病,以自治疗开始记录的最小的测量值作为参考)。通常,患者的最好应答评估将取决于测量和证实标准的完成,如表18所示。表18:基于目标、非目标和新病变的患者总体应答目标病变非目标病变新病变总体应答CRCR无CRCR非CR/非-PD无PRPR非-PD无PRSD非-PD无SDPD任何有或无PD任何PD有或无PD任何任何有PD健康状况全面恶化需要中止治疗、而当时没有病情进展的客观证据的患者将报告为”临床恶化”。甚至在中止治疗后也要尽一切努力记录其客观进展。在一些情况下,区分残留病症和正常组织可能会比较困难。当完全应答的评估依赖于这种判断时,建议在确认完全应答状态前进行残留病变检查(微针吸取/活检)。确认:若指定为部分应答(PR)或完全应答(CR)的状态,肿瘤测量值的变化必须在首次符合应答标准后经过进行不少于4周的反复研究来确认。在SD的情形下,在以6-8周的最小间隔进入研究后,跟踪测量值必须满足SD标准至少一次。Rustin标准:如果只有CA125是可评估的(升高超过35U/ml),应根据GCIG而不是Rustin标准定义应答。GCIGCA125应答定义:与治疗前样品相比,如果CA125水平在有至少50%的降低,则产生了CA125应答。该应答必须被确认并持续至少28天。只有当患者的治疗前样品至少是正常上限的两倍,并且在开始治疗的2周内,他们才可以根据CA125进行评估。如果CA125有确认的升高(两次记录)或者之前的正常CA125升高至≥2xULN(两次记录),则发生了基于CA125的进展。预期的不良事件在临床前小鼠毒理学研究中,VB-111引起最小的毒性。观察到轻微贫血、轻度的血小板减少症、轻度的白细胞增多、脾肿大和骨髓增生。也观察到与临床病理学无关的短暂的肝酶升高。全身性施用腺病毒载体耐受较好。流感样症状(发热、疲劳、发冷、恶心和/或呕吐)是最常见的不良事件。在参与I/II期试验的几个患者中观察到无症状的aPTT延长和阳性LAC。另外,在II期患者中报告了唯一一例严重腹泻。大部分静脉内注射的腺病毒颗粒集中于肝脏,其因此引起了以急性转氨酶和血管损伤为特征的炎症反应。抗血管生成剂的主要不良反应为伤口愈合障碍、出血、血栓栓塞和心血管疾病、高血压和蛋白尿。相关研究分布根据附录I收集所有患者的血液样品进行分布评估。在最大耐受剂量组或最高剂量组检查这些样品的腺病毒和进行VB-111转基因水平定量。在预先确定的施用后时间点分别通过血液的Q-PCR和Q-RT-PCR测定血液中病毒DNA水平和转基因水平,从而进行分布评估。将在所有预定的时间点收集所有患者的样品。对来自开始于最高剂量的患者的样品进行检查,并继续较低剂量的检查。对施用后未发现可检测水平的病毒DNA的样品将不进行转基因水平的检查,并且不进行之后时间点的评估。抗体将收集血清样品用于分析针对腺病毒的抗体水平(总IgG和中和抗体)。血管生成的生物标志物目前没有针对抗血管生成疗法的生物标志物,但是已经确定了几种候选的生物标志物[Jain2009]。将在列入本研究的所有患者外周血液样品中对此进行检查。进行血浆分析以评估循环血管生成性和炎症性标志物:VEGF、PlGF、sVEGFR1、bFGF、IL-1β、IL-6、IL-8、和TNF-α(使用Meso-ScaleDiscovery的多重ELISA平板)以及sVEGFR2和SDF1α(使用R&DSystems试剂盒),其中使用已经确定的方法,样品一式两份进行检查[HorowitzClinicalOvarianCancer2011付印中]。将使用标准流式细胞术计数新鲜样品中的血液循环细胞。定量分析终点是治疗后血液单个核细胞中循环性CD34brightCD45dimCPC或VEGFR2+CD45+单核细胞级分发生变化,如之前所述的[HorowitzClinicalOvarianCancer2011打印中]。将对归档组织评价CD31、CD34、VEGFR2和vWF。组织收集组织探查不是本研究的必须部分,但是可选的,若有预算支持非临床指示的活检或穿刺获得样品。完成其没有特定的时间。VB-111首次施用后的一到两个月被认为是理想的时间。预计20-50%的参与者可能会有合适的区域用于安全活检或适合腹水穿刺。统计方法的说明将使用标准的“3+3”设计确定VB-111的MTD。也就是,起始将3名患者以特定的剂量水平进行治疗。如果多于一名患者发生DLT,则停止升高,下一个较低的剂量水平被接受为MTD。如果没有DLT发生,则开始升高至下一个较高剂量水平。如果发生一例DLT,另外3名患者将被加入到那个剂量水平。如果这3名患者没人发生DLT,将升高VB-111至下一个较高的水平,但是如果一名或多名患者发生此类事件,则将停止升高,并将MTD定义为该下一个较低的剂量水平。利用这一升高方案,表19给出了对于多种假想的潜在毒性率升高至下一个更高剂量水平的可能性。表19:基于DLTVB-111剂量升高的可能性从表19可以看出,如果发生DLT的潜在风险<20%,则存在>71%的机率升高该组合,如果潜在风险<10%,则有>91%的机率升高。相反,如果发生DLT风险>50%,则最高有17%的机率升高,而如果风险>60%,则有<8%的机率。客观应答的评估将主要是描述性的。通常来讲,将计算总体应答率和相应的95%置信区间。II期方面的设计将评估由RECIST标准或CA125(GCIG,不是Rustin标准)确定的应答率,以及描述安全性特征并表征不良事件及毒性。根据报告的复发卵巢癌患者对化疗剂-抗血管生成剂组合的应答,选择30%作为目标应答,通常在20-25%范围内。设计为两步骤(two-stage)优化设计,其中最初的10名患者在步骤1被列入。这将包括在I期开始紫杉醇剂量为80mg/m2的参与者(即剂量水平2和3的参与者)。从本研究I期部分的剂量水平2和3组列入2到6名患者,在中期效力分析之前另外8到4名参与者将被列入到II期第一个步骤。如果观察到一个应答或没有应答,那么该试验将停止招募。否则,如果有两名或多名应答,那么另外19名参与者将被列入(即可能最多共29名)到II期中(那么对于整个研究总共将有I期的2-18名与II期的0-29名重叠)。如果有5名或更少的应答,那么该疗法没有进一步研究的必要。如果真实RR≤10%,在步骤1结束该试验的机率至少是74%。如果真实RR≥30%,那么该试验在步骤1停止的机率≤15%。最终分析的能力是:80%拒绝H0:RR≤10%利于H1:RR≥30%,目标类型-1,错误率5%。如在步骤I发现超过2名发生IV级的GI穿孔将中止该试验。在任何时间如果有3名GI穿孔,那么该试验将被中止。假设真实的GI穿孔率是4%,那么在步骤I观察到超过2次事件的可能性是6.2%,从整个试验观察到3次以上事件的可能性是2.7%。定量的和半定量的数据比如IHC数据将被视为初步试验数据,使用描述性统计学和非参数分析,试图探讨相关性,承认这些样品的数量不足以得出明确的结论,但是在多项研究中使用同一组分析的优势,使我们能够评价对效力和毒性潜在地最有用的预测指标。生物标志物将主要使用非参数方法(例如Wilcoxon符号秩或秩和检验)评价VB-111对CEC的影响、相关性/预见性措施,所有统计学显著性检验都是双侧的,并且对多重比较不做调整。显著性水平计算(双侧)95%的置信水平下的置信区间。实验室检查血管生成生物标志物分析(当地)进行血浆分析以评估循环血管生成性和炎症性生物标志物VEGF、PlGF、sVEGFR1、bFGF、IL-1β、IL-6、IL-8、和TNF-α(使用Meso-ScaleDiscovery的多重ELISA平板)以及sVEGFR2和SDF1α(使用R&DSystems试剂盒)。使用标准流式细胞术计数新鲜样品中的血液循环细胞。将对存档组织评价CD31、CD34、VEGFR2和vWF。肿瘤标志物:CA-125。在室温EDTA管中的每个时间点10cc总血浆将被分析。将在下列时间点收集样品:1.在基线2.周期1:研究药物施用前第1天,第8、15和22天3.周期2:研究药物施用前第1天4.周期3开始后的每2个周期,研究药物施用前,直至病情发展。抗体检查针对Ad-5病毒的抗体(包括IgG和中和抗体)的效价将被收集用于分析。在下列时间点收集样品:1.在每一周期:第1、8、15和22天在研究药物施用前;2.在研究完成回访时。以下列方式收集并准备血液:1.将6ml血液收集到没有抗凝剂的管中2.将样品在室温放置1小时,然后在2-8℃保存过夜以进行血块凝缩。3.在第二天离心血液。4.将提取大约2ml的血清,分装成4管(每管0.5ml,在1.5ml的Nalgene100中,总计2ml),保存于-20℃直至运输去分析。生物学分布检查进行下列检查:1.血液生物学分布:病毒DNA和转基因表达2.尿液生物学分布:病毒DNA在下列时间点收集全血样品用于生物学分布检查:1.在每个奇数周期的第1天和第8天在研究药物施用前。2.在VB-111施用日:a.输注前(与第1天样品相同)b.输注结束时c.3±0.5小时d.6±0.5小时e.在研究完成回访时以下列方式准备血液样品:1.收集每一时间点的血液到4个含有EDTA的管中(0.75ml/管)a.两管用于病毒DNA分析b.两管用于转基因表达分析2.管子应该标记受试者号码、名字首字母、日期和样品收集时间,并保存于-70℃或低于-70℃的冰箱中。按下列方式收集尿液:1.从保存的总收集体积中收集两份1-2ml的尿液样品。2.尿液样品和总收集体积将冷冻保存直至进一步分析。结果对6名患者施用VB-111,每名患者在研究开始前都具有持续至少一年的输卵管或卵巢上皮癌,剂量为每名受试者3x1012VPs与紫杉醇(40mg或80mg)的组合,如图3所示。患者没有表现任何与VB-111相关的严重不良事件。没有观察到剂量限制性毒性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1