叶酸受体靶向超声造影纳米微泡的制备方法与流程
本发明涉及一种靶向纳米微泡的制备方法,该纳米微泡可以通过被动和主动两种靶向效应准确定位到叶酸受体高表达的肿瘤细胞,并被肿瘤细胞摄取,从而实现该肿瘤细胞的特异性超声分子成像,属于医疗药物领域。
背景技术:
超声检查由于其无创无辐射、操作方便、价格低廉、对设备场地要求低等优势,是临床诊断肿瘤的重要手段,超声造影在多年的临床应用中已经证实在肿瘤的检出和定性诊断中有着重要的意义。超声造影优于常规造影,与CT、MRI相比拥有更多的优越性。安全高效的超声造影剂是超声造影的基础与关键,目前临床常用的是二代微泡造影剂SonoVue即脂质微泡造影剂,但长期的临床实践发现其对肿瘤组织的特异性不强,对病变组织缺乏亲和力,并且由于微泡粒径大多集中在2~10μm范围内(平均粒径为3~5μm),而毛细血管内皮间隙约为380~780nm,因此微米级微泡是无法穿透血管内皮间隙而到达肿瘤组织中,实际为微血管的非特异性显影,缺乏血管外肿瘤组织细胞的特异性;尽管多数肿瘤的血供丰富,然而对于乏血供的肿瘤就容易漏检,这大大限制了声学显像对于肿瘤鉴别诊断的效能。近来研究者们开始了靶向超声微泡(第三代微泡造影剂)的研究,靶向超声造影剂是将特异性抗体或配体连接到声学造影剂表面,依靠抗原-抗体/配体-受体之间特异性识别并结合,通过血液循环积聚到带有相应抗原/受体的靶器官或靶组织,从而使器官或组织在超声检查中得到特异性增强。与普通微泡相比,靶向超声造影通过特异性作用于病变区生物分子组成成分,来突出显示病变部位,从而提高超声诊断的准确性与敏感性。研究表明,肿瘤细胞膜表面或肿瘤供应血管表面存在着一些受体并在肿瘤组织中存在异常表达,与相应配体或配体类似物能特异结合。受体与配体的结合具有特异性、选择性、饱和性、亲合力强和生物效应明显的特点,为肿瘤的靶向诊治提供了靶向途径。其中叶酸受体(folatereceptor,FR)是目前研究较多的一种,其是一种糖基化磷脂酰肌醇(GPI)连接的膜糖蛋白,与叶酸(FA)具有高亲和力,可通过受体介导的内吞作用将叶酸(FA)摄入细胞胞浆。叶酸受体(FR)在正常组织中的表达高度保守,FRα主要在上皮细胞系肿瘤(如卵巢癌、结直肠癌、子宫内膜癌、睾丸癌、脑瘤、肺腺癌等)中高水平表达。虽然在正常细胞中FR可选择性的表达在细胞表面但是其呈极性分布,血液循环中的靶向制剂不能接近该受体,亦不能进入正常细胞,而恶性肿瘤细胞中FR分布失去极性,血液循环中的靶向制剂可接触该受体。与大分子抗体相比,叶酸(FA)属于小分子物质,FA-FR的配体/受体结合具有高亲和力(Kd=10-10mol/L),化学性质简单,易于修饰,体积小(Mr=441.4),高度化学稳定性和生物学稳定性,与有机溶剂的生理相容性,低免疫原性,达到靶点时间短、血液清除速度快、穿透能力强、低成本等诸多优点,使得FA成为肿瘤诊断和治疗理想的靶向载体之一,并且FA的靶向作用已经在核素PET-CT、MRI的靶向显像中得到证实。经检索,利用有序超分子膜层层自组装原理,构建叶酸受体介导的靶向纳米超声造影剂未见文献报道。
技术实现要素:
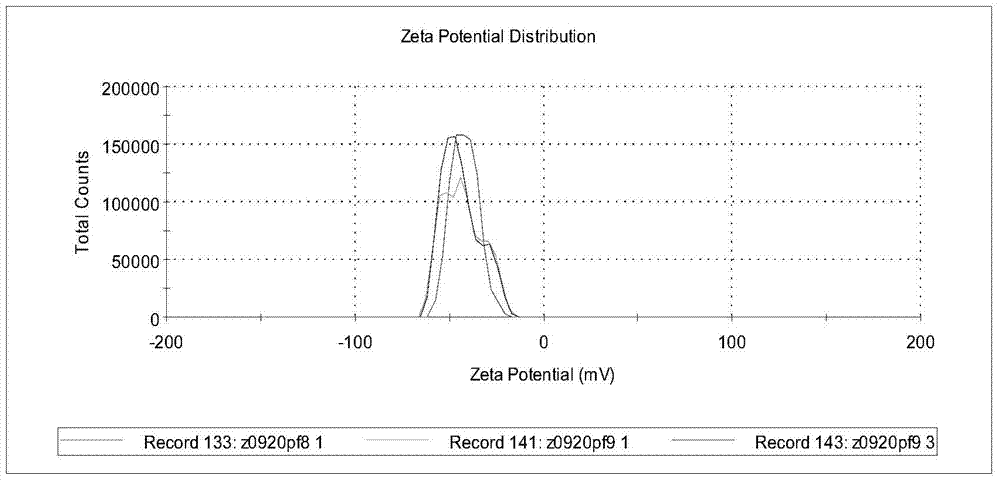
本发明所要解决的技术问题是针对上述的技术现状而提供一种新型应用于肿瘤细胞超声分子成像的叶酸受体靶向超声造影纳米微泡的制备方法。本发明解决上述技术问题所采用的技术方案为:一种叶酸受体靶向超声造影纳米微泡的制备方法,该纳米微泡由核心模板和外壳构成,其特征在于所述的核心模板为液态氟碳纳米乳化剂,所述的外壳为叶酸接枝聚乙二醇化壳聚糖衍生物,所述的液态氟碳纳米乳化剂包括如下组分及质量体积百分比浓度:全氟辛溴烷2.895%~4.825%;甘油2.25%~2.5%;泊洛沙姆1880.4%~0.8%;油酸0.15%~0.25%;蛋黄卵磷脂2.2%~2.6%;其余为水,包括如下步骤:①将甘油、泊洛沙姆188、油酸、蛋黄卵磷脂及超纯水混合配成乳化剂混悬液,将全氟辛溴烷加入到乳化剂混悬液涡旋混合后,在超声波作用下,形成核心模板材料;②配置叶酸接枝聚乙二醇化壳聚糖衍生物,形成外壳材料;③将核心模板材料逐滴加入到外壳材料中并磁力旋转搅拌,离心,纯化水洗,灭菌,过滤,得到产物;所述超声满足如下条件:超声用时5~15分钟,超声启动5~15秒,间隔时间5~15秒,超声温度20~30℃。进一步,步骤①中所述的核心模板材料通过如下步骤制得:将甘油、泊洛沙姆188、油酸及蛋黄卵磷脂涡旋混合于超纯水中形成混悬液,该混悬液在30~40℃条件下孵育0.5小时至1.5小时,形成乳状液;再涡旋混合下逐滴加入全氟辛溴烷,定容,超声,离心,获得纳米乳化剂。进一步,步骤②中所述的外壳材料通过如下步骤制得:将叶酸(250~300mg)、N,N'-二环己基碳二亚胺(230~250mg)、N-羟基丁二酰亚胺(120~150mg)共同溶解于二甲基亚砜(5~6ml)中,20~30℃下反应6~8小时,生成叶酸活性酯,过滤去除沉淀,备用;将α-羧基-ω-氨基聚乙二醇(0.8~1.2g)添加到上述的叶酸活性酯中,形成羧基-聚乙二醇-叶酸;将羧基-聚乙二醇-叶酸在无水嘧啶中孵育2~4小时,透析24~30小时,超纯水透析48~50小时;过滤去除不溶物,冰冻干燥获得产物羧基-聚乙二醇-叶酸;将壳聚糖(200~250mg)溶解于重量百分比为2%的醋酸水溶液(20~25ml)中,获得壳聚糖醋酸水溶液,备用;将羧基-聚乙二醇-叶酸(200~250mg)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(20~25mg)、N-羟基丁二酰亚胺(10~15mg)溶解于二甲基亚砜中,预激活4~6小时,然后逐滴加入到前述的壳聚糖醋酸水溶液中,暗室中搅拌20~24小时直至反应完成,生成的产物超纯水透析72~80小时,脱水,冷冻真空干燥制得叶酸-聚乙二醇-壳聚糖干粉;用无水乙醇配制浓度为10mg/ml的异硫氰酸荧光素溶液10~15ml,嫁接于合成的叶酸-聚乙二醇-壳聚糖作为荧光示踪剂,2%醋酸水溶液配制浓度为4~6mg/ml的叶酸-聚乙二醇-壳聚糖,磁力搅拌下将上述异硫氰酸荧光素溶液逐滴加入到上述步骤(2)制备的叶酸-聚乙二醇-壳聚糖的醋酸水溶液中,避光反应2~3h,使两者结合完成荧光标记,pH调整为9.0,离心去除上清,2%醋酸水溶液重悬至20ml,重复多次离心至上清无色,最后用1%的醋酸水溶液重悬沉淀,4-6℃叶酸-聚乙二醇-壳聚糖避光保存备用.进一步,所述步骤③如下:取制备的异硫氰酸荧光素-壳聚糖-聚乙二醇-叶酸醋酸水溶液用1mol/L的氢氧化钠溶液调节pH至5.5~6.5,取核心模板材料(2~3ml),磁力搅拌下缓慢滴加入异硫氰酸荧光素-壳聚糖-聚乙二醇-叶酸醋酸水溶液中,搅拌,36~38℃孵育25~35mim,15000rpm~16000rpm高速冷冻离心(冷冻同时离心),沉淀超纯水清洗,灭菌,过滤去除杂质与现有技术相比,本发明的优点在于:以液态氟碳纳米乳化剂为核心模板,以叶酸接枝聚乙二醇化壳聚糖衍生物为外壳获得的纳米微泡具有稳定性较佳、无体外毒性作用、静脉注射生物相容性较好、具有较高特异性结合力的优点。附图说明图1为实施例1中液态氟碳核心模板乳剂的强度-粒径分布图;图2为实施例1中液态氟碳核心模板乳剂的Zeta电位分布图;图3为实施例1中液态氟碳核心模板乳剂的普通光镜图像(400×);图4为实施例1中液态氟碳核心模板乳剂的透射电镜图像(80000.0V-120000×);图5为实施例1中DMSO测得的FA和FA-PEG-COOH的氢核磁共振波谱图;图6为实施例1中CS.0、FA-PEG-COOH、FA-PEG-CS的红外光谱图;图7为实施例1中叶酸受体介导的靶向超声造影纳米微泡的强度-粒径分布图;图8为实施例1中荧光分光光度计检测叶酸受体介导的靶向超声造影纳米微泡的荧光吸收情况;图9为实施例1中叶酸受体介导的靶向超声造影纳米微泡的透射电镜图像(80000.0V-120000×);图10为实施例5中叶酸受体介导的靶向超声造影纳米微泡的体外安全性评价数据;图11为实施例5中叶酸受体介导的靶向超声造影纳米微泡的体外靶向荧光成像图;图12为实施例5中叶酸受体介导的靶向超声造影纳米微泡的靶向摄取流式细胞检测图;图13为实施例5中叶酸受体介导的靶向超声造影纳米微泡的体外超声成像图。具体实施方式以下结合附图实施例对本发明作进一步详细描述。实施例1,叶酸受体介导的靶向超声造影纳米微泡核心模板纳米乳剂的制备。称取0.1125g甘油(2.25%(w/v))作为等渗调剂剂和助乳化剂,与乳化剂0.12g精制蛋黄卵磷脂(2.4%,w/v)和0.03g泊洛沙姆188(0.6%,w/v)及稳定剂0.01g油酸(0.2%,w/v)涡旋混合于4ml超纯水中形成混悬液,将制备的混悬液放置于37℃振荡孵育1h制成乳状液,再涡旋混合下逐滴加入100μl全氟辛溴烷,超纯水定容至5ml,装入15ml康宁离心管中,迅速上机超声,温度控制在20~30℃,以40%超声强度作用10min,超声启动10s,暂停10s,制得液态氟碳核心模板纳米乳剂,所获得的液态氟碳核心模板纳米乳剂取1ml超纯水稀释10倍数后,将适量该溶液用动态光散射法测定其粒径并使用激光粒度仪检测未稀释乳剂的Zeta电位,光学显微镜及透射电镜进行表面形貌和构成物质观察。图1所示结果平均粒径为(131.5±4.3)nm,其中300nm以下粒子强度占93.5%,PDI为(0.265±0.006),电位分布曲线图2所示,Zeta电位值为(-42.8±1)mV。pH计显示酸碱度值为(6.73±0.11)符合静注乳剂对pH的要求。PFOB(全氟辛溴烷)核心模板乳剂外观呈匀匀半透明状;如图3所示为普通光学显微镜和图4透射电镜下观察PFOB核心模板乳剂,外观似球形,分布较匀匀。(2)FITC荧光标记的FA-PEG-CS合成。叶酸FA(264.84mg,0.6mmol)、N,N'-二环己基碳二亚胺DCC(242.2mg,1.2mmol)和N-羟基丁二酰亚胺NHS(135.2mg,1.2mmol)共同溶解于二甲基亚砜DMSO中,室温下反应过夜(6-8h),生成叶酸活性酯备用。α-羧基-ω-氨基聚乙二醇NH2-PEG-COOH(1g,0.32Mmol)溶于DMSO后加入至叶酸活性酯溶液形成FA-PEG一COOH。混合物在无水吡啶(1.2ml,14.72mmol)中室温孵育2~4h,随后DMSO透析(MWCO1000)24h,超纯水透析48h。产物过滤去除不溶性产物,冰冻干燥获得FA-PEG-COOH。壳聚糖(CS)(200mg)溶解于20ml2%的醋酸水溶液备用。FA-PEG-COOH(200mg,52umol)溶于含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)(20.6mg,0.1mmol)及NHS(11.5mg,0.1mmol)的5ml无水DMSO中预激活4h,而后逐滴加入到上述配制的壳聚糖(CS)溶液中,暗室中持续搅拌直至反应完成大约20h。生成的产物用超纯水透析(MWCO8-14KD)72h,透析脱水剂脱去多余的水份,至冷冻干燥仪真空干燥制得FA-PEG-CS干粉。用无水乙醇配制浓度为10mg/ml的FITC溶液10ml,2%醋酸水溶液配制浓度为5mg/ml的FA-PEG-CS20m1,磁力搅拌下将FITC溶液逐滴加入到FA-PEG-CS醋酸水溶液中,避光2h,配制1mol/LNaOH将反应溶液pH调整为9.0,离心去除上清,2%醋酸水溶液重悬,重复多次离心至上清无色,最后用1%的醋酸水溶液定容至20ml重悬沉淀,4℃避光保存备用。叶酸溶于DMSO中的1HNMR图谱,各个峰的归属如图5中所示a、b、c、d、e、f、g是识别叶酸的特征峰。FA-PEG-COOH的1HNMR图谱,位于6.0~9.0ppm之间的三个峰e、d、g是叶酸的特征峰,而位于h处3.1ppm~3.8ppm的峰是聚乙二醇-(CH2-CH2)-重复单元中氢的位移,2.5ppm为溶剂DMSO的特征峰。位于FAρ苯环上的4个质子在6.65ppm和7.55ppm处出现特征峰e、d可证实FA成功连接到PEG上。从图6中可看出壳聚糖的O-H和-N-H伸缩振动吸收峰位于3446cm-1附近,1645cm-1和1607cm-1处吸收峰分别对应壳聚糖酰胺Ⅰ带和酰胺Ⅱ带,连接FA-PEG-COOH后1100cm-1左右的峰明显增强,且壳聚糖1604cm-1处的吸收峰减弱,FA-PEG-COOH1712cm-1处的吸收峰也随之消失,在FA-PEG-CS取而代之的是在1561cm-1出现新的较强的特殊吸收峰,由此证明壳聚糖的氨基和FA-PEG-COOH的羧基发生聚合形成了酰胺键。如图8所示用异硫氰酸荧光素标记壳聚糖从而获得荧光效果,FITC的激发波长在490~495nm,发射波长在520-530nm。荧光分光光度计检测谱显示FITC一CS-PEG-FA合成物在492nm处有吸收峰,同时在518nm处有发射峰,证实FA-PEG-CS已成功标记上FITC。(3)层层自组装构建完整的靶向造影纳米微泡及物理性质测定。FITC-CS-PEG-FA配制成浓度为5%该物质的醋酸水溶液,1mol/L的NaOH调节pH至6.0,以体积比2:1的比例取PFOB纳米乳剂核心,在磁力搅拌下缓慢滴加入FITC-CS-PEG-FA醋酸水溶液中充分搅拌,37度孵育30min,制得混悬液。将纳米混悬液4度15000rpm高速冷冻离心10min,沉淀超纯水清洗3次,经低频超声在超纯水中分散并经0.45um的滤膜滤过去除较大杂质。将最终合成的靶向纳米超声造影微泡用超纯水稀释一定倍数后经激光粒度仪测定平均粒径及Zeta电位,pH计测定其酸碱度,透射电镜观察表面形貌。如图7所示为所测得的FITC-CS-PEG-FA/PFOB超声纳米微泡粒径,25℃条件下测量所得平均粒径分别为(229.5±7.5)nm,PDI指数显示为(0.205±0.014),且相关数据显示FITC-CS-PEG-FA/PFOB粒径大多分布在91.28-615.1之间,小于500nm的粒子强度占到98.8%,Zeta电位平均值为(44.7±0.6)mV。由于包裹上了一层FA-PEG-CS使得其粒径及电位与PFOB核心模板纳米乳剂有显著的差别。该纳米粒子长时间保存后虽会出现分层,但轻摇后可混匀、大小无明显变化。并通过透射电镜对其进行了进一步观察,如图9所示粒子外层明显包裹上一层壳聚糖并且粒子呈球形,大小较均一。实施例2,(1)制成叶酸受体介导的靶向超声造影纳米微泡核心模板纳米乳剂。称取0.1125g甘油(2.25%(w/v))作为等渗调剂剂和助乳化剂,与乳化剂0.12g精制蛋黄卵磷脂(2.4%,w/v)和0.04g泊洛沙姆188(0.8%,w/v)及稳定剂0.0125g油酸(0.25%,w/v)涡旋混合于4ml超纯水中形成混悬液,将制备的混悬液放置于37℃振荡孵育1h制成乳状液,再涡旋混合下逐滴加入100μl全氟辛溴烷,超纯水定容至5ml,装入15ml康宁离心管中,迅速上机超声,温度控制在20-30℃,以40%超声强度作用10min,超声启动10s,暂停10s,制得液态氟碳核心模板纳米乳剂,所获得的液态氟碳核心模板纳米乳剂取1ml超纯水稀释10倍数后,将适量该溶液用动态光散射法测定其粒径并使用激光粒度仪检测未稀释乳剂的Zeta电位,光学显微镜及透射电镜进行表面形貌和构成物质观察。所示结果平均粒径为(145.5±5.6)nm,其中300nm以下粒子强度占90.3%,PDI为(0.196±0.008),电位分布,Zeta电位值为(-45.2±2.5)mV。pH计显示酸碱度值为(6.85±0.21)符合静注乳剂对pH的要求。(2)FITC荧光标记的FA-PEG-CS合成。(3)层层自组装构建完整的靶向造影纳米微泡及物理性质测定。FITC-CS-PEG-FA配制成浓度为5%该物质的醋酸水溶液,1mol/L的NaOH调节pH至6.0,以体积比2:1的比例取PFOB纳米乳剂核心,在磁力搅拌下缓慢滴加入FITC-CS-PEG-FA醋酸水溶液中充分搅拌,37度孵育30min,制得混悬液。将纳米混悬液4度15000rpm高速冷冻离心10min,沉淀超纯水清洗3次,经低频超声在超纯水中分散并经0.45um的滤膜滤过去除较大杂质。将最终合成的靶向纳米超声造影微泡用超纯水稀释一定倍数后经激光粒度仪测定平均粒径及Zeta电位,pH计测定其酸碱度,透射电镜观察表面形貌。所测得的FITC-CS-PEG-FA/PFOB超声纳米微泡粒径,25℃条件下测量所得平均粒径分别为(238.8±8.2)nm,PDI指数显示为(0.221±0.02),且相关数据显示FITC-CS-PEG-FA/PFOB粒径大多分布在68.06.28-712.4之间,小于500nm的粒子强度占到92.2%,Zeta电位平均值为(45.1±0.6)mV。由于包裹上了一层FA-PEG-CS使得其粒径及电位与PFOB核心模板纳米乳剂有显著的差别。该纳米粒子长时间保存后虽会出现分层,但轻摇后可混匀、大小无明显变化。并通过透射电镜对其进行了进一步观察,粒子外层明显包裹上一层壳聚糖并且粒子呈球形,大小较均一。实施例3,制成叶酸受体介导的靶向超声造影纳米微泡核心模板纳米乳剂。称取0.125g甘油(2.5%(w/v))作为等渗调剂剂和助乳化剂,与乳化剂0.11g精制蛋黄卵磷脂(2.2%,w/v)和0.04g泊洛沙姆188(0.8%,w/v)及稳定剂0.0075g油酸(0.15%,w/v)涡旋混合于4ml超纯水中形成混悬液,将制备的混悬液放置于37℃振荡孵育1h制成乳状液,再涡旋混合下逐滴加入125μl全氟辛溴烷,超纯水定容至5ml,装入15ml康宁离心管中,迅速上机超声,温度控制在20-30℃,以45%超声强度作用10min,超声启动15s,暂停15s,制得液态氟碳核心模板纳米乳剂,所获得的液态氟碳核心模板纳米乳剂取1ml超纯水稀释10倍数后,将适量该溶液用动态光散射法测定其粒径并使用激光粒度仪检测未稀释乳剂的Zeta电位,光学显微镜及透射电镜进行表面形貌和构成物质观察。结果平均粒径为(198.5±4.9)nm,其中300nm以下粒子强度占92.5%,PDI为(0.186±0.012),电位分布曲线图2所示,Zeta电位值为(-47.2±1.8)mV。pH计显示酸碱度值为(6.65±0.32)符合静注乳剂对pH的要求。(2)FITC荧光标记的FA-PEG-CS合成。(3)层层自组装构建完整的靶向造影纳米微泡及物理性质测定。FITC-CS-PEG-FA配制成浓度为5%该物质的醋酸水溶液,1mol/L的NaOH调节pH至6.0,以体积比2:1的比例取PFOB纳米乳剂核心,在磁力搅拌下缓慢滴加入FITC-CS-PEG-FA醋酸水溶液中充分搅拌,37度孵育30min,制得混悬液。将纳米混悬液4度15000rpm高速冷冻离心10min,沉淀超纯水清洗3次,经低频超声在超纯水中分散并经0.45um的滤膜滤过去除较大杂质。将最终合成的靶向纳米超声造影微泡用超纯水稀释一定倍数后经激光粒度仪测定平均粒径及Zeta电位,pH计测定其酸碱度,透射电镜观察表面形貌。所测得的FITC-CS-PEG-FA/PFOB超声纳米微泡粒径,25℃条件下测量所得平均粒径分别为(301.2±6.8)nm,PDI指数显示为(0.235±0.05),且相关数据显示FITC-CS-PEG-FA/PFOB粒径大多分布在105.07-955.4之间,小于500nm的粒子强度占到88.9%,Zeta电位平均值为(40.5±0.8)mV。由于包裹上了一层FA-PEG-CS使得其粒径及电位与PFOB核心模板纳米乳剂有显著的差别。该纳米粒子长时间保存后虽会出现分层,但轻摇后可混匀、大小无明显变化。并通过透射电镜对其进行了进一步观察,粒子外层明显包裹上一层壳聚糖并且粒子呈球形,大小较均一。实施例4,制成叶酸受体介导的靶向超声造影纳米微泡核心模板纳米乳剂。称取0.125g甘油(2.5%(w/v))作为等渗调剂剂和助乳化剂,与乳化剂0.11g精制蛋黄卵磷脂(2.2%,w/v)和0.03g泊洛沙姆188(0.6%,w/v)及稳定剂0.0075g油酸(0.15%,w/v)涡旋混合于4ml超纯水中形成混悬液,将制备的混悬液放置于37℃振荡孵育1h制成乳状液,再涡旋混合下逐滴加入150μl全氟辛溴烷,超纯水定容至5ml,装入15ml康宁离心管中,迅速上机超声,温度控制在20-30℃,以35%超声强度作用10min,超声启动10s,暂停10s,制得液态氟碳核心模板纳米乳剂,所获得的液态氟碳核心模板纳米乳剂取1ml超纯水稀释10倍数后,将适量该溶液用动态光散射法测定其粒径并使用激光粒度仪检测未稀释乳剂的Zeta电位,光学显微镜及透射电镜进行表面形貌和构成物质观察。结果平均粒径为(204.1±3.5)nm,其中300nm以下粒子强度占87.8%,PDI为(0.258±0.013),电位分布,Zeta电位值为(-40.1±3.4)mV。pH计显示酸碱度值为(6.67±0.38)符合静注乳剂对pH的要求。(2)FITC荧光标记的FA-PEG-CS合成(3)层层自组装构建完整的靶向造影纳米微泡及物理性质测定。FITC-CS-PEG-FA配制成浓度为5%该物质的醋酸水溶液,1mol/L的NaOH调节pH至6.0,以体积比2:1的比例取PFOB纳米乳剂核心,在磁力搅拌下缓慢滴加入FITC-CS-PEG-FA醋酸水溶液中充分搅拌,37度孵育30min,制得混悬液。将纳米混悬液4度15000rpm高速冷冻离心10min,沉淀超纯水清洗3次,经低频超声在超纯水中分散并经0.45um的滤膜滤过去除较大杂质。将最终合成的靶向纳米超声造影微泡用超纯水稀释一定倍数后经激光粒度仪测定平均粒径及Zeta电位,pH计测定其酸碱度,透射电镜观察表面形貌。所测得的FITC-CS-PEG-FA/PFOB超声纳米微泡粒径,25℃条件下测量所得平均粒径分别为(323.2±4.6)nm,PDI指数显示为(0.229±0.12),且相关数据显示FITC-CS-PEG-FA/PFOB粒径大多分布在105.07-1281之间,小于500nm的粒子强度占到85.7%,Zeta电位平均值为(47.2±1.5)mV。由于包裹上了一层FA-PEG-CS使得其粒径及电位与PFOB核心模板纳米乳剂有显著的差别。该纳米粒子长时间保存后虽会出现分层,但轻摇后可混匀、大小无明显变化。并通过透射电镜对其进行了进一步观察,粒子外层明显包裹上一层壳聚糖并且粒子呈球形,大小较均一。实施例5,制成叶酸受体介导的靶向超声造影纳米微泡核心模板纳米乳剂。称取0.125g甘油(2.5%(w/v))作为等渗调剂剂和助乳化剂,与乳化剂0.13g精制蛋黄卵磷脂(2.6%,w/v)和0.02g泊洛沙姆188(0.4%,w/v)及稳定剂0.01g油酸(0.2%,w/v)涡旋混合于4ml超纯水中形成混悬液,将制备的混悬液放置于37℃振荡孵育1h制成乳状液,再涡旋混合下逐滴加入75μl全氟辛溴烷,超纯水定容至5ml,装入15ml康宁离心管中,迅速上机超声,温度控制在25℃,以35%超声强度作用5min,超声启动15s,暂停15s,制得液态氟碳核心模板纳米乳剂,所获得的液态氟碳核心模板纳米乳剂取1ml超纯水稀释10倍数后,将适量该溶液用动态光散射法测定其粒径并使用激光粒度仪检测未稀释乳剂的Zeta电位,光学显微镜及透射电镜进行表面形貌和构成物质观察。结果平均粒径为(148.9±6.9)nm,其中300nm以下粒子强度占93.1%,PDI为(0.212±0.012),电位分布,Zeta电位值为(-40.5±3.8)mV。pH计显示酸碱度值为(6.77±0.35)符合静注乳剂对pH的要求。(2)FITC荧光标记的FA-PEG-CS合成。(3)层层自组装构建完整的靶向造影纳米微泡及物理性质测定。FITC-CS-PEG-FA配制成浓度为5%该物质的醋酸水溶液,1mol/L的NaOH调节pH至6.0,以体积比2:1的比例取PFOB纳米乳剂核心,在磁力搅拌下缓慢滴加入FITC-CS-PEG-FA醋酸水溶液中充分搅拌,37度孵育30min,制得混悬液。将纳米混悬液4度15000rpm高速冷冻离心10min,沉淀超纯水清洗3次,经低频超声在超纯水中分散并经0.45um的滤膜滤过去除较大杂质。将最终合成的靶向纳米超声造影微泡用超纯水稀释一定倍数后经激光粒度仪测定平均粒径及Zeta电位,PH计测定其酸碱度,透射电镜观察表面形貌。如图7所示为所测得的FITC-CS-PEG-FA/PFOB超声纳米微泡粒径,25℃条件下测量所得平均粒径分别为(248.6±5.5)nm,PDI指数显示为(0.222±0.08),且相关数据显示FITC-CS-PEG-FA/PFOB粒径大多分布在68.06-955.4之间,小于500nm的粒子强度占到91.6%,Zeta电位平均值为(39.8±1.3)mV。由于包裹上了一层FA-PEG-CS使得其粒径及电位与PFOB核心模板纳米乳剂有显著的差别。该纳米粒子长时间保存后虽会出现分层,但轻摇后可混匀、大小无明显变化。并通过透射电镜对其进行了进一步观察,粒子外层明显包裹上一层壳聚糖并且粒子呈球形,大小较均一。叶酸受体介导的靶向超声造影纳米微泡的体外性质评价。稳定性分析:取制备靶向超声造影纳米微泡(FITC-CS-PEG-FA/PFOB)测定其置备后储存于含5%(w/v)的甘露醇水溶液中4℃冰箱中避光保存,分别取即刻、7天、15天的平均粒径、PDI和pH值的变化,从而确定其长期稳定性,每组重复3次,取平均值。表1稳定性试验结果经单因素方差分析表平均粒径之间存在统计学差异(P<0.05),随后的两两比较T检验证实第1天和第7天之间存在统计学差异,P=0.04(P<0.05),而第7天和第15天之间无显著的统计学差异P=0.088(P>0.05);PDI方面亦经单因素方差分析证实各组间不存在显著的统计学差异(P>0.05)。由此表明在4℃保存时该纳米微泡在一定时间内是可以保持相对稳定的。细胞毒性能力测试:普通1640培养基培养正常人肝细胞系L02,待达到对数生长期后,0.25%的胰蛋白酶消化,细胞计数后培养基调整细胞浓度接种于96孔板,细胞浓度为1x104个/孔,培养箱中孵育24h。用不含叶酸的培养基调整FITC-CS-PEG-FA/PFOB浓度为5.58nmol/L、2.79nmol/L、1.40nmol/L和0.70nmol/L,分别取200ul的上述溶液加入96孔板接种的正常人肝细胞系L02共培养24h,同时用等量普通新鲜培养基为对照,每组设3个复孔。培养24h后去除培养基,用PBS漂洗3次,每孔加入CellTiter96Aqueous20ul和不含叶酸的1640培养基100ul,混合均匀,继续培养1h。1h后上酶标仪设定490nm和630nm波长获得OD值,计算细胞抑制率。图10中MTS结果:正常人肝细胞L02孵育24h后FA-PEG-CS/PFOB纳米微泡浓度在5.58nmol/L的细胞毒性较强细胞存活率仅48.3%,随着微泡浓度的减小毒性也随之减小,当浓度达到2.79nmol/L时细胞毒性较小细胞存活达89.5%,随后微泡浓度减小毒性基本保持不变,各组浓度间比较差异无统计学意义(P>0.05),细胞存活率较高。因此浓度在2.79nmol/L以下叶酸靶向超声纳米微泡对正常肝细胞并无体外毒性作用。溶血能力测定:通过静脉抽取健康捐献者的血液样本4ml,保存于含肝素锂的收集管中。2000g离心5min快速分离出红细胞。将得到的lml红细胞重悬于50ml生理盐水中形成含2%(w/v)红细胞的悬液,取FITC-CS-PEG-FA/PFOB调整浓度至5.58nmol/L、2.79nmol/L、1.40nmol/L和0.70nmol/L。各取0.3ml与2.5ml的红细胞悬液混合加入其中再用生理盐水定容至5ml,分别以生理盐水和超纯水作为阴性(0%)和阳性(100%)对照。37℃孵育3h后,样品2000g离心5min,取100nl上清液加入2ml乙醇/Hcl混合液(39份99%的乙醇(V/V)和1份37%盐酸(W/V))。利用酶标仪设定波长409nm检测血红蛋白的释放量,溶血百分比的计算公式如下:溶血百分比(%)=As-A0/A100-A0x100%。其中As为样本吸光度,A0为阴性对照的吸光度,A100为阳性对照的吸光度。图10溶血实验结果:两种超声造影纳米微泡都随浓度的减小溶血性逐渐减小,当浓度达2.79nmol/L时溶血性都小于10%,当浓度至0.7nmol/L时几乎不产生溶血现象,因此在0.7nmol/L以下两种纳米粒子对于静脉注射生物相容性较好。体外寻靶能力研究:先用不含叶酸的1640培养基培养人肝癌细胞系Bel7402和正常人肝细胞系L02,传代常规培养,调整浓度至5x105/孔接种在6孔板中培养24h,2种细胞各分3组每组设制3个重复组,去除1640培养基,PBS清洗,胰酶消化后,加入无叶酸的1640培养基重悬同时加入液态氟碳超声造影微泡与细胞共培养2h,爬片用PBS冲洗干净,PBS冲洗2-3次,加入500μL无水乙醇/丙酮(1:1)于-20℃固定15min,PBS冲洗后荧光显微镜下观察。以下为分组情况:第一组为空白组,细胞培养板中加入100ulPBS;第二组为FA-PEG-CS/PFOB组,细胞培养板中加入100ul合成的液态氟碳靶向超声造影剂;将上述细胞与对数生长其传代,调整浓度至2x105/孔接种于12孔板中。将细胞分为空白组和FA-PEG-CS/PFOB组,每组设3个复孔,分别加入不含叶酸的1640培养基1ml培养24h。更换不含叶酸的1640培养基,分别加入相关微泡造影剂100nl共培养2h常规消化,1000rpm离心5min,去除上层液体加入500μL无水乙醇/丙酮(1:1)于-20℃固定15min,1000rpm离心5min后加入PBS0.5ml重悬,流式细胞仪检测各组细胞吸收的荧光强度。结果:图11所示肝癌细胞系Bel7402和正常肝细胞系L02在微泡造影剂存在的环境下孵育2小时所得到的荧光图像。光镜下可见靶向造影剂组中Bel7402细胞周围聚集大量液态氟碳纳米粒而正常人肝细胞系L02周围纳米粒较少。如图12所示为流式细胞术测试结果,靶向实验组人肝癌细胞系Bel7402携带荧光的比例为(97.3±1.55)%,而靶向实验组正常人肝细胞系L02携带荧光的比例为(61.57±6.96)%,两种细胞的空白对照组带荧光的比例分别为(0.15±0.05)%和(0.23±0.13)%,上述研究结果表明叶酸靶向纳米粒与叶酸受体高表达的Bel7402肝癌细胞具有较高的特异性结合力。体外超声成像能力研究:将FA-PEG-CS/PFOB浓度分别调整至14.20nmol/L、7.10nmol/L、3.55nmol/L和1.78nmol/L,各取2ml加入乳胶手套中扎实,超纯水作为耦合剂,以生理盐水作为阴性对照,以声诺维作为阳性对照。使用超声诊断仪,设置成浅表器官常规测试模式,收集储存图片。结果:体外超声成像能够间接的预测FA-PEG-CS/PFOB造影微泡在体内成像的效果,从图13中我们的能够直观的看到超声成像测试实验组液态氟碳靶向超声造影纳米粒具有较强的增强效果,与阳性对照组的声诺维相比虽强度有所减弱但有其自身的优势,而比阴性对照的水具有明显的增强,并且随FA-PEG-CS/PFOB造影微泡浓度的增加超声增强信号也随之增加。超声成像完成后光镜下纳米粒仍形态完整,呈球形;经粒度检测粒径变化不明显且电位有所减少。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺