用于巩膜的医学治疗的装置的制作方法
本发明总体涉及用于眼睛的巩膜组织的局部限定和精确治疗的物质施加和辐射系统(SAIS-Spot)。因此,本发明涉及在眼科外科手术过程中,用于对患者进行物质施加(和/或辐射)的医疗装置。具体地,本发明涉及用于巩膜的医学治疗的装置。
背景技术:
前些年,在用于对具有角膜(眼睛前部中的外膜的半透明部分)的浸渍病的患者的治疗的眼科学中,已使用胶原交联(通过施加核黄素和UV-A光辐射)(Wollensak等人,American Journal of Ophthalmology 2003,135:620-627)。在眼睛前部中,物质和光的施加是明显更容易的,因为该部分可直接达到而无需外科手术。
用于渐进性近视的治疗的巩膜的胶原交联(巩膜交联)是新的,并且目前已仅在动物实验中进行测试(Iseli等人,Journal of Refractive Surgery2008,24:752-755;Wollensak等人,Acta Ophthalmologica Scandinavica 2005,83:477-482)。
在此时间点,对于巩膜的病理学变形的治疗,不存在用于眼睛外部(尤其是巩膜的后部区域和赤道区域)的全面治疗的用于物质施加或辐射的系统。一方面,用于渐进性近视的治疗的该治疗方法(通过核黄素和蓝光疗法的巩膜交联)是全新的,并且另一方面,在眼科学中,不存在用于需要物质施加/辐射系统的其他疾病的治疗方法。
在本发明人的实验研究中,感光物质(核黄素)滴入特农氏(Tenon)空间中,并且利用设计为用于在牙科中使用的光施加系统(Bluephase 16i,Ivoclar Vivadent GmbH,Ellwangen-Jagst,德国)进行辐射。为了在我们的领域中使用,本发明人进行几处修改(诸如,用于调节光能的量的某些附件)。利用该辅助系统进行全面且均匀的辐射(尤其对巩膜的后部区域)是不可能的。必须将物质分开地且与辐射交替地施加,并且将遍布整个特农氏空间不均匀地散布。对于人类眼睛手术中的使用,该系统是完全不合适的,尤其因为它不能考虑到解剖(人类眼睛、肌肉和神经末梢、血管解剖等的大小和形状)。
用于物质施加的已知仪器被设计为用于在直接位于巩膜上的纤维结缔组织(巩膜外层,特农氏空间下(sub-Tenon’s space))上进行局部施加。已知专利描述巩膜外层下/特农氏空间下的物质施加(WO 01/28473 A1,US 2010/0114039 A,WO 03/009784 A1),或者它们用于在结膜上进行局部施加(WO 2010/105130 A2)。这些施加针对视网膜的小规模的、相当选择性的治疗;即,眼睛最内部中的巩膜下组织(另外参见图1)。因此,物质必须首先穿透眼睛的外部组织(诸如,巩膜和脉络膜)以达到其目标位置,视网膜。已知系统仅使用向巩膜的外部施加,以避免在视网膜的表面上直接向眼睛施加手术。这些方法仍承担眼睛的术后炎症以及外膜损伤的风险,并且另外不被设计为用于巩膜组织的治疗。因此,这些治疗方法的治疗目的是完全不同的一种。根据本发明的物质施加和辐射系统(SAIS-Spot)直接在特农氏空间(眼睛与眼窝之间的空间;参见图1)中施加至巩膜的待治疗部位。当前要求保护的系统被准确定位在治疗部位所处的位置;即,外部巩膜组织。与已创建的手术方法相比,我们的方法不带来术中和术后的并发症的任何增加的风险。
目前已描述的施加器用于形成或释放用于药品的储藏处(WO 01/28473 A1,US 2010/0114039 A),并且不被设计为在手术治疗期间释放药品/药剂并且随后在手术之后被再次移除。
WO 03/009784 A1建议向特农氏空间下永久植入药品储藏处,因此它在手术结束时将不会被移除。如已经提及的,所有这些施加器利用视网膜作为主要目标组织。本申请针对巩膜的治疗。施加器都不能够充分覆盖巩膜以用于治疗。所有现有施加器必须被理解为局部小规模施加器,它们影响完全不同的目标组织并且具有用于不同疾病的不同治疗方法。此外,所有施加器都不能真正调节物质施加/传递。此外,这些施加器都不能确保物质的不期望扩散,并且都不能确保相邻组织将不会受到治疗的影响。
WO 2012/058382 A2描述了用于向包括体液的部位处的目标组织传递活性剂的装置。该装置包括具有第一外表面的主体,该第一外表面包括具有形成在主体中以用于保留活性剂的局部的、不连续的凹入区域的第一截面。该主体包括以管的形式的表面流动特征,该表面流动特征形成在主体中且相对于外表面凹入。该表面流动特征与第一截面以及局部凹入区域相连接,并且被配置为引导或修改体液相对于主体的流动,使得在体液与局部凹入区域之间提供流体连通。局部凹入区域相对于管的至少一部分凹入。该装置也可以是以具有可侵蚀构件的装置的形式,该可侵蚀构件在规定时间段内释放活性剂。
WO 2006/058189 A2提供具有用于温度测量的热敏电阻、用于流体交换和治疗形式施加的冲洗/吸入端口、用于压力测量的压力计以及用于温度、压力及流速的控制的外部系统的医疗装置。当施加至眼睛和眼眶时,该装置可用在体温过低或体温过高的应用中、眼内压(IOP)控制以及治疗形式的应用中。描述了使用该装置来治疗患如下病的患者、眼睛在术前/术中/术后的治疗以及通过半渗透膜来施加治疗形式的方法:中心视网膜动脉阻塞、前部视神经疾病、脉络膜以及包括黄斑的视网膜的病理、包括玻璃体片段以及前面片段的眼睛的炎症、青光眼、眼睛的前面片段和/或后面片段的炎症和/或感染。
在WO 2008/011125 A2中,描述了用于向眼组织传递药物的装置、系统以及技术。在至少一些实施方式中,末端组件(例如,手术针或导管的开口端)植入眼组织中,并且用于传递一种或多种药物。传递的药物可来自也被植入的源,或者可从外部源引入(例如,经由端口)。可使用固态和液体药物制剂这两种。可替换地,眼部植入物可包括向眼组织释放药物的薄膜涂层。
US 5725493 A公开了玻璃体内药物传递装置以及包括植入装置的方法,通过该植入装置,包括药物或其他药理学药剂的各种有益药品可仅利用单个初始手术在延长时间段内引入至玻璃体腔中以便植入装置。该装置和方法最小化植入所需的手术切口,并且避免未来或重复的侵入性手术或过程。额外量的初始药品可容易引入,或根据需要药品可改变或变化。此外,该装置和方法允许控制传递至玻璃体腔的剂量,并且该装置被构造为过滤传递至腔体的药品,并且还在植入期间或使用期间避免对眼睛的其他部分的损害或干扰。
WO 02/074196 A1描述了用于以控制且持续的方式向眼睛传递治疗药剂的眼部植入器件。示出并描述了双模式和单模式药物传递设备。描述了适于结膜下放置的植入物。还描述了适于玻璃体内放置的植入物。本发明还包括与本文呈现的唯一眼部植入器件相关联的制造和实现技术。
US 2012/0209051描述了用于向巩膜传递核黄素(R/F)和UVA照射的传递系统和方法。R/F被传递并且随后通过LED或光纤以及用于LED的分离冷却物质通道利用UVA照射激活,由此引起胶原组织的交联。传递系统包括提供与巩膜相符合的表面的可植入结构。该传递系统包括用于向巩膜表面上传递R/F的各种类型的结构。此外,该传递系统包括在巩膜胶原组织中提供R/F的照射的UVA源。
目前的现有技术都未描述向相同施加系统引入分离系统(例如,药剂/物质和电磁波,或不同分离药剂的施加),这对于胶原交联的方法可能是必要的。现有技术都未考虑到对精细调整的局部药品释放或辐射的同时给药的控制。在这些施加器中,也未提供用于多余物质/药剂的抽吸系统。
目前,不存在适于在巩膜上使用的利用根据本发明的新的治疗方法的施加系统。现有物质施加器被设计为用于在治疗所针对的组织不是巩膜而是基础组织(主要地,眼睛内部中的视网膜)的情况下的物质的局部施加。目前要求保护的施加器可全面地且以控制的方式向巩膜的所有部分施加物质、电磁波(诸如光或热),这在目前是不可能的。
目前已用在动物实验中的系统的缺点是有限空间中的辐射单元的尺寸,这导致对眼睛的严重或危险操纵。利用该辅助系统,也进行巩膜的后部的全面且均匀的辐射是不可能的。此外,辐射系统仅以某一预定时间间隔辐射。不可能自由控制辐射能级。由于我们采用的辐射源中的光功率设置只是50%或100%,所以必须开发使能够使用分等级光功率水平的辅助塑料附件。只可通过将物质滴在组织上来施加物质,这导致物质的不均匀分布。因此,物质也达到不应被处理的组织区域。此外,物质施加器及并行系统(例如,光)不能同时使用。不存在特别形成的抽吸系统。目前,还不能够全面治疗眼睛/巩膜的中间部分和后部。
本发明分别解决来自动物实验的辅助系统以及其他系统和治疗方法的缺陷。这些缺陷是:
-考虑到所治疗的眼睛的解剖,在解剖学上不适于巩膜的全面/综合治疗;
-不同物质的局部或暂时并行施加是不可能的
-物质施加和电磁辐射(例如,光)和/或电力(单极和双极凝固)的暂时和局部结合是不可能的;物质施加与光施加之间的必需交替导致手术/治疗持续时间的相当大的增加
-蛋白质凝固或热量施加是不可能的
-由于物质施加器和光施加器必须周期性交替连接和分离,所以治疗变得不均匀,因为外科医生总是必须重新布置一切;此外,连接和分离承担损害周围组织的增加的风险
-不存在用于多余物质的返回/抽吸系统,未被治疗的组织总是受影响/被共同治疗
-不能保护辐射敏感物质免受辐射,直至辐射到达施加部位/治疗部位(不存在物质供给的屏蔽物)
-在视觉控制(视频系统)下,不能引入已知施加系统
-已知系统不能向巩膜提供高光量
-已知系统不能检测施加器与巩膜之间的接触
目前,不存在适于在巩膜上使用的施加系统或根据本发明的治疗方法。由于巩膜浸渍,所以用于渐进性近视或病理学变化的治疗的治疗方法是全新的。因此,不存在满足该治疗方法或该外科手术的需求的手术设备。用于物质施加或用于区域/组织的辐射的单独技术方法总是被简化以用于其特殊用途,并且不满足我们的治疗方法的需求。需要用于均匀物质施加和/或辐射的全面系统,该全面系统考虑到眼睛的精确解剖结构并且满足治疗或外科手术程序的所有技术需求。
在动物实验中使用的物质施加和辐射单元的缺陷和缺点也将被新的施加系统(SAIS-Spot)消除。
技术实现要素:
在一个方面中,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有第一表面,其中,施加器的第一表面可表面地接触巩膜的区域的表面以便表面地覆盖所述区域;并且
该施加器包括单个光学出口,该单个光学出口连接至从轴的近端向施加器的第一表面处的单个远端光学出口延伸的单个光学引导元件,该光学引导元件被构造为朝向光学出口引导电磁波,其中,光学引导元件被构造为通过蛋白质凝固引导适于巩膜的热治疗的波长的电磁波。
在装置的一个实施方式中,光学出口的远端表面被至少部分着色以适于生成热量。
在装置的一个实施方式中,施加器包括连接至单个光学引导元件的多个单独光学出口。多个光学出口中的至少一个的远端表面可被着色以适于生成热量。
在装置的一个实施方式中,光学出口相对于施加器的第一表面规则、不规则或不同分布,并且优选地,施加器的第一表面事实上被细分为具有光学出口的不同分布的不同区域。光学出口的密度可相对于施加器的第一表面而改变。
在装置的一个实施方式中,施加器具有对称形状,并且光学出口根据施加器的对称性而对称布置。
在装置的一个实施方式中,施加器包括从轴的近端向施加器的表面处的远端通道开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。单个药剂通道可从轴的近端向施加器的第一表面处的至少两个远端通道开口延伸。施加器可进一步包括用于吸走多余药剂的通道。
在装置的一个实施方式中,施加器包括多个药剂通道。每个药剂通道可从轴的近端向施加器的第一表面处的至少两个远端通道开口延伸。在一个实施方式中,一个或多个药剂通道用于施加诸如核黄素的药剂,然而一个或多个剩余通道用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构。表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
在装置的一个实施方式中,施加器进一步包括连接至从轴的近端向施加器的第一表面处的单个远端光学出口延伸的单个光学引导元件的单个光学出口,该光学引导元件被构造为朝向光学出口引导被配置为用于交联(crosslink)巩膜组织的电磁波。该施加器可包括连接至光学引导元件的多个单独光学表面区域。
在装置的一个实施方式中,施加器包括连接至第一光学引导元件的多个单独第一光学表面区域以及连接至第二光学引导元件的多个单独第二光学表面区域,该第一光学引导元件和第二光学引导元件从轴的近端向施加器的第一表面处的相应远端光学表面区域延伸,第一光学引导元件被构造为朝向第一光学表面区域引导电磁波,并且第二引导元件与光敏剂相关联。
在装置的一个实施方式中,施加器进一步包括连接至从轴的近端向施加器的第一表面处的电极延伸的单个电导体元件的单个单极或双极电极。
在装置的一个实施方式中,施加器进一步包括连接至从轴的近端向施加器的第一表面处的电极延伸的多个电导体元件的多个单极或双极电极。该电极可在斑点处提供电气蛋白质凝固。
在一个方面中,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,施加器的第一表面可表面地接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至从相应轴的近端向施加器的第一表面处的单个远端光学出口延伸的单个光学引导元件的单个光学出口,该光学引导元件被构造为朝向光学出口引导电磁波,其中,光学引导元件被构造为通过蛋白质凝固引导适于巩膜的热治疗的波长的电磁波;并且
其中,施加器的轴近侧连接至单个近端轴。
在装置的一个实施方式中,光学出口的远端表面被至少部分着色以适于生成热量。
在装置的一个实施方式中,每个施加器包括连接至单个光学引导元件的多个单独光学出口。光学出口中的至少一个的远端表面可被着色以适于生成热量。光学出口可相对于施加器的第一表面规则、不规则或不同分布,并且优选地,施加器的第一表面事实上被细分为具有光学出口的不同分布的不同区域。光学出口的密度可相对于施加器的第一表面而改变。施加器可具有对称形状,并且光学出口根据施加器的对称性而对称布置。
在装置的一个实施方式中,每个施加器包括从轴的近端向施加器的表面处的远端通道开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。单个药剂通道可从轴的近端向施加器的第一表面处的至少两个远端通道开口延伸。每个施加器可进一步包括用于吸走多余药剂的通道。每个施加器可包括多个药剂通道。每个药剂通道可从轴的近端向施加器的第一表面处的至少两个远端通道开口延伸。
在装置的一个实施方式中,一个或多个药剂通道用于施加诸如核黄素的药剂,然而一个或多个剩余通道用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,每个施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构。表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
每个施加器可进一步包括连接至从轴的近端向施加器的第一表面处的单个远端光学出口延伸的单个光学引导元件的单个光学出口,该光学引导元件被构造为朝向光学出口引导被配置为用于交联巩膜组织的电磁波。每个施加器可包括连接至光学引导元件的多个单独光学表面区域。
在装置的一个实施方式中,每个施加器包括连接至第一光学引导元件的多个单独第一光学表面区域以及连接至第二光学引导元件的多个单独第二光学表面区域,该第一光学引导元件和第二光学引导元件从轴的近端向施加器的第一表面处的相应远端光学表面区域延伸,第一光学引导元件被构造为朝向第一光学表面区域引导电磁波,并且第二引导元件与光敏剂相关联。
在装置的一个实施方式中,每个施加器进一步包括连接至从轴的近端向施加器的第一表面处的电极延伸的单个电导体元件的单个单极或双极电极。
在装置的一个实施方式中,每个施加器进一步包括连接至从轴的近端向施加器的第一表面处的电极延伸的多个电导体元件的多个单极或双极电极。
在装置的一个实施方式中,电极在斑点处提供电气蛋白质凝固。
在装置的一个实施方式中,该装置进一步包括屏蔽元件,该屏蔽元件的大小和形状被形成为在装置使用过程中至少部分覆盖角膜。
在装置的一个实施方式中,该装置包括形成在施加器的边缘中的一个或多个凹部。一个或多个凹部可定位和形成为使得当施加器位于巩膜的所述区域上时,凹部留出用于眼部肌肉、血管和/或神经的自由空间。
在装置的一个实施方式中,施加器包括由优选地是可消毒和耐热中的至少一种的材料制成,例如,医用钢或塑料的材料制成的基础层,并且优选地,该材料不透光。
在装置的一个实施方式中,施加器包括一个或多个附加层,其中,基础层和一个或多个附加层布置为层叠层,且基础层在施加器的外侧上以支撑附加层,并且其中,优选地,一个或多个附加层中的每一个由塑料或金属材料制成,更优选地,光扩散、遮光和/或海绵状材料。附加层中的至少一个可以是适于扩散电磁波的扩散器,并且其中,远端开口的至少一部分布置在作为扩散器的附加层(多个附加层)内或附加层的外侧处。
在一个方面中,本发明提供治疗受试者的巩膜的方法,该方法包括如下步骤:
(i)将前述实施方式中任一项的装置的施加器放入受试者眼睛中的特农氏空间中,使得施加器的第一表面与巩膜的区域的表面表面地接触,
(ii)通过蛋白质凝固向受试者的巩膜施加适于巩膜的热治疗的波长的电磁辐射。
该方法可包括向巩膜施加用于交联的核黄素的步骤。
该方法可包括在斑点处施加电气蛋白质凝固。
本发明的一方面涉及用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有表面,其中,施加器的表面可表面地接触巩膜的区域的表面以便表面地覆盖所述区域;并且
该施加器和轴包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
在装置的一个实施方式中,药剂通道的单个开口提供用于巩膜的治疗的局部斑点。
在装置的一个实施方式中,药剂通道针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
施加器可进一步包括可用于吸走多余药剂的通道。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
施加器具有表面,其中,施加器的表面可表面地接触巩膜的区域的表面以便表面覆盖所述区域;并且
该施加器包括连接至从轴的近端向施加器的表面处的单个远端光学表面区域延伸的两个引导元件的单个光学表面区域,一个光学引导元件被构造为用于朝向光学表面元件引导电磁波,并且另一个引导元件与光敏剂相关联。
单个远端光学表面区域可被至少部分着色以适于生成热量。由于只有部分或半透明着色,所以不被着色吸收而是穿过着色的光可用于交联。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的单个单极电极,或者连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的双极电极。这可在斑点处提供电气蛋白质凝固。
施加器可进一步包括可用于吸走多余药剂的通道。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
施加器具有第一表面,其中,施加器的第一表面可表面地接触巩膜的区域的表面以便表面地覆盖所述区域;并且
该施加器包括连接至从轴的近端向施加器的第一表面处的单个远端光学出口延伸的单个光学引导元件的单个光学出口,该光学引导元件被构造为朝向光学出口引导电磁波。
优选地,光学引导元件被构造为引导适于巩膜的热治疗的波长的电磁波。
光学出口的远端表面可被至少部分着色以适于生成热量,即,以通过颜色吸收的波长生成热量的方式,并且利用投射光(transmitting light),交联是可能的。
该实施方式的施加器可包括从轴的近端向施加器的表面处的远端通道开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
施加器可进一步包括可用于吸走多余药剂的通道。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有表面,其中,施加器的表面可表面地接触巩膜的区域的表面以便表面地覆盖所述区域;并且
施加器包括连接至从轴的近端向施加器的第一表面处的单个远端电极延伸的电导体元件的单个单极电极,或者连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的双极电极。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个平坦施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有表面,其中,该施加器的表面可表面地接触巩膜的区域的表面以便表面地覆盖所述区域;并且
施加器包括从轴的近端向施加器的第一表面处的至少两个远端通道开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
药剂通道可针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
施加器可进一步包括可用于吸走多余药剂的通道。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有第一表面,其中,该施加器的第一表面可表面地接触巩膜的区域的表面以便表面覆盖所述区域;并且
施加器包括连接至第一光学引导元件的第一光学表面区域以及连接至第二光学引导元件的第二光学表面区域,该第一光学引导元件和第二光学引导元件从轴的近端向施加器的第一表面处的相应远端光学表面区域延伸,第一光学引导元件被构造为朝向光学表面区域引导电磁波,并且第二引导元件与光敏剂相关联。
第一光学表面区域可被至少部分着色以适于生成热量。由于只有部分着色,所以未被着色吸收而是穿过着色的光可用于交联。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的单个单极电极,或者连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的双极电极。这可通过交联在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面地接触巩膜的区域的表面以便表面覆盖所述区域;并且
施加器包括连接至第一光学引导元件的多个单独第一光学表面区域以及连接至第二光学引导元件的多个单独第二光学表面区域,该第一光学引导元件和第二光学引导元件从轴的近端向施加器的第一表面处的相应远端光学表面区域延伸,第一光学引导元件被构造为朝向第一光学表面区域引导电磁波,并且第二引导元件与光敏剂相关联。
第一光学表面区域中的至少一个的远端表面可被至少部分着色以适于生成热量。由于只有部分或半透明着色,所以未被着色吸收而是穿过着色的光可用于交联。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的电极(多个电极)延伸的单个(或多个)电导体元件的单个或多个单极电极或双极电极(多个电极)。这可在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的第一表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;并且
该施加器包括连接至从轴的近端向施加器的第一表面处的远端光学出口延伸的单个光学引导元件的多个单独光学出口,该光学引导元件被构造为朝向光学出口引导电磁波,其中,光学引导元件被构造为引导适于巩膜的热治疗的波长的电磁波。
光学出口可相对于施加器的第一表面规则、不规则或不同分布,并且施加器的第一表面可事实上被细分为具有光学出口的不同分布的不同区域。
光学出口的密度可相对于施加器的第一表面而改变。
施加器可具有对称形状,并且光学出口根据施加器的对称性而对称布置。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的电极(多个电极)延伸的单个(或多个)电导体元件的单个或多个单极电极或双极电极(多个电极)。这可在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的第一表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面地接触巩膜的区域的表面以便表面覆盖所述区域;并且
该施加器包括连接至从轴的近端向施加器的第一表面处的远端光学出口延伸的单个光学引导元件的多个单独光学出口,该光学引导元件被构造为朝向光学出口引导电磁波,其中,光学出口中的至少一个的远端表面被着色以适于生成热量。
光学出口可相对于施加器的第一表面规则、不规则或不同分布,并且施加器的第一表面可事实上被细分为具有光学出口的不同分布的不同区域。
光学出口的密度可相对于施加器的第一表面而改变。
施加器可具有对称形状,并且优选地,光学出口根据施加器的对称性而对称布置。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的电极(多个电极)延伸的单个(或多个)电导体元件的单个或多个单极电极或双极电极(多个电极)。这可在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的第一表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的单个施加器,其中:
该施加器被构造为放入特农氏空间中;
该施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;并且
施加器包括连接至从轴的近端向施加器的第一表面处的至少两个远端电极延伸的单个电导体元件的至少两个电极。
电极可在斑点处提供电气蛋白质凝固。电极可以是单极电极或双极电极。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,每个施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器和轴包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部;并且
其中,施加器的轴近侧连接至单个近端提供轴。
在装置的一个实施方式中,药剂通道的单个开口提供用于巩膜的治疗的局部斑点(spot)。
在装置的一个实施方式中,药剂通道针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
施加器可进一步包括可用于吸走多余药剂的通道。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,每个施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;并且
每个施加器包括连接至从相应轴的近端向施加器的第一表面处的单个远端光学表面区域延伸的两个引导元件的单个光学表面区域,一个光学引导元件被构造为朝着光学表面元件引导电磁波,并且另一个引导元件与光敏剂相关联;并且
其中,施加器的轴近侧连接至单个近端轴。
单个远端光学表面区域可被至少部分着色以适于生成热量。由于只有部分着色,所以不被着色吸收而是穿过着色的光可用于交联。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的单个远端电极延伸的单个电导体元件的单个单极电极,或者连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的双极电极。这可在斑点处提供电气蛋白质凝固。
施加器可进一步包括可用于吸走多余药剂的通道。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;以及
每个施加器包括连接至从相应轴的近端向施加器的第一表面处的单个远端光学出口延伸的单个光学引导元件的单个光学出口,该光学引导元件被构造为朝向光学出口引导电磁波;并且
其中,施加器的轴近侧连接至单个近端轴。
光学引导元件可被构造为引导适于巩膜的热治疗的波长的电磁波。
光学出口的远端表面可被至少部分着色以适于生成热量,即,以通过颜色吸收的波长生成热量的方式,并且利用投射光,交联是可能的。
该实施方式的施加器可包括从轴的近端向施加器的表面处的远端通道开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
施加器可进一步包括可用于吸走多余药剂的通道。
在装置的一个实施方式中,施加器的表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至从轴的近端向施加器的第一表面处的单个远端电极延伸的电导体元件的单个单极电极,或者连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的双极电极;并且
其中,施加器的轴近侧连接至单个近端轴。
电极可在斑点处提供电气蛋白质凝固。电极可以是单极电极或双极电极。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括从相应轴的近端向施加器的第一表面处的至少两个远端通道开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部;并且
其中,施加器的轴近侧连接至单个近端药剂提供轴。
药剂通道可针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
施加器的第一表面可具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
远端通道出口可相对于施加器的第一表面规则、不规则或不同分布,其中,施加器的第一表面可事实上被细分为具有开口的不同分布的不同区域。
远端通道出口的密度可相对于施加器的第一表面可变。
施加器可具有对称形状,并且优选地,远端通道开口根据施加器的对称性而对称布置。
药剂通道可针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
施加器的第一表面可具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
施加器可进一步包括可用于吸走多余药剂的通道。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至第一光学引导元件的第一光学表面区域以及连接至第二引导元件的第二光学表面区域,第一引导元件和第二引导元件从相应轴的近端向施加器的第一表面处的相应远端光学表面区域延伸,第一光学引导元件被构造为朝着光学表面区域引导电磁波,并且第二引导元件与光敏剂相关联;并且
其中,施加器的轴近侧连接至单个近端轴。
第一远端光学表面区域可被至少部分着色以适于生成热量。由于只有部分着色,所以不被着色吸收而是穿过着色的光可用于交联。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的单个远端电极延伸的单个电导体的单个单极电极,或者连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件的双极电极。这可通过交联在斑点处提供电气蛋白质凝固。
施加器也可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至第一光学引导元件的多个单独第一光学表面区域以及连接至第二引导元件的多个单独第二光学表面区域,第一光学引导元件和第二光学引导元件从相应轴的近端向施加器的第一表面处的相应远端光学表面区域延伸,第一光学引导元件被构造为朝着第一光学表面区域引导电磁波,并且第二引导元件与光敏剂相关联;并且
其中,施加器的轴近侧连接至单个近端轴。
第一光学表面区域中的至少一个的远端表面可被至少部分地着色以适于生成热量。由于只有部分或半透明着色,所以不被着色吸收而是穿过着色的光可用于交联。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的电极(多个电极)延伸的单个(或多个)电导体元件的单个或多个单极电极或双极电极(多个电极)。这可在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的第一表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面,其中,每个施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至从相应轴的近端向施加器的第一表面处的远端光学出口延伸的单个光学引导元件的多个单独光学出口,光学引导元件被构造为朝着光学出口引导电磁波,其中,光学引导元件被构造为引导适于巩膜的热治疗的波长的电磁波;并且
其中,施加器的轴近侧连接至单个近端轴。
光学出口可相对于施加器的第一表面规则、不规则或不同分布,并且施加器的第一表面事实上可被细分为具有光学出口的不同分布的不同区域。
光学出口的密度可相对于施加器的第一表面而改变。
施加器可具有对称形状,并且优选地,光学出口根据施加器的对称性而对称布置。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的电极(多个电极)延伸的单个(或多个)电导体元件的单个或多个单极电极或双极电极(多个电极)。这可通过交联在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的第一表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至从相应轴的近端向施加器的第一表面处的远端光学出口延伸的单个光学引导元件的多个单独光学出口,光学引导元件被构造为朝着光学出口引导电磁波,其中,光学出口中的至少一个的远端表面被着色以适于生成热量;并且
其中,施加器的轴近侧连接至单个近端轴。
光学出口可相对于施加器的第一表面规则、不规则或不同分布,并且施加器的第一表面事实上可被细分为具有光学出口的不同分布的不同区域。
光学出口的密度可相对于施加器的第一表面而改变。
施加器可具有对称形状,并且优选地,光学出口根据施加器的对称性而对称布置。
施加器可进一步包括连接至从轴的近端向施加器的第一表面处的电极(多个电极)延伸的单个(或多个)电导体元件的单个或多个单极电极或双极电极(多个电极)。这可在斑点处提供电气蛋白质凝固。
施加器还可包括从轴的近端向施加器的第一表面处的单个远端开口延伸的单个药剂通道,该药剂通道的近端可连接至药剂提供部。
此外,可提供多个药剂通道。在该优选实施方式中,一个或多个药剂通道可用于施加诸如核黄素的药剂,然而一个或多个剩余通道可用于吸走多余药剂。
在装置的一个实施方式中,药剂通道(多个药剂通道)针对电磁辐射至少部分隔离,优选地,针对具有100nm与2000nm之间的范围中的波长的电磁辐射隔离,并且最优选地,针对具有300nm与800nm之间的范围中的波长的电磁辐射隔离。
在装置的一个实施方式中,施加器的第一表面具有适配为当通过药剂通道引导药剂时,允许改进的药剂分布的结构,并且其中,表面结构可包括斜面或诸如杆、半球体、角锥体或圆锥体的元件。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括各自连接至相应轴的两个、三个、四个或更多个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;
每个施加器包括连接至从相应轴的近端向施加器的第一表面处的至少两个远端电极延伸的单个电导体元件的至少两个电极;并且
其中,施加器的轴近侧连接至单个近端轴。
电极可在斑点处提供电气蛋白质凝固。电极可以是单极电极或双极电极。
根据任意实施方式的本发明的装置可进一步包括屏蔽元件,该屏蔽元件的大小和形状形成为在装置使用过程中至少部分覆盖角膜。
根据任意实施方式的施加器可具有2mm与30mm之间的长度,优选地,5mm与25mm之间的长度,或更优选地,15mm的长度。
根据任意实施方式的施加器可具有2mm与25mm之间的宽度,优选地,5mm与20mm之间的宽度,或更优选地,10mm与15mm之间的宽度。
根据任意实施方式的施加器的厚度可小于或等于5mm,或优选地,小于或等于3mm,并且优选地具有最小2mm的厚度。
根据任意实施方式,一个或多个凹部形成在施加器的边缘中。一个或多个凹部可定位和形成为使得当施加器位于巩膜的所述区域上时,凹部留出用于眼部肌肉、血管和/或神经的自由空间。
根据任意实施方式的施加器可包括优选地由消毒和耐热的材料(例如,医用钢或塑料)中的至少一种制成的基础层,并且优选地,该材料不透光。
在一个实施方式中,施加器的外表面中的至少一个以及施加器的边缘不透光。
在一个实施方式中,施加器包括一个或多个附加层,其中,基础层和一个或多个附加层布置为层叠层,且基础层在施加器的外侧上以支撑附加层,并且其中,优选地,一个或多个附加层中的每一个由塑料或金属材料制成,更优选地,由光扩散、遮光和/或海绵状材料制成。
在一个实施方式中,附加层中的至少一个可以是适于扩散电磁波的扩散器,并且其中,远端开口的至少一部分布置在作为扩散器的附加层(多个附加层)内或附加层的外侧处。
在一个实施方式中,把手布置在施加器的边缘处。把手可连接至单个近端轴且布置为管,并且通道系统中的每一个的第一通道通过把手延伸。
在一个实施方式中,把手与施加器的边缘可连接,并且其中,优选地,把手布置为管,并且药剂通道可通过把手引导。
根据另一方面,本发明提供用于巩膜的医学治疗的装置,该装置包括连接至轴的至少一个施加器,其中:
每个施加器被构造为放入特农氏空间中;
每个施加器具有第一表面和相对的第二表面,其中,施加器的第一表面可表面接触巩膜的区域的表面以便表面覆盖所述区域;并且
每个施加器和轴包括:
药剂通道,该药剂通道从轴的近端向施加器的第一表面处的单个远端开口延伸,该药剂通道的近端可连接至药剂提供部;
光学表面区域,该光学表面区域连接至从轴的近端向施加器的第一表面处的远端光学表面区域延伸的光学引导元件,该光学引导元件被构造为朝向光学表面元件引导电磁波,以及
双极电极,该双极电极连接至从轴的近端向施加器的第一表面处的远端电极延伸的电导体元件。
在所有实施方式中,装置可进一步包括一个或多个传感器(多个传感器)或测量系统(多个测量系统),诸如温度传感器(具体地,对于使用光和电气凝固的实施方式)和/或照相机系统(例如,对于施加器(多个施加器)的内窥镜、微创移动)和/或生物力学传感器(例如,用于检测施加器是否接触巩膜),优选地,压力传感器和/或pH计。
在所有描述的实施方式中,装置可包括施加器的圆周处的突起或轮缘。
根据另一方面,本发明提供治疗受试者的巩膜的方法,该方法包括如下步骤:
(i)将实施方式中的任一个的装置的施加器放入受试者眼睛中的特农氏空间中,使得施加器的第一表面与巩膜的区域的表面表面地接触,
(ii)向受试者的巩膜施加药剂。
根据另一方面,本发明提供治疗受试者的巩膜的方法,该方法包括如下步骤:
(i)将实施方式中的任一个的装置的施加器放入受试者眼睛中的特农氏空间中,使得施加器的第一表面与巩膜的区域的表面表面地接触,
(ii)向受试者的巩膜施加电磁辐射。
在一个实施方式中,该方法用于治疗眼镜的病理学变化或疾病。
根据本发明的装置:
-可适配至眼睛的解剖(anatomy)和大小
-使能够进行巩膜组织(以及后部巩膜)的全面治疗
-使能够进行不同系统的暂时和局部控制使用(例如,物质施加及抽吸、辐射、视觉控制)
-由于系统的内部和外部上的表面修改,物质的均匀、全面分布是可能的(使用套管时,是不可能的)
-能够结合不同治疗(例如,互连、凝固和交联)。
物质施加和辐射系统使能够进行用于巩膜胶原交联和/或胶原凝固的外部巩膜(眼睛的白色组织)的全面和/或局部限定治疗。通过向巩膜施加特殊化学物质和/或不同波长的光,能够交联胶原分子并且因此改变组织的生物力学特性。因此,可治疗眼睛的某些病理学变化和疾病(例如,渐进性近视、巩膜炎、组织浸渍炎症、青光眼、屈光不正、老花眼)。这些病理学变化最小化巩膜的生物力学稳定性,并且导致眼球的异常膨胀,并且由此导致严重的视觉缺陷或失明。另一方面,看起来可行的是,单独照射或另一单独治疗可能影响巩膜组织的生物力学特性以治疗不同眼部疾病;例如,互补以增加用于渐进性近视防止的巩膜硬度,可行的是,通过单独蓝光施加来降低巩膜组织硬度以治疗和/或避免青光眼发展。
此外,根据本发明的物质施加和辐射系统(SAIS-Spot)使能够进行用于渐进性近视、巩膜的病理学变化或可由不同原因(例如,炎症、局部感染、巩膜炎)造成的其他生物力学浸渍症状的治疗的巩膜交联的外部巩膜(眼睛的白色组织)的全面治疗。由于眼睛的复杂解剖,对眼睛的这些特殊疾病的治疗方法是新的,并且需要利用适配形状和某些技术特征的手术施加系统。
另一方面,看起来可行的是,单独照射或另一单独治疗可影响巩膜组织的生物力学特性以治疗不同眼部疾病;例如,互补以提高用于渐进性近视防止的巩膜硬度,可行的是,通过单独蓝光施加来降低巩膜组织硬度以治疗和/或避免青光眼发展。
附图说明
现将相对于以下附图详细描述本发明:
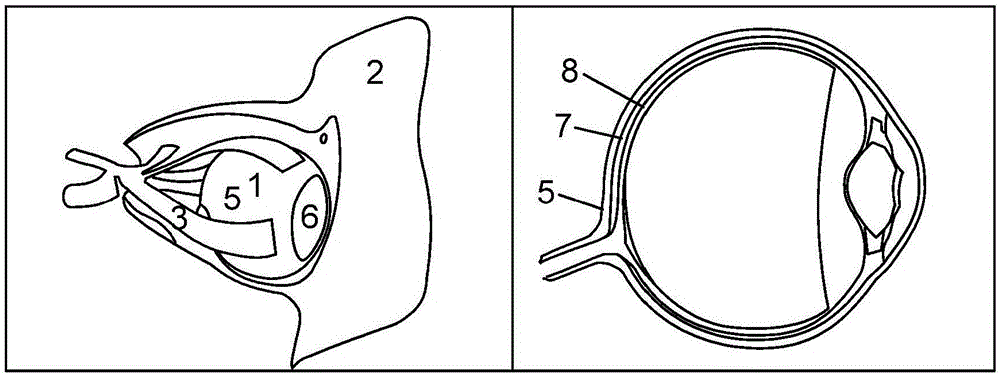
图1示出眼睛的解剖及其附件的详细表示;
图2A-图2D示出根据本发明的第一优选实施方式的装置;
图3A-图3F示出根据本发明的第二优选实施方式的装置;
图4A-图4E示出根据本发明的第三优选实施方式的装置;
图5A-图5D示出根据本发明的第四优选实施方式是装置;
图6A-图6E示出根据本发明的第五优选实施方式的装置;
图7A示出根据本发明的第六优选实施方式的装置;
图7B示出根据本发明的第七优选实施方式的装置;
图7C示出根据本发明的第八优选实施方式的装置;
图8A-图8D示出根据本发明的第九优选实施方式的装置;
图9A-图9C示出根据本发明的装置的进一步实例;
图10示出根据本发明的装置的另一实例;
图11示出来自各种物种的巩膜瓣中的核黄素的完全组织渗透的平均时长。
图12a-图12f表明来自各种物种的有(虚线)和没有(实线)核黄素施加的巩膜组织的频谱光透射特征。
图13示出来自各种物种的有和没有核黄素施加的以450nm的波长的新隔离巩膜组织的光透射特征。
图14A-图14B示出组织学半薄截面(0.5μm厚度、甲苯胺蓝染色)的光学显微镜图像以比较来自各种物种的巩膜组织的尺寸和结构。
图15示出具有(C;左下;以及D;右下)且没有(A和B)交联治疗的急性隔离(A;左上)与冻结/解冻(B-D)巩膜组织的形态学特性的比较的显微照片。
图16示出具有(C和D)且没有(A和B)交联治疗的巩膜组织的急性隔离(A)与冻结/解冻(B-D)的电子微观显微照片。
图17A-图17G示出利用根据本发明的装置可获得的各种治疗图案。
具体实施方式
蛋白质(例如,胶原)交联是在生物技术中创建的方法。蛋白质的交联可由化学交联剂/药剂执行或利用后续辐射通过感光物质(例如,核黄素施加以及UV-A光或蓝光辐射)执行。进一步机制是例如,由于热量的施加的蛋白质凝固。
因此,推测胶原交联会引起改变生物力学特性(固化)的分子的连接。在若干年内,在用于对具有角膜(眼睛前部中的外膜的半透明部分)的浸渍病的患者的治疗的眼科学中,已使用通过施加核黄素和UV-A光辐射的胶原交联(Wollensak等人,American Journal of Ophthalmology 2003,135:620-627)。在眼睛前部中,物质和光的施加是更容易的,因为该部分可直接达到而无需外科手术。然而,那时,不均匀辐射和物质分布的问题未被完全消除。
用于渐进性近视以及其他浸渍病的治疗的巩膜的胶原交联(巩膜交联)是新的,并且目前已仅在动物实验中进行测试(Iseli等人,Journal of Refractive Surgery 2008,24:752-755;Wollensak等人,Acta Ophthalmologica Scandinavica 2005,83:477-482)。动物实验中的所有技术手段具有各种缺陷并且不适于患者使用。
此外,蛋白质和胶原可通过仅施加交联化学物质来交联而无需后续辐射(参见Wong SS、Wong LJ的“化学交联以及蛋白质和酶的稳定化(Chemical crosslinking and the stabilization of proteins and enzymes)”,Enzyme Microb Technol,1992年11月;14(11):866-74)。
利用根据本发明的装置,能够第一时间从外部向局部限定且精确的巩膜的后部和赤道部分全面提供药剂。同时,可使用其他系统。多余药剂被移除。表面的附加修饰分别允许药剂的更好分布以及不被治疗区域中的药剂的更好移除。根据本发明的装置是用于在患者和动物实验中的新的治疗方法的时间节省(短手术时间)施加的前提。根据本发明的装置符合人体工程学地被适配为人类眼睛的解剖。其材料是可灭菌且可再用的,或者可生产作为一次性装置。
本发明考虑到药剂(例如,物质、药品)的局部和暂时控制的释放和回流,并且允许与巩膜的限定区域上的其他物理施加(电磁辐射)相结合。它还允许交联与胶原凝固的结合。此外,本发明考虑到局部和暂时控制电磁辐射的限定功率电平的辐射和施加(即,每一时间和区域的能量)。
眼睛的外部、周围胶原层是巩膜(白色部分)和角膜(半透明部分;图1)。在某些疾病中,眼睛的该组织部分变弱。这可以是相对于生物力学稳定性、对消化的酶抗性或关于其膨胀行为的情况。眼睛(角膜和巩膜)的该弱化可通过交联或胶原凝固而积极影响。为此,在有或没有附加添加剂(例如,电磁辐射,第二药剂)的情况下,药剂(流体)必须被引入至眼睛的相应组织层中以开始化学反应或物理反应。这些反应导致生物力学特性改变以及眼睛的治疗层相对于上述缺点的改进。这种治疗被称为“交联”。
图1示出眼睛的解剖及其附件的详细表示。左边图像示出眼窝(骨头2)中的眼睛1及其肌肉连接3。眼睛1位于围巩膜淋巴液空间(即,特农氏空间)的眼窝中,该空间在角膜缘4与眼睑(此处未示出)之间通常闭合至前部。巩膜5是外眼的白色部分,角膜6是眼睛1的半透明部分。两种组织都由胶原组织形成。右边图像示出眼睛1的内部组织的解剖学层的详细标记。在右边图像中,突出了巩膜5/脉络膜7/视网膜8的组织结构。
在巩膜部分中,眼球由连接至巩膜5的非常薄的黏膜下层——巩膜外层(未分开示出)围绕。
根据本发明的装置使能够进行用于巩膜胶原交联或胶原凝固的外部巩膜的全面治疗。优选地,根据一个实施方式的装置(SAIS-Spot)是平坦的、大型的且勺状的弯曲眼科手术仪器,且具有用于向巩膜或其部分按剂量释放物质/药剂的可变图形形状。
SAIS-Spot的精确图形形状和尺寸起因于眼睛的准确解剖学特征或者甚至单独患者或单独患者的临床和治疗需要。此外,SAIS-Spot的精确图形形状和尺寸起因于所确定的需要被治疗以用于生长抑制的最小区域。因此,SAIS-Spot可具有可变形状,优选地,简单或复杂形式的图形形状或者可甚至是帽罩状且覆盖眼睛的整个巩膜部分。本发明还包括小斑点。
图2A示出本发明的装置的第一示例性实施方式。图2A所示的装置具有单个施加器21,该施加器具有轴22。在使用该装置时,施加器21放置在两个相邻肌肉连接3之间。
图2B示出本发明的装置的变型第一示例性实施方式。图2B所示的装置具有两个施加器21,该两个施加器各自具有轴22。两个轴22合并至近端轴23中。在使用该装置时,每个施加器21放置在两个相邻肌肉连接3之间。
图2C的截面图示出具有由护套26围绕的中心光学引导元件25的圆柱形施加器21。光学引导元件25适于施加例如UV光或蓝光的光。这由黑色箭头指出。此外,提供药剂通道27、28。在该实例中,一个药剂通道(即,药剂通道27)用于施加诸如核黄素的药剂(另外参见指向施加器的远端的灰色箭头),然而另一通道28用于吸走多余药剂(参见近端方向上的灰色箭头)。
图2D的截面图示出具有由护套26围绕的光学引导元件25的平坦施加器21b。光学引导元件25适于施加例如UV光或蓝光的光。这由黑色箭头指出。此外,药剂通道27、28与光学引导通道25并列设置。在该实例中,一个药剂通道27用于施加诸如核黄素的药剂(参见远端方向上的灰色箭头),然而另一通道28用于吸走多余药剂(参见近端方向上的灰色箭头)。
图3A-图3F示出本发明的装置的第二示例性实施方式。示出的装置具有两个小的弯曲的或平面施加器10,每个施加器各自具有轴22。两个轴22合并至近端轴23。在使用该装置时,每个施加器10放置在两个相邻肌肉连接3之间。图3B和图3C还示出施加器10的两个示例性示意性截面图(图3B示出稍微弯曲形状,并且图3C示出平面形状)以及施加器10的三个可替换表面构造。在图3D中,施加器包括允许精确施加光、热量的两个斑点(spot)25,和/或用于向巩膜上施加药剂的两个斑点27、28。可替换地,如图3E所示,四个斑点25被设置为布置在虚拟正方形的拐角处。也示出了用于向巩膜上施加药剂的两个斑点27、28。作为如图3F所示的进一步替换方案,“斑点”25覆盖施加器10的大量区域。这些实例中的施加器的基本外部形状是正方形。
图4A示出本发明的装置的第三示例性实施方式。示出的装置具有两个弯曲施加器20,该两个弯曲施加器各自具有轴22。两个轴22合并至近端轴23中。在使用该装置时,每个施加器20放置在两个相邻肌肉连接3之间。图4B示出施加器20的示意性截面图(示出稍微弯曲的形状)。在图4C-图4E中示出施加器20的三个可替换构造。在图4C中,施加器20包括沿着允许向巩膜上精确施加光、热量和/或药剂的虚拟线布置的四个斑点25。可替换地,如图4D所示,八个斑点25的图案设置为沿着两条平行虚拟线布置。作为图4E中的进一步替换方案,“斑点”25覆盖施加器20的大量区域。在这些实例中,施加器20的基本外部形状是细长椭圆形或具有弯曲拐角的矩形。
图5A示出本发明的装置的第四示例性实施方式。示出的装置具有两个弯曲施加器30,该两个弯曲施加器各自具有轴22。两个轴22合并至近端轴23。在使用该装置时,每个施加器30放置在两个相邻肌肉连接3之间。图5B还示出了施加器30的示意性截面图(示出稍微弯曲的形状)。图5C和图5D示出施加器30的两个可替换构造。在图5C中,施加器30包括沿着允许向巩膜上精确施加光、热量和/或药剂的虚拟线布置的四个斑点25。作为进一步替代方案,图5D中的“斑点”25覆盖施加器30的大量区域(在示出替代方案中,以矩形形式)。在这些实例中,施加器30的基本外部形状是矩形。此处,施加器30在形状上也是细长且狭窄的。
图6示出本发明的装置的第五示例性实施方式。在该实施方式中,施加器适于较大治疗区域。示出的装置具有两个弯曲施加器40,该两个弯曲施加器各自具有轴22。两个轴22合并至近端轴23。在使用该装置时,每个施加器40放置在两个相邻肌肉连接3之间。图6B示出施加器40的示意性截面图(示出稍微弯曲的形状)。图6C至图6E示出施加器40的三个可替换构造。在图6C中,施加器40包括允许向巩膜上精确施加光、热量和/或药剂的三个斑点25。替换地,如图6D所示,六个斑点25设置为沿着两条平行虚拟线布置。作为图6F的进一步替代方案,“斑点”25覆盖施加器40的大量区域。在这些实例中,施加器的基本外部形状是正方形。
图7A示出根据本发明的装置的第六示例性实施方式。该实施方式类似于图4的实施方式,但是具有四个施加器20。在使用该装置时,每个施加器20放置在两个相邻肌肉连接3之间。这允许同时进行对所有区域的治疗。然而,在该实施方式中,能够单独和分开控制每个施加器20。前视图(图7A的右边)示出肌肉连接3之间的四个施加器20的布置。
在图7B中示出进一步变型实施方式。此处,装置另外包括角膜屏蔽29。角膜屏蔽用作至少两个目的:它保护眼睛并且固定施加器20。
在图7C所示的替代方案中,只存在单个施加器21,类似于图2A所示的一个施加器。在该实施方式中,还存在角膜屏蔽29。此处,屏蔽也可用于辅助施加器21的适当定位。
通常,角膜屏蔽可仅是部分角膜屏蔽。
图8示出另一实例。该实例类似于图2所示的实施方式。它示出在光学通道输出83的中心,用于光施加。此外,提供可选照相机(多个照相机)84以及两个温度测量传感器85。此外,两个药剂通道81被设置为用于施加和抽吸核黄素。此外,两个斑点82被设置为用于蛋白质凝固。如图8B所示,用于凝固的光纤82被至少部分着色以适于生成热量。由于只有部分涂层,所以未被涂层吸收而穿过涂层的光可另外用于交联。尽管通道或斑点中的一些成对示出,但是本发明还包括只存在每个通道或斑点中的单独一个。可选地,包括一个或两个通道以及斑点的任意结合。
图8C示出施加器21的示意性侧视图,然而,图8D示出施加器21的底视图,该施加器具有其轴22。
图9示出根据本发明的施加器的第一表面的不同结构。根据图9A,第一表面91是平坦的。图9A的底视图(即,向施加器90a的第一表面91上的视图)示出根据图8的布置为跨越第一表面91的四个元件80。
在图9B的替代方案中,施加器90b是平坦的,且具有突起。图9B的底视图(即,向施加器90b的第一表面91上的视图)示出根据图8的布置为跨越第一表面91的五个元件80。
在图9C的第三替代方案中,施加器90c是平坦的,且具有根据图8的七个突起元件80以及轮缘92。
图10示出包括核黄素药剂提供部102、光和/或热量发出元件80的另一实例。在该实例中,提供扩散器101以用于空中交联。用于热量施加(蛋白质凝固)的元件可造成尖锐尖端以改进施加器的定位和/或增加疤痕诱导过程(更深地透入组织)。
图17示出利用根据本发明的装置/施加器可获得的不同治疗图案。根据图17A至图17C,治疗是以期望模式进行单独斑点的“连续”施加。如图2A或图7C所示的施加器可用于施加这种图案。在图17D至图17F中,一次施加至少两个斑点,即,例如,利用如图3D、图3E、图4C、图4D或图5C所示的多斑点施加器。在图17F中示出利用根据图6C或图6D的施加器获得的图案。它示出用于热凝固的斑点的成对布置。在斑点之间的区域(示出为浅灰色)中,施加规则空中交联。
光纤(还被称为光学波导或玻璃纤维)可以以不同实现方式选择并且必须能够进行不同波长的电磁辐射(UV光至红外光,从大约300nm-1100nm)。随后,SAIS-Spot的某些结构实现方式可被优化以用于电磁辐射的特定波长以及特定光能级。因此,特定光纤材料(例如,额外UV光传导)和特定光纤直径(例如,用于高能级的更大线缆直径)可用于SAIS-Spot。该装置的光纤应能够向装置的内表面上投射1-300mW/cm2的辐射能级。用于SAIS-Spot中的光纤的光由外部可控制且可调节的辐射源(例如,一个LED单元中的不同LED、不同激光或不同灯类型)提供。外部辐射源可控制(i)辐射波长,(ii)辐射能级以及(iii)施加时间(辐射脉冲的长度和顺序)。因此,由控制光纤的外部辐射源保证装置的发光功率的控制(每一时间单位的辐射能级)。此外,利用该外部光源,能够分开控制光纤的特定组,并且因此单独照亮SAIS-Spot内表面的某些区域。因此,能够向SAIS-Spot内的不同区域同时提供不同波长和不同辐射能级。
光纤和/或其端部可以以不同方式布置在SAIS-Spot内部上(扩散器内)。
在该装置内,物质和辐射的供给完全分离(用于通道的光学不透明材料,可能此外,分别地,具有全内反射的反射光纤或普通光纤),使得光敏物质不受影响并且通过辐射在SAIS-Spot内变化。通过外部耦合设备,物质供给和辐射单元也可分开暂时控制。
在打开眼窝与眼球之间的组织连接之后,本发明的装置被引入至特农氏空间中。该装置穿过肌肉放置在巩膜的赤道部分和侧向部分上。因此,在手术期间能够在不必从待治疗部位移除装置的情况下施加物质或辐射(优点:(i)在手术期间节省时间,(ii)物质施加和辐射的均匀或特别选定的分布,(iii)降低由于手术仪器的重复插入和移除而对周围组织造成损害的风险)。
根据本发明的装置也可在扩散器内(SAIS-Spot的内部部分)配备有温度探测器。以与扩散器中的光纤的集成相同的方式,接着发生向记录单元的供给或连接。附加设备可用于确定施加器是否接触巩膜。
SAIS-Spot也可与视频监视系统相结合,其中,内窥镜视觉系统附接至/集成至SAIS-Spot。
在该上下文中,优选地,药剂是化学交联剂或感光物质。例如,感光物质是核黄素。例如,在施加核黄素之后,可施加光辐射或蛋白质凝固剂。
优选地,在本发明的器件和方法的背景下的光辐射是UV-A光辐射(大约315至大约380nm,例如,大约370nm)或“蓝光”辐射(优选地,“蓝光”指的是它具有从大约420至大约480nm的波长,优选地,大约425至大约475nm,更优选地,大约450至大约465nm;优选的波长是大约450nm和大约465nm),具体地,当核黄素用作感光物质时。当光辐射是UV-A光辐射时,在巩膜的表面处,例如,光强度在1至200mW/cm2的范围中,优选地,2至4mW/cm2。当光辐射是“蓝光”辐射时,在巩膜的表面处,光强度可通常高于UV-A辐射,例如,它可在1至350mW/cm2的范围中,优选地,它在10与200mW/cm2之间,更优选地,在20与100mW/cm2之间,并且甚至更优选地,在25与100mW/cm2之间。通常,与连续辐射的施加相比,当使用脉冲光时,可使用更高光强度。在某些实施方式中,带通滤波器可用于创建某些光分布,例如,320至400nm或420至480nm或425至475nm或450至465nm。
在本发明的背景下,眼睛的病理学变化或疾病可例如,选自本文中以上论述的疾病和状况,并且具体地,选自渐进性近视、巩膜炎以及巩膜的病理学变化(诸如,组织浸渍炎症)。
本发明还涉及本文如上描述的用于在治疗眼睛的病理学变化或疾病时所使用的装置。
使用SAIS-Spot装置来用于巩膜交联的示例性过程
外科手术的目的是通过作为光敏剂的核黄素的施加以及照射与蓝光的组合,来交联患者眼睛的巩膜组织中的胶原分子。使用SAIS-Spot装置来施加核黄素和/或光照射(优选地,这两者)。还可使用其他光敏剂以及另一波长的电磁照射。
在目前用于人类眼睛的巩膜交联(SXL)的过程中,在照射开始之前,等渗NaCl溶液中的0.01-20%(优选地,0.5%)的核黄素施加至整个巩膜的表面(或只施加至应被治疗的区域)1秒-40分钟,优选地,60秒至30分钟。在施加之前,可例如,使用装置中的加热容器或加热系统来预热(例如,高达大约35℃)核黄素溶液。还可通过添加葡萄聚糖或另一补充物质来修改核黄素溶液,例如,在其粘度或其组织渗透行为方面修改。核黄素的施加可在照射期间连续/交替重复,或者可替换地,可只在一开始施加。
在人类巩膜组织上,蓝光的照射功率可大约在1至2000mW/cm2之间,优选地,在10与200mW/cm2之间,更优选地,在20与1000mW/cm2之间,并且甚至更优选地,在25与100mW/cm2之间的蓝光功率。在治疗期间,还能够交替或同时施加其他电磁波长度,例如,诸如UV-A的UV光或者两个或多个不同波长的组合。此外,能够施加某一电磁波长度的带宽的光(例如,具有从420至480nm的带宽的蓝光;参见以上)。
在SXL操作期间,巩膜组织可例如,以最优蓝光功率(正如以上讨论的)照射1秒至40分钟,优选地,约20分钟。照射时间间隔可例如是1-30秒,优选地,10-30秒,且具有例如10秒的中断以避免用于巩膜组织的任意种类的局部分布的热应力,或者可以以任意方式连续或搏动。在蓝光照射期间,新鲜核黄素溶液可交替施加,例如,每5分钟以更新使用过的核黄素,并且此外,冷却照射的巩膜组织。它还可连续施加。取决于光功率,其他照射间隔和频率以及延长或缩短照射过程是可行的。相比较其他光源,这是SAIS-Spot装置的关键优势:在整个照射期间,SAIS-Spot的位置不需要改变或缩回以及重新定位,因为核黄素施加能够同时进行。在SXL治疗之后,SAIS-Spot装置的物质施加和吸入通道部分可用于移除过多核黄素,并且利用无菌等渗NaCl溶液冲洗眼眶。
此外,SAIS-Spot装置的该物质施加和吸入通道部分可用于利用各种冲洗溶液来冲洗特农氏空间。这些溶液可包含药理学活性物质或分子以支持或稳定SXL治疗结果。例如,作为对交联治疗的响应,可激活纤维原细胞。纤维原细胞可例如,改变它们的形态、细胞内超微结构和/或新陈代谢,并且可在数量上增加。胶原束和原纤维结构的变化(小尺寸胶原原纤维的增加数量)可被视为改造胶原束结构的标志。这些改造过程可通过纤维原细胞的增殖活动或迁移以及基因和蛋白质表达谱的变化来支持。因此,可能地,基质金属蛋白酶(MMP)将被生产用于胶原和细胞外基质成分的改造过程。TIMP是用于抑制MMP活性的调节蛋白质。因此,可行的是,在SXL治疗之后,施加药理学活性物质以调制MMP和/或TIMP的活性。经由SAIS-Spot装置施加的药理学活性物质也可调制生成基因的胶原的活性或天然出现的胶原交联酶(例如,赖氨酸氧化酶),或者那些物质可调节纤维原细胞和其他血源性细胞的增殖和迁移。
人类患者中的SXL的外科手术
为了执行用于巩膜交联(SXL)的手术,麻醉是强制的。它可能是通过麻醉剂的眼球后或眼球旁注射的任意种类的局部麻醉,或者全身麻醉。利用眼药水的局部施加来进行局部麻醉或者麻醉的完全省略是不推荐的且非常不可能的。优选地,结合肌肉松弛剂的施加来执行全身麻醉。可能需要另外注射眼球后阻滞和/或向眼睛上滴局部麻醉剂。整个外科手术过程(麻醉、术前和术后过程以及SXL)可花费10分钟到3小时。
对水平稳定的患者执行SXL治疗。例如,可通过极度小心地向睫状体和结膜施加聚维酮碘或任意其他消毒溶液来执行消毒。常见的外科纱布用于在眼睛保持易于操作的同时,覆盖患者。
能够在执行手术的同时使用间接检眼镜检查、黄色带通滤波器和/或操作显微镜。
在消毒之后,优选地,眼睑窥器将插入眼睑下方以保持眼睑完全打开。不使用眼睑窥器的操作是可行的但是不优选。在以下步骤过程中,人工泪水将落到眼睛的暴露部分(角膜、巩膜和/或结膜)上。在保持眼睑通过窥器完全打开之后,结膜将被解剖刀或小型剪刀切开,并且结膜将与异色边缘分离。在从小血管流血的情况下,流血将被停止(例如,通过热治疗-烧灼)并且血液将被移除。推荐整个眼睛周围的结膜(即,眼睑/眼睛的上部和下部)的部分或完全切开以及结膜与异色边缘的完全分离。还能够降低切口的尺寸,或者在某些情况下,可能只需要打开结膜的一部分(上部或下部)。这取决于SAIS-Spot装置以及待治疗的巩膜区域的形状和结构。结膜的完全切开使得能够进入眼眶中的特农氏空间。现在,四个直眼部肌肉通过肌肉后面的线的插入而成环形,并且使能够进行眼睛的操纵和定向。在某些情况下,可能不需要操纵眼部肌肉或整个眼睛。这取决于将插入的SAIS-Spot装置的形状、结构和尺寸。SAIS-Spot可仅由一个具有简单形状的相对小的勺状施加器,或者具有适配为眼睛的解剖或必须被治疗的患者和/或病理的需求的复杂形状的两个、三个或四个施加器部分组成。形状还可被适配为待治疗的最小所需区域。施加器的各个部分可同时引入至眼球周围的特农氏空间中,或者治疗可连续执行。这取决于必须被治疗的巩膜区域。同时插入SAIS-Spot施加器的若干部分降低操作时间。SAIS-Spot装置的具体适配形状避免肌肉、较大血管、周围组织以及眼睛神经的不期望交联。能够定制用于待治疗的每个患者的施加器的形状。
在插入SAIS-Spot装置以及将其正确放置在眼球上之后,开始物质施加,并且巩膜将培养有核黄素,例如,至少1秒(正如以上讨论的:各种培养期和不同浓度以及核黄素与其他治疗物质的混合物是可能的)。能够通过加入其他治疗物质来降低培养时间。
在该预培养之后,开始光照射(参见以上)。在照射周期过程中,在某些状况下,核黄素物质交替施加以更新使用过/漂白过的核黄素。使用过的或过多的核黄素可由SAIS-Spot抽吸通道吸出。此外,SAIS-Spot装置的该物质施加和抽吸部分可用于利用各种冲洗溶液来冲洗特农氏空间(参见上面)。在SXL治疗以及利用各种物质的可选冲洗时间段之后,SAIS-Spot施加器/多个施加器可从眼眶缩回。随后,眼睛肌肉周围的线应被移除,并且结膜必须通过缝合进行手术闭合。治疗后的患者眼睛可利用局部抗生素、抗真菌剂和/或类固醇药膏或眼药水来用药治疗。在一些情况下,该医学治疗不是强制性的。眼睛可通过眼罩、眼睛软膏敷裹和/或填塞来封住和屏蔽。在手术之后,患者应持续处于麻醉科医师的监督下,并且应由眼科医师监控。
从包括附图和权利要求的说明书中,其他方面、特征以及优点将是显而易见的。
虽然在附图和以上描述中详细说明和描述了本发明,但是这种说明和描述应被视为说明性或示例性的,而并非限制性的。将理解,在以下权利要求的范围内,本领域普通技术人员可进行变更和修改。具体地,本发明覆盖具有以上和以下描述的不同实施方式的特征的任意组合的进一步实施方式。
此外,在权利要求中,措辞“包括”并不排除其它元件或步骤,并且不定冠词“一(a)”或“一个(an)”并不排除多个。单个单元可履行在权利要求中叙述的几个特征的功能。与属性或值相结合的术语“基本上”、“大致”、“大约”等还特别地分别精确限定该属性或精确地限定该值。权利要求中的任意附图标记不应被解释为限制范围。
实施例
实施例1:兔子实验中的外科手术
为了执行核黄素/蓝光胶原交联,通过盐酸氯胺酮的肌肉内注射对动物进行麻醉(50mg/kg体重;氯胺酮5%,德国通益,乌尔姆,德国)以及盐酸塞拉嗪(10mg/kg体重;龙朋;德国拜耳,勒沃库森,德国)。为了维持麻醉,盐酸氯胺酮(25mg/kg体重)以及盐酸塞拉嗪(5mg/kg体重)注入肌肉内。只有右眼经历治疗,然而对侧的未治疗的眼睛起单独控制的作用。为了避免在手术同时对角膜的损害,用眼睛软膏(格哈德曼公司,柏林,德国)对左眼进行处理。此外,奥布卡因(conjuncain)用于右眼的局部麻醉。在暂时眦切开术之后,在异色边缘处切开结膜以打开特农氏空间。随后,在上部暂时四分体中直接切开特农氏空间。借助于5/0聚丙烯缝线(爱惜康,诺尔斯特,德国)来显示并固定上部眼直肌和暂时眼直肌,以便允许在巩膜治疗过程中巩膜的更好呈现以及眼睛位置的更容易操纵。随后,在暴露巩膜上每五分钟下滴一次核黄素-5'-磷酸盐(PBS中的0.5%的维他命B2,没有任意葡萄聚糖添加剂,斯特里制药,乌茨纳赫,瑞士),以保证核黄素平面渗透至巩膜基质中。在20分钟的浸泡之后,使用商用牙科光源(蓝相16i,Ivoclar Vivadent GmbH,埃尔万根-雅格斯特,德国),利用不同强度(10、25、50、100、200、400以及650mW/cm2)的蓝光(450±25nm)中的一个(匹配核黄素的一个最大吸收(450nm))对暂时巩膜照射20分钟。此处,由于蓝光对角膜和视网膜组织的破坏特性,必须避免对角膜和视网膜的照射。在整个照射周期过程中,每5分钟施加一次核黄素滴,以避免荧光团的过多光致漂白。通过定制聚丙烯隔离套管来实现对所施加的光强度的调节(10mW/cm2,高达400mW/cm2),并且利用功率计与可见光传感器(LaserMate Q,相关公司,圣克拉拉,加利福尼亚,美国)的结合来测量光强度。在没有额外隔离套管的情况下,由光源实现650mW/cm2的光强度。在照射之后,移除缝合线,并且使用可吸收医用缝合线使结缔组织附接至巩膜。最后,利用可吸收医用缝合线重新适配眦切开术。利用眼睛软膏(格哈德曼公司,柏林,德国)进入结膜穹窿以及角膜中来处理双眼以避免感染和干涩。动物被监测直到醒来,并且将动物在莱比锡大学的医学实验研究中心中保持3周。
实施例2:巩膜组织中的核黄素渗透的测量
图11显示来自各种物种的在巩膜瓣中的核黄素的总组织渗透的平均时长。通过向巩膜组织瓣的一侧施加核黄素来计算渗透时间,并且通过荧光显微镜将相对侧上的总外表监测为最大荧光。与核黄素渗透兔子巩膜所花费的10-20分钟相比,核黄素渗透人类巩膜约花费30-40分钟。冻结/解冻巩膜组织用于该检查;然而,结果与新隔离(即,非冻结)组织类似。
图12示出来自各种物种的巩膜组织的频谱光透射率特征。只有约0.5-1%的光(高达500nm波长)穿透所有物种的巩膜组织。核黄素的施加进一步降低在高达530nm的波长处的透射率,这是由核黄素在该波长处的强光吸收所引起的。
图13示出来自各种物种的以450nm的波长的新隔离巩膜组织的光透射率特征。只有约0.5%的光穿透所有物种的巩膜组织。核黄素(“Ribo”)的施加进一步降低在450nm处的透射率,这是由核黄素在该波长处的强光吸收所引起的。
实施例3:不同物种中的巩膜交联的结果
图14:对组织半薄截面(0.5μm厚度,甲苯胺蓝染色)进行光显微镜检查,以比较来自各种物种的巩膜组织的尺寸和结构。A(猕猴)巩膜中的比例尺对于A中的所有巩膜片段都是有效的,并且示出巩膜的后部中的厚度的差异。B以更高放大倍率示出组织截面以反映结构差异。组织(histological)检查显示兔子与人类巩膜之间的大的结构相似性以及与其他物种相比的差异。B(猕猴)巩膜中的比例尺对于B中的所有巩膜片段都是有效的。
图15:具有(C和D)且没有(A和B)交联治疗的急性隔离(A)与冻结/解冻(B-D)巩膜组织的形态学特性的比较。显微照片显示通过光显微镜检查(甲苯胺蓝染色)显现的巩膜组织的组织半薄截面。A:急性隔离未治疗巩膜组织的特征在于,非常紧凑的胶原束布置以及胶原束之间的纤维原细胞(箭头)的纺锤状椭圆体细胞体。B:相比较急性隔离巩膜组织,解冻(之前冻结以用于存储)巩膜组织示出松弛的束结构以及扭曲束(星号)。C:与B中的未治疗解冻组织相比,在利用核黄素以及25mW/cm2进行交联治疗之后,(解冻)巩膜组织的总体结构的显著变化不是显而易见的。纤维原细胞的细胞体出现膨胀(箭头)并且束结构扭曲(星号)。D:在利用核黄素和200mW/cm2的蓝光进行交联治疗之后,束结构进一步松弛并且胶原束出现强扭曲。内部束和内部原纤维空间增加(箭头头部),并且许多胶原原纤维出现分离。D中的比例尺对于A-D都是有效的。
图16:具有(C和D)且没有(A和B)交联治疗的巩膜组织的急性隔离(A)与冻结/解冻(B-D)的电子微观显微照片。A:急性隔离非治疗巩膜组织的特征在于,具有不同方向的非常紧凑的胶原束布置(束的横截面和横切面切向可见)。具有微细胞过程的纤维原细胞(星号)的纺锤状电子密集细胞体位于胶原束之间,并且子蜂窝结构被良好限定且是完整的。B:由于-20℃下的存储,巩膜组织的解冻纤维原细胞(星号)膨胀并且示出中断的蜂窝结构和细胞膜。胶原原纤维看起来完整,并且通常原纤维束仍然组织紧凑。C:在利用核黄素以及25mW/cm2进行交联治疗之后,巩膜纤维原细胞示出与B中所示的未治疗解冻组织类似的中断外观。胶原纤维结构本身表现完整。D:在利用核黄素以及200mW/cm2的蓝光进行交联治疗之后,胶原束结构出现稍微松弛,并且很少的胶原原纤维布置出现中断(箭头头部)。偶尔,内部原纤维空间增加(黑色星号)并且蜂窝结构(白色星号)表现出被破坏。D中的比例尺对于A-D都是有效的。
- 还没有人留言评论。精彩留言会获得点赞!