用于治疗多发性硬化的方法与流程
本发明涉及用于治疗或预防多发性硬化的方法,所述方法包括施用二十二碳六烯酸(DHA)和羟脯氨酸的缀合物。
发明背景
4-羟脯氨酸(4-羟基-2-吡咯烷-羧酸,本文称之为羟脯氨酸)是天然存在的氨基酸。4-羟脯氨酸被认为不是必需氨基酸,并且此外,4-羟脯氨酸的药理活性在本领域中是未知的。
然而,某些包含N-取代的羟脯氨酸衍生物的取代的肽为已知的ACE-抑制物,并且已确立了它们控制高血压的能力(例如卡托普利;赖诺普利;依那普利和莫维普利)。奥沙西罗(一种另外的N-酰基衍生物)具有消炎、抗风湿和伤口愈合活性。用于肠胃外营养的市售输注物偶尔包含脯氨酸作为佐剂(例如,与其他氨基酸、碳水化合物和电解质组合)。
某些ω-3和ω-6脂肪酸被认为是必需脂肪酸,尽管是人类健康所必需的,但它们不能由人体产生。已知其他ω脂肪酸是条件必需的,即,在某些条件下是人体必需的。ω脂肪酸可见于鱼类、海产品和某些植物中。ω脂肪酸也称为多不饱和脂肪酸(PUFA),在脑功能以及正常的生长和发育中发挥关键作用。同时,由于它们可降低心脏病的风险,它们变得受欢迎。研究显示,ω脂肪酸减少炎症,并可有助于降低慢性疾病诸如心脏病、癌症和关节炎的风险。ω脂肪酸在脑中高度集中,并且显示对认知和行为功能是重要的。ω脂肪酸缺乏的症状包括疲劳、记忆力差、皮肤干燥和心脏问题。
多发性硬化(MS)为中枢神经系统(CNS)的慢性疾病,与脱髓鞘和神经退行性变相关。MS表现出炎性自身免疫性紊乱的许多特点(hallmark),包括血脑屏障(BBB)的破坏;淋巴细胞、小胶质细胞和巨噬细胞至病变部位的募集;多种CNS病变的存在。已提出了多种病因,包括自身免疫、致病因子(infectious agent)、环境触发物和遗传因素。然而,存在实质性证据表明,失调的免疫应答(包括针对髓鞘蛋白的免疫机制)在触发疾病发作中起作用。
通常,MS影响CNS中的脑、脊髓和视神经,且不损害(spare)外周神经系统中的神经根和外周神经。MS中炎性和神经退行性过程之间的相互作用通常导致间歇性神经失调(disturbance)(急性恶化事件),随后是障碍(disability)的进行性累积。在MS发作(attack)期间,炎症在称为“斑块(plaque)”的呈块状(patch)的CNS的白质区域中发生。该过程之后是脑和脊髓中的髓鞘的破坏,导致功能减退或损失。
发明概述
在本发明的一个实施方案中,提供了一种用于治疗多发性硬化(MS)或治疗多发性硬化症状的方法,所述方法包括施用根据式MW-001的羟脯氨酸和二十二碳六烯酸(DHA)的缀合物:
在本发明的一些实施方案中,提供了一种用于预防多发性硬化(MS)的突发(outburst)的方法,所述方法包括施用根据式MW-001的羟脯氨酸和二十二碳六烯酸(DHA)的缀合物:
在一些实施方案中,提供了一种用于预防由多发性硬化(MS)引起的持续慢性退化(deterioration)的方法,所述方法包括施用根据式MW-001的羟脯氨酸和二十二碳六烯酸(DHA)的缀合物:
附图简述
本文仅以示例的方式参考附图描述了本发明。现详细具体参考附图,强调的是,所示的细节仅以示例的方式并且仅用于本发明的优选实施方案的说明性讨论的目的,并且为了提供被认为是本发明的原理和概念方面的最有用和容易理解的描述是什么而呈现。就这一点而言,不试图以比对于本发明的基本理解所必需的更详细地显示本发明的结构细节,结合附图的描述使得在实践中如何可具体化本发明的若干形式对本领域技术人员明显。
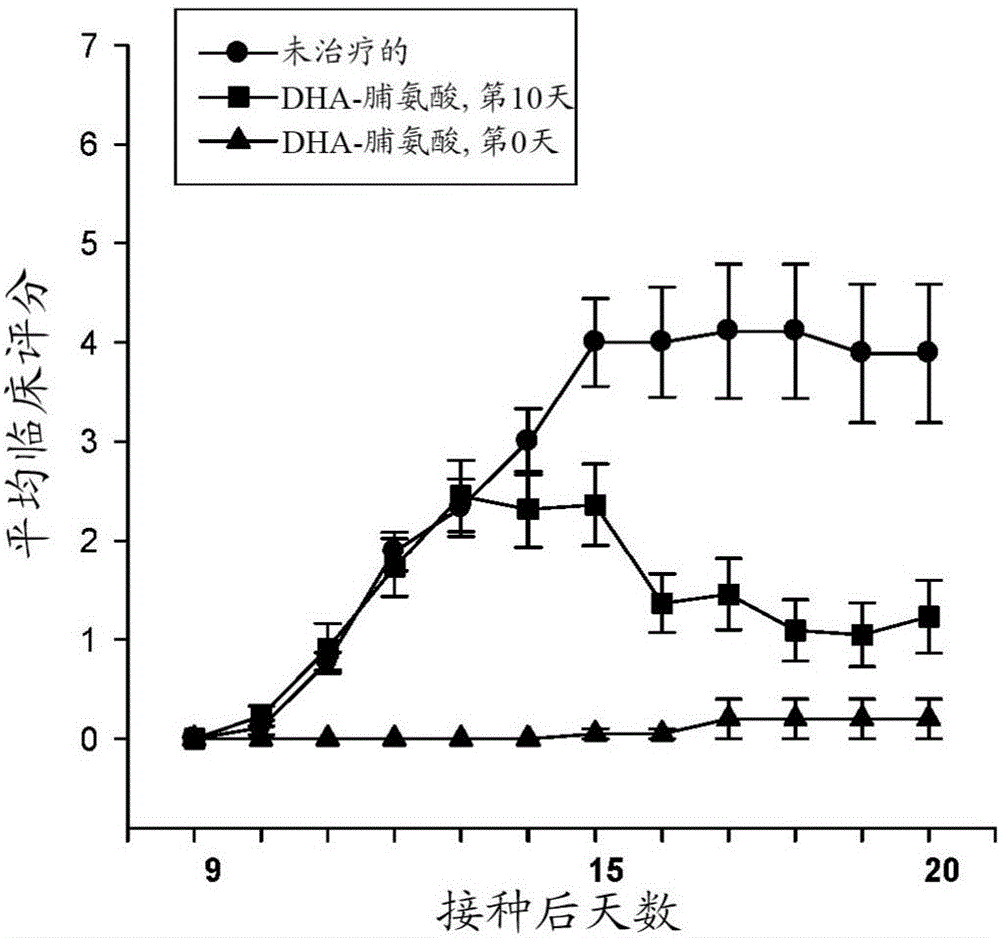
图1为示出了未治疗的EAE小鼠、从第0天起用羟脯氨酸和二十二碳六烯酸(DHA)的缀合物即MW-001(本文还称为MWL-001)治疗的EAE小鼠和从第10天起用同一缀合物治疗的EAE小鼠的平均临床评分的图。
图2为示出了未治疗的EAE小鼠、用MW-001(本文还称为MWL-001)口服治疗的EAE小鼠和用MW-001ip治疗的EAE小鼠的平均临床评分的图。
图3为示出了用MP治疗的EAE小鼠、用MW-001(本文还称为MWL-001)治疗的EAE小鼠和用MW-001+MP(甲基泼尼松龙)治疗的EAE小鼠的平均临床评分的图。
图4为示出了MWL-001对人类淋巴细胞的活化的体外作用的图。
图5(A、B和C)为对照未治疗的EAE动物的用H&E染色的脊髓切片的组织病理学照片。P=实质浸润,M=脑膜浸润,及D=扩散浸润。
图6(A和B)为在第0天用MWL-001(i.p.)治疗的EAE动物的用H&E染色的脊髓切片的组织病理学照片。
图7(A和B)为在第10天用MWL-001(i.p.)治疗的EAE动物的用H&E染色的脊髓切片的组织病理学照片。
具体实施方式
根据本发明的一个实施方案,提供了一种用于治疗或预防多发性硬化(MS)的突发和/或预防由MS引起的持续慢性退化的方法,所述方法包括施用根据式MW-001的羟脯氨酸和二十二碳六烯酸(DHA)的缀合物:
术语“治疗(treatment)”或“治疗(treating)”旨在包括急性症状的治疗、预防急性症状的复发及急性症状的改善。注意,“治疗(treating)”指症状的改善和潜在状况的消退中的一者或两者。在许多实施方案中,化合物或组合物的施用可以不直接作用于疾病状态,而是作用于某些恶性症状,并且该症状的改善导致疾病状态的一般性和期望的改善。
如本文使用的,措辞“多发性硬化”指中枢神经系统(CNS)的炎性脱髓鞘疾病,其典型特征为神经功能障碍的多种症状。可根据本发明的教导治疗任何类型的多发性硬化(MS),包括具有非标准行为的复发缓解型MS、继发进展型MS、原发进展型MS、进展复发型MS和特殊情况的MS(还称为边界形式的MS),诸如例如但不限于视神经脊髓炎(NMO)、巴洛同心圆硬化(Balo concentric sclerosis)、希尔德病(Schilder disease)、马尔堡多发性硬化(Marburg multiple sclerosis)、急性播散性脑脊髓炎(ADEM)和外周神经病变的自身免疫性变体。可在任何阶段治疗疾病,包括但不限于当受试者正在经历急性发作时治疗疾病。根据一些实施方案,可长期治疗疾病以预防爆发和由其引起的损害、在疾病的发作(flare up)期间治疗疾病以用于降低和预防退化或两者。
根据一些实施方案,缀合物在疾病爆发之前被施用。根据一些实施方案,在对常规治疗诸如用类固醇治疗耐受和/或不敏感的患者中治疗疾病。根据一些实施方案,疾病的症状通过如本文详述的缀合物来治疗。
根据一些实施方案,缀合物被口服施用,可能地以片剂、胶囊、粉末、锭剂(troche)、软明胶胶囊、糖浆、液体悬液或锭剂(lozenge)的形式。根据一些实施方案,缀合物以肠胃外制剂的形式,诸如用于皮下、肌内或静脉内施用的形式被施用。根据另外的实施方案,缀合物通过任何合适的经鼻施用、肺部施用、局部地或通过任何合适的皮肤学施用来施用。
根据一些实施方案,缀合物连同任何合适的无毒药物载体一起被施用。载体可以是气体、固体或液体。根据一些实施方案,载体选自盐溶液、水、任何合适的乳液或分散体或其任何组合。
根据一些实施方案,缀合物连同适合用于修饰活性缀合物从制剂释放的任何成分一起被施用。可使用延时剂,诸如肠溶包衣的明胶胶囊。
根据一些实施方案,缀合物可连同任何另外的活性成分一起被施用,所述另外的活性成分诸如但不限于干扰素β1a、干扰素β1b、醋酸格拉替雷(Glatiramer acetate)、米托蒽醌、甲基-泼尼松龙、泼尼松、泼尼松龙、地塞米松、促肾上腺皮质激素(adreno-corticotrophic hormone)(ACTH)、促肾上腺皮质素(corticotrophin)、β干扰素、皮质类固醇、那他珠单抗芬戈莫德(fingolimod)醋酸格拉替雷(glatiramer acetate)米托蒽醌、特立氟胺或其任何合适的组合。
根据一些实施方案,缀合物可以以约1mg/kg至1000mg/kg的量被施用。根据一些实施方案,缀合物可以以约1-10mg/kg的量被施用。根据一些实施方案,缀合物可以以约10-50mg/kg的量被施用。根据一些实施方案,缀合物可以以约50-100mg/kg的量被施用。根据一些实施方案,缀合物可以以约100-200mg/kg的量被施用。根据一些实施方案,缀合物可以以约200-300mg/kg的量被施用。根据一些实施方案,缀合物可以以约300-400mg/kg的量被施用。根据一些实施方案,缀合物可以以约400-500mg/kg的量被施用。根据一些实施方案,缀合物可以以约500-600mg/kg的量被施用。根据一些实施方案,缀合物可以以约600-700mg/kg的量被施用。根据一些实施方案,缀合物可以以约700-800mg/kg的量被施用。根据一些实施方案,缀合物可以以约800-900mg/kg的量被施用。根据一些实施方案,缀合物可以以约900-1000mg/kg的量被施用。
根据一些实施方案,缀合物可以每天一次被施用。根据其他实施方案,缀合物每天两次、每天三次或更多被施用。
根据一些实施方案,缀合物被长期施用。根据一些实施方案,缀合物持续约10天或更长、20天、30天、60天、90天、120天或更长被施用。
如本文定义的,治疗和预防包括完全治愈状况、部分治愈状况使得改善发生以及预防或至少部分地预防状况的发生。
术语“预防(preventing)”指在受试者中避免发生疾病、紊乱或状况。在一些情况下,受试者可能处于发展疾病的风险中,但尚未被诊断为患有该疾病。在一些情况下,术语“预防”指防止下一周期的疾病的发生。
如本文使用的,术语“约”指±10%。
在以下实施例中更详细地描述了本发明的多个方面,这些实施例代表本发明的实施方案,并且决不意味着被解释为限制本发明的范围。
实施例
实施例1
在多发性硬化模型中测试缀合物MW-001的疗效
实验性自身免疫性脑脊髓炎(EAE)的诱导
在雌性C57BI小鼠(6-8周龄;Harlan)中诱导疾病。将髓鞘少突胶质细胞糖蛋白(MOG)35-55溶解于盐水(3mg/ml)中并用完全弗氏佐剂(CFA)(gibco;包含5mg灭活的结核分枝杆菌(MT))乳化(1:1)。将200μl的乳液(包含300μg的MOG)注射到每只小鼠的右胁腹(right flank)中,其中每只小鼠通过腹膜内注射接受250ng百日咳毒素(PT,List)的补充物。24小时后,将另外250ng的PT注射到每只小鼠的右胁腹中。从EAE后第9天每天观察小鼠,并如下表I中描述的对临床征象进行评分:
表I-临床EAE征象的评价
治疗范例
将MW-001缀合物溶解于乙醇(60mg/ml)中并以50mg/kg的剂量(在盐水中的10%储备液)通过腹膜内注射每天两次被施用,一次在上午9点且一次在下午14点。每个剂量以0.2ml/小鼠(~20g)的体积被施用。一组动物在第0天(指疾病的诱导开始的第一天)开始被治疗,且另一组动物在第10天(当临床征象最初出现时)开始被治疗。实验持续一个月。
结果的解释
疾病的发病率的计算:将每组中患病动物的数目相加,并计算每组中患病动物的百分比。
平均最大评分(MMS)的计算:将组中10只小鼠中的每一只的最大评分相加,并且将每组的平均最大评分计算如下:Σ每只小鼠的最大评分/该组中小鼠的数目。
组平均评分(GMS)的计算:将组中10只小鼠中每一只的评分相加,并计算每天的平均评分。将组平均评分计算如下:Σ每天每只小鼠的总评分/组中小鼠的数目。
平均最大评分(MMS):定义为疾病严重程度;以0-5的规格评分,其中对于中间临床征象以0.5的分等级进行评分。将评分在表II中描述。
结果
*9/9(2)-一组9只动物中的9只动物发展为MS,其中两只动物在实验期间死亡。
**1/10-一组10只动物中的1只动物发展为MS。
如图1和以上表II中示出的,经治疗的组呈现了这样的结果:当与未治疗的组相比时在所有测试参数中显示了施用的缀合物的效力。此外,在两个经治疗的组之间的比较显示,在第0天开始的治疗比在第10天开始的治疗更有效。因此,所呈现的结果显示了MW-001缀合物显著地且出人意料地高度有效地预防和改善小鼠中的EAE,这出人意料地教导了,相同的缀合物将有效治疗和/或预防多发性硬化。
实施例2
在脑炎(MS)模型中测试口服MWL-001的疗效
方法
EAE的诱导:在雌性C57BI小鼠(6-8周龄;Harlan)中诱导疾病。将髓鞘少突胶质细胞糖蛋白(MOG 35-55)(Hadassah ein karem)溶解于盐水(3mg/ml)中并用完全弗氏佐剂(CFA)(gibco;包含5mg灭活的MT)乳化(1:1)。将200微升的乳液(包含300mg的MOG)注射到右胁腹,并且每只小鼠i.p.接受250ng百日咳毒素(List)的补充物。24小时后,注射另外250ng的百日咳毒素(PT)。从EAE后第9天起每天观察小鼠,并如下表III中描述的对临床征象进行评分。
表III:EAE临床征象的评价。
治疗范例:
将MWL-001溶解于乙醇(60mg/ml)中,其中在一组中MWL-001被ip施用,且在第二组中MWL-001以50mg/kg的剂量(在盐水中的10%储备液)通过灌胃被口服施用。将MWL-001每天一次(从第0天起)在上午9点施用。治疗在接种后第15天结束。每个剂量以0.2ml/小鼠的体积施用。
将第三组动物以25mg/kg的剂量在第7天开始并在第15天结束进行ip治疗。
将第四组动物用甲基泼尼松龙(MP,10mg/kg)在第7天开始并在第15天结束进行口服治疗。
将第五组动物用MP(10mg/kg)和MWL-001(25mg/kg)一起在第7天开始并在第15天结束进行治疗。
以上五组中的每一组中的动物数目在9和11之间。
结果的解释:
疾病发病率的计算:将每组中患病动物的数目相加,并计算每组中患病动物的百分比。
平均最大评分(MMS)的计算:将组中10只小鼠中的每一只的最大评分相加,并且将每组的平均最大评分计算如下:Σ每只小鼠的最大评分/该组中小鼠的数目。
组平均评分(GMS)的计算:将组中10只小鼠中每一只的评分相加,并计算每天的平均评分。将组平均评分计算如下:Σ每天每只小鼠的总评分/组中小鼠的数目。
结果:
发现每天一次口服或ip给予的50mg/kg的剂量有效抑制疾病的临床征象。在药物停止几天之后,轻微的疾病征象出现持续一段短的时间段,如图2中示出的。
在接种后7天给予的25mg/kg的剂量的MWL-001抑制疾病的严重程度(为3对比对照组中的5),但不抑制在接种后第10-11天的疾病的出现,正如对照未治疗的组。MP的剂量(10mg/kg)未有效抑制疾病,但两种药物的组合与单独的每一种相比更有效,如图3中示出的。
将组织病理学照片示出为图5、6和7。图5A-C示出对照EAE未治疗的动物的脊髓中的大量单核细胞浸润。相比之下,如可观察到的,与未治疗的相比,在第0天以i.p.施用的MWL-001治疗的动物中可观察到非常少的脑膜浸润(图6A和B),参见实施例2中的细节。
此外,在DHA-脯氨酸(MWL-001)治疗的EAE动物中(在第10天开始的i.p.治疗),可观察到非常少的脑膜浸润。此外,不存在实质或扩散浸润(图7A和B)。
MWL-001对人类淋巴细胞的活化的体外作用
进行该实验以阐明MWL-001在多发性硬化(MS)中的作用机制。认为活化的淋巴细胞在发展MS中具有关键作用。
以phicoll-hypaque细胞的梯度(每孔105个)将单核细胞从全血分离,并在滋养培养基(包含抗生素、谷氨酰胺、丙酮酸钠、巯基乙醇和10%FCS的RPMI)中在96孔板(nunclon)中孵育,并在为T细胞的非特异性有丝分裂原的植物凝集素(PHA)的不存在或存在下孵育。将MWL-001溶解于细胞的完全培养基中,并立即添加至细胞中。对照细胞添加了MWL-001的媒介物。
将细胞在37℃的温度下在加湿培养箱中孵育4天。在第3天添加3H-胸苷,并然后收获细胞并在β闪烁计数器中计数。结果示于图4中。
尽管本文已阐述和描述了本发明的某些特征,本领域普通技术人员现在将想到许多修改形式、替换形式、变化形式和等同物。因此,应当理解,所附权利要求旨在涵盖落入本发明的真实精神内的所有此类修改形式和变化形式。
- 还没有人留言评论。精彩留言会获得点赞!