脑膜炎球菌疫苗的制作方法
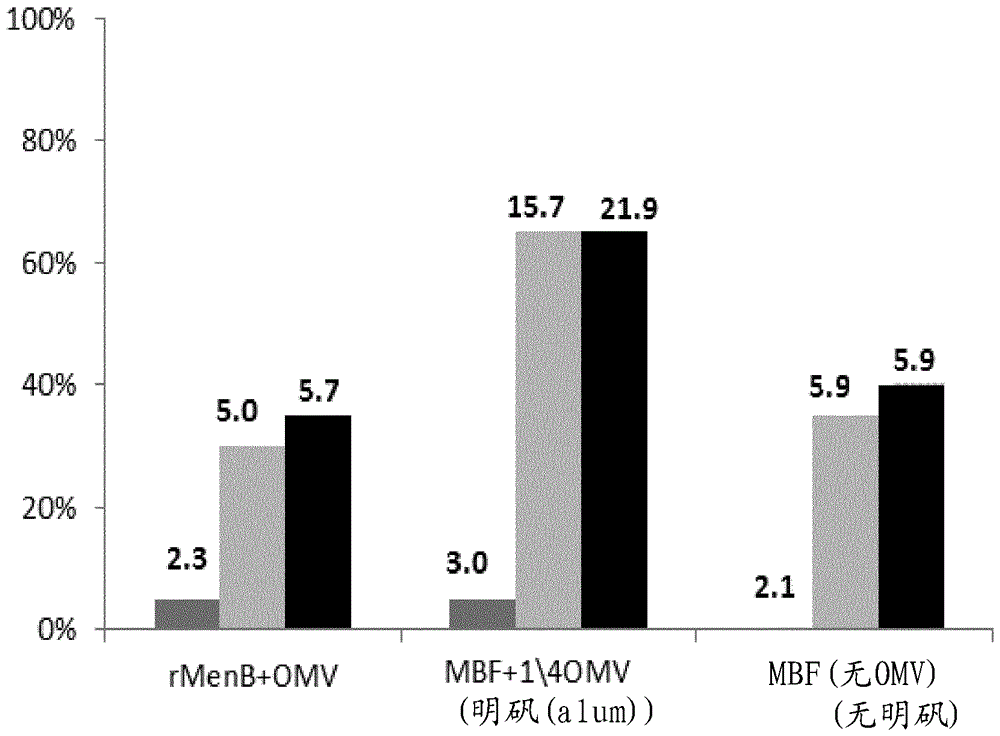
本发明在脑膜炎球菌疫苗接种的领域中。背景脑膜炎奈瑟氏菌(Neisseriameningitidis)是一种革兰阴性荚膜细菌,其定居在大约10%人群的上呼吸道。针对血清群A、C、W135和Y的缀合物疫苗可用,但可用于保护免于血清群B的唯一疫苗通常是在2013年批准的BEXSERO™产品。该产品包括四种主要免疫原性组分:因子H结合蛋白,‘fHbp’;肝素结合蛋白,NHBA;奈瑟氏菌黏附素A,NadA;和外膜囊泡(OMV)。发明概述本发明的一个方面是免疫原性组合物,其包含与以下中的一种或多种组合的包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽:(i)NHBA多肽、(ii)NadA多肽和/或(iii)脑膜炎球菌外膜囊泡。本发明的一个进一步方面是免疫原性组合物,其包含与以下中的一种或多种组合的脑膜炎球菌外膜囊泡:(i)NHBA多肽、(ii)NadA多肽和/或(iii)包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽;其中外膜囊泡(OMV)以5-30μg/ml的浓度存在。具体地,包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽是稳定化的和/或fHbp非结合融合多肽。又更具体地,v1fHbp包含位置R41的突变,例如R41S突变。还更具体地,v2和v3fHbp多肽在根据全长序列(SEQIDNO:1和3)以及根据ΔG序列(SEQIDNO:8和7)编号的以下位置包含一个或多个稳定化和/或因子H(fH)非结合突变:本发明的一个进一步方面是免疫原性组合物,其包含具有式NH2—A-[-X-L]3-B—COOH的氨基酸序列的融合多肽,其中每个X是不同的变体fHbp序列,L是任选的接头氨基酸序列,A是任选的N末端氨基酸序列,且B是任选的C末端氨基酸序列。本发明的一个进一步方面是保护哺乳动物诸如人免于脑膜炎球菌感染的方法,其包括施用根据本发明的免疫原性组合物。附图简述图1显示RCD曲线,其具有y轴上的比例(0.0至1.0)和x轴上的SBA滴度(0至256,以16的步幅(steps))。最上面曲线是组C;最快达到0.0的组是S。图2提供引入v1、v2和v3fHbp多肽以产生731S和731SNB融合蛋白的稳定化且因子H(fH)非结合的突变的示意图。图3(a)-(g)表明包含741-231融合体(SEQIDNO:10)和1/4OMV的组合物与BEXSEROTM相比引发更高的针对七种测试菌株(3a=v2,3b=v2,3c=v3,3d=v3,3e=v2,3f=v2,3g=v3)的GMT。详述为了增强BEXSERO™产品,进一步增强BEXSERO™针对不同脑膜炎球菌菌株的覆盖度(在随着疫苗的使用扩散的潜在转变和突变的情况下)且还减少罕见的发热发生(当该疫苗与常规婴儿疫苗共同施用时有时可见[1])将是有利的。为了这些目的,本发明人以两种方式修饰BEXSERO™:(i)包括fHbp的多个等位基因或变体,以便提供对于该蛋白已知的多样性的更广覆盖度;和(ii)减少每个剂量中的OMV组分的量。如本文中所示,这两个修饰确实导致疫苗的改善。因此,在第一个实施方案中,本发明提供免疫原性组合物,其包含与以下中的一种或多种组合的包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽:(i)NHBA多肽、(ii)NadA多肽和/或(iii)脑膜炎球菌外膜囊泡。此外,在第二个实施方案中,本发明提供免疫原性组合物,其包含与以下中的一种或多种组合的脑膜炎球菌外膜囊泡:(i)NHBA多肽、(ii)NadA多肽和/或(iii)包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽;其中外膜囊泡以5-30μg/ml的浓度存在。类似地,组合这两个实施方案,本发明提供免疫原性组合物,其包含(i)包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽、(ii)NHBA多肽、(iii)NadA多肽和(iv)5-30µg/ml脑膜炎球菌外膜囊泡。因子H结合蛋白(fHbp)本发明的组合物可以包括免疫原性fHbp多肽。BEXSERO™产品包括fHbp多肽,且fHbp也称为'741'(参考文献2中的SEQIDNO:2536;本文中的SEQID1)、'NMB1870'、'GNA1870'[3-5]、'P2086'、'LP2086'或'ORF2086'[6-8]。该蛋白的3D结构是已知的[9,10],且该蛋白具有通过短接头连接的两个β-桶(β-barrels)。许多出版物都报道了该蛋白在脑膜炎球菌疫苗中的保护效力,例如参见参考文献11-15。该蛋白在所有血清群的多种菌株中以脂化形式表达。已将fHbp序列分为三种变体[3](在本文中称为v1、v2和v3),并且已通常发现针对给定变体产生的血清针对表达该变体的菌株是杀细菌的,但其对表达其他两种变体之一的菌株无活性,即存在变体内交叉保护、但不存在变体间交叉保护(除了一些v2和v3交叉反应性)。为了增加变体间交叉反应性,fHbp序列已被工程改造以含有针对所有三种变体的特异性[16]。然而,代替遵循该方法,本发明利用包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽。v1fHbpv1中来自菌株MC58的全长fHbp具有以下氨基酸序列(SEQIDNO:1):成熟脂蛋白缺乏SEQIDNO:1的前19个氨基酸(加下划线;提供SEQIDNO:4,以Cys-20开始)。BEXSERO™产品包括v1fHbp的‘ΔG’形式,其中全长序列被截短最多达残基26(即去除聚甘氨酸区段,并且代替以Val-27开始),得到SEQIDNO:7。本发明所用的v1脑膜炎球菌fHbp将包含(i)与SEQIDNO:7具有至少i%序列同一性和/或(ii)包含SEQIDNO:7的片段的氨基酸序列。i的值可以选自80、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或更高。其优选为90(即,所述氨基酸序列与SEQIDNO:7具有至少90%同一性)且更优选为95。(ii)的片段将通常为至少7个氨基酸长,例如来自SEQIDNO:7的8、10、12、14、16、18、20、22、24、26、28、30、32、24、26、28、40、45、50、55、60、65、70、75、80或更多个连续氨基酸。所述片段将通常包括来自SEQIDNO:7的至少一个表位。对于fHbp确立了表位鉴定和作图[12;17-21]。与SEQIDNO:7共享至少30个连续氨基酸将是典型的,并且通常v1fHbp氨基酸序列将包括来自SEQIDNO:7的几个(例如2、3、4、5个或更多个)片段。总体而言,v1fHbp氨基酸序列可以与SEQIDNO:7具有至少i%序列同一性且包括SEQIDNO:7的几个片段。v1fHbp序列通常包括至少一个不存在于SEQIDNO:2中的氨基酸序列和/或至少一个不存在于SEQIDNO:3中的氨基酸序列。施用于合适宿主哺乳动物(诸如小鼠或人)之后,本发明所用且包括v1序列的多肽可以引发可以识别由SEQIDNO:4组成的野生型脑膜炎球菌多肽的抗体。这些抗体将包括不识别v2或v3多肽(例如,将不识别由SEQIDNO:5组成的野生型脑膜炎球菌多肽和由SEQIDNO:6组成的野生型脑膜炎球菌多肽)的一些抗体,尽管它们还可以包括与v2和/或v3多肽交叉反应的一些抗体。所述抗体理想地针对表达v1fHbp的脑膜炎球菌菌株、例如针对MC58菌株是杀细菌的(参见下文)。v2fHbpv2中来自菌株2996的全长fHbp具有以下氨基酸序列(SEQIDNO:2):成熟脂蛋白缺乏SEQIDNO:2的前19个氨基酸(加下划线;提供了SEQIDNO:5),且SEQIDNO:2的ΔG形式缺乏前26个氨基酸(SEQIDNO:8)。本发明所用的v2脑膜炎球菌fHbp将包含(i)与SEQIDNO:8具有至少j%序列同一性和/或(ii)包含SEQIDNO:8的片段的氨基酸序列。j的值可以选自80、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或更多。其优选为90(即,所述氨基酸序列与SEQIDNO:8具有至少90%同一性)且更优选为95。(ii)的片段将通常为至少7个氨基酸长,例如来自SEQIDNO:8的8、10、12、14、16、18、20、22、24、26、28、30、32、24、26、28、40、45、50、55、60、65、70、75、80或更多个连续氨基酸。所述片段将通常包括来自SEQIDNO:8的至少一个表位。对于fHbp确立了表位鉴定和作图(参见上文)。与SEQIDNO:8共享至少30个连续氨基酸将是典型的,并且通常v2fHbp氨基酸序列将包括来自SEQIDNO:8的几个(例如2、3、4、5个或更多个)片段。总体而言,v2fHbp氨基酸序列可以与SEQIDNO:8具有至少j%序列同一性且包括SEQIDNO:8的几个片段。v2fHbp序列通常包括至少一个不存在于SEQIDNO:1中的氨基酸序列和/或至少一个不存在于SEQIDNO:3中的氨基酸序列。施用于合适宿主哺乳动物(诸如小鼠或人)之后,本发明所用且包括v2序列的多肽可以引发可以识别由SEQIDNO:5组成的野生型脑膜炎球菌多肽的抗体。这些抗体将包括不识别v1或v3多肽(例如,将不识别由SEQIDNO:4组成的野生型脑膜炎球菌多肽和由SEQIDNO:6组成的野生型脑膜炎球菌多肽)的一些抗体,尽管它们还可以包括与v1和/或v3多肽交叉反应的一些抗体。所述抗体理想地针对表达v2fHbp的脑膜炎球菌菌株、例如针对M2091菌株是杀细菌的(参见下文)。v3fHbpv3中来自菌株M1239的全长fHbp具有以下氨基酸序列(SEQIDNO:3):成熟脂蛋白缺乏SEQIDNO:3的前19个氨基酸(加下划线;提供了SEQIDNO:6),且SEQIDNO:3的ΔG形式缺乏前31个氨基酸(SEQIDNO:9)。本发明所用的v3脑膜炎球菌fHbp将包含(i)与SEQIDNO:9具有至少k%序列同一性和/或(ii)包含SEQIDNO:9的片段的氨基酸序列。k的值可以选自80、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或更多。其优选为90(即,所述氨基酸序列与SEQIDNO:9具有至少90%同一性)且更优选为95。(ii)的片段将通常为至少7个氨基酸长,例如来自SEQIDNO:9的8、10、12、14、16、18、20、22、24、26、28、30、32、24、26、28、40、45、50、55、60、65、70、75、80或更多个连续氨基酸。所述片段将通常包括来自SEQIDNO:9的至少一个表位。对于fHbp确立了表位鉴定和作图(参见上文)。与SEQIDNO:9共享至少30个连续氨基酸将是典型的,并且通常v1fHbp氨基酸序列将包括来自SEQIDNO:9的几个(例如2、3、4、5个或更多个)片段。总体而言,v3fHbp氨基酸序列可以与SEQIDNO:9具有至少k%序列同一性且包括SEQIDNO:9的几个片段。v3fHbp序列通常包括至少一个不存在于SEQIDNO:1中的氨基酸序列和/或至少一个不存在于SEQIDNO:2中的氨基酸序列。施用于合适宿主哺乳动物(诸如小鼠或人)之后,本发明所用且包括v3序列的多肽可以引发可以识别由SEQIDNO:6组成的野生型脑膜炎球菌多肽的抗体。这些抗体将包括不识别v1或v2多肽(例如,将不识别由SEQIDNO:4组成的野生型脑膜炎球菌多肽和由SEQIDNO:5组成的野生型脑膜炎球菌多肽)的一些抗体,尽管它们还可以包括与v1和/或v2多肽交叉反应的一些抗体。所述抗体理想地针对表达v3fHbp的脑膜炎球菌菌株、例如针对M01-240355菌株是杀细菌的(参见下文)。融合多肽本发明利用包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽。作为结果,所述融合多肽可以包括来自SEQIDNO:7、8和9中每一个的至少一个表位,并且在施用于宿主哺乳动物后,可以引发可以识别以下中所有三种的抗体:(i)由SEQIDNO:4组成的野生型脑膜炎球菌多肽、(ii)由SEQIDNO:5组成的野生型脑膜炎球菌多肽和(iii)由SEQIDNO:6组成的野生型脑膜炎球菌多肽。这些抗体理想地针对表达v1fHbp的脑膜炎球菌菌株、表达v2fHbp的脑膜炎球菌菌株以及表达v3fHbp的脑膜炎球菌菌株(例如针对MC58、M2091和M01-240355菌株中的每一种)是杀细菌的。参考上文给出的定义,当相关时,对于所述融合多肽,优选i=j=k。通常,本发明的fHbp融合多肽具有下式的氨基酸序列:NH2—A-[-X-L-]3-B—COOH其中每个X是不同的变体fHbp序列,L是任选的接头氨基酸序列,A是任选的N-末端氨基酸序列,且B是任选的C-末端氨基酸序列。三个X部分是如本文所讨论的v1、v2和v3序列。这些可以以从N-末端至C-末端的任何顺序存在,即v1-v2-v3、v1-v3-v2、v2-v1-v3、v2-v3-v1、v3-v1-v2或v3-v2-v1。最优选的顺序是v2-v3-v1。对于[-X-L-]的每种情况,接头氨基酸序列-L-可以存在或不存在。接头氨基酸序列-L-通常是短的(例如20个或更少氨基酸,即19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1个氨基酸)。实例包括促进克隆的短肽序列,聚-甘氨酸接头(即Glyn,其中n=2、3、4、5、6、7、8、9、10或更多(SEQIDNO:42))和组氨酸标签(即Hisn,其中n=3、4、5、6、7、8、9、10或更多(SEQIDNO:43))。其他合适的接头氨基酸序列是本领域技术人员将显而易见的。一种有用的接头是GSGGGG(SEQIDNO:22),其中Gly-Ser二肽从BamHI限制性位点形成,因此有助于克隆和操作。另一种有用的接头是SEQIDNO:23,其可以任选地前置有Gly-Ser二肽(SEQIDNO:24,来自BamHI)或Gly-Lys二肽(SEQIDNO:25,来自HindIII)。-A-是任选的N-末端氨基酸序列。这通常是短的(例如,40个或更少氨基酸,即39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1个氨基酸)。实例包括引导蛋白运输的前导序列。如果X1缺乏其自身的N-末端甲硫氨酸,则-A-可以在翻译的多肽中提供此类甲硫氨酸残基(例如,-A-是单个Met残基)。Met可以在接头序列诸如SEQIDNO:23的N-末端(即SEQID:26),或在短序列的N-末端(例如SEQIDNO:27)。-B-是任选的C-末端氨基酸序列。这通常是短的(例如,40个或更少氨基酸,即39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1个氨基酸)。实例包括指导蛋白运输的序列,有利于克隆或纯化的短肽序列(例如包含组氨酸标签,即Hisn,其中n=3、4、5、6、7、8、9、10或更多(SEQIDNO:43)),或增强多肽稳定性的序列。其他合适的C-末端氨基酸序列是本领域技术人员将显而易见的。一种合适的-B-部分是SEQIDNO:28,其中组氨酸标签上游的Leu-Glu产生自XhoI限制性位点。适用于本发明的一种融合多肽包含SEQIDNO:10。根据上式,在SEQIDNO:10中,-A-是SEQIDNO:26,X1是v2fHbp序列(SEQIDNO:8),-L1-是SEQIDNO:24,X2是v3fHbp序列(SEQIDNO:9),-L2-是SEQIDNO:22,X3是v1fHbp序列(SEQIDNO:7),且L3和B不存在。SEQIDNO:10中的三个fHbp序列如下加下划线:用于本发明的更优选融合多肽包含SEQIDNO:29。根据上式,在SEQIDNO:29中,-A-是SEQIDNO:26,X1是v2fHbp序列(SEQIDNO:8),-L1-是SEQIDNO:22,X2是v3fHbp序列(SEQIDNO:9),-L2-是SEQIDNO:22,X3是v1fHbp序列(SEQIDNO:7),且L3和B不存在。SEQIDNO:29中的三个fHbp序列如下加下划线:因此,本发明理想地利用具有氨基酸序列SEQIDNO:10或SEQIDNO:29的多肽,但本发明还可以使用包含SEQIDNO:10或SEQIDNO:29、但通过最多达10个单一氨基酸改变(即1、2、3、4、5、6、7、8、9或10个单一氨基酸取代、缺失和/或插入)修饰的多肽,条件是所述多肽可以引发可以识别如上所讨论的SEQIDNO:4-6的野生型脑膜炎球菌多肽中的所有三种的抗体。此外,可以修饰SEQIDNO:10或SEQIDNO:29以改变其-A-部分(例如使用SEQIDNO:26的替代物),所以本发明所用的多肽可以包含SEQIDNO:30,其任选地通过最多达10个单一氨基酸改变来修饰(如上所讨论)。例如,可以修饰SEQIDNO:30以引入破坏每个fHbp与fH相互作用的能力的点突变。例如,SEQIDNO:30可以在残基E240、E496和R543处突变,由此得到SEQIDNO:31(包含突变E240X、E496X和R543X,其中X是除了所述氨基酸以外的任何氨基酸,即,E240X是指在残基240处除了E以外的任何氨基酸)。SEQIDNO:31的一个优选实施方案是SEQIDNO:32(其包含突变E240A、E496A、R543S)。本发明可以使用SEQIDNO:31(例如SEQIDNO:32),其任选地通过最多达5个单一氨基酸改变来修饰(如上所讨论),条件是残基E240、E496和R543不存在。此外,可以修饰SEQIDNO:30以引入增加fHbp的稳定性的点突变。例如,SEQIDNO:30可以在残基S32、L123、S285和L379处突变,由此得到SEQIDNO:33(其包含突变S32X、L123X、S285X和L379X)。SEQIDNO:33的一个优选实施方案是SEQIDNO:34(其包含突变S32V、L123R、S285V、L379R)。本发明可以使用SEQIDNO:33(例如SEQIDNO:34),其任选地通过最多达5个单一氨基酸改变来修饰(如上所讨论),条件是残基S32、L123、S285和L379不存在。一种此类多肽是SEQIDNO:35,其中v1序列已经被修饰以包括参考文献22中报道的突变,例如‘R41S’突变(SEQIDNO:36)。SEQIDNO:35包含突变S32X、L123X、S285X、L379X和R543X,且SEQIDNO:36包含突变S32V、L123R、S285V、L379R和R543S。‘R41S’命名法相对于成熟v1多肽(SEQIDNO:4)进行编号,因此,例如,其作为R543X存在于SEQIDNO:35融合多肽中,且作为R543S存在于SEQIDNO:36中。可以组合这些多种方法,因此本发明可以利用包含SEQIDNO:37的多肽(例如,具有氨基酸序列SEQIDNO:38的多肽)。SEQIDNO:37和SEQIDNO:38包含突变S32V、L123R、E240A、S285V、L379R、E496A和R543S。SEQIDNO:38进一步在N-末端包含SEQIDNO:26。在一个进一步实施方案中,本发明可以使用SEQIDNO:39(其包含突变L123X和L379X),例如SEQIDNO:40(其包含突变L123R和L379R)。本发明可以类似地使用SEQIDNO:39(例如SEQIDNO:40),其任选地通过最多达5个单一氨基酸改变来修饰(如上所讨论),条件是残基L123和L379不存在(例如参见SEQIDNO:34,其通过包括如上所示的两个S/V取代而不同于SEQIDNO:40)。一种此类多肽是SEQIDNO:41,其中v1序列已经被修饰以包括‘R41S’突变,因此包含L123R、L379R和R543S。在进一步实施方案中,当此类融合蛋白存在于本发明的组合物中时,OMV可以以2.5µg/ml至12.5µg/ml的浓度存在。相对于特定起始序列定义对于上述突变所示的氨基酸残基。任何其他fHbp序列中的相应氨基酸残基可以通过序列比对容易地鉴定,例如是这样的氨基酸:当使用双序列比对算法(例如,Needleman-Wunsch全局比对算法,如下面详述)比对时,其与本文提及的氨基酸对齐。通常所述氨基酸将是相同的,但如果不是这样,所述比对将容易地鉴定出来。fHbp是脑膜炎奈瑟氏菌的天然脂蛋白。也已经发现其当在大肠杆菌中具有其天然前导序列或具有异源前导序列表达时被脂化。本发明的多肽可具有可被脂化的N-末端半胱氨酸残基,例如,其包含棕榈酰基,通常形成三棕榈酰-S-甘油酰-半胱氨酸。然而,在通常实施方案中,本发明的融合多肽在表达宿主中不被脂化(通常因为N-末端-A-部分并不引导脂化)。奈瑟氏菌肝素结合抗原(NHBA)本发明的组合物可以包括免疫原性NHBA多肽。NHBA抗原作为基因NMB2132包括于脑膜炎球菌血清群B菌株MC58的公开基因组序列[23]中(GenBank登录号GI:7227388;本文为SEQIDNO:11)。从那时起已经公开了来自许多菌株的NHBA抗原的序列。例如,NHBA的等位基因形式可见于参考文献24的图5和15中和参考文献2的实施例13和图21中(其中的SEQID3179至3184)。还已经报道了NHBA抗原的各种免疫原性片段,包括SEQIDNO:12的‘ΔG’片段。用于本发明使用的优选的NHBA抗原包含以下氨基酸序列:(a)与SEQIDNO:12具有60%或更高同一性(例如65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高);和/或(b)包含SEQIDNO:12的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自SEQIDNO:12的表位。在施用于合适的宿主哺乳动物(诸如小鼠或人)之后,本发明的最有用的NHBA抗原可以引发可以结合由氨基酸序列SEQIDNO:13组成的脑膜炎球菌多肽的抗体。在施用于哺乳动物主体之后,用于本发明使用的有利的NHBA抗原可以引发杀细菌性抗脑膜炎球菌抗体。本发明所用的特别优选的NHBA多肽包含SEQIDNO:12,其任选地通过最多达3个单一氨基酸改变(即1、2或3个单一氨基酸取代、缺失和/或插入)来修饰,条件是所述多肽可以引发可以结合SEQIDNO:13的抗体,如上所讨论。如在BEXSERO™产品中所见,NHBA多肽可以有用地作为融合多肽存在,例如融合至NMB1030多肽。在此类融合多肽中,NMB1030优选在NHBA的下游。来自菌株MC58的NMB1030具有GenBank登录号GI:7226269(本文的SEQIDNO:14)。本发明所用的NMB1030序列可以包含以下氨基酸序列:(a)与SEQIDNO:14具有60%或更高同一性(例如65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高);和/或(b)包含SEQIDNO:14的至少‘n’个连续氨基酸的片段,其中‘n’是30或更多。一种有用的NMB1030片段是SEQIDNO:15。一种此类NHBA-NMB1030融合多肽具有氨基酸序列SEQIDNO:16。因此,本发明可以使用SEQIDNO:16,其任选地通过最多达3个单一氨基酸改变(即1、2或3个单一氨基酸取代、缺失和/或插入)来修饰,条件是所述多肽可以引发可以结合SEQIDNO:13的抗体,如上所讨论。奈瑟氏菌黏附素A(NadA)本发明的组合物可以包括免疫原性NadA多肽。NadA抗原作为基因NMB1994包括于脑膜炎球菌血清群B菌株MC58的公开基因组序列[23]中(GenBank登录号GI:7227256;本文为SEQIDNO:17)。从那时起已经公开了来自许多菌株的NadA抗原的序列,并且已经充分记录了该蛋白作为奈瑟氏菌黏附素的活性。也已经报道了NadA的各种免疫原性片段。用于本发明使用的优选的NadA抗原包含以下氨基酸序列:(a)与SEQIDNO:17具有60%或更高同一性(例如65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高);和/或(b)包含SEQIDNO:17的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自SEQIDNO:17的表位。在施用于宿主哺乳动物之后,本发明的最有用的NadA抗原可以引发可以结合至由氨基酸序列SEQIDNO:18组成的脑膜炎球菌多肽的抗体。在施用于宿主哺乳动物之后,用于本发明使用的有利的NadA抗原可以引发杀细菌性抗脑膜炎球菌抗体。本发明所用的特别优选的NadA多肽具有SEQIDNO:19,其任选地通过最多达3个单一氨基酸改变(即1、2或3个单一氨基酸取代、缺失和/或插入)来修饰,条件是所述多肽可以引发可以结合SEQIDNO:18的抗体,如上所讨论。脑膜炎球菌外膜囊泡(OMV)本发明的组合物包括脑膜炎球菌OMV,即通过破坏脑膜炎球菌外膜或从脑膜炎球菌外膜发泡(blebbing)以由其形成保留外膜的蛋白组分(例如PorA、PorB、RmpM、Opa、Opc、Omp85、FetA/FrpB、NspA等)的囊泡而获得的任何蛋白脂质体囊泡,其具有50-200nm范围内的直径。因此,该术语可以包括OMV(有时被称为“小泡(bleb)”)以及被称为微泡(MV[25])或“天然OMV”(“NOMV”[26])的囊泡。还参见参考文献27-33。典型的外膜囊泡从细菌人工制备,并且可使用去污剂处理(例如用脱氧胆酸盐)或通过非去污剂方式(例如参见参考文献37)制备。用于形成OMV的技术包括:用胆汁酸盐去污剂(例如,石胆酸、鹅脱氧胆酸、熊脱氧胆酸、脱氧胆酸、胆酸、熊胆酸等的盐,且脱氧胆酸钠[34和35]优选用于处理奈瑟氏菌)在不沉淀去污剂的足够高pH下处理细菌[36]。其他技术基本上可以在去污剂不存在的情况下[37,38]使用技术诸如超声处理、均质化、微流化、空化、渗透压休克、研磨、弗氏压碎器压碎(Frenchpress)、混合等来进行。不用去污剂或使用低去污剂的方法可以保留有用的抗原,诸如NspA和fHbp[127]。因此,本发明使用的OMV可以使用含有约0.5%或更低、例如约0.2%、约0.1%、<0.05%或甚至零的脱氧胆酸盐的OMV提取缓冲液来制备。被称为MV和NOMV的囊泡是天然存在的膜囊泡,其在细菌生长期间自发形成,且释放至培养基中。可以通过以下获得MV:在肉汤培养基中培养奈瑟氏菌,将肉汤培养基中的全细胞与较小MV分离(例如,通过过滤或通过低速离心以仅沉淀细胞而不沉淀较小囊泡),然后从细胞耗竭的培养基收集MV(例如,通过过滤,通过差速沉淀或MV的聚集,通过高速离心以沉淀MV)。通常可根据培养基中产生的MV的量来选择用于产生MV的菌株,例如,参考文献45和46描述了具有高MV产量的奈瑟氏菌。囊泡可以从已经遗传操作的细菌制备[39-42],例如,以增加免疫原性(例如超表达免疫原)、降低毒性、抑制荚膜多糖合成、下调PorA表达等。它们可以从高发泡菌株(hyperblebbingstrains)制备[43-46]。可使用来自具有不同I类外膜蛋白亚型的细菌的囊泡,例如,使用两种不同的遗传工程改造的囊泡群体(各自展示三种亚型)的六种不同亚型[47,48],或使用三种不同的遗传工程改造的囊泡群体(各自展示三种亚型)的九种不同亚型等。有用的亚型包括:P1.7,16;P1.5-1,2-2;P1.19,15-1;P1.5-2,10;P1.12-1,13;P1.7-2,4;P1.22,14;P1.7-1,1;P1.18-1,3,6。然而,通常,对于本发明优选的是,从野生型脑膜炎球菌菌株制备OMV。因此,本发明所用的囊泡可以从任何野生型脑膜炎球菌菌株制备。所述囊泡通常来自血清群B菌株,但也可能从除了B以外的血清群(例如,参考文献36公开了血清群A的方法)诸如A、C、W135或Y来制备囊泡。所述菌株可以是任何血清型(例如,1、2a、2b、4、14、15、16等)、任何血清亚型(例如,P1.4)和任何免疫型(例如,L1;L2;L3;L3,7;L3,7,9;L10;等)。所述脑膜炎球菌可以来自任何合适的谱系,包括高侵袭性和高毒力谱系,例如以下七种高毒力谱系中的任一种:亚群I;亚群III;亚群IV-1;ET-5复合群(complex);ET-37复合群;A4簇;谱系3。最优选地,从菌株NZ98/254或具有P1.4PorA血清亚型的另一菌株制备OMV。本发明有利地使用BEXSERO™和MENZB™产品中使用的从菌株NZ98/254制备的相同OMV。囊泡将通常包括脑膜炎球菌LOS(也称为LPS),但OMV中的LOS的热原效应比用相同量的纯化的LOS所见的热原效应低得多,并且OMV至氢氧化铝的吸附进一步降低热原性。LOS水平以内毒素的国际单位(IU)表示,并且可以通过LAL测定法(鲎变形细胞溶解物)测试。优选地,LOS以小于2000IU/μgOMV蛋白存在。当LOS存在于囊泡中,可处理囊泡,以便连接其LOS和蛋白组分(“泡内”缀合[49])。用于OMV纯化的一种有用方法描述于参考文献50中,并且涉及对粗制OMV超滤,而非代替高速离心。该方法可以涉及在超滤进行之后的超离心的步骤。OMV也可以使用参考文献51中描述的两阶段大小过滤方法进行纯化。OMV可以在已经制备它们之后有用地悬浮于蔗糖溶液中。组合本发明的组合物可以包括以下中的每种:(a)包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽、(b)NHBA多肽、(c)NadA多肽和(d)OMV。在此类组合中:(a)fHbp融合多肽理想地包含氨基酸序列SEQIDNO:10,但其任选地通过最多达10个单一氨基酸改变来修饰,如上所讨论;(b)NHBA多肽理想地包含氨基酸序列SEQIDNO:12,但其任选地通过最多达3个单一氨基酸改变来修饰,如上所讨论;且(c)NadA多肽理想地包含氨基酸序列SEQIDNO:19,但其任选地通过最多达3个单一氨基酸改变来修饰,如上所讨论。更优选地:(a)fHbp融合多肽具有氨基酸序列SEQIDNO:10;(b)NHBA多肽包含氨基酸序列SEQIDNO:12;且(c)NadA多肽具有氨基酸序列SEQIDNO:19。甚至更优选地:(a)fHbp融合多肽具有氨基酸序列SEQIDNO:10;(b)NHBA多肽具有氨基酸序列SEQIDNO:16;且(c)NadA多肽具有氨基酸序列SEQIDNO:19。本发明的组合物中的多肽可以以导致宿主中的有效免疫应答的任何浓度存在。该给药可以通过常规测试建立,特别是鉴于由BEXSERO™产品提供的指导,所述BEXSERO™产品具有各自以100μg/ml存在的fHbp、NHBA和NadA多肽。因此,fHbp、NHBA和/或NadA多肽可以各自以20μg/ml至400μg/ml、例如50-150µg/ml、80-120µg/ml或约100µg/ml的浓度存在于本发明的组合物中。抗原浓度容易地通过标准蛋白测定法来定量。类似地,本发明的组合物中的OMV可以以导致宿主中的有效免疫应答的任何浓度存在。该给药可以通过常规测试建立,特别是鉴于由BEXSERO™产品提供的指导,在所述BEXSERO™产品中OMV以50µg/ml存在。因此,根据本发明的第一个实施方案,OMV可以以20μg/ml至100μg/ml、例如30-75µg/ml、40-60µg/ml或理想地约50µg/ml的浓度存在于组合物中。然而,在本发明的第二个实施方案中,OMV以较低浓度(即5µg/ml至30µg/ml、例如10µg/ml至15µg/ml或理想地约12.5µg/ml)存在。在某些实施方案中,OMV以2.5µg/ml至12.5µg/ml、例如2.5µg/ml、3.0µg/ml、3.5µg/ml、4.0µg/ml、4.5µg/ml、5.0µg/ml、5.5µg/ml、6.0µg/ml、6.5µg/ml、7.0µg/ml、7.5µg/ml、8.0µg/ml、8.5µg/ml、9.0µg/ml、9.5µg/ml和10µg/ml的较低浓度存在。本发明的组合物中的OMV量和浓度以与BEXSERO™产品中相同的方式、即通过参考其总蛋白含量来定义。这可以使用各种测定法来评价,例如,参考文献29公开了Folin-Lowry测定法的使用。总蛋白可以根据欧洲药典Ph.Eur.测定法2.5.33使用七种药典方法中的任一种测定。方法2提供了Lowry测试,这是优选的。因此,本发明的第二个实施方案的组合物包括具有5-30µg/ml总蛋白的OMV。多肽可通过各种方式,例如通过化学合成(至少部分地),通过使用蛋白酶消化较长多肽,通过从RNA翻译,通过从细胞培养物(例如从重组表达或从脑膜炎奈瑟氏菌培养物)纯化等制备本发明的多肽。大肠杆菌宿主中的异源表达是优选的表达途径。本发明的多肽理想地为至少100个氨基酸长,例如150aa、175aa、200aa、225aa或更长。例如,fHbp融合多肽通常为至少500aa长,NHBA多肽通常为至少400aa长,且NadA多肽通常为至少250aa长。优选制备实质上纯或实质上分离的形式的多肽(即实质上不含其他奈瑟氏菌或宿主细胞多肽)。通常,在非天然存在的环境中提供所述多肽,例如,将其与其天然存在的环境分开。在某些实施方案中,与起始材料相比,所述多肽存在于富含所述多肽的组合物中。因此提供纯化的多肽,其中纯化的意指所述多肽存在于实质上不含其他表达多肽的组合物中,其中实质上不含意指所述组合物的总多肽中的超过50%(例如>75%、>80%、>90%、>95%或>99%)为本发明的多肽。多肽可以采用各种形式(例如,天然的,融合体,非糖基化的,脂化的,二硫键等)。序列诸如SEQIDNO:19不包括N-末端甲硫氨酸。如果通过在生物宿主中翻译来产生本发明的多肽,则需要起始密码子,其在大多数宿主中将提供N-末端甲硫氨酸。因此,本发明的多肽将至少在新生阶段包括位于所述SEQIDNO序列上游的甲硫氨酸残基。在一些实施方案中,本发明的组合物中的多肽可以包括(适当时)fHbp、NHBA或NadA多肽序列的上游的N-末端序列。在一些实施方案中,所述多肽在N-末端具有单一甲硫氨酸,随后紧接着相关免疫原的氨基酸序列;在其他实施方案中,可以使用更长的上游序列。这样的上游序列可以较短(例如,40个或更少氨基酸,即39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1个氨基酸)。实例包括指导蛋白运输的前导序列,或有利于克隆或纯化的短肽序列(例如组氨酸标签,即Hisn,其中n=4、5、6、7、8、9、10或更多(SEQIDNO:44))。本发明的多肽也可以包括fHbp、NHBA或NadA(适当时)氨基酸序列的最后氨基酸下游的氨基酸。这样的C-末端延伸可以较短(例如,40个或更少氨基酸,即39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1个氨基酸)。实例包括指导蛋白运输的序列,有利于克隆或纯化的短肽序列(例如包含组氨酸标签,即Hisn,其中n=4、5、6、7、8、9、10或更多(SEQIDNO:44)),或增强多肽稳定性的序列。其他合适的C-末端氨基酸序列是本领域技术人员将显而易见的。术语“多肽”是指任何长度的氨基酸聚合物。所述聚合物可以是直链或支链的,其可以包含修饰的氨基酸,并且其可以被非氨基酸中断。该术语也涵盖天然或通过干预修饰的氨基酸聚合物;所述干预例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,诸如与标记组分缀合。该定义还包括,例如,含有氨基酸的一个或多个类似物(包括例如,非天然氨基酸等)以及本领域已知的其他修饰的多肽。多肽可以作为单链或缔合链存在。本发明的多肽优选在异源宿主(例如,在大肠杆菌中)重组表达,然后纯化,然后与OMV组合并配制以提供本发明的组合物。在一些实施方案中,多肽包含如上所述的氨基酸序列,除了N-末端处的最多达10个(即1、2、3、4、5、6、7、8、9或10个)氨基酸和/或C-末端处的最多达10个(即1、2、3、4、5、6、7、8、9或10个)氨基酸缺失。杀细菌应答如上所提及,本发明的优选多肽和组合物可以引发针对脑膜炎球菌杀细菌的抗体应答。杀细菌抗体应答在免疫小鼠后方便地测量,并且是疫苗效力的标准指标(例如,参见参考文献52的尾注14;还有参考文献53)。因此,所述抗体在合适的血清杀细菌测定法(SBA)中针对测试菌株是杀细菌的。融合fHbp多肽可以优选地引发针对表达v1fHbp的脑膜炎球菌菌株、表达v2fHbp的脑膜炎球菌菌株以及表达v3fHbp的脑膜炎球菌菌株杀细菌的抗体应答。用于SBA测试的合适v1菌株是MC58,其为广泛可得的(例如ATCCBAA-335),并且是在参考文献23中测序的菌株。用于SBA测试的合适的v2菌株是M2091(ATCC13091)。用于SBA测试的合适的v3菌株是M01-240355,其为已经完全测序(参见EMBLIDCP002422[55])的奈瑟氏菌MLST参考菌株(参考文献54中的id19265)。因此,优选的fHbp融合多肽可以在小鼠中引发抗体,所述抗体在血清杀细菌测定中针对菌株MC58、M2091和M01-240355中的每种是杀细菌的。例如,本发明的组合物可以提供>1:4的血清杀细菌滴度(其使用用人补体的Goldschneider测定[56-58]),和/或提供>1:128的血清杀细菌滴度(其使用幼兔补体)。免疫如上所讨论的多肽可用作免疫原性组合物的活性成分,所以本发明提供了本发明的包含如上所讨论的多肽的免疫原性组合物(例如,疫苗)。本发明还提供在哺乳动物、诸如小鼠或人中产生抗体应答的方法,其包括向哺乳动物施用本发明的免疫原性组合物。所述抗体应答优选为保护性和/或杀细菌抗体应答。本发明还提供了本发明的组合物,其用于此类方法中。本发明还提供了用于保护哺乳动物、诸如小鼠或人免于奈瑟氏菌(例如脑膜炎球菌)感染的方法,其包括向哺乳动物施用本发明的免疫原性组合物。本发明提供本发明的组合物,其用作药物(例如,作为免疫原性组合物或作为疫苗)。在一个实施方案中,其还提供包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽以及以下中的一种或多种:(i)NHBA多肽、(ii)NadA多肽和/或(iii)脑膜炎球菌外膜囊泡在制备用于在哺乳动物中预防奈瑟氏球菌(例如脑膜炎球菌)感染的药物中的用途。在另一个实施方案中,本发明提供脑膜炎球菌外膜囊泡以及以下中的一种或多种:(i)NHBA多肽、(ii)NadA多肽和/或(iii)包含v1、v2和v3脑膜炎球菌fHbp中的所有三种的融合多肽在制备用于预防哺乳动物中的奈瑟氏球菌(例如脑膜炎球菌)感染的药物中的用途,其中所述药物中的外膜囊泡的浓度在5-30µg/ml之间。所述哺乳动物优选是人。所述人可以是成人或优选为儿童。当所述疫苗用于预防性用途时,所述人优选是儿童(例如幼童或婴儿);当疫苗用于治疗用途时,所述人优选是成人。意图用于儿童的疫苗也可施用于成人,例如,以评估安全性、剂量、免疫原性等。所述用途和方法特别可用于预防/治疗疾病,包括但不限于脑膜炎(特别是细菌性脑膜炎,诸如脑膜炎球菌性脑膜炎)和菌血症。例如,它们适合于针对由脑膜炎奈瑟氏菌(例如血清群B中)引起的侵袭性脑膜炎球菌疾病主动免疫个体。治疗性治疗的效力可以通过在施用本发明的组合物之后监测奈瑟氏菌感染来测试。预防性治疗的效力可以通过在施用所述组合物之后监测针对fHbp、NHBA、NadA和PorA(适当时)的免疫应答来测试。本发明的组合物的免疫原性可通过向测试主体(例如,12-16月龄的儿童,或动物模型)施用它们,然后确定标准参数,包括血清杀细菌抗体(SBA)和ELISA滴度(GMT)来确定。通常在施用所述组合物之后约4周确定这些免疫应答,并与施用所述组合物之前测定的值进行比较。至少4倍或8倍的SBA增加是优选的。当施用多于一个剂量的组合物时,可以进行多于一次施用后确定。本发明的优选组合物可以在患者中赋予抗体滴度,所述抗体滴度优于各抗原组分对于可接受百分比的人主体的血清保护的标准。具有这样的相关抗体滴度的抗原是众所周知的,高于所述相关抗体滴度宿主被认为针对抗原是血清转化的,并且这样的滴度由组织诸如WHO公布。优选多于80%的统计学显著的主体的样品发生血清转化,更优选多于90%,仍更优选多于93%,最优选96-100%。本发明可用于引发全身和/或粘膜免疫。本发明的组合物将通常直接施用于患者。直接递送可通过肠胃外注射(例如皮下、腹膜内、静脉内、肌内或至组织间隙),或通过直肠、经口、阴道、局部、透皮、鼻内、眼、耳、肺或其他粘膜施用完成。优选在大腿或上臂进行肌内施用。注射可以经由针头(例如皮下针头)进行,但或者可以使用无针注射。肌内剂量通常为约0.5ml(例如,如BEXSERO™产品中所见)。剂量治疗可以是单剂量时间表或多剂量时间表。多剂量可用于初次免疫时间表和/或加强免疫时间表。初次剂量时间表之后可以是加强剂量时间表。可以常规确定引发剂量之间(例如4-16周之间)和引发和加强之间的合适时机。例如,取决于主体(例如婴儿或其他),BEXSERO™产品作为两个或三个剂量施用,注意分开少于1个月或不少于2个月。本发明的免疫原性组合物将通常包括药学上可接受的载体,其可以是本身不诱导产生对接受所述组合物的患者有害的抗体的任何物质,且可以在无不当毒性的情况下施用。药学上可接受的载体可包括液体,诸如水、盐水、甘油和乙醇。辅助物质,诸如湿润剂或乳化剂、pH缓冲物质等也可存在于这样的媒介物中。合适运体的充分讨论可见于参考文献59中。例如,BEXSERO™产品包括氯化钠、组氨酸、蔗糖、氢氧化铝和注射用水。奈瑟氏菌感染影响机体的各个区域,所以可将本发明的组合物以各种形式制备。例如,可将所述组合物制备为可注射剂,作为液体溶液或悬浮液。也可制备适合在注射前溶解或悬浮于液体媒介物中的固体形式。适合于肠胃外注射(例如至肌肉)的组合物是最优选的。所述组合物优选是无菌的。其优选不含热原。其优选被缓冲的,例如在pH6到pH8之间,通常为约pH7。当组合物包含氢氧化铝盐时,优选使用组氨酸缓冲剂[60]。本发明的组合物相对于人可以是等张的。免疫原性组合物包含免疫有效量的免疫原,以及需要的任何其他的其他指定组分。“免疫有效量”意指以单一剂量或作为一系列剂量的部分向个体施用该量对于治疗或预防是有效的。该量取决于待治疗个体的健康和身体状况、待治疗个体的年龄、分类组(例如非人灵长类动物、灵长类动物等)、个体的免疫系统合成抗体的能力、期望的保护程度、疫苗制剂、治疗医生对医学情况的评估和其他相关因素而不同。预期所述量将落入可通过常规试验确定的相对宽范围内。剂量治疗可以是单剂量时间表或多剂量时间表(例如,包括加强剂量)。所述组合物可与其他免疫调节剂结合施用。本发明的组合物中可以使用的佐剂包括但不限于不溶性金属盐,水包油乳剂(例如MF59或AS03,两者均含有角鲨烯),皂苷,LPS的无毒衍生物(诸如单磷酰脂质A或3-O-脱酰化MPL),免疫刺激性寡核苷酸,脱毒的细菌ADP-核糖基化毒素,微粒,脂质体,咪唑并喹诺酮类(imidazoquinolones),或其混合物。充当免疫刺激剂的其他物质公开于参考文献61的第7章。使用氢氧化铝和/或磷酸铝佐剂是特别优选的,并且多肽通常吸附至这些盐。这些盐包括羟基氧化物和羟基磷酸盐(例如参见参考文献61的第8和9章)。所述盐可采取任何合适的形式(例如,凝胶、晶体、无定形等)。Al+++应当以<1mg/剂量存在。最优选的佐剂是氢氧化铝,如BEXSERO™产品中所使用。本发明的组合物中的多肽和OMV可以吸附至该佐剂,如BEXSERO™产品中所见。氢氧化铝可以以约1mg/mlAl+++(即0.5mg/0.5ml剂量)被包括。其他抗原性组分本发明的组合物可以包含除了fHbp、NHBA、NadA和/或OMV以外的其他脑膜炎球菌多肽免疫原。例如,其可以包括NspA、App、NhhA、HmbR等中的一种或多种。本发明的组合物还可以包括‘936’抗原。936抗原作为基因NMB2091包括于脑膜炎球菌血清群B菌株MC58的公开基因组序列[23]中(本文为SEQIDNO:20)。用于本发明使用的优选的936抗原包含以下氨基酸序列:(a)与SEQIDNO:21具有50%或更高同一性(例如60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高);和/或(b)包含SEQIDNO:21的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自SEQIDNO:21的表位。在施用于宿主哺乳动物之后,本发明的最有用的936抗原可以引发可以结合由氨基酸序列SEQIDNO:20组成的脑膜炎球菌多肽的抗体。936抗原是fHbp的良好融合伴侣(例如,参见参考文献62和63)。除了脑膜炎球菌多肽抗原以外,所述组合物可包括用于针对其他疾病或感染免疫的抗原。例如,所述组合物可包括以下其他抗原中的一种或多种:-来自脑膜炎奈瑟氏菌血清群A、C、W135和/或Y的糖抗原,诸如参考文献64中公开的来自血清群C的糖(还参见参考文献65)或参考文献66中的糖。-来自肺炎链球菌(Streptococcuspneumoniae)的糖抗原[例如,67,68,69]。-来自甲型肝炎病毒,诸如灭活病毒的抗原[例如,70,71]。-来自乙型肝炎病毒的抗原,诸如表面和/或核心抗原[例如,71,72]。-白喉抗原,诸如白喉类毒素[例如参考文献73的第3章],例如CRM197突变体[例如,74]。-破伤风抗原,诸如破伤风类毒素(例如参考文献73的第4章)。-来自百日咳博德特氏菌(Bordetellapertussis)的抗原,诸如来自百日咳博德特氏菌的百日咳全毒素(PT)和丝状血凝素(FHA),也可任选与百日咳杆菌黏附素(pertactin)和/或凝集原2和3组合(例如参考文献75和76)。-来自流感嗜血杆菌B(HaemophilusinfluenzaeB)的糖抗原[例如65]。-脊髓灰质炎抗原[例如,77,78],诸如IPV。-麻疹、腮腺炎和/或风疹抗原(例如参考文献73的第9、10和11章)。-流感抗原(例如参考文献73的第19章),诸如血凝素和/或神经氨酸酶表面蛋白。-来自卡他莫拉菌(Moraxellacatarrhalis)的抗原[例如79]。-来自无乳链球菌(Streptococcusagalactiae)(B群链球菌)的蛋白抗原[例如80,81]。-来自无乳链球菌(Streptococcusagalactiae)(B群链球菌)的糖抗原。-来自酿脓链球菌(Streptococcuspyogenes)(A群链球菌)的抗原[例如81,82,83]。-来自金黄色葡萄球菌(Staphylococcusaureus)的抗原[例如84]。所述组合物可以包含这些其他抗原中的一种或多种。必要时,可使毒性蛋白抗原脱毒(例如通过化学和/或遗传方式使百日咳毒素脱毒[76])。当所述组合物中包括白喉抗原时,优选还包括破伤风抗原和百日咳抗原。类似地,当包括破伤风抗原时,优选还包括白喉和百日咳抗原。类似地,当包括百日咳抗原时,优选还包括白喉和破伤风抗原。DTP组合因此是优选的。糖抗原优选为缀合物的形式。下文更详细讨论缀合物的载体蛋白。组合物中的抗原通常各以至少1μg/ml的浓度存在。通常,任何给定抗原的浓度将足以引发针对该抗原的免疫应答。本发明的免疫原性组合物可以治疗性地(即,治疗已有感染)或预防性地(即,预防将来的感染)使用。作为本发明的免疫原性组合物中使用蛋白抗原的替代方案,可使用编码该抗原的核酸(其可以是RNA,诸如自复制RNA,或DNA,诸如质粒)。在一些实施方案中,本发明的组合物包含来自脑膜炎球菌血清群A、C、W135和Y中的1、2、3或4种的缀合的荚膜糖抗原。在其他实施方案中,本发明的组合物包含至少一种缀合的肺炎球菌荚膜糖抗原。脑膜炎球菌血清群Y、W135、C和A目前的血清群C疫苗(MENJUGATE™[64,85],MENINGITEC™和NEISVAC-C™)包括缀合的糖。MENJUGATE™和MeningitecMENINGITEC™具有与CRM197载体缀合的寡糖抗原,而NEISVAC-C™使用与破伤风类毒素载体缀合的完整多糖(脱-O-乙酰化)。MENACTRA™疫苗含有来自血清群Y、W135、C和A每种的缀合的荚膜糖抗原。本发明的组合物可包括来自脑膜炎球菌血清群Y、W135、C和A中的一种或多种的荚膜糖抗原,其中所述抗原与载体蛋白缀合和/或是寡糖。例如,所述组合物可包括来自:血清群C;血清群A和C;血清群A、C和W135;血清群A、C和Y;血清群C、W135和Y;或来自血清群A、C、W135和Y中的所有四种的荚膜糖抗原。每剂量各脑膜炎球菌糖抗原的典型量为1μg至20μg,例如,约1μg、约2.5μg、约4μg、约5μg或约10μg(表示为糖)。当混合物包含来自血清群A和C的荚膜糖时,MenA糖∶MenC糖的比率(w/w)可以为大于1(例如,2:1、3:1、4:1、5:1、10:1或更高)。在混合物包含来自血清群Y以及血清群C和W135之一或两者的荚膜糖时,MenY糖:MenW135糖的比率(w/w)可以大于1(例如,2:1、3:1、4:1、5:1、10:1或更高),和/或MenY糖:MenC糖的比率(w/w)可以小于1(例如,1:2、1:3、1:4、1:5或更低)。来自血清群A:C:W135:Y的糖的优选比率(w/w)为:1:1:1:1;1:1:1:2;2:1:1:1;4:2:1:1;8:4:2:1;4:2:1:2;8:4:1:2;4:2:2:1;2:2:1:1;4:4:2:1;2:2:1:2;4:4:1:2;和2:2:2:1。来自血清群C:W135:Y的糖的优选比率(w/w)为:1:1:1;1:1:2;1:1:1;2:1:1;4:2:1;2:1:2;4:1:2;2:2:1;和2:1:1。优选使用实质上相等质量的各种糖。可以使用寡糖形式的荚膜糖。这些通过以下方便地形成:对纯化的荚膜多糖进行片段化(例如通过水解),通常随后为纯化期望大小的片段。优选进行多糖的片段化,以使寡糖的最终平均聚合度(DP)小于30(例如,对于血清群A,10至20,优选约10;对于血清群W135和Y,15至25,优选约15-20;对于血清群C,12至22;等)。DP可通过离子交换层析或通过比色测定方便地测量[86]。如果进行水解,则通常对水解产物进行筛分,以去除短长度寡糖[65]。这可以各种方式诸如超滤和随后离子交换层析实现。对于血清群A,优选去除聚合度小于或等于约6的寡糖;对于血清群W135和Y,优选去除聚合度小于约4的寡糖。参考文献85中公开了优选的MenC糖抗原,如Menjugate™中所使用。共价缀合本发明的组合物中的荚膜糖通常与载体蛋白缀合。通常,缀合增强糖的免疫原性,因为所述缀合可将糖从T-非依赖性抗原转化为T-依赖性抗原,因此引发免疫记忆。缀合对于儿科疫苗是特别有用的,并且是众所周知的技术。典型的载体蛋白是细菌毒素,诸如白喉或破伤风毒素或类毒素或其突变体。CRM197白喉毒素突变体[87]是有用的,并且是PREVNAR™产品中的载体。其他合适的载体蛋白包括脑膜炎奈瑟氏菌外膜蛋白复合物[88]、合成肽[89,90]、热休克蛋白[91,92]、百日咳蛋白[93,94]、细胞因子[95]、淋巴因子[95]、激素[95]、生长因子[95]、包含多种来自各种病原体衍生抗原的人CD4+T细胞表位的人工蛋白[96]诸如N19[97]、来自流感嗜血杆菌(H.influenzae)的蛋白D[98-100]、肺炎球菌溶血素[101]或其无毒衍生物[102]、肺炎球菌表面蛋白PspA[103]、摄铁蛋白[104]、来自艰难梭菌(C.difficile)的毒素A或B[105]、重组铜绿假单胞菌(P.aeruginosa)胞外蛋白A(rEPA)[106]等。可以使用任何合适的缀合反应,在必要时使用任何合适的接头。糖通常将在缀合前活化或官能化。活化可涉及例如氰化剂(cyanylatingreagents),诸如CDAP(例如1-氰基-4-二甲氨基吡啶四氟硼酸盐(1-cyano-4-dimethylaminopyridiniumtetrafluoroborate)[107、108等])。其他合适的技术使用碳二亚胺、酰肼、活性酯、降冰片烷(norborane)、对硝基苯甲酸、N-羟基琥珀酰亚胺、S-NHS、EDC、TSTU等。可使用任何已知程序,例如参考文献109和110中描述的程序,经由接头基团进行连接。一种类型的连接涉及多糖的还原胺化,将所得氨基与己二酸接头基团的一个末端偶联,然后将蛋白偶联至己二酸接头基团的另一末端[111,112]。其他接头包括B-丙酰胺基[113]、硝基苯基-乙胺[114]、卤代酰基卤化物[115]、糖苷键[116]、6-氨基己酸[117]、ADH[118]、C4至C12部分[119]等。作为使用接头的替代方案,可使用直接连接。与蛋白的直接连接可包括氧化多糖,随后与蛋白还原胺化,如例如参考文献120和121中所述。优选涉及以下的方法:将氨基引入糖中(例如通过用-NH2替代末端=O基团),随后用己二酸二酯(例如己二酸N-羟基琥珀酰亚胺基二酯)衍生化,并且与载体蛋白反应。另一种优选的反应使用CDAP活化蛋白D载体,例如对于MenA或MenC。一般概念术语“包含”涵盖“包括”以及“由……组成”,例如,“包含”X的组合物可以仅由X组成或可包括额外物质,例如X+Y。提及“包含(comprising)”(或“包含(comprises)”等)可以任选地被提及“由...组成(consistingof)”(或“由…组成(consistsof)”等)替代。与数值x相关的术语“约”是任选的,并且意指,例如x±10%。词语“基本上”不排除“完全”,例如“基本上不含”Y的组合物可能完全不含Y。必要时,可以从本发明的定义中省略词语“基本上”。“序列同一性”优选通过Needleman-Wunsch全局比对算法[122]使用默认参数(例如,缺口开放罚分=10.0和缺口延伸罚分=0.5,使用EBLOSUM62评分矩阵)确定。在EMBOSS软件包中的needle工具方便地进行该算法[123]。当应用是指与具体SEQID的序列同一性,应当经该SEQID的全长来计算同一性。血清群之后,脑膜炎球菌分类包括血清型、血清亚型和然后免疫型,并且标准命名法列出血清群、血清型、血清亚型和免疫型,其各自通过冒号隔开,例如B:4:P1.15:L3,7,9。在血清群B内,一些谱系经常引起疾病(高侵袭性),一些谱系引起比其他谱系更严重形式的疾病(高毒力),且其他谱系完全很少引起疾病。识别七种高毒力谱系,即亚群I、III和IV-1、ET-5复合群、ET-37复合群、A4簇和谱系3。这些已经通过多位点酶电泳(MLEE)定义,但多位点序列分型(MLST)也已经用于分类脑膜炎球菌。四种主要的高毒力簇是ST32、ST44、ST8和ST11复合群。实施例实施例1:BEXSERO™疫苗(用于参考)BEXSERO™产品是安全且有效的,且在欧洲和其他地方已被授权用于人类使用。其每0.5ml剂量具有以下免疫原性成分:免疫原量注释fHbp50µg在N-末端具有NMB2091的融合多肽NHBA50µg在C-末端具有NMB1030的融合多肽NadA50µg-OMV25µg(总蛋白)菌株NZ98/254(B:4:P1.7-2,4,L1,3)这些免疫原被吸附至氢氧化铝佐剂(每个剂量0.5mgAl+++)。所述组合物还包括NaCl、组氨酸缓冲剂和蔗糖。实施例2:稳定化和稳定化的非结合融合多肽本发明人已经研究了v2和v3中的两种不同类型的突变:首先,他们已经鉴定了SEQIDNO:2和SEQIDNO:3内可以被修饰以增加多肽的稳定性的残基。其次,他们已经鉴定了减少与人因子H(fH)的结合的残基。包含两种类型的突变的突变体fHbp多肽具有增强的特性。具体地,不结合因子H、但保留免疫原性的fHbp突变体是有利的,因为所得抗体应答针对fH结合位点中或附近的表位。在使用野生型fHbp疫苗抗原接种后,此类表位可能被因子H结合遮蔽。最感兴趣的氨基酸如下,其根据全长序列(SEQIDNO:1和3)以及还根据ΔG序列(SEQIDNO:8和7)进行编号:**当这些残基中只有一个被突变时,其优选为亮氨酸。将用于稳定性和fHbp结合的突变组合入v2和v3的突变体形式,并与包含R41S突变的突变体v1序列融合。将突变体以顺序v2-v3-v1融合,并使用接头连接,以得到731SNB(SEQIDNO:38)。与三种野生型序列相比,该融合多肽包括总共7个点突变(图2)。分别将v2和v3中用于稳定性的突变与‘R41S’突变体v1序列以顺序v2-v3-v1融合,并使用接头连接,以得到731S(SEQIDNO:40)。因此,与三种野生型序列相比,该融合多肽包括总共5个点突变(图2)。在转基因(Tg)小鼠中测试fHbp的非fH结合形式引发SBA滴度的能力:这些数据表明fHbp的非结合形式可以是更具免疫原性的。实施例3:NMB2091-fHbp融合体的取代通过用fHbp变体的“三联融合体”多肽(其中从N-末端至C-末端,v2-v3-v1)代替NMB2091-fHbp融合多肽来修饰BEXSERO™产品。该融合多肽具有氨基酸序列SEQIDNO:10。此外,去除OMV组分。在第0、21和35天免疫的小鼠中比较两种疫苗,其中在第34和49天针对各种克隆复合群(MLST和ET分类)中的一组15种血清群B菌株评价血清。使用3mg/ml的佐剂,以20μg/剂量施用抗原。具有高于各个阈值的SBA滴度的菌株的比例如下:阈值初始疫苗修饰疫苗>128100%100%>102493%80%>409653%60%因此,在高抗MenBSBA滴度(>4096)下,使用v2-v3-v1融合多肽可以提供针对组的更高比例(60%vs.53%)的覆盖。实施例4:OMV剂量的4倍减少通过用“三联融合体”fHbpv2-v3-v1多肽(SEQIDNO:10)代替NMB2091-fHbp融合多肽并且还通过(i)将OMV剂量4倍减少至12.5µg/ml或(ii)去除OMV组分来修饰BEXSERO™产品。因此,制备三种组合物:为了评价这三种疫苗的免疫原性,人主体以每月时间间隔接受三次剂量(第0、1、2个月)。在第0、1、2和3个月取血清,然后在第三个剂量后6个月(第8个月)取血清,用于针对一组相关菌株进行评价。滴度(GMT)如下:合并的患者血清用于评价一组7种表达v1fHbp的MenB菌株的覆盖度。在每组中充分覆盖相似数目的菌株,但组C中的滴度(GMT)是最高的:MCS时间零<10<10<103个月70140408个月155010针对一组6种表达v2或v3fHbp的MenB菌株测试单个患者血清(一种菌株测试两次)。再次,组C中的滴度(GMT)是最高的:此外,与组M和S相比,组C中SBA滴度高于1:8的经免疫主体的比例通常更高,例如3次剂量后菌株M1239为80%或更高,相比之下,其他两组种为50%或更低。SBA滴度的RCD曲线(反向累积分布)也显示更好的概况,例如,图1显示针对菌株UK293的3月血清的曲线,其中组C明显高于其他组。合并的患者血清用于评价一组26种表达v2或v3fHbp的MenB菌株的覆盖度。再次,组C中的滴度(GMT)是最高的:MCS3个月2391258个月7439因此,这些数据显示疫苗‘C’(其中fHbp免疫原已经被替代并且OMV剂量减少4倍)不逊于BEXSERO™疫苗。实际上,当与BEXSERO™疫苗相比时,单个主体和合并的血清都对于疫苗‘C’显示更好的血清反应率、更高的GMT和增加的菌株覆盖度。实施例5:抗体亲合力使用基于Gyrolab的系统比较来自组‘C’和‘S’中的患者的抗体的亲合力(avidity),所述基于Gyrolab的系统包括使用离液剂以从抗原解离低亲和力(affinity)抗体的洗涤步骤,给出作为总v1.fHbp-特异性抗体中高亲和力抗-v1.fHbp抗体的百分比的“亲合力指数”。在第一个剂量后1个月和第三个剂量后1个月评价20份分离血清。此外,针对菌株H44/76评价SBA滴度,并测定亲合力指数和SBA滴度(log2)之间的相关性。结果(通过Pearson相关性的R和p)如下:因此,在组‘C’中在两个时间点的SBA滴度和亲合力指数之间存在显著的相关性,但在组‘S’中不存在。在接受具有12.5µg/mlOMV的疫苗的主体中,亲合力指数与SBA滴度相关,这表明OMV的存在对诱导的抗体的质量具有积极影响。总体而言,在接受OMV的主体中,趋势是杀细菌滴度是较高的,并且它们与由疫苗制剂诱导的抗体的亲合力相关。基于以下标准选择var2/3菌株的亚组用于单个主体血清测试:(i)先前临床试验中未被Bexsero覆盖的菌株,(ii)菌株属于相关克隆复合群,(iii)菌株表达流行病学相关的fHbp亚变体(subvariant),(iv)fHbp表达水平为中等,(v)菌株被741-231(竞争性hSBA)特异性杀死。结果显示于图3(a)至3(g)中,证明741-231+1/4OMV+明矾(alum)针对所测试的7种菌株引发更高的GMT。因此,hSBA测试表明包括741-231融合体的制剂不逊于Bexsero。事实上,对var2/3菌株的单个主体血清和合并血清分析显示对于包括741-231+1/4OMV+明矾(alum)的制剂的更好的血清反应率、更高的GMT滴度和增加的菌株覆盖度。实施例6:OMV剂量的减少以及731‘S’和731‘SNB’的使用通过用“三联融合体”稳定化或稳定化的非结合fHbpv2-v3-v1多肽(分别为SEQIDNO:40和38)代替NMB2091-fHbp融合多肽并且还通过将OMV剂量减少至10µg/ml或2.5µg/ml来修饰BEXSERO™产品:为了制备小鼠抗血清,使用20μgNadA、NHBA-NMB1030以及NMB2091-fHbp、fHbp231S或fHbp231SNB与10μg或2.5μg源自菌株NZ98/254的OMV来免疫6周龄CD1雌性小鼠(CharlesRiver)。每组使用8只小鼠。在第0、21和35天,将所述抗原与氢氧化铝(3mg/ml)一起腹膜内施用。在最后一次取血后2周收集血清,并在测试前在56℃下热灭活30分钟。用动物血清和人补体的血清杀细菌测定如前所述评估针对Nm菌株的血清杀细菌活性。来自健康成人的人血清或血浆(当以25或50%的最终浓度测试时没有内在杀细菌活性)用作补体来源。血清杀细菌滴度被定义为导致细菌与反应混合物孵育60分钟后的每ml菌落形成单位(CFU)与在时间0时的每ml对照CFU相比减少50%的血清稀释度。对于每种血清测试的最低稀释度为1:16(检测限值)。为了分析的目的,将低于检测限值的滴度设定为该限值的一半,并且将阳性阈值定义为与该值(即32)相比的4倍上升。来自用Bexsero制剂免疫的小鼠的合并血清在所测试的34种菌株中的14种菌株的阳性阈值之下,而源自第二代制剂的合并血清在含有fHbp231SNB的疫苗制剂的情况下对于仅1种菌株在检测限值之下,且在含有fHbp231S的制剂的情况下对于1种菌株在检测限值之下。下表中报道的hSBA数据显示,在一组测试的34种菌株中,与Bexsero相比,含有fHbp231S或fHbp231SNB的疫苗制剂引发的覆盖度的增加:应该理解的是,本发明仅借助实例上文进行描述,并且可以作出修改,而仍在本发明的范围和精神内。参考文献[1]Carter(2013)BioDrugs27:263-74.[2]WO99/57280.[3]Masignani等人(2003)JExpMed197:789-799.[4]Welsch等人(2004)JImmunol172:5605-15.[5]Hou等人(2005)JInfectDis192(4):580-90.[6]WO03/063766.[7]Fletcher等人(2004)InfectImmun72:2088-2100.[8]Zhu等人(2005)InfectImmun73(10):6838-45.[9]Cendron等人(2011)ActaCrystallogrSectFStructBiolCrystCommun.67:531-5.[10]Mascioni等人(2009)JBiolChem284:8738-46.[11]Pizza等人(2008)Vaccine26Suppl8:I46-8.[12]Malito等人(2013)PNASUSA110:3304-9.[13]Marshall等人(2012)PediatrInfectDisJ31:1061-8.[14]McNeil等人(2013)MicrobiolMolBiolRev77:234-52.[15]Serruto等人(2012)Vaccine30Suppl2:B87-97.[16]Scarselli等人(2011)SciTranslMed3:91ra62.[17]Beernink等人(2008)InfectImmun76:4232-40.[18]Scarselli等人(2009)JMolBiol386:97-108.[19]Giuntini等人(2012)PLoSOne7:e34272.[20]Vu等人(2012)SciRep2:341.[21]Faleri等人(2013)FASEBJfj.13-239012.[22]Beernink等人(2011)JImmunol186:3606-14.[23]Tettelin等人(2000)Science287:1809-1815.[24]WO00/66741.[25]WO02/09643.[26]Katial等人(2002)InfectImmun70:702-707.[27]WO01/52885.[28]欧洲专利0301992.[29]Frasch等人(2001)MethodsinMolecularMedicine,volume66的第7章(‘MeningococcalVaccines:MethodsandProtocols’,编辑Pollard&Maiden).[30]Bjune等人(1991)Lancet338(8775):1093-1096.[31]Fukasawa等人(1999)Vaccine17:2951-2958.[32]WO02/09746.[33]Rosenqvist等人(1998)Dev.Biol.Stand.92:323-333.[34]欧洲专利0011243.[35]Fredriksen等人(1991)NIPHAnn.14(2):67-80.[36]WO01/91788.[37]WO2004/019977.[38]美国专利6,558,677.[39]WO01/09350.[40]欧洲专利0449958.[41]EP-A-0996712.[42]EP-A-0680512.[43]WO02/062378.[44]WO99/59625.[45]美国专利6,180,111.[46]WO01/34642.[47]Peeters等人(1996)Vaccine14:1008-1015.[48]Vermont等人(2003)InfectImmun71:1650-1655.[49]WO2004/014417.[50]WO2005/004908.[51]WO2011/036562.[52]Pizza等人(2000)Science287:1816-1820.[53]WO2007/028408.[54]http://pubmlst.org/neisseria/[55]Budroni等人(2011)PNASUSA108:4494-99.[56]Goldschneider等人(1969)J.Exp.Med.129:1307-26.[57]Santos等人(2001)ClinicalandDiagnosticLaboratoryImmunology8:616-23.[58]Frasch等人(2009)Vaccine27S:B112-6.[59]Gennaro(2000)Remington:TheScienceandPracticeofPharmacy.第20版,ISBN:0683306472.[60]WO03/009869.[61]VaccineDesign…(1995)编辑Powell&Newman.ISBN:030644867X.Plenum.[62]Giuliani等人(2006)ProcNatlAcadSciUSA.103:10834-9.[63]WO2004/032958.[64]Costantino等人(1992)Vaccine10:691-698.[65]Costantino等人(1999)Vaccine17:1251-1263.[66]WO03/007985.[67]Watson(2000)PediatrInfectDisJ19:331-332.[68]Rubin(2000)PediatrClinNorthAm47:269-285,v.[69]Jedrzejas(2001)MicrobiolMolBiolRev65:187-207.[70]Bell(2000)PediatrInfectDisJ19:1187-1188.[71]Iwarson(1995)APMIS103:321-326.[72]Gerlich等人(1990)Vaccine8Suppl:S63-68&79-80.[73]Vaccines(1988)编辑Plotkin&Mortimer.ISBN0-7216-1946-0.[74]DelGuidice等人(1998)MolecularAspectsofMedicine19:1-70.[75]Gustafsson等人(1996)N.Engl.J.Med.334:349-355.[76]Rappuoli等人(1991)TIBTECH9:232-238.[77]Sutter等人(2000)PediatrClinNorthAm47:287-308.[78]Zimmerman&Spann(1999)AmFamPhysician59:113-118,125-126.[79]McMichael(2000)Vaccine19Suppl1:S101-107.[80]Schuchat(1999)Lancet353(9146):51-6.[81]WO02/34771.[82]Dale(1999)InfectDisClinNorthAm13:227-43,viii.[83]Ferretti等人(2001)PNASUSA98:4658-4663.[84]Kuroda等人(2001)Lancet357(9264):1225-1240;还参见第1218-1219页.[85]Jones(2001)CurrOpinInvestigDrugs2:47-49.[86]Ravenscroft等人(1999)Vaccine17:2802-2816.[87]ResearchDisclosure,453077(Jan2002).[88]EP-A-0372501.[89]EP-A-0378881.[90]EP-A-0427347.[91]WO93/17712.[92]WO94/03208.[93]WO98/58668.[94]EP-A-0471177.[95]WO91/01146.[96]Falugi等人(2001)EurJImmunol31:3816-3824.[97]Baraldo等人(2004)InfectImmun72(8):4884-7.[98]EP-A-0594610.[99]Ruan等人(1990)JImmunol145:3379-3384.[100]WO00/56360.[101]Kuo等人(1995)InfectImmun63:2706-13.[102]Michon等人(1998)Vaccine.16:1732-41.[103]WO02/091998.[104]WO01/72337.[105]WO00/61761.[106]WO00/33882[107]Lees等人(1996)Vaccine14:190-198.[108]WO95/08348.[109]美国专利4,882,317[110]美国专利4,695,624[111]Porro等人(1985)MolImmunol22:907-919.s[112]EP-A-0208375[113]WO00/10599[114]Gever等人Med.Microbiol.Immunol,165:171-288(1979).[115]美国专利4,057,685.[116]美国专利4,673,574;4,761,283;4,808,700.[117]美国专利4,459,286.[118]美国专利4,965,338[119]美国专利4,663,160.[120]美国专利4,761,283[121]美国专利4,356,170[122]Needleman&Wunsch(1970)J.Mol.Biol.48,443-453.[123]Rice等人(2000)TrendsGenet16:276-277.当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1