表达免疫应答刺激细胞因子以吸引和/或激活免疫细胞的基因修饰间充质干细胞的制作方法
本发明涉及基因修饰间充质干细胞(MSC),以及它们作为治疗肿瘤的药物的用途,所述MSC包含一种或多种外源核酸分子,其中所述外源核酸分子包括可操作地连接于启动子或启动子/增强子组合的、编码一种或多种免疫应答刺激细胞因子或免疫应答调节细胞因子的区域。本发明进一步涉及包含至少一种外源核酸分子的基因修饰间充质干细胞,所述外源核酸分子包括编码例如诱导T细胞增殖和/或分化的免疫刺激分子的区域。
本发明涵盖MSC作为治疗肿瘤和/或肿瘤疾病的药物的用途,例如通过调节肿瘤微环境以吸引免疫效应细胞和促进所述免疫效应细胞的激活和/或记忆表型的过继。本发明的一个方面涉及所述MSC在抗肿瘤治疗中的用途,所述抗肿瘤治疗包括联合施用所述间充质干细胞与免疫治疗,所述免疫治疗例如检查点抑制剂(包括例如抗CTLA-4、PD-1、PD-L1和其他免疫共刺激分子的抗体),免疫细胞例如T细胞(如具有人工T细胞受体的T细胞,例如嵌合抗原受体(CAR-T)或外源T细胞受体(TCR)转导的细胞),NK细胞或巨噬细胞/单核细胞,或活性免疫治疗药物,例如肿瘤抗原、来源于患者的肿瘤物质和旨在激活和/或指导免疫应答对抗肿瘤或肿瘤特征的其他治疗药物。
背景技术:
间充质干细胞(MSC)是存在于骨髓和其他组织中的非造血起源的细胞。MSC一般被认为是多能成体祖细胞,其具有分化为有限数目的细胞谱系如成骨细胞、软骨细胞和脂肪细胞的能力。基于直接分化为这些末期表型的能力,已经对MSC作为治疗实体的用途进行了研究,包括MSC促进或提高骨修复和用于修复软骨缺损的用途(Vilquin和Rosset,再生医学(Regenerative Medicine)2006:1,4,p 589以及Veronesi等人,干细胞和发育(Stem Cells and Development)2013;22,p 181)。已经描述了用于许多治疗性适应症的MSC的分离和培养,并且这代表了针对治疗炎症相关障碍的有前途的方法(例如WO 2010/119039)。
已知MSC展示了施用于患者后的免疫逃逸特性。已经显示MSC展示了在移植同种异体供体材料情况下有利的免疫调节作用(Le Blanc等人,Lancet2004:363,p 1439),从而减少了潜在致病的同种异体反应性和排斥。MSC治疗还可以在创伤愈合中起治疗作用。可以经由全身注射进行MSC的治疗递送,然后MSC归巢并移入于损伤的部位(Kidd等人,干细胞(Stem Cells)2009:27,p 2614)。还已知MSC展示了关于在体内向肿瘤归巢的迁移特性。
使用基因修饰MSC的基于MSC的细胞治疗能够使治疗性基因产品递送至患者体内感兴趣的特定区域。例如,已经显示MSC迁移至炎症区域如肿瘤,从而在局部发挥治疗影响。MSC典型地具有免疫调节作用,引起在感兴趣的区域中的免疫抑制,从而调节或减少炎症以促进恢复。然而,本发明利用MSC作为细胞载体,用于递送用于刺激免疫应答的免疫调节效应物,从而利用MSC靶向于炎症区域,尤其是肿瘤的独特的归巢能力,从而基于适当的免疫应答的激活,发挥局部治疗作用。
通过针对肿瘤组织的免疫应答的适当激活或加强,可以阻止肿瘤生长。然而,在癌症治疗领域需要用于局部增强这样的免疫应答,而不启动不想要的全身性副作用的手段。存在许多用于治疗癌症的药物在不引起显著不想要的副作用(例如发烧、肝酶水平升高或全身炎症,如细胞因子风暴,可能会导致死亡)的情况下不能被全身施用。用于避免这样的副作用的一种选择是施用显著减少剂量的这样的药物,这虽然在减少副作用中是有效的,但是通常在靶位点产生不足的药物水平并且产生不足的治疗益处。
技术实现要素:
鉴于现有技术,基于本发明的技术问题是提供用于癌症免疫治疗的新策略。具体地,基于本发明的问题是提供用于局部刺激针对受试者的肿瘤组织的免疫应答的合适手段。基于本发明的进一步问题是提供用于施用有效剂量的治疗剂如免疫调节剂或免疫刺激剂的手段,其在靶组织提供有效的局部作用和减少水平的不想要的副作用。
通过独立权利要求的特征解决这个问题。通过从属权利要求提供了本发明的优选实施方式。
因此,本发明涉及在肿瘤治疗中用作药物的基因修饰间充质干细胞,其中所述MSC包含一种或多种外源核酸分子,其中所述外源核酸分子包括编码一种或多种免疫应答刺激细胞因子的区域,所述编码一种或多种免疫应答刺激细胞因子的区域可操作地连接于启动子或启动子/增强子组合,其中所述治疗包括联合施用所述间充质干细胞与抗肿瘤免疫治疗。
联合施用可涉及在所述免疫治疗之前、期间和/或之后,同时和/或有顺序地施用所述间充质干细胞。联合施用还应包括联合治疗方案,该联合治疗方案包括治疗的任一种治疗性组分的多次施用。本文提供了联合施用的进一步实施方式。
因此,除了用于治疗具有肿瘤的受试者的方法或治疗肿瘤和/或肿瘤疾病的方法之外,本发明涵盖本文描述的MSC的医学用途,尤其是用于治疗癌症。
本发明还涵盖本文描述的基因修饰间充质干细胞,其本身不依赖于它们的特定医学用途。
本发明使得能够刺激参与抗肿瘤免疫应答的细胞,从而局部激活、支持和/或加强抗肿瘤免疫应答。如本文描述的MSC由于它们的天然的或工程化的在体内归巢至炎症区域的能力而迁移至肿瘤组织。归巢和/或移入肿瘤组织(肿瘤基质)导致免疫刺激细胞因子的局部表达,从而使得局部肿瘤环境中免疫细胞的量和/或活性提高,从而使患者的免疫系统能够攻击肿瘤细胞,并且还提供对联合免疫治疗的支持。
本发明使得能够施用经由移植的MSC表达的有效和治疗相关剂量的一种或多种免疫刺激细胞因子,同时避免显著的副作用,所述副作用在没有适当靶向剂的情况下是全身施用细胞因子中固有的。因此,本发明涉及利用作为靶向剂的MSC和/或载体,所述载体用于在炎症区域,优选在肿瘤组织内和接近于肿瘤组织处,局部递送免疫调节信号,优选免疫刺激信号。
免疫治疗的成功开发和临床使用中的关键限制是通过建立免疫抑制的肿瘤微环境,肿瘤逃逸和抑制对抗肿瘤细胞的天然免疫应答的能力。该现象被称为肿瘤介导的免疫抑制,并且该现象在很大程度上是通过由存在于肿瘤中的显示调节性表型的免疫细胞(例如调节性T细胞(TReg)和单核细胞衍生抑制细胞(MDSC))分泌抗炎性细胞因子所介导的。因此,本发明提供了改变肿瘤微环境的手段,使肿瘤微环境成为促炎的,促进存在于肿瘤中的免疫细胞的激活和外部免疫细胞的募集和激活,从而促进免疫系统对抗肿瘤的广泛激活;和/或提高抗肿瘤免疫治疗性治疗的有效性的手段。
在一种实施方式中,在免疫治疗性治疗之前,可以施用如本文描述的MSC以修改肿瘤微环境和使得肿瘤微环境有利于和有助于免疫治疗。
本发明利用MSC作为用于递送用于模拟免疫应答的免疫调节效应物的细胞载体,从而利用MSC靶向炎症区域(尤其是肿瘤)的独特归巢能力,从而基于适当的免疫应答的激活发挥局部治疗作用(其中所述免疫应答优选涉及宿主(受试者)的天然免疫应答),从而提高免疫治疗剂的有效性和治疗作用,所述免疫治疗剂如双特异性抗体、过继免疫治疗剂、抗肿瘤疫苗和/或检查点抑制剂。
MSC响应于促炎信号(例如,转化生长因子β(TGF-b),吲哚胺2,3-双加氧酶)能够表达不同的抗炎因子。对于TGF-b,已经显示了它能提高激活的T细胞的存活率,因为它保护细胞免受所谓的“激活诱导的细胞死亡”。惊人地,MSC中促炎细胞因子的表达允许旁观T细胞(bystander T cells)的靶向激活和持续激活,而不诱导T细胞中的激活诱导的细胞死亡(AICD)。本文描述的细胞的这种特性是由于抗炎因子(例如TGF-b)的存在,所述抗炎因子也由MSC表达,并且防止AICD。表达抗炎因子的MSC与促炎转基因细胞因子的组合产生预料不到的技术效果,这在刺激抗肿瘤的免疫应答中是有利的。
惊人地,用一种或多种如本文描述的免疫应答刺激细胞因子修饰的MSC显示所述细胞因子在体外和体内的预料不到的良好表达和分泌。基于固有应答或和免疫治疗,技术人员不会预料到这些特定的细胞因子可以以足够的量表达,并且以足够的量从细胞中输出以诱导或提高希望的局部免疫应答。
本发明还涵盖经由本文描述的基于MSC的方法,在肿瘤中表达免疫激活细胞因子和/或趋化因子的组合,目的是吸引免疫效应细胞和辅助细胞、诱导免疫激活、促进记忆免疫细胞的成熟和/或抑制抑制性免疫细胞和/或调节性免疫细胞的出现和存留。
在一种实施方式中,使用了细胞因子的组合,以促进免疫应答的不同分支的激活,包括固有免疫应答和适应性免疫应答、效应细胞、辅助细胞和/或抗原提呈细胞。
预期细胞因子如TNF-α会激活免疫系统的多个方面,然而该作用可能缺少对肿瘤应答必要的特异性。
另一方面,IL-2、IL-7、IL-15和IL-21特异性地激活使对抗肿瘤细胞的特异性应答增强的细胞毒性淋巴细胞如T细胞和NK细胞。同样地,IL-12会激活细胞毒性淋巴细胞,还有单核细胞和辅助细胞。
IL-12与例如IL-2、IL-7、IL-15和/或IL-21的组合会具有如下作用:(i)激活肿瘤定向的细胞毒性细胞,(ii)激活辅助细胞,所述辅助细胞增强细胞毒性细胞的激活,和/或(iii)激活单核细胞,所述单核细胞可以发展对抗肿瘤的附加免疫应答。因此,细胞因子的组合产生协同效应,正如在天然免疫应答中所见,以及在本发明中,该细胞因子的组合大大提高了治疗效果。惊人的结果是,在使用基于MSC的转基因方法中,天然免疫应答可以以增强的方式实际上交叉(mirrored)或类似地应用。
因此,本发明基于如下的惊人发现:通过提供在一种或多种MSC中编码免疫应答刺激细胞因子的转基因的组合,可以获得更有效的局部和安全的抗肿瘤应答。MSC载体中多种细胞因子的组合引起导致局部抗肿瘤应答(包括免疫应答的多个分支)的独特的免疫刺激因子的局部表达和分泌,而不诱导如对肿瘤患者全身施用细胞因子时所观察到的全身毒性。
此外,MSC的独特特性,即归巢和移入肿瘤组织,引起治疗性细胞因子的持续表达,以保持免疫应答用于治疗作用。在一种实施方式中,诱导型启动子的使用使得局部和肿瘤特异性细胞因子表达成为可能,所述诱导型因子优选接近于肿瘤组织处表达或在肿瘤组织内表达或在发炎组织中表达,在该区域中的肿瘤(因此优选是炎性)随后减少后,所述局部和肿瘤特异性细胞因子表达随后减少。
本发明还涉及基因修饰间充质干细胞(MSC),其中所述MSC包含一种或多种外源核酸分子,其中所述外源核酸分子包括编码两种或更多种免疫应答刺激细胞因子的区域,所述编码两种或更多种免疫应答刺激细胞因子的区域可操作地连接于一个或多个启动子或启动子/增强子组合。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,外源核酸包括编码两种或更多种免疫应答刺激细胞因子的区域,所述编码两种或更多种免疫应答刺激细胞因子的区域可操作地连接于一个或多个启动子或启动子/增强子组合,其中细胞因子选自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ组成的组。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,两种或更多种免疫应答刺激细胞因子至少包括IL-12,以及IL-2、IL-7、IL-15和/或IL-21中的一种或多种。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,两种或更多种免疫应答刺激细胞因子至少包括IL-7和IL-21。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,两种或更多种免疫应答刺激细胞因子包括至少一种趋化因子和至少一种免疫应答刺激细胞因子,所述免疫应答刺激细胞因子选自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ组成的组。
本发明在某些实施方式中涵盖了如本文描述的细胞中的细胞因子转基因的组合,尤其是本文公开的单独的细胞因子或趋化因子的任何给定的特定组合,优选是IL-2、IL-7、IL-12、IL-15、IL21、IFNγ、IFNβ、CD28、趋化因子(C-C基序)配体1、2、4、17、19、22、23(CCL1、CCL2、CCL4、CCL17、CCL19、CCL22、CCL23)、基质细胞衍生因子1(SDF-1)中的两种或更多种的任何给定的特定组合。
通过在由固有免疫系统或由联合免疫治疗产生的抗肿瘤免疫应答中局部免疫系统刺激的惊人和有利的构思,,将由两种或更多种免疫应答刺激细胞因子限定的MSC和包括施用由一种或多种免疫应答刺激细胞因子限定的MSC与其他抗肿瘤免疫治疗的组合的肿瘤治疗方法联系起来。出人意料的是,在刺激抗肿瘤应答中编码转基因免疫刺激细胞因子的MSC可以用作有效的抗肿瘤佐剂。相关的现有技术仅教导了使用MSC载体用于局部施用(转基因)细胞毒性剂,具有直接效果。然而,使用编码(可能是多种)转基因免疫刺激细胞因子的MSC,或这样的MSC与抗肿瘤免疫治疗的组合来加强局部抗肿瘤免疫应答,代表本发明的特别的技术特征。
惊人地,用如本文描述的多种细胞因子修饰的MSC显示出所述细胞因子在体外和体内的不可预料的良好表达和分泌。基于固有应答或和免疫治疗,技术人员不会预料到这些特定细胞因子可以以足够的量表达,并且以足够的量从细胞中输出以诱导或提高希望的局部免疫应答。
因此本发明涉及用作肿瘤治疗中的药物的本文描述的基因修饰间充质干细胞,所述间充质干细胞包含一种或多种外源核酸分子,其中所述外源核酸分子包括编码两种或更多种免疫应答刺激细胞因子的区域。本文公开的任何特征还应用于包括用于至少两种或更多种免疫应答刺激细胞因子的转基因物质的MSC,所述特征为关于治疗或医学施用或施加MSC的方法,或它们与本文描述的抗肿瘤免疫治疗剂的联合施用的特征。
本发明提供了在受试者中局部刺激对抗肿瘤组织的免疫应答的适当手段。这包括患者的天然免疫应答和旨在使免疫应答针对肿瘤的免疫治疗性治疗(例如检查点抑制剂、抗肿瘤抗原的CART和其他肿瘤免疫治疗)。免疫应答的这样的支持或诱导在不同的临床环境下可以是有利的,以便启动和保持免疫应答,以及逃避肿瘤介导的常常阻止这种激活的免疫抑制。
本发明的细胞可以用于提高活性和/或增加已经存在于受试者中的内源免疫细胞的量。可供选择地或另外地,可以与本发明的MSC联合施用(例如同时地或顺序地)额外的免疫细胞(自体的或同种异体的)以便提高希望的治疗性免疫应答。
可以使用本领域技术人员已知的技术进行本文描述的基因修饰MSC的构建。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,外源核酸包括病毒载体序列,例如病毒表达构建体形式的病毒载体序列。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,外源核酸是非病毒表达构建体。
如本文所使用的,“核酸”是指任何核酸分子,包括但不限于DNA、RNA和其杂交体或修饰的变体。“外源核酸”和“外源基因元件”涉及引入细胞的任何核酸,其不是细胞“原始”或“天然”基因组的组件。外源核酸可以整合于或不整合于靶标间充质干细胞的遗传物质中,或涉及稳定转导的核酸。
本发明涵盖了任何给定的基因递送方法,并且所述基因递送方法优选涉及病毒或非病毒载体,以及转染的生物或化学方法,或其组合。该方法可以在使用的系统中产生稳定或瞬时基因表达。
基因修饰的病毒已经广泛应用于将基因递送至干细胞。可以使用腺病毒,或RNA病毒如慢病毒,或其他反转录病毒。腺病毒在基因治疗和细胞工程领域中已经被用于产生一系列用于基因转移的载体。通过删除E1基因(病毒复制所需)产生具有4kb克隆能力的载体,来生产初代腺病毒载体。另外删除E3(负责宿主免疫应答)允许8kb克隆能力。通过E2和/或E4删除产生进一步的代次。本发明涵盖任何给定的腺病毒载体的使用,例如根据上文描述的腺病毒载体。
慢病毒是病毒的反转录病毒家族的成员(M.Scherr等人,使用慢病毒载体将基因转移至造血干细胞(Gene transfer into hematopoietic stem cells using lentiviral vectors).Curr Gene Ther.2002Feb;2(1):45-55)。通过删除除了LTR和顺式作用包装信号以外的整个病毒序列产生慢病毒载体。获得的载体具有约8kb的克隆能力。这些载体与反转录病毒载体的一个区别特征是它们转导分裂细胞和非分裂细胞以及终末分化细胞的能力。
还可以采用非病毒方法,如以下供选择的策略,其包括:通过使用基于核酸酶的基因编辑的靶向基因整合法人常规质粒转移和应用,整合酶或转座酶技术。这些表示用于载体转化的方法,所述方法具有有效并且通常在它们的整合中是位点特异性的优势。将载体导入细胞的物理方法是技术人员已知的。一个例子涉及电穿孔,其依赖于使用通过克服它的电容在膜上产生瞬时孔的短时高电压的电脉冲。该方法的一个优势是可以将它用于在大多数细胞类型中稳定和瞬时基因表达。可供选择的方法涉及使用脂质体或蛋白转导域。适当的方法对技术人员是已知的,并且不意欲作为本发明的限制性实施方式。
本发明涵盖使用多于一种病毒或病毒和其他基因编辑事件或基因修饰,包括使用mRNA、siRNA、miRNA或其他基因修饰,以便控制基因表达任何给定的相关因素。在本发明的某些实施方式中,免疫应答刺激细胞因子涉及多种细胞因子和/或趋化因子或其组合。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子或启动子/增强子组合产生外源核酸的组成性表达。因为在全身施用后或局部施用后的受试者体内,MSC的对肿瘤有利的归巢特性,使用用于表达一种或多种免疫应答刺激细胞因子的组成型启动子是优选的。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是EF1α启动子,例如EF1αS启动子。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是PGK启动子。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是CMV或SV40病毒启动子。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是GAG启动子。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是UBC启动子。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,当基因修饰间充质干细胞与肿瘤组织或肿瘤基质组织接近时,表达免疫应答刺激细胞因子。
考虑到间充质干细胞可以显示选择性迁移至正常以及病态情况下的不同的组织微环境,本发明涵盖组织特异性启动子、或与特定疾病微环境关联的其他启动子、或在募集的干细胞中由启动的分化途径诱导的启动子的使用,并且所述使用可以用于驱动治疗性基因的选择性表达,如本文描述的细胞因子,具体地在限定的生物背景下。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,所述细胞在施用后分化时诱导启动子或启动子/增强子组合。施用后分化的一个例子是内皮分化,其中MSC可以移入并且随后分化为在肿瘤组织中或接近于肿瘤组织处的内皮细胞或内皮样细胞,从而使刺激性细胞因子能够以局部方式表达。
募集到其他组织环境(niches)而没有经历疾病区域(肿瘤环境)的干细胞不应表达治疗性基因。该方法允许对治疗性基因在限定的微环境中的选择性表达进行显著程度的潜在控制,从而减少与全身施用促炎细胞因子相关的已知毒性发生的可能性,并且该方法已经被成功地应用于在新血管生成(neovascularization)期间调节治疗性基因表达。WO 2008/150368和WO 2010/119039公开了这样的基因修饰的可能方法,据此将这些专利公开全文并入。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是Tie2启动子。
在炎症或新血管生成的情况下,选择性地调节可以引入的启动子。就这一点而言,已经针对内皮特异性表达研究了Tie2启动子、Flkl启动子和内含子增强子、内皮素-1启动子和内皮素原-1(pre-proendothelin-1)启动子(Huss,R,von Luttichau,I,Lechner,S,Notohamiprodjo,M,Seliger,C,Nelson,P(2004)[在创伤愈合和组织再生中趋化因子指导移植成体干细胞的归巢(Chemokine directed homing of transplanted adult stem cells in wound healing and tissue regeneration)].Verh Dtsch Ges Pathol 88:170-173)。
本发明的另一种实施方式提供了包含启动子或启动子/增强子组合的间充质干细胞,所述启动子或启动子/增强子组合可由炎性介质诱导以及控制刺激性细胞因子(免疫应答刺激细胞因子)的转录。这些炎性介质可以由肿瘤基质组织释放,使得当干细胞与肿瘤基质组织接近时,诱导细胞毒性蛋白在间充质干细胞中的表达。炎性介质可以是例如细胞因子、如TNFα或IFNγ。特别地,启动子可以是RANTES启动子,其尤其可以由TNFOC或IFNγ诱导(Nelson PJ,Kim HT,Manning WC等人.RANTES趋化因子基因的基因组结构和转录调节(Genomic organization and transcriptional regulation of the RANTES chemokine gene).J Immunol 1993;151(5):2601-12;von Luettichau I,Nelson PJ,Pattison JM等人.病态的和正常的人体组织中RANTES趋化因子的表达(RANTES chemokine expression in diseased and normal human tissues).Cytokine 1996;8(l):89-98;Nelson PJ,Pattison JM,Krensky AM.RANTES的基因表达(Gene expression of RANTES).Methods Enzymol 1997;287:148-62;Duell EJ,Casella DP,Burk RD等人.促炎基因TNF-A、RANTES和CCR5中的炎症、基因多态性和胰腺癌的风险(Inflammation,genetic polymorphisms in proinflammatory genes TNF-A,RANTES,and CCR5,and risk of pancreatic adenocarcinoma).Cancer Epidemiol Biomarkers Prev 2006;15(4):726-31;Marfaing-Koka,A.,等人,由内皮细胞调节RANTES趋化因子的产生(Regulation of the production of the RANTES chemokine by endothelial cells).IFNγ与TNFα的协同诱导和IL-4和IL-13的抑制(Synergistic induction by IFN-gamma plus TNF-alpha and inhibition by IL-4and IL-13).Journal of Immunology,1995.154(4):p.1870-8)。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,启动子是RANTES启动子。“RANTES”启动子在本领域也被称为“CCL5”启动子。
由促炎介质诱导的启动子的另外的例子是NF-kB应答元件,以及一般地为可以由TNF诱导的启动子。
此外,抗炎性介质(例如TGF-β)激活的启动子可以用于实现细胞毒性蛋白在间充质干细胞中的靶向表达。例子是含有Smad-结合元件的启动子。使用由炎性介质诱导的启动子使得能够选择性治疗尚未经历血管生成的肿瘤。
此外,癌组织中激活的或由癌细胞释放的信号激活的启动子可以用于本发明以实现编码的细胞因子在患者的有关部位中选择性表达,以避免不想要的全身作用。在癌症中上调的启动子的一个例子是HSP70启动子。HSP70蛋白是主要的应激诱导型热休克蛋白,它是在人肿瘤和肿瘤细胞系中丰富和优先表达的伴侣蛋白。由于HSP70保护细胞免受大范围的凋亡和坏死刺激的能力,已经假设HSP70可以为肿瘤细胞提供存活优势(Rohde等人,Genes Dev.Mar 1,2005;19(5):570–582;Nylandsted等人.,Ann N Y Acad Sci.2000;926:122-5;Ramp等人,Histol Histopathol.2007Oct;22(10):1099-107;Ricaniadis等人,Eur J Surg Oncol.2001Feb;27(1):88-93)。因此,HSP70启动子是选择性表达本发明涵盖的治疗性细胞因子的一种选择。HSP70启动子的更多信息可以获得自Wu等人,Proc.Natl.Acad.Sci.USA,Vol.83,pp.629-633,1986。
“肿瘤特异性”启动子的使用,或在炎性或“癌症样”条件下优先表达或诱导的启动子的使用可以显示与关于减少不想要的全身作用的MSC归巢特性组合的协同作用。本发明的MSC向炎性组织迁移,尤其是向肿瘤组织迁移,从而提供了避免编码的细胞因子在患者体内全身表达的有效手段。使用用于表达优先在炎症条件下表达或在肿瘤组织中存在的条件下表达的细胞因子的启动子进一步以协同方式增强了全身表达的减少,从而以基于MSC的方式施用本文描述的细胞因子提供了惊人的益处。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子保持或提高了肿瘤组织内的或接近肿瘤组织的免疫细胞的活性、存活率和/或数目。
如本领域已知的,免疫应答刺激细胞因子要被理解为直接或间接引起或产生免疫应答的诱导、激活和/或增强的任何细胞因子,所述免疫应答优选地针对抗原,例如肿瘤抗原。特别地,本发明的免疫应答刺激细胞因子优选被认为是引起对治疗肿瘤疾病有利的免疫应答的诱导、激活和/或增强的细胞因子。
如本文使用的,术语免疫应答调控细胞因子或免疫应答相关的细胞因子可以相互交换地使用,并且涉及参与、调控、控制和/或调节由于免疫细胞分化、成熟和激活引起的包括抗肿瘤活性的免疫应答和/或炎性反应。
细胞因子是起细胞之间介质的作用的不同组的非抗体蛋白质。目前,细胞因子在临床上被用作用于治疗各种疾病的生物应答调节剂。术语细胞因子是用于描述一大组蛋白质的通用术语。特定类型的细胞因子可以包括:单核因子,也就是由单核吞噬细胞产生的细胞因子;淋巴因子,也就是由激活的淋巴细胞,特别是Th细胞产生的细胞因子;白细胞介素,也就是在白细胞之间起介质作用的细胞因子;以及趋化因子,也就是主要负责白细胞迁移的小的细胞因子。细胞因子信号传导是灵活的,并且可以诱导保护应答和损伤应答。它们可以产生级联反应,或提高或抑制其他细胞因子的产生。尽管细胞因子具有各种角色,技术人员知道可以将哪种细胞因子看作刺激免疫应答的细胞因子,并且因此将其应用于如本文描述的肿瘤疾病的治疗中。
细胞因子具有调节免疫应答的能力,并且通常被肿瘤利用以允许肿瘤生长和操纵免疫应答。这些免疫调节作用允许细胞因子被用作药物以驱使对抗肿瘤的免疫应答。
可以将以下细胞因子称为免疫应答刺激细胞因子或免疫应答调节细胞因子。
在抗肿瘤治疗中常用的两组细胞因子是干扰素和白细胞介素。
干扰素是由通常参与抗病毒应答的免疫系统产生的细胞因子,而且还显示了在治疗癌症中的有效性。存在三组干扰素(IFN):I型(IFNα和IFNβ)、II型(IFNγ)和相对新发现的III型(IFNλ)。IFNα被应用于毛细胞白血病、AIDS相关的卡波济氏肉瘤、滤泡性淋巴瘤、慢性粒细胞白血病和黑色素瘤的治疗。I型和II型IFN已经被广泛研究,并且虽然两种类型促进免疫系统的抗肿瘤作用,但是到目前为止仅I型IFN显示了在癌症治疗中在临床上是有效的。已经检测了IFNλ在动物模型中的抗肿瘤作用,并且显示了希望。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IFNα。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IFNγ。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IFNβ。
根据本发明的某些实施方式,免疫应答刺激细胞因子或免疫应答调节细胞因子优选是参与T细胞调节或具有对T细胞的效应功能的细胞因子(T细胞调节细胞因子)。这些细胞因子展示了关于诱导促炎微环境的希望的特性,从而促进对抗肿瘤的免疫系统的激活和/或提高抗肿瘤免疫治疗性治疗的效果。这样的细胞因子可能能够吸引免疫效应细胞如T细胞,以及促进记忆免疫细胞的成熟。这些细胞因子的例子是IFNγ、IL-2、IL-12、IL-23、IL-15和IL-21(参考凯利的风湿病学教科书(Kelley's Textbook of Rheumatology);Firestein等人,8th ed.(ISBN 978-1-4160-3285-4),p367“细胞因子(Cytokines)”)。
本文提到的特定分子优选涉及哺乳动物分子,优选是人类分子,原因是对人受试者施用的适用性。例如,本文提到的细胞因子和/或趋化因子优选涉及人类序列,如技术人员可以不过分费力地获得的,例如从序列数据库如由美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)维护的序列数据库获得。
蛋白序列或编码蛋白的核酸序列与通常已知的序列对比可以是修饰的,例如通过进行例如蛋白序列中的保守氨基酸置换或通过利用遗传密码的简并性以改变编码序列而不改变编码的蛋白序列。正如技术人员所认识到的,生物分子的序列可以经由标准技术改变(突变),从而与已知的原始序列对比改善或保持它们的特性。因此,本发明的范围涵盖了保持已知序列的基本特性或功能上类似于已知序列的任何修饰的细胞因子序列。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IL-2。
白细胞介素-2是可以提高免疫系统的抗肿瘤活性的细胞因子的例子,并且因此可以被用作癌症的治疗剂。白细胞介素-2被用于治疗恶性黑色素瘤(商品名,)和肾细胞癌。在正常生理条件下,白细胞介素-2促进效应T细胞(产生免疫应答的细胞)和T调节细胞(抑制免疫应答的细胞),但是它在治疗癌症中的确切机制是未知的。最近的研究表明IL-2表达在癌症治疗中的有利作用。IL-2已经与过继免疫治疗如CART治疗联合使用,以促进T细胞的激活。然而,IL-2的全身施用带来了广泛免疫激活的风险,所述的广泛免疫激活带来了与CART治疗相关的毒性。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IL-7。
白细胞介素-7(IL-7)是由骨髓和胸腺中的基质细胞分泌的造血生长因子。IL-7刺激多能造血干细胞分化为淋巴样祖细胞。在临床前的动物研究和最近的用于各种恶性肿瘤和HIV感染期间的人类临床试验中检测了作为免疫治疗剂的IL-7(Fry TJ,Mackall CL(2002年6月).“白细胞介素-7:从实验台到临床(Interleukin-7:from bench to clinic)”.Blood 99(11):3892–904)。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IL-15。
白细胞介素15(IL-15)是与IL-2具有结构相似性的细胞因子。与IL-2一样,IL-15结合于由IL-2/IL-15受体β链(CD122)和共同的γ链(γ-C,CD132)组成的复合物,并且通过所述复合物发信号。IL-15诱导天然杀伤细胞的细胞增殖;该天然杀伤细胞为固有免疫系统的细胞,其首要作用是杀伤病毒感染细胞或癌细胞。IL-15在临床前模型中已经显示提高CD8+T细胞的抗肿瘤免疫性(Klebanoff CA等人.Proc.Natl.Acad.Sci.U.S.A.101(7):1969–74)。
在优选的实施方式中,如本文描述的基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是IL-21。
白细胞介素21(IL-21)是对免疫系统细胞具有有效调节作用的细胞因子,所述免疫系统细胞包括可以破坏病毒感染细胞或癌细胞的天然杀伤(NK)细胞和细胞毒性T细胞。IL-21已被批准用于转移性黑色素瘤(MM)和肾细胞癌(RCC)患者的I期和II期临床试验(H,Skak K,Tissue Antigens74(6):467–79)。IL-21已经显示对于伴有类似感冒症状作为副作用的施用是安全的。剂量限制性毒性包括低数量的淋巴细胞、嗜中性粒细胞和血小板,以及低的肝毒性。
白细胞介素12(IL-12)是由树突细胞、巨噬细胞和人B类淋巴母细胞(NC-37)响应于抗原刺激而天然产生的白细胞介素。IL-12参与初始T细胞分化为Th1细胞。它被称为T细胞刺激因子,能够刺激T细胞的生长和功能,从而落入本发明的构思中。已知IL-12刺激干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)从T细胞和天然杀伤(NK)细胞中产生,并且减少IL-4介导的IFN-γ的抑制。IL-12还具有已知的抗血管生成活性。IL-12通过提高IFN-γ的产生起作用,这转而提高了趋化因子CXCL10的产生。
白细胞介素12(IL-12)通过调节炎性应答、对感染的固有抗性和适应性免疫,尤其关于对抗癌细胞的免疫应答,在免疫的固有分支和适应性分支之间的相互作用中起作用(Colombo等人,细胞因子生长因子(Cytokine Growth Factor)Rev.2002Apr;13(2):155-68)。IL-12对于对许多病原体和对可移植或化学诱导的肿瘤的抗性是需要的。已知重组IL-12治疗对可移植的肿瘤,对化学诱导的肿瘤和基因修饰小鼠中自发产生的肿瘤显示抗肿瘤作用。因为这种能力,IL-12在癌症中具有有效的佐剂活性。
然而直到目前,在临床试验中观察到过度的临床毒性和中度的临床应答,因此需要使毒性最小化而不影响IL-12的抗肿瘤作用的新方法和施用方案。IL-12到目前为止在以对受试者无毒的剂量经由全身施用所测试的肿瘤中,没有显示出具有实质活性。
因此,本发明涉及如本文描述的MSC和其医学用途,其中外源核酸编码IL-12。有助于IL-12的位点特异性表达的基于MSC的方法代表了有助于避免在IL-12全身施用中固有的毒性的新颖且有利的方法。
本发明经由在本文描述的MSC中表达免疫刺激因子使得惊人的和有利的抗肿瘤活性成为可能。由MSC表达如本文描述的刺激性细胞因子支持抗肿瘤免疫应答,并且引起肿瘤尺寸和/或生长的减小,以及显示了由全身施用本领域已知的这样的细胞因子产生的副作用的显著减小和/或避免。副作用如恶心和呕吐、口腔或唇部溃疡、腹泻、困倦、过敏反应、发热或发冷、荨麻疹、瘙痒、头痛、咳嗽、呼吸短促,或脸部、舌或喉部肿胀,可以通过本文描述的基于MSC的治疗来避免。
因此,本发明提供了减少细胞因子治疗的副作用的手段,以及细胞因子与免疫治疗的共同使用,这通过使局部的(或局部限制的)肿瘤特异性作用成为可能,优选通过细胞的全身施用实现,但是以组织特异性方式,经由在合适的组织特异性条件下使用包含并表达所述细胞因子的MSC的细胞治疗发挥作用。
因此本发明涉及用作本文描述的药物的基因修饰间充质干细胞,其中外源核酸包含编码两种或更多种免疫应答刺激细胞因子的区域,所述编码两种或更多种免疫应答刺激细胞因子的区域可操作地连接于一个或多个启动子或启动子/增强子组合,其中细胞因子选自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ组成的组。
因此本发明涉及用作本文描述的药物的基因修饰间充质干细胞,其中外源核酸包含编码两种或更多种免疫应答刺激细胞因子的区域,所述编码两种或更多种免疫应答刺激细胞因子的区域可操作地连接于一个或多个启动子或启动子/增强子组合,其中所述细胞因子至少包括IL-7和IL-21、IL-12和IL-2、IL-15和IL-12、IL-7和IL-12、或IL-21和IL-12。
本发明还涉及包含外源核酸分子的基因修饰间充质干细胞,其中所述外源核酸分子包括编码诱导T细胞增殖和/或分化(和/或成熟为记忆细胞和避免肿瘤介导的免疫抑制)的免疫刺激分子的区域,该区域可操作地连接于启动子或启动子/增强子组合。
诱导T细胞增殖和/或分化的免疫刺激分子可以是如本文描述的细胞因子或其他免疫刺激分子,如趋化因子或细胞因子和趋化因子的组合。组合可以是优选的以确保免疫细胞被趋化因子适当地吸引,被适当地激活(通过引起激活的适当的细胞因子),以及针对记忆表型(通过促进记忆效应免疫细胞成熟的适当的细胞因子)。
在优选的实施方式中,基因修饰间充质干细胞的特征在于,诱导T细胞增殖和/或分化的免疫刺激分子是CD28。CD28(分化群28)是表达于T细胞上的提供对T细胞的激活所需要的共刺激信号的蛋白质之一。还发现了CD28刺激嗜酸性粒细胞,其中CD28与抗CD28抗体的结合引起IL-2、IL4、IL-13和IFNγ的释放。
在优选的实施方式中,基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是趋化因子。
本发明还涉及用作本文描述的药物的基因修饰间充质干细胞,其中外源核酸包括编码两种或更多种免疫应答刺激细胞因子的区域,所述编码两种或更多种免疫应答刺激细胞因子的区域可操作地连接于一个或多个启动子或启动子/增强子组合,其中至少一种免疫应答刺激细胞因子是趋化因子。
本发明还涉及用作本文描述的药物的基因修饰间充质干细胞,其中外源核酸包括编码两种或更多种免疫应答刺激细胞因子的区域,所述编码两种或更多种免疫应答刺激细胞因子的区域可操作地连接于一个或多个启动子或启动子/增强子组合,其中至少一种免疫应答刺激细胞因子是趋化因子,以及至少一种免疫应答刺激细胞因子选自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ组成的组。
在一种实施方式中,基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是炎性趋化因子。
在一种实施方式中,基因修饰间充质干细胞的特征在于,免疫应答刺激细胞因子是具有用于吸引T细胞的趋化特性的趋化因子,例如CCL1、CCL2和/或CCL17。
趋化因子是指由细胞分泌的细胞因子(信号传导蛋白)的亚组。趋化因子具有在附近的应答细胞中诱导指向趋化性的能力,它们是趋化细胞因子。根据共同结构特征如小的尺寸(尺寸典型为约8~10千道尔顿)和在对形成其三维形态关键的保守位置中存在4个半胱氨酸残基将蛋白分类为趋化因子。在供选择的定义下,细胞因子是已知的,如细胞因子的SIS家族、细胞因子的SIG家族、细胞因子的SCY家族、血小板因子-4超家族或间分泌(intercrines)。趋化因子被分类为四个主要亚族:CXC、CC、CX3C和XC。所有这些蛋白均通过与G蛋白偶联膜受体(称为趋化因子受体)相互作用发挥它们的生物作用,所述趋化因子受体选择性地发现于它们的靶细胞的表面上。
趋化因子的主要作用是起化学引诱物的作用,以诱导免疫细胞或指导免疫细胞迁移。由趋化因子吸引的细胞循着增加趋化因子浓度的信号朝向趋化因子的来源。在免疫监视的过程中,某些趋化因子控制免疫系统的细胞,比如指导淋巴细胞到达淋巴结,因此它们能够通过与存在于这些组织中的抗原提呈细胞相互作用筛选病原的入侵。某些趋化因子在发育中具有作用;它们促进血管生成(新血管的生长),或指导细胞到达提供对细胞成熟关键的特定信号的组织。其他趋化因子是炎性的并且响应于细菌感染、病毒和导致身体损伤的试剂如痛风中出现的二氧化硅或尿酸盐结晶,从多种细胞中释放。通常由促炎细胞因子如白细胞介素1刺激它们的释放。炎性细胞因子主要起对白细胞的化学引诱物的作用,将来自血液的单核细胞、嗜中性粒细胞和其他效应细胞募集至感染或组织损伤的部位。某些炎性趋化因子激活细胞以起始免疫应答或促进创伤愈合。
趋化因子通常被认为是促炎或体内稳态的。在免疫应答期间可以诱导促炎细胞因子以将免疫系统的细胞募集至感染的部位或其他免疫靶标如肿瘤,然而体内稳态的细胞因子参与在组织保持或发育的过程中控制细胞的迁移。炎性细胞因子和趋化因子典型地在病理条件下形成(在促炎刺激下,如IL-1、TNF-α、LPS或病毒),以及主动地参与到吸引免疫细胞至炎症部位的炎性应答中。
因此,本发明涉及本文描述的间充质干细胞,其中外源核酸编码炎性趋化因子。这样的趋化因子对技术人员是已知的。炎性趋化因子的例子涉及CXCL-8、CCL2、CCL3、CCL4、CCL5、CCL11和CXCL10、CXCL1、CXCL2。
在本发明的一种实施方式中,趋化因子能够诱导T细胞(T淋巴细胞)迁移至表达趋化因子的MSC的部位。参与到将T淋巴细胞募集至炎症部位的趋化因子的例子是CCL2、CCL1、CCL22和CCL17。这些趋化因子是已知的T细胞引诱物,并且因此可以被用于吸引内源患者的T细胞或提高过继免疫治疗剂(例如CART)归巢至肿瘤。肿瘤中过继免疫治疗剂的归巢是许多这样的治疗的已知缺陷,因此本发明带来了显著提高过继免疫治疗剂如CART的归巢以及随后的治疗效果的潜力。
在某些实施方式中,趋化因子是CXC趋化因子,优选是CXCL13。
CXC趋化因子涉及其中CXC趋化因子(或α-趋化因子)的两个N末端半胱氨酸被一个氨基酸(在该名称中以“X”表示)分开的趋化因子。典型地存在两类CXC趋化因子,一类是在CXC基序的第一个半胱氨酸之前紧接谷氨酸-亮氨酸-精氨酸基序(ELR基序)(ELR阳性),以及一类是不具有ELR基序(ELR阴性)。ELR阳性CXC趋化因子的例子是白细胞介素8(IL-8),其诱导嗜中性粒细胞离开血流并且进入周围组织。ELR阴性趋化因子的例子是CXCL13,其显示了对淋巴细胞的化学引诱物特性。
在本发明的一种实施方式中,趋化因子是CX3CL1,其属于称为CX3C趋化因子的趋化因子组。CX3C趋化因子涉及在两个半胱氨酸之间具有三个氨基酸的趋化因子。CX3CL1被分泌并限制于表达它的细胞的表面,从而起到化学引诱物和粘附分子的作用。
在本发明的某些实施方式中,趋化因子选自由以下组成的组:基质细胞衍生因子1(SDF-1;CXCL12)、趋化因子(C-C基序)配体23(CCL23;巨噬细胞炎性蛋白3(MIP-3))、趋化因子(C-C基序)配体19(CCL19;EBI1;ELC或巨噬细胞炎性蛋白3-β(MIP-3-β))和趋化因子(C-C基序)配体4(CCL4;巨噬细胞炎性蛋白1-β(MIP-1-β))。
基质细胞衍生因子1也被称为C-X-C基序趋化因子12(CXCL12)。基质细胞衍生因子1-α和基质细胞衍生因子1-β是属于趋化因子家族的小细胞因子,是激活白细胞的成员,以及通常由促炎刺激物如脂多糖、TNF或IL1诱导。趋化因子被表征为存在形成2个二硫键的4个保守半胱氨酸。它们可以被分为2个亚家族。在CC亚家族中,半胱氨酸残基是彼此相邻的。在CXC亚家族中,它们被介于中间的氨基酸所分开。SDF1蛋白属于后一组。SDF-1是通过交替拼接相同的基因以两种形式,即SDF-1α/CXCL12a和SDF-1β/CXCL12b产生。因此,本发明涉及本文描述的MSC,其中外源核酸编码SDF-1趋化因子,如SDF-1α/CXCL12a和/或SDF-1β/CXCL12b。
趋化因子(C-C基序)配体23(CCL23)是属于CC趋化因子家族的细胞因子,也被称为巨噬细胞炎性蛋白3(MIP-3)和髓系祖细胞(Myeloid progenitor)抑制因子1(MPIF-1)。CCL23主要表达于肺和肝脏组织中,然而其也在骨髓和胎盘中被发现。CCL23针对休眠T细胞和单核细胞是趋化性的。
趋化因子(C-C基序)配体19(CCL19)是属于CC趋化因子家族的细胞因子,也被称为EBI1配体趋化因子(ELC)和巨噬细胞炎性蛋白3-β(MIP-3-β)。CCL19在胸腺和淋巴结中丰富表达,在气管和结肠中具有中等水平,以及在胃、小肠、肺、肾和脾脏中具有低水平。已知CCL19在T细胞在胸腺中的运输和在将T细胞和B细胞迁移至次级淋巴器官中起重要作用。
CCL4,也被称为巨噬细胞炎性蛋白1-β(MIP-1-β),是对CCR5受体具有特异性的CC趋化因子。它是对天然杀伤细胞、单核细胞和各种其他免疫细胞的化学引诱物。
所有免疫治疗依赖于免疫应答的局部和适时激活,并且这转而大大依赖于效应细胞的存在以发挥其功能。在肿瘤学的情况下,该功能导致肿瘤细胞的杀伤。然而,在许多情况下,仅不足量的免疫效应细胞被吸引至肿瘤,并且免疫治疗的效果降低。
本文描述的趋化因子能够展示对于在对抗肿瘤疾病的免疫应答中有利的T细胞募集特性。在基于MSC的表达和分子的递送的情况下使用这样的趋化因子能够使关于位点特异性T细胞募集的惊人益处,以及减少与非靶向作用相关的副作用成为可能,所述非靶向作用由这样的细胞因子/趋化因子的全身施用所导致。
在本发明的另一方面,基因修饰间充质干细胞用作本文描述的药物的用途的特征在于,所述治疗包括所述间充质干细胞与检查点抑制剂的联合施用。
正常地,由免疫系统破坏潜在癌性的细胞。所有癌细胞经历将其与其邻近细胞区别开的变化,最明显的变化是能够不受抑制地繁殖。癌细胞使用避免常规免疫系统控制的机制。检查点蛋白已经被显示为通过向免疫系统传达潜在癌性的细胞将不被破坏而起作用。可能存在信号传导细胞是癌性的其他分子,但是如果在细胞表面存在足够的检查点蛋白,免疫系统可能忽视癌性信号。
已经被研究作为癌症治疗靶标的配体受体相互作用是跨膜程序性死亡1蛋白(PD-1;也称为CD279)和它的配体PD-1配体1(PD-L1)之间的相互作用。在正常生理下,细胞表面上的PD-L1结合于免疫细胞表面上的PD1,抑制免疫细胞的活性。由此看来癌细胞表面上的PD-L1的上调可以允许它们通过抑制可能另外攻击肿瘤细胞的T细胞而逃逸宿主免疫系统。结合于PD-1或PD-L1并因此阻断相互作用的抗体可以使T细胞攻击肿瘤。
检查点抑制剂(也被称为免疫检查点调节剂,或CPM)被设计为减轻检查点蛋白的效力。虽然它们可能具有各种作用机制,但是如果是有效的,它们能够使免疫系统识别癌细胞的表面上的其他分子。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的医学用途的特征在于,检查点抑制剂与所述MSC的联合施用,所述检查点抑制剂优选为PD-L1和/或PD-1抑制剂。例子包括:纳武单抗(Nivolumab)(BMS-936558、MDX-1106、ONO-4538),一种完全人免疫球蛋白G4(IgG4)单克隆PD-1抗体;兰博利珠单抗(Lambrolizumab)(MK-3475),一种人源化单克隆IgG4PD-1抗体;和BMS-936559,一种完全人IgG4PD-L1抗体。
在一种实施方式中,如本文描述的基因修饰间充质干细胞的医学用途的特征在于,检查点抑制剂与所述MSC的联合施用,所述检查点抑制剂优选为CTLA-4抑制剂。例子包括曲美母单抗(Tremelimumab)(Pfizer,NY,USA)和伊匹单抗(ipilimumab),两种抗CTLA-4的完全人单克隆抗体。
表达诱导T细胞增殖和/或分化的免疫应答刺激细胞因子和/或免疫刺激分子的MSC与检查点抑制剂一起联合施用引起关于希望的抗癌作用的协同作用。细胞因子或其他免疫刺激物提供对抗癌组织的T细胞应答的局部增强,同时检查点抑制剂也使T细胞能够更有效地攻击和破坏癌组织。这两种药剂的作用是以协同方式联合,导致技术效果大于单独考虑时这两个方面的总和。
在进一步的实施方式中,本发明涉及用作本文描述的药物的基因修饰间充质干细胞,其中免疫治疗包括肿瘤抗原的施用。
本发明用于提高癌症疫苗的治疗效果。癌症疫苗指挥免疫系统增强对体内癌细胞的攻击。它们激活免疫系统以攻击已经存在的疾病,而不是像用于防止感染的疫苗一样防止疾病。某些癌症治疗疫苗是由癌细胞、细胞的部分或纯抗原制成的。有时,将患者自身的免疫细胞如T细胞或抗原提呈细胞移出并且在实验室中暴露于这些物质以制造疫苗。一旦准备好疫苗,将其注入体内以介导对抗癌细胞的免疫应答。疫苗通常与帮助更进一步加强免疫应答的称为佐剂的其他物质或细胞联合。癌症疫苗引起免疫系统攻击具有一个或多个特异性抗原的细胞。细胞适应性免疫应答的激活引起免疫学记忆,因此,希望在给予疫苗后,疫苗可以继续长时间工作。在许多情况下,肿瘤介导的免疫抑制阻碍了癌症疫苗的效果和免疫激活。期望癌症疫苗与所述间充质干细胞的联合以去除或降低免疫抑制,或不管任何持续免疫抑制而促进免疫激活。
因此,如本文描述的MSC可以被认为是免疫治疗剂本身,或作为用于共同施用的免疫治疗剂或药剂的佐剂。
本发明的进一步的方面涉及用作如本文描述的药物的基因修饰间充质干细胞,其中所述治疗包括所述间充质干细胞与免疫细胞的联合施用。本发明涵盖了,由于适当的趋化因子的表达,在施用免疫细胞(例如CART)前施用基因修饰MSC会提供CART和其他免疫效应细胞的趋化性。刺激细胞因子的表达会仅仅局部地,优选在肿瘤内或接近于肿瘤处提高T细胞的激活,并且随后导致记忆效应细胞表型,从而延长治疗的疗效。
通过参与免疫应答的大量不同类型的细胞的复杂相互作用和活性,安排对病原体和癌组织的应答。如本文使用的免疫细胞可以涉及如以下过程的情况中所描述的任何如下的细胞类型:固有免疫应答是第一道防线,并且在病原体暴露或暴露于“外来”或癌性物质之后不久发生。这通过吞噬细胞(如嗜中性粒细胞和巨噬细胞)、细胞毒性天然杀伤(NK)细胞和粒细胞进行。随后的适应性免疫应答包括抗原特异性防御机制,并且可能需要几天以发展。在适应性免疫中具有关键作用的细胞类型是包括巨噬细胞和树突细胞的抗原提呈细胞。包括T细胞亚集、B细胞和巨噬细胞的各种细胞类型的抗原依赖性刺激都在宿主防御中起关键作用。如本文描述的免疫细胞涉及参与受试者的免疫应答的生物细胞。免疫细胞优选选自T细胞、B细胞、树突细胞、粒细胞、固有淋巴样细胞(ILC)、巨核细胞、单核细胞/巨噬细胞、天然杀伤(NK)细胞、血小板、红细胞(RBC)和/或胸腺细胞。
由其获得间充质干细胞和/或免疫细胞的受试者可以与细胞培养后所要施用的受试者是相同的。因此,这样的细胞可以被认为是自体的。然而,细胞可以获得自与预期患者不同的受试者,因此被认为是同种异体的。如本文使用的,相对于受试者,如果细胞或任何其前体细胞来自相同物种的另一受试者,则该细胞是“同种异体的”。如本文使用的,就受试者而言,如果细胞或任何其前体细胞来自相同的受试者,则该细胞是“自体的”。在优选的实施方式中,免疫细胞对医学治疗的受试者是自体的。
在优选的实施方式中,免疫细胞是T细胞。在其他实施方式中,免疫细胞是包括人工T细胞受体(如嵌合抗原受体(CART))的T细胞,其中所述T细胞受体特异性结合于肿瘤抗原(Lee,DW等人,Clin Cancer Res;2012;18(10);2780–90)。在进一步的实施方式中,免疫细胞是巨噬细胞,优选是M1巨噬细胞和/或单核细胞。
单核细胞是一类白细胞(白细胞(leukocyte))。它们是所有白细胞中最大的。它们是包括所有哺乳动物(包括人类)的脊椎动物的固有免疫系统的一部分。单核细胞通过骨髓由称为成单核细胞的前体产生,所述成单核细胞是由造血干细胞分化的双能(bipotent)细胞。单核细胞在血液中循环大约1至3天,然后典型地移动入遍及全身的组织中。它们构成了血液中3%~8%的白细胞。在组织中,单核细胞在不同的解剖学位置成熟为不同类型的巨噬细胞。
巨噬细胞(macrophage),有时称为巨噬细胞(macrophagocyte),是通过组织中的单核细胞分化产生的细胞。单核细胞和巨噬细胞是吞噬细胞。巨噬细胞在非特异性防御(固有免疫)中起作用,以及帮助启动脊椎动物的特异性防御机制(适应性免疫)。主要表达杀伤表型的巨噬细胞被称为M1巨噬细胞,而参与组织修复的巨噬细胞被称为M2巨噬细胞。巨噬细胞的作用是作为静止细胞或移动细胞吞噬或吞入然后消化细胞碎片和病原体。它们还刺激淋巴细胞和其他免疫细胞以应答病原体。它们是通过破坏和摄取攻击外来物质、感染性微生物和癌细胞的专门的吞噬细胞。
因此,在一种实施方式中,本发明涉及癌症免疫治疗和包括过继细胞转移的方法,其涵盖了用于攻击癌细胞的基于T细胞的细胞毒性应答。
癌症免疫治疗试图刺激免疫系统以排斥和破坏肿瘤。首先,免疫疗法治疗涉及细胞因子如白细胞介素的施用。然后,因为静脉和全身施用细胞因子的不良作用,使用从血液提取淋巴细胞,并且在体外针对肿瘤抗原扩增这些细胞,然后将所述细胞与适当的刺激性细胞因子注射来尝试供选择的方法。然后所述细胞特异性地靶向并破坏针对它们所产生的肿瘤表达抗原。尽管有这些方法,用于用细胞因子适当刺激这样的细胞的方法不足以有效地产生令人信服的肿瘤减小。显著的副作用也由所需要的大量细胞因子产生。
免疫治疗的这些之前尝试的一种方法涉及使患者自身的免疫细胞工程化以识别和攻击他们的肿瘤。而且虽然这种称为过继细胞转移(ACT)的方法目前被限制于临床试验,但是使用这些工程化的免疫细胞的治疗已经对患有晚期癌症的患者产生了治疗应答。
因此,本发明涵盖与施用本文描述的MSC联合的过继细胞转移。本发明涵盖了,由于适当的细胞因子的表达,在施用免疫细胞(CART)前施用基因修饰MSC会提高CART和在过继细胞转移期间施用的其他免疫效应细胞的趋化性。刺激细胞因子的表达会仅仅局部地优选在肿瘤内或接近于肿瘤处提高T细胞的激活,随后导致记忆效应细胞表型,从而延长治疗的疗效。
过继细胞转移使用基于T细胞的细胞毒性应答来攻击癌细胞。在体外产生对患者的癌细胞具有天然或基因工程化的反应性的T细胞,然后转移回至癌症患者。使用自体肿瘤浸润淋巴细胞作为对患有转移性黑色素瘤的患者有效的治疗。这可以通过取患者的肿瘤中发现的T细胞,培养所述T细胞以攻击癌细胞来实现。这些T细胞可以被称为肿瘤浸润淋巴细胞(TIL)。可以使用高浓度的IL-2、抗CD3和异常反应性饲养细胞刺激这样的T细胞以在体外扩增。习惯上,然后将这些T细胞转移回至患者,同时外源施用IL-2以进一步加强它们的抗癌活性。
在一种实施方式中本发明涵盖经由如本文描述的基因修饰MSC施用用IL-2。通过该方法,避免了全身施用IL-2的副作用,同时保持和/或提高了T细胞转移的有利作用。对于单独的IL-12、IL-7、IL-21和/或IL-15或其组合,获得相似的效果以实现免疫学记忆的激活和建立。
因此,本发明提供了用于产生局部和组织特异性细胞因子以刺激抗肿瘤免疫应答,优选由细胞毒性T细胞和/或NK细胞介导的抗肿瘤免疫应答的新方法。
人工T细胞受体(也称为嵌合T细胞受体、嵌合免疫受体、嵌合抗原受体(CAR))是将任意的特异性移入免疫效应细胞上的工程化受体。典型地,这些受体用于将单克隆抗体的特异性移入T细胞上;通过反转录病毒载体促进所述受体的编码序列的转移。
在一种实施方式中,可以通过用含有T细胞受体(TCR)基因拷贝的病毒感染患者的细胞来制备基因工程化T细胞,所述T细胞受体(TCR)基因是专门识别肿瘤抗原的。病毒不能在细胞中复制,然而可以整合到人基因组中。这是有利的,因为新的TCR基因在T细胞中保持稳定。将患者自身的T细胞暴露于这些病毒,然后非特异性地扩增或使用基因工程化的TCR刺激。然后将细胞转移回至患者中,并且准备对肿瘤具有免疫应答。第二代和第三代CAR典型地由单克隆抗体的片段组成,称为单链可变区片段(scFv),其存在于T细胞膜的外部,并且连接于T细胞内侧的刺激部分。scFv部分引导细胞至靶抗原。一旦T细胞结合于它的靶抗原,刺激分子为T细胞提供必要的信号以成为完全活性的T细胞。在该完全活性状态下,T细胞可以更有效地增殖,以及可以攻击癌细胞。
表达诱导T细胞增殖和/或分化的免疫应答刺激细胞因子和/或免疫刺激因子的MSC与免疫细胞,优选为T细胞如本文描述的那些一起联合施用,以及任选地与检查点抑制剂的进一步联合施用,导致关于希望的抗癌作用的协同作用。检查点抑制剂可以与表达刺激性细胞因子的MSC组合,以提高另外施用的免疫细胞的抗肿瘤作用,从而在抗肿瘤治疗中产生与预料不到的效果相关的因素的组合。
在进一步的实施方式中,本发明涉及用作如本文所述的药物的基因修饰间充质干细胞,其中免疫治疗包括来源于患者的肿瘤物质的施用。
在进一步的实施方式中,本发明涉及用作如本文所述的药物的基因修饰间充质干细胞,其中免疫治疗包括靶向于肿瘤特异性抗原的抗体或抗体片段的施用。
例如,抗体依赖性细胞介导的细胞毒性(ADCC)是细胞介导的免疫防御机制,由此,免疫系统的效应细胞主动地裂解靶细胞如癌细胞,所述靶细胞的膜表面抗原被特异性抗体结合。这是作为体液免疫应答的部件的抗体可以用于限制和控制癌生长的机制之一。之前的报道已经表明ADCC是包括曲妥单抗和利妥昔单抗的治疗性单克隆抗体对抗肿瘤的重要作用机制。本发明涵盖了如本文描述的MSC与抗肿瘤抗体治疗的联合施用。
例如,可以施用同时靶向于肿瘤特异性抗原和T细胞上的CD3分子的双特异性抗体作为抗肿瘤免疫治疗。
具体实施方式
免疫系统的重要作用是鉴别和消除肿瘤。肿瘤的转化癌细胞表达在正常细胞上没有发现的抗原。对于免疫系统来说,这些抗原表现出是外来的,并且它们的出现导致免疫细胞攻击转化的肿瘤细胞。由肿瘤表达的抗原具有几种来源。某些抗原来源于致癌病毒如导致宫颈癌的人乳头瘤病毒,而其他抗原是有机体自身的蛋白,所述蛋白在正常细胞种以低水平存在,但是在肿瘤细胞中达到高水平。一个例子是称为酪氨酸酶的酶,当该酶以高水平表达时使某些皮肤细胞(例如黑色素细胞)转化为称为黑色素瘤的肿瘤。肿瘤抗原的第三种可能的来源是对调节细胞增长和存活通常重要的蛋白,其通常突变为称为癌基因的癌症诱导分子。
免疫系统对肿瘤的主要应答是使用杀伤T细胞破坏异常细胞,有时伴随辅助T细胞的协助。肿瘤抗原以与病毒抗原相似的方式提呈给MHC I类分子。这允许杀伤T细胞识别肿瘤细胞为异常的细胞。NK细胞也以相似的方式杀伤肿瘤细胞,尤其是如果肿瘤细胞在该NK细胞表面上具有比正常细胞少的MHC I类分子;这是肿瘤的常见现象。某些肿瘤细胞还释放抑制免疫应答的产物;例如通过分泌抑制巨噬细胞和淋巴细胞的活性的细胞因子TGF-β。
因此,本发明提供了通过由如本文描述的基因修饰MSC表达免疫刺激细胞因子来支持抗肿瘤免疫反应的方法。
在本发明的情况下,免疫治疗被理解为涵盖使用免疫系统治疗癌症的任何治疗剂。免疫治疗利用了如下事实:癌细胞在其表面上具有可以被免疫系统检测到的微妙不同的分子。这些分子被称为癌症抗原,是最常见的蛋白质,而且包括如碳水化合物的分子。免疫治疗在攻击肿瘤细胞中通过使用这些抗原作为靶标激发或增强免疫系统。
免疫治疗涵盖但不限于细胞治疗和抗体治疗。
细胞治疗典型地涉及施用从患者的血液或从患者的肿瘤中分离的免疫细胞。将针对要治疗的肿瘤的免疫细胞激活、培养,以及转移回患者的免疫细胞攻击癌症的位置。可以以该方式使用的细胞类型不限于天然杀伤细胞、淋巴因子激活的杀伤细胞、细胞毒性T细胞和树突细胞。树突细胞治疗通过引起树突细胞提呈肿瘤抗原来激发抗肿瘤应答。树突细胞将抗原提呈至淋巴细胞,这激活了淋巴细胞并且使其致敏以杀伤提呈该抗原的其他细胞。
抗体是由免疫系统产生的结合于细胞表面上的靶抗原的蛋白质。结合于癌症抗原的抗体可以用于治疗癌症。细胞表面受体是用于抗体治疗的常见靶标,并且包括例如CD20、CD274和CD279。一旦结合于癌症抗原,抗体可以诱导抗体依赖性细胞介导的细胞毒性,激活补体系统,或防止受体与其配体相互作用,所有这些都可以导致细胞死亡。多种抗体被批准用于治疗癌症,包括阿伦单抗(Alemtuzumab)、伊匹单抗、纳武单抗、奥法木单抗(Ofatumumab)和利妥昔单抗。
抗体依赖性细胞介导的细胞毒性(ADCC)是通过免疫系统攻击的机制,其需要抗体结合于靶细胞表面的抗体。抗体由可以通过免疫细胞经由其Fc表面受体检测到的结合区(Fab)和Fc区组成。在包括天然杀伤细胞的许多免疫系统细胞上发现了Fc受体。当天然杀伤细胞遭遇抗体包覆的细胞时,后者的Fc区与天然杀伤细胞的Fc受体相互作用,导致穿孔素和颗粒酶B的释放。这两种化学物质编程肿瘤细胞中的细胞死亡(凋亡)。有效抗体包括利妥昔单抗、奥法木单抗和阿伦单抗。
补体系统包括在抗体结合于细胞表面后引起细胞死亡的血液蛋白。通常地,系统处理外来病原体,但是可以用癌症中的治疗性抗体激活。如果抗体是嵌合的、人源化的或人的,就可以触发系统;只要它含有IgG1的Fc区。补体可以通过膜攻击复合体的激活,其被称为补体依赖性细胞毒性;增强抗体依赖性细胞介导的细胞毒性;以及CR3依赖性细胞毒性引起细胞死亡。当抗体结合于癌细胞表面、C1复合体结合于这些抗体、随后在癌细胞膜上形成蛋白孔时,补体依赖性细胞毒性会发生。
可以通过优选细胞的或基于抗体的抗肿瘤免疫疗法靶向于肿瘤相关抗原或肿瘤特异性抗原,所述肿瘤相关抗原或肿瘤特异性抗原包括但不限于唯一地或主要地由肿瘤细胞表达并且可以被免疫治疗靶向的、技术人员已知的或可以由技术人员鉴别的抗原。作为非限制性的例子,肿瘤相关抗原或肿瘤特异性抗原涵盖在由于突变导致具有异常结构的肿瘤细胞中产生的蛋白质,如原癌基因、ras和p53基因的异常产物;或与肿瘤细胞相关的其他蛋白,如组织分化抗原、分化群(通常缩写为CD)细胞表面分子、突变蛋白抗原、致癌病毒抗原、癌-睾丸抗原(cancer-testis antigens)和血管或基质特异性抗原。糖蛋白、糖脂、碳水化合物或生长因子受体也可以被认为是作为抗肿瘤免疫治疗靶标的肿瘤相关抗原或肿瘤特异性抗原。
本发明的MSC能够通过它们的来源于免疫应答刺激转基因细胞因子的独特特性和MSC固有的抗炎特性支持和/或增强本文描述的免疫治疗。
如本文描述的,“肿瘤”应该包括但不限于前列腺瘤、胰腺瘤、鳞状细胞癌、乳腺瘤、黑色素瘤、基底细胞癌、肝细胞癌、胆管细胞癌、睾丸癌、成神经细胞瘤、胶质瘤或恶性星形细胞瘤如多形性成胶质细胞瘤(glioblastma multiforme)、结肠直肠瘤、子宫内膜癌、肺癌、卵巢瘤、宫颈瘤、骨肉瘤、横纹肌/平滑肌肉瘤、滑膜肉瘤、血管肉瘤、艾文氏肉瘤/PNET和恶性淋巴瘤。这些包括原发肿瘤以及转移肿瘤(血管化的和非血管化的)。
本文公开的“间充质干细胞”可以产生循环系统和淋巴系统中的结缔组织、骨、软骨和细胞。在间充质中发现间充质干细胞,所述间充质是由宽松包裹的梭形或星形非专门化细胞组成的胚胎中胚层的一部分。如本文使用的,间充质干细胞包括但不限于CD34阴性干细胞。
在本发明的一种实施方式中,间充质干细胞是塑料粘着性细胞(plastic-adherent cells),在某些实施方式中定义为多能间充质干细胞,并且还包括CD34阴性细胞。为了避免任何疑问,术语间充质干细胞涵盖多能间充质基质细胞,该多能间充质基质细胞也包括间充质细胞、MSC和它们的前体的亚群,所述亚群由能够在体内分化为多种细胞类型的多能(multipotent)或多能(pluripotent)自我更新细胞组成。
如本文使用的,CD34阴性细胞应该是指在其表面缺少CD34的细胞或仅表达可以忽略水平的CD34的细胞。CD34阴性细胞和分离这样的细胞的方法,例如描述于Lange C.等人,“在无动物血清的培养基中快速和安全地扩增人间充质基质细胞用于移植和再生医学(Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine)”.J.Cell Physiol.2007,Apr.25中。
可以通过许多指标将间充质干细胞与造血干细胞(HSC)区别开。例如已知HSC在培养物中漂浮并且不黏着于塑料表面。相反,间充质干细胞黏着于塑料表面。本发明的CD34阴性的间充质干细胞在培养物中是粘附的。
本文描述的基因修饰的细胞可以根据其以固体、液体还是喷雾形式施用,以及对于这样的施用途径其作为注射剂是否需要无菌,包括不同类型的载体。本发明可以静脉内、皮内、动脉内、腹腔内、病变内、颅内、关节腔内、前列腺内、胸腔内、气管内、鼻内、玻璃体内、阴道内、直肠内、总体地(topically)、瘤内、肌内、腹腔内、皮下、结膜下、小泡内(intravesicularlly)、粘膜、心包内、脐带内、眼内、经口、总体地(topically)、局部地(locally),吸入(例如雾化吸入)、注射、输注、持续输注、局部灌注直接洗涤靶细胞,经由导管、经由灌洗,以膏状、以脂质组合物(例如脂质体),或通过如本领域技术人员已知的其他方法或上述的任意组合施用(见例如,雷明顿的药物科学(Remington's Pharmaceutical Sciences),18th Ed.Mack Printing Company,1990,通过引用在此并入)。
本发明涵盖了通过将治疗有效数目的细胞引入受试者的血流来治疗患者。如本文使用,将细胞“引入受试者的血流”应包括但不限于将这样的细胞通过注射引入受试者的静脉或动脉之一。这样的施用也可以进行例如一次、多次和/或在一个或多个延长的时间段内。单次注射是优选的,但是在某些情况下经过一段时间(例如每季度、每半年或每年)重复注射是必要的。这样的施用也优选使用CD34-阴性细胞和药学上可接受的载体的混合物进行。药学上可接受的载体对本领域技术人员是熟知的,其包括但不限于0.01-0.1M和优选0.05M磷酸盐缓冲液或0.8%盐水,以及通常使用的专用深低温保存培养基。
可以局部地进行施用,例如通过注入患者体内接近于肿瘤疾病的区域。MSC显示向癌组织迁移。无论如何,局部施用如本文描述的细胞会在其作用部位导致高水平的细胞。
此外,这样的药学上可接受的载体可以是水溶液或非水溶液、悬浮液和乳液,最优选是水溶液。含水载体包括水、酒精/水溶液、乳液和悬浮液,包括盐水和缓冲介质。非胃肠载体包括氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏液和固定油。静脉内载体包括流体营养补充剂、电解质补充剂如林格氏葡萄糖、基于林格氏葡萄糖的载体等。通常可以在例如雷明顿:药学的科学与实践(Remington:The Science and Practice of Pharmacy),20th Ed.,p.808,Lippincott Williams S-Wilkins(2000)中找到通常用于静脉内施用的流体。还可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂、惰性气体等。
如本文使用的,“治疗有效数目的细胞”包括但不限于以下的量和量的范围:(i)约1×102至约1×108个细胞/kg体重;(ii)约1×103至约1×107个细胞/kg体重;(iii)约1×104至约1×106个细胞/kg体重;(iv)约1×104至约1×105个细胞/kg体重;(v)约1×105至约1×106个细胞/kg体重;(vi)约5×104至约0.5×105个细胞/kg体重;(vii)约1×103个细胞/kg体重;(viii)约1×104个细胞/kg体重;(ix)约5×104个细胞/kg体重;(x)约1×105个细胞/kg体重;(xi)约5×105个细胞/kg体重;(xii)约1×106个细胞/kg体重;以及(xiii)约1×107个细胞/kg体重。人体重预期包括但不限于约5kg、10kg、15kg、30kg、50kg、约60kg;约70kg;约80kg、约90kg;约100kg、约120kg和约150kg。这些数目基于临床前的动物实验和人体试验以及来自CD34+造血干细胞移植的标准方案。单核细胞(包括CD34+细胞)通常含有1:23000至1:300000的CD34阴性细胞。
如本文使用的,“治疗”患有疾病的受试者应该是指减慢、停止或逆转疾病进程。在优选的实施方式中,治疗患有疾病的受试者是指理想地使疾病进程逆转至消除疾病本身的点。如本文使用的,改善疾病和治疗疾病是等价的。本发明的治疗也可以或供选择地涉及所述细胞的预防性施用。这样的预防性施用可以涉及防止任何给定的医学疾病,或防止所述疾病的发展,由此防止或预防将不在所有条件下狭义地被解释为绝对的防止。防止或预防可能还涉及减少受试者发展出任何给定的医学病症的风险,优选对于处于所述病症的风险中的受试者。
联合施用涵盖同时治疗,共同治疗(co-treatment)或联合治疗,并且包括施用MSC与免疫治疗剂如检查点抑制剂和/或免疫细胞的单独制剂,据此,治疗可以在彼此间的几分钟内发生,与彼此发生在同一小时内,在同一天,在同一周内或在同一个月内。术语“联合施用”还涵盖有顺序地施用组合剂(例如MSC、免疫细胞和/或检查点抑制剂)的任何给定的组合。还使用了包含一种或多种所述MSC与另一种免疫治疗剂如检查点抑制剂和/或免疫细胞的组合药物,以共同施用单次施用或单次剂量的各种组分。
通过几分钟至几周的间隔,联合免疫治疗可以在用基因修饰的干细胞治疗之前或之后。在将其他免疫治疗剂和基因修饰干细胞单独施用于感兴趣的部位的实施方式中,通常会确保在每次递送的时间之间主要的时间段没有过期,以使得药剂和基因修饰的干细胞仍然能够在治疗部位发挥有利的联合作用。在这样的情况下,预期将会使两种形式的细胞在以下时间内接触:在彼此间的约12-24小时内,以及更优选在彼此间的约6-12小时内,最优选具有仅约12小时的延迟时间。然而在某些情况下,显著延长治疗的时期可能是希望的,其中在各自施用之间经过几天(2、3、4、5、6或7)至几周(1、2、3、4、5、6、7或8)。
如本文使用的术语“基质”是指组织或器官(或腺体、组织或其他结构)的支持性骨架,通常由胞外基质(ECM)和基质细胞组成。基质与由该器官的关键功能元件组成的实质(parenchyma)不同。与表皮(皮肤的最顶层)相邻的(真皮层中的)基质细胞释放促进细胞分裂的生长因子。基质由非恶性的宿主细胞组成。基质提供了胞外基质,在所述胞外基质上肿瘤可以生长并保持存在或将它们自身从免疫环境分离。
如本文使用的,术语“肿瘤微环境”涉及任何给定的肿瘤所存在的细胞环境,包括肿瘤基质、周围的血管、免疫细胞、成纤维细胞、其他细胞、信号传导分子和ECM。
如本文使用的,“细胞迁移”或“归巢”意图是指细胞朝向特定的化学或物理信号的移动。细胞通常响应于特定的外部信号而迁移,包括化学信号和机械信号。如本文描述的MSC能够归巢至肿瘤组织或其他炎症信号。
趋化性是关于应答于化学刺激的细胞迁移的一个例子。体外趋化性测定如博伊登室测定(Boyden chamber assays)可以用于确定在任何给定的细胞中是否有细胞迁移。
例如,可以纯化和分析感兴趣的细胞。使用板可以进行趋化性测定(例如根据Falk等人,1980J.Immuno.Methods 33:239-247),在所述板中将特定的化学信号关于有兴趣的细胞和迁移的细胞放置,然后收集并且分析。例如,博伊登室测定需要使用通过过滤器分离的室,用作准确确定趋化行为的工具。这些室的先锋类型由Boyden构建(Boyden(1962)"多形核白细胞上的抗原和抗体的混合物的趋化作用(The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes)".J Exp Med 115(3):453)。将运动细胞置于上室,同时将含有测试物质的流体过填充至下室。要研究的运动细胞的尺寸决定过滤器的孔径;选择允许活性迁移的直径是必要的。对于在体内条件下建模,几种方案优选用胞外基质分子(胶原蛋白、弹性蛋白等)覆盖过滤器。通过发展多孔室(例如NeuroProbe),增加测量的有效性,其中可平行评价24、96、384个样本。该变体的优势是在相同的条件下测试多个平行样本。
如本文使用的“移入”是指将移植的(grafted)或移植的(transplanted)组织或细胞并入宿主体内的过程。移入也涉及将移植的细胞整合至宿主组织以及它们的存活和在某些条件下分化为非干细胞状态。
用于评价MSC的移入和由此MSC在一定程度上的迁移和生物分布的技术可以涵盖体内或体外方法。体内方法的例子包括生物发光,由此转导细胞以表达荧光素酶,然后可以通过它们的荧光素代谢将细胞成像,导致光发射;荧光,由此使细胞负载荧光染料或转导以表达然后可以成像的荧光报告分子;放射性核素标记,其中使细胞负载放射性核素并用闪烁照相法(scintigraphy)、正电子放射断层造影术(PET)或单光子发射计算机断层造影术(SPECT)以及磁共振成像(MRI)定位,其中用MRI扫描仪追踪负载有顺磁性化合物(例如氧化铁纳米颗粒)的细胞。评价生物分布的体外方法包括定量PCR、流式细胞术和组织学方法。组织学方法包括追踪荧光标记的细胞;对例如Y染色体和人特异性ALU序列原位杂交;和对物种特异性的或基因引入的蛋白(如细菌β-半乳糖苷酶)的组织化学染色。这些免疫组织化学方法用于辨别移入位置,但是有必要切除组织。对于进一步回顾这些方法和它们的应用,见Kean等人,MSC:递送的路径和移入细胞靶向策略以及免疫调节(MSCs:Delivery Routes and Engraftment,Cell-Targeting Strategies,and Immune Modulation),Stem Cells International,Volume 2013(2013)。
祖细胞或多能细胞,如本发明的间充质干细胞,可以被描述为基因递送载体,基本上能够使治疗性基因产物在受试者体内的特定组织或区域内定位和表达。这样的治疗性细胞提供了为其他治疗难治的疾病提供细胞治疗的能力。对于每种类型的治疗性细胞,最终目标是相同的:细胞应该表达特异性的全部基因,优选编码治疗性基因产物的外源核酸,由此修改细胞一致性以表达所述基因产物,以及提供治疗性作用,如免疫刺激作用。当本发明的细胞在体外扩增时,其表现出包括多代间充质(基质)细胞后代的异源群体,其缺少多数分化标记如CD34的表达。这些群体可能保留了沿着间充质谱系和非间充质谱系的终末分化和成熟的有限的增殖潜力和应答性。
如本文使用的“诱导型表达”或“条件性表达”涉及基因表达的状态、多重状态或系统,其中感兴趣的基因如免疫刺激细胞因子优选是不表达的,或在某些实施方式中,以可忽略的或相对低的水平表达,除非细胞中存在允许基因表达的一种或多种分子(诱导剂)或其他一组条件。诱导型启动子可以涉及在特定的生物条件下以相对高水平表达的天然存在的启动子,或涉及包括任何给定的诱导型元件的其他合成启动子。诱导型启动子可以是指通过特定组织或微环境或存在于特定组织或微环境中的生物信号的组合所诱导的启动子,或指由外部因素,例如通过施用小的药物分子或其他外部施加的信号诱导的启动子。
如本文使用的,接近组织包括例如在组织的50mm、10mm、5mm、1mm之内,在组织的0.5mm之内和在组织的0.25mm之内。
本文描述的细胞因子可以涉及与本文所称的细胞因子对应的任何哺乳动物细胞因子。优选地,细胞因子涉及人细胞因子或小鼠细胞因子。
考虑到干细胞可以显示在正常以及病态环境下对不同组织微环境的选择性迁移,本发明涵盖了与在募集的干细胞中启动的分化途径联系的组织特异性启动子的使用,并且所述组织特异性启动子理论上可以用于在限定的生物环境下仅驱动选择性表达治疗性基因。募集至其他组织部位但是没有经历分化的相同程序的干细胞不应表达治疗性基因。该方法使得显著程度地控制治疗性基因在限定的微环境内选择性表达,以及该方法已经成功应用于在新血管生成期间调节治疗性基因表达。WO 2008/150368和WO 2010/119039中公开了这样的基因修饰的可能方法,据此将其全文并入。
附图说明
为了描述本发明的具体实施方式,通过证明本发明的实践实施提供了以下附图,而不限制对本发明的范围或本文描述的构思。
附图简述:
图1:在体外表达细胞因子的基因修饰的人MSC。
图2:本发明的优选的病毒表达构建体。
图3:用病毒表达构建体转导的细胞的胞内FACS分选。
图4:转基因细胞因子的ELISA检测。
附图详述:
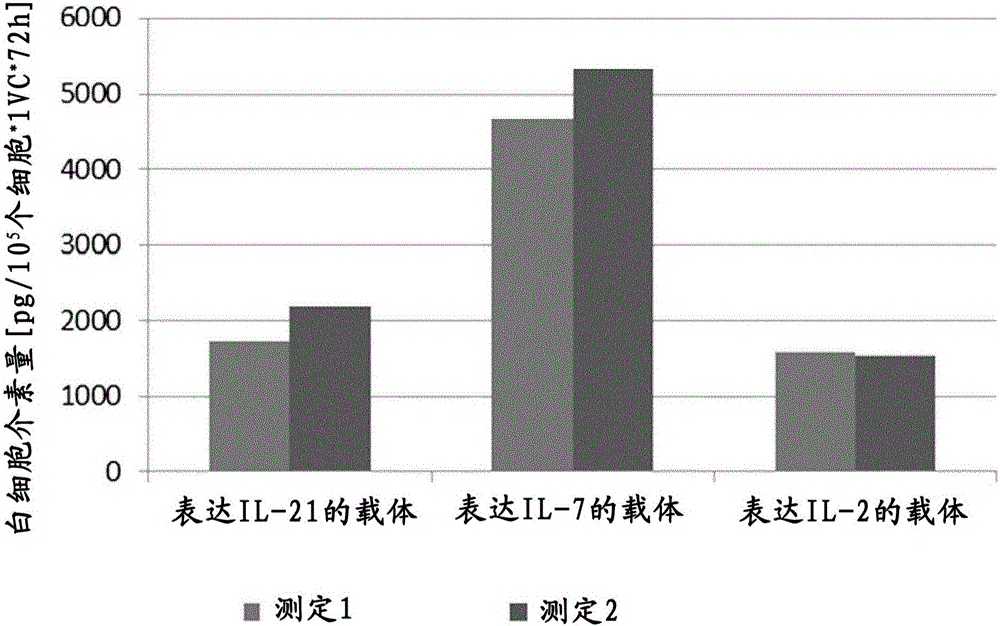
图1:在体外表达细胞因子的基因修饰的人MSC:用表达图中所示细胞因子和pac嘌呤霉素抗性基因的反转录病毒载体转导原代人MSC(MOI为0.25)。转导后,使用嘌呤霉素选择转导的MSC,并且通过qPCR确定每个细胞的平均载体拷贝数。然后将选择的细胞接种用于ELISA测定(人IL-2Thermo Scientific公司(赛默飞世尔科技公司)EH2IL2,人IL-7Thermo Scientific公司EHIL7,人IL-21Thermo Scientific公司EHIL21)。接种后72小时,接种1×105个细胞,收集上清,随后测试。以1×105个细胞和一个载体拷贝数归一化生成的数据。
图2:本发明的优选的病毒表达构建体。将构建体克隆至γ-反转录病毒骨架(pSERS11,EP2019134A1)。通过延长因子短(pEFS)启动子驱动所有构建体。存在被P2A分开的两种白细胞介素。IL-12的α-链和β-链必须被T2A分开。使用人白细胞介素序列(IL-2:基因库(GenBank):DQ861285.1,IL-7:基因库:EF064721.1,IL-12α:基因库:AF101062.1,IL-12β:NCBI参考序列:NM_002187.2,IL-15:基因库:AY720442.1,IL-21:基因库:BC066260.1)。pac基因和oPRE序列位于IRES序列之后。在构建体的5’端和3’端是LTR。骨架含有LTR,其位于构建体的5’端和3’端。构建体5’端处的LTR含有SV40增强子、RSV启动子、R区和U5区。构建体的3’端处的LTR缺失U3区、R区、U5区和多聚腺苷酸(PolyA)信号。骨架含有细菌部分:lacZ启动子、复制起点、bla基因和LacZ基因(pUC19)。
图3:用病毒表达构建体转导的细胞的胞内FACS分选。通过转染293T细胞产生编码指定载体的病毒颗粒。以0.25的MOI转导原代人MSC。用嘌呤霉素(Sigma Aldrich,P9620-10ML,10mg/mL,终浓度:3μg/mL)选择转导的细胞。通过ic-FACS分析选择的细胞。为了增强对表达的细胞因子的检测,用GolgiPlug(BD,555029)处理细胞16h以富集蛋白。根据制造商说明,使用(BD,554722)使细胞透性化;然后使用对HA-Tag特异性的抗体(Miltenyi,130-092-257)对细胞因子染色(每次染色1.33μL)。通过流式细胞术(FC500,美国贝克曼库尔特有限公司(Beckman coulter))分析细胞。
3A:未转导的细胞
3B:包括IL7和IL21的构建体,重复1
3C:包括IL7和IL21的构建体,重复2
3D:包括IL2和IL12的构建体,重复1
3E:包括IL2和IL12的构建体,重复2
3F:包括IL15和IL121的构建体,重复1
3G:包括IL15和IL12的构建体,重复2
3H:包括IL7和IL12的构建体,重复1
3I:包括IL7和IL12的构建体,重复2
3J:包括IL21和IL12的构建体,重复1
3K:包括IL21和IL12的构建体,重复2
图4:转基因细胞因子的ELISA检测。用所指示的载体转导人MSC。细胞是嘌呤嘧啶选择的细胞,以及1×105个细胞接种于6孔板。72h后收集上清,并通过ELISA分析。将生成的数据归一化为1×105个细胞和载体拷贝数。根据制造商说明,使用ELISA试剂盒:人IL-2(Thermo Scientific公司,EH2IL2),人IL-7(Thermo Scientific公司,EHIL),人IL-15(BioLegend,431707),人IL-21(Thermo Scientific公司,EHIL21)。
实施例
为了描述本发明的实际实施方式和在某些情况下的优选实施方式,通过证明本发明的实践实施提供了以下实施例,而不限制对本发明的范围或本文描述的构思。
实验模型:
根据Lange C.等人(“在无动物血清的培养基中快速和安全地扩增人间充质基质细胞用于移植和再生医学(Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine)”,J.Cell Physiol.2007,Apr.25)或Soleimani(“用于分离和培养来自小鼠骨髓的间充质干细胞的方案(A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow)”,Nat Protoc.2009;4(1):102-6)。
在细胞培养物中,细胞贴附和连续生长。可以用包含编码细胞因子的基因序列的反转录病毒载体或慢病毒载体转化MSC。根据标准方案使病毒构建体工程化,并且产生该病毒构建体,所述病毒构建体表达编码IL-2、IL-7、IL-15、IL-21、IL-12、IFNγ、IFNβ、SDF-1、CCL23、CCL19、CCL1、CCL2、CCL17、CCL22和/或CCL4和其组合的基因。
选择并进一步培养转化的细胞后,收获以用于施用。所有载体可以包括例如抗生素抗性基因,如嘌呤霉素抗性基因。因此,嘌呤霉素可以以0.1-10μg/ml或优选3-5μg/ml的浓度,用于选择转染的细胞。在注射入小鼠或其他受试者之前,使细胞从培养瓶脱离,用PBS洗涤两次,以及重悬于PBS或其他适当的缓冲液中。
可以在内源性小鼠乳腺癌模型(如WO2008150368中描述的)或原位胰腺癌模型(如WO2010119039中描述的)中进行适当的实验。在平行实验中,使用含或不含从同系受试者分离的T细胞的各种工程化的MSC,和/或检查点抑制剂,注射具有生长中的肿瘤的小鼠。五天后,可以将动物处死并且检测肿瘤。初步结果表明与适当的对照相比,前述处理的受试者中肿瘤尺寸/生长减小。
人间充质干细胞的制备:
在本实施例中,通过塑料吸附性从骨髓中分离人MSC,并且在生长培养基例如含有FBS的DMEM中培养所述人MSC,如Pittinger,M.F.(2008)来自成人骨髓的间充质干细胞(mesenchymal stem cells from adult bone marrow),在D.J.Prockop,D.G.Phinney,B.A.Bunnell,分子生物学449中的方法(Methods in Molecular Biology 449),间充质干细胞(mesenchymal stem cells),Totowa:Humana Press)中描述的。
用于表达细胞因子和趋化因子的载体的产生:
使用如Julia Lodge,Peter Lund,Steve Minchin(2007)基因克隆(Gene Cloning),New York:Tylor and Francis Group中描述的标准克隆技术,构建由启动子和用于免疫刺激因子或支持免疫应答的因子的基因(例如cDNA)组成的转基因表达盒。启动子可以是组成型启动子如CMV启动子或PGK启动子,或诱导型启动子如Tie2、RANTES或HSP70启动子。
编码免疫刺激因子或支持免疫应答的因子的基因的例子是IL-2、IL-7、IL-15、IL-21、IL-12、IFNγ、IFNβ、SDF-1、CCL23、CCL19、CCL1、CCL2、CCL17、CCL22和/或CCL4(Strengell等人,M,The Journal of Immunology,2003,170:5464–5469;Borish等人,J Allergy Clin Immunol.2003Feb;111(2Suppl):S460-7)。基因可以或不可以与标签序列(例如,标记蛋白/肽,如血细胞凝集素标签或HIS标签)融合,以使得随后容易检测表达(Hinrik Garoff,1985,细胞生物学年度综述(Annual Review of Cell Biology),Vol.1:403-445)。
然后,通过标准克隆技术将转基因插入适当的载体系统(例如慢病毒载体或γ-反转录病毒载体)。适当的载体例如由Baum(EP 1757703A2)所描述。载体可以包括或可以不包括由启动子和选择性标记基因(细胞表面标记或抗性基因,例如用于赋予嘌呤霉素抗性的pac基因)组成的第二转基因盒以在随后的过程中允许富集基因修饰的细胞(David P.Clark,Nanette J.Pazdernik,2009,生物科技:应用基因革命(Biotechnology:Applying the Genetic Revolution),London:Elsevier)。
根据本发明的优选的构建体示于图2中。
间充质干细胞的基因修饰:
如Murray等人,1999,人基因治疗(Human Gene Therapy).10(11):1743-1752和Davis等人,2004Biophysical Journal Volume 86 1234–1242描述的使用修饰物进行转导。详细地:
用聚L-赖氨酸(PLL)(例如Sigma-Aldrich,P4707-50ML)包被6孔细胞培养板(例如Corning):用PBS将PLL溶液(0.01%)稀释至终浓度为0.0001%~0.001%。将2ml稀释的PLL用于每孔。在室温下温育板至少2h。在温育之后,用PBS小心地洗涤板。
将终体积为2ml的病毒载体上清添加至每个PLL包被的孔。颗粒数目应在2×103~1×106每孔,这会导致感染复数为0.25~10。将已装载的板以2000×g,在4℃下离心30min。然后,将上清弃去,并每孔接种1×105个间充质干细胞。在37℃,5%CO2下温育板用于进一步使用。
MSC中转基因表达的分析:
流式细胞术:
为了显示免疫刺激因子在MSC中表达,进行细胞内流式细胞术测定。转导后3天,将MSC培养基更换为每1ml培养基中含有1μl BD Golgi Plug(目录号555029)的培养基,以富集转导细胞的高尔基体中的表达的因子。将细胞在37℃下温育16h,然后针对因子的表达将细胞免疫染色。收获MSC,并根据制造商的说明,使用BD Cytofix/Cytoperm细胞透性化/固定溶液(Becton Dickinson,554722)使MSC透性化以允许靶蛋白的胞内染色。用藻红蛋白(PE)(Milteny,120-002-687)标记的血细胞凝集素标签特异性抗体用于检测表达的因子。将2×105个MSC用100μl抗体(用Perm/洗涤溶液,Becton Dickinson,554723以1:75稀释)染色。供选择地,根据制造商的说明,可以使用直接针对因子的抗体(例如用PE标记的抗-IL2抗体,ebiosience公司12-7029-41)。将细胞用PBS洗涤以及重悬于PBS中。然后在FC500流式细胞仪(Beckman Coulter)上分析细胞。
图3显示了细胞因子转基因的表达。
ELISA:
将转导的MSC接种于6孔板(1×105个MSC每孔)。通过嘌呤霉素选择富集携带pac嘌呤霉素抗性基因的转导的MSC。为此,将嘌呤霉素(3μg/ml培养基)添加至培养基,在37℃和5%CO2下将细胞培养5天,每2天更换培养基以从培养物中去除未转导的细胞。然后将无嘌呤霉素的培养基用于培养。在6孔板中以限定的细胞数目1×105个细胞每孔重接种MSC并温育48小时。收集培养基,并根据制造商的说明,将所述培养基用于免疫因子特异性ELISA以定量(例如IL-7ELISA:Thermo Scientific公司,EHIL7;IL-15ELISA:Thermo Scientific公司,EHIL15)。
图4显示了细胞因子转基因的表达。
通过ELISA监测T细胞和巨噬细胞的体外激活:
如Ivan J.Fuss,Marjorie E.Kanof,Phillip D.Smith,Heddy Zola,2009Curr.Protoc.Immunol.85:7.1.1-7.1.8描述的,使用聚蔗糖梯度离心从人血液中分离外周血单核细胞(PBMC)。为了评价在体外的MSC中表达的因子的免疫刺激作用,进行共培养测定。将1~5×105个PBMC与0.2~1×105个转导的MSC、未转导的MSC(对照)或无MSC一起接种于12孔板的孔中。进行在培养物中T细胞的非特异性次最优刺激,模拟T细胞受体的衔接:因此,在细胞接种之前,用刺激性抗CD3抗体(例如OKT3,Janssen-Cilag)包被板的孔。抗体溶液应该具有0.5-0.1μg/mL的浓度。供选择地,可以以20μg/ml的浓度将PHA添加至共培养物(Ngoumou等人,Cytokine 25(2004)172-178)。在37℃和5%CO2下温育孔2~5天,之后分析。
与具有未转导的MSC的孔或不具有MSC的孔相比,用免疫刺激因子转导的MSC引起培养的T细胞的激活增高。通过测量培养物中INFγ浓度,评价T细胞的激活状态,因为这些细胞因子指示T细胞激活(Boehm等人,Annu Rev Immunol.1997;15:749-95.)。为了评价单核细胞的激活状态,收集培养基,以及确定肿瘤坏死因子α(TNFα)的释放。收集培养基,以及根据制造商说明将所述培养基用于IFNγ或TNFα特异性ELISA以定量(例如ELISA:IFNγ,Thermo Scientific公司,EHIFNG;TNFαELISA:Thermo Scientific公司,EH3TNFA)。
通过流式细胞术监测T细胞和巨噬细胞的体外激活:
如Ivan J.Fuss,Marjorie E.Kanof,Phillip D.Smith,Heddy Zola,2009Curr.Protoc.Immunol.85:7.1.1-7.1.8描述的,使用聚蔗糖梯度离心从人血液中分离外周血单核细胞(PBMC)。为了评价在体外的MSC中表达的因子的免疫刺激作用,进行共培养测定。将1~5×105个PBMC与0.2~1×105个转导的MSC、未转导的MSC(对照)或无MSC一起接种于12孔板的孔中。进行在培养物中T细胞的非特异性次最优刺激,模拟T细胞受体的衔接:因此,在细胞接种之前,用刺激性抗CD3抗体(例如OKT3,Janssen-Cilag)包被板的孔。抗体溶液应该具有0.5-0.1μg/mL的浓度。供选择地,可以以20μg/ml的浓度将PHA添加至共培养物(Ngoumou等人,Cytokine 25(2004)172-178)。在37℃和5%CO2下温育孔2~5天,之后分析。
与具有未转导的MSC的孔或不具有MSC的孔相比,用免疫刺激因子转导的MSC引起培养的T细胞和巨噬细胞的激活增高。通过胞内流式细胞术评价T细胞和巨噬细胞的激活状态。在收获细胞前24h,用每1ml培养基中含有1μl BD Golgi Plug(目录号555029)的培养基处理细胞。然后收获细胞,并且根据制造商说明,用对T细胞特异性的荧光团标记抗体(例如抗CD4,ebioscience公司17-0048或抗CD8,ebioscience公司9017-0087)或对巨噬细胞/单核细胞特异性的荧光团标记抗体(抗CD14,ebioscience公司,9017-0149)对细胞染色。然后,根据制造商说明,使用BD Cytofix/Cytoperm细胞透性化/固定溶液(Becton Dickinson,554722)透性化细胞,以允许IFNg(ebioscience公司,11-7319)或TNFa(ebioscience公司,11-7349)的胞内染色。根据制造商的说明使用抗体。然后使用FC500流式细胞仪(Beckman Coulter)分析细胞。
在动物模型中监测施用MSC的抗肿瘤作用:
在免疫缺陷小鼠(例如SCID小鼠)中,使来自人肿瘤细胞系的肿瘤生长2周,并且经由例如尾静脉,静脉内施用工程化MSC。然后,静脉内施用PBMC。然后,将肿瘤尺寸与未处理的动物或仅用MSC处理的动物或仅用PBMC处理的动物的肿瘤尺寸比较。
在另一实验中,在免疫缺陷小鼠(例如SCID小鼠)中,使来自人肿瘤细胞系的肿瘤与工程化的MSC的组合生长2周,并且静脉内施用PBMC。然后,将肿瘤尺寸与未处理的动物或仅用MSC处理的动物或仅用PBMC处理的动物的肿瘤尺寸比较。
然而,可以不使用PBMC,而使用纯化的细胞毒性T淋巴细胞(CTL)或携带CAR的CART细胞进行以上实验,所述CAR针对肿瘤上存在的肿瘤抗原。同样地,可以与MSC和PBMC、或MSC和CTL、或MSC和CART,一起使用检查点抑制剂(例如抗PD-1或抗PD-L1抗体)。
通过使针对这些细胞因子反应性的抗体,组织学分析来自以上实验的肿瘤以评价MSC表达细胞因子和细胞因子组合的量。使用苏木精和曙红染料(H&E),评价肿瘤通过PBMC、CTL和CART浸润的程度。可以通过使用抗CD3抗体的免疫组织化学法评价肿瘤通过T细胞的浸润程度。可以通过使用抗CD19抗体的免疫组织化学法评价肿瘤通过单核细胞浸润的程度。可以通过使用抗CD69抗体以及IFNγ的免疫组织化学法,评价肿瘤中浸润的T细胞的激活程度。
为了证实以上实验,以不同类型的肿瘤重复这些实验,所述肿瘤使用不同的人肿瘤细胞系和CART生长,所述CART具有针对与各自肿瘤相关抗原的特异性。
- 还没有人留言评论。精彩留言会获得点赞!
- 抗PD-L1纳米抗体及其编码序列和用途的制造方法与工艺
- 用于HPV‑相关病症的新方法、生物试验和生物标记物与制造工艺
- 用于去除血液中的促炎介质以及粒细胞和单核细胞的系统的制造方法与工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 免疫原性组合产品的制造方法与工艺
- 白介素2的超级激动剂、部分激动剂和拮抗剂的制造方法与工艺
- 表达免疫应答刺激细胞因子以吸引和/或激活免疫细胞的基因修饰间充质干细胞的制造方法与工艺
- 一种研究北虫草多糖对机体的体液免疫应答和细胞免疫应答反应的方法与制造工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种干扰乙肝病毒复制的siRNA、其构建方法及应用与制造工艺