包括野生人参或人参的人参属的包含大量稀有人参皂苷的提取物、源自人参属的形成层的植物干细胞或制备其提取物的方法与流程
本发明涉及在制备包括野生人参或人参的人参属的提取物、源自人参属形成层分生细胞或其提取物中增加稀有人参皂苷的含量的方法、通过所述方法制备的人参提取物、通过所述方法制备的源自人参属形成层分生细胞(cmc)或其提取物和用于预防或治疗糖尿病、改善血液循环或改善肝脏功能的组合物,所述组合物包含通过所述方法制备的源自人参属的人参提取物或形成层分生细胞(cmc)或其提取物作为活性成分。
背景技术:
:人参是属于人参属的植物且其根部用于医药目的。人参的医药作用可归因于作为存在于人参中的活性成分的人参皂苷。根据人参皂苷苷元的结构可将人参皂苷分为三类即原人参二醇型人参皂苷、原人参三醇型人参皂苷和齐墩果烷型人参皂苷。人参皂苷衍生物是以下化合物,其中糖例如葡萄糖、鼠李糖、木糖或阿拉伯糖与作为三萜苷元的原人参二醇或原人参三醇中的醇性oh基团即r1、r2和r3形成酯结合。人参中目前已知的主要人参皂苷包括约13种常见人参皂苷和由其转化的约11种稀有人参皂苷。人参可按多种形式使用,包括新鲜人参、通过干燥新鲜人参制备的白参和通过蒸制新鲜人参制备的红参。本领域已知新鲜人参主要包含人参皂苷例如rg1、re、rb1、rb2、rc、rd等且经加工的人参可包含增加量的在新鲜人参中很少存在的稀有人参皂苷例如rg3、rh1、rh2和化合物k。最近已积极进行了多项研究以进一步增加仅在经加工的人参产品中存在的人参皂苷的含量。红参即一种代表性的经加工的人参产品可通过蒸制新鲜人参制备且在制备过程中化学不稳定的与人参皂苷苷元的c-20位结合的苷可发生水解。通过该方法加工的红参中人参皂苷例如rh1、rh2、rg2、rg3等的量比新鲜人参或白参大。然而,已知人参皂苷rh2即一种稀有人参皂苷甚至在红参中都以非常小的量存在。由于报道了此类经加工的人参产品的药理活性成分在预防癌症、抑制癌症、降低血压、保护脑神经元、抗血栓形成、抗氧化活性等方面的作用好于包含常见人参皂苷的人参,因此已尝试了多种方法以获得在经加工的人参中可能存在的稀有人参皂苷。最熟知的方法包括通过使用微生物或通过用酸和酶水解人参皂苷增加特定人参皂苷的含量的方法。本发明的发明人在该背景下发现源自人参属形成层分生细胞中所需特定人参皂苷的含量可通过以下方法增加,所述方法包括培养源自人参属形成层分生细胞并热处理所培养的源自人参属形成层分生细胞,由此完成本发明。
背景技术:
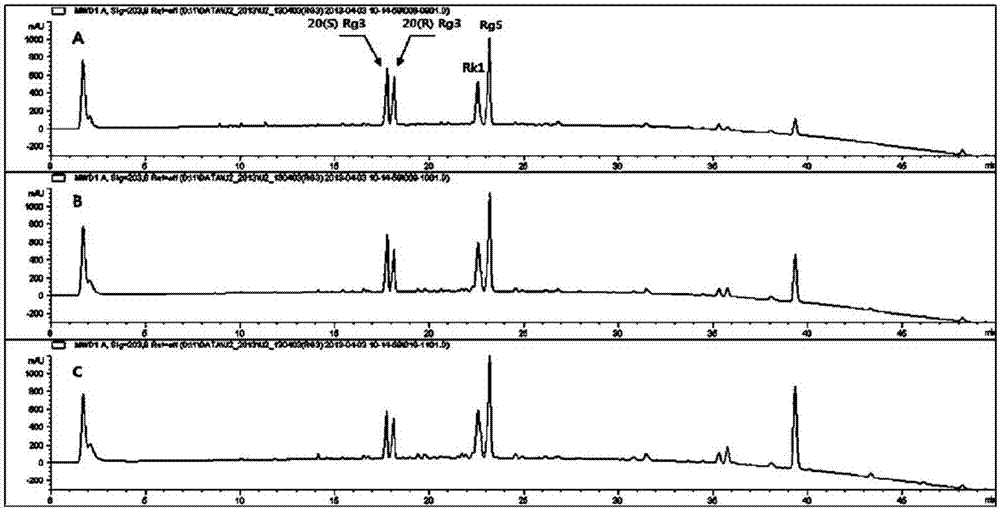
部分所公开的信息仅用于加强对本发明背景的理解且因此可不包含本领域技术人员已知的构成现有技术的信息。技术实现要素:技术问题本发明的目的是提供用于在制备有效的人参属提取物、源自人参属形成层分生细胞或其提取物中增加特定人参皂苷例如在未经处理的人参属提取物或源自人参属形成层分生细胞或其提取物中很少存在的稀有人参皂苷或用于将在未经处理的人参属提取物或源自人参属形成层分生细胞或其提取物中存在的常见人参皂苷转化成稀有人参皂苷的方法。技术方案为了实现上述目的,本发明提供用于在制备人参属形成层分生细胞(以下称为cmc)或其提取物中增加人参皂苷rh2和一种或多种选自以下的人参皂苷的含量的方法:rg3、rk1、rg5、rk2、rh3和原人参二醇(以下称为ppd),所述方法包括在85℃-160℃的温度对所培养的人参属形成层分生细胞(cmc)或其提取物进行热处理。本发明还提供用于在制备人参提取物中增加人参皂苷rh2和一种或多种选自以下的人参皂苷的含量的方法:rg3、rk1、rg5、rk2、rh3和ppd,所述方法包括在85℃-160℃的温度对人参提取物进行热处理。本发明还提供通过所述方法制备的源自人参属形成层分生细胞(cmc)或其提取物,其中人参皂苷rh2和一种或多种选自以下的人参皂苷的含量与热处理前相比是增加的:rg3、rk1、rg5、rk2、rh3和ppd。本发明还提供用于预防或治疗糖尿病的组合物,其包含源自人参属形成层分生细胞(cmc)或其提取物或人参提取物作为活性成分。本发明还提供用于预防或治疗糖尿病的方法,所述方法包括向受试者给药上述源自人参属形成层分生细胞或其提取物或人参提取物或包含其的组合物。本发明还提供用于改善血液循环的组合物,其包含源自人参属形成层分生细胞(cmc)或其提取物或人参提取物作为活性成分。本发明还提供用于改善血液循环的方法,所述方法包括向受试者给药上述源自人参属形成层分生细胞或其提取物或人参提取物或包含其的组合物。本发明还提供用于改善肝脏功能的组合物,其包含源自人参属形成层分生细胞(cmc)或其提取物或人参提取物作为活性成分。本发明还提供用于改善肝脏功能的方法,所述方法包括向受试者给药上述源自人参属形成层分生细胞或其提取物或人参提取物或包含其的组合物。附图说明图1显示了在热处理前进行静置培养的情况下对通过hplc检测的稀有人参皂苷进行分析的结果。a:在85℃提取24小时;b:在85℃提取48小时;c:在85℃提取72小时。图2显示了在热处理前不进行静置培养的情况下对通过hplc检测的稀有人参皂苷进行分析的结果(a:在85℃提取24小时;b:在85℃提取48小时;c:在85℃提取72小时)。图3显示了对通过hplc检测的稀有人参皂苷作为热处理前静置培养时间的函数进行分析的结果。图4显示了在进行或不进行搅拌的情况下对通过hplc检测的稀有人参皂苷进行分析的结果。图5显示了在热处理前对以下样品中的常见人参皂苷进行分析的结果,所述样品包括野生人参cmc、人参、红参、林下栽培的人参或所培养的野生人参不定根(a:野生人参cmc;b:人参;c:红参;d:林下栽培的人参;e:所培养的野生人参不定根)。图6显示了在热风干燥和热处理后对以下样品中所检测的稀有人参皂苷进行分析的结果,所述样品包含野生人参cmc、人参、红参、林下栽培的人参或所培养的野生人参不定根(a:野生人参cmc;b:人参;c:红参;d:林下栽培的人参;e:所培养的野生人参不定根)。图7显示了进行口服葡萄糖耐量测试(ogtt)以确认根据本发明的实施例制备的野生人参cmc的抗糖尿病作用的结果。图8显示了对根据本发明的实施例制备的野生人参cmc进行抗血小板测定的结果。图9显示了对根据本发明的实施例制备的野生人参cmc的肝炎相关肝脏功能改善作用进行评估的结果(alt:丙氨酸氨基转移酶;ast:天冬氨酸转氨酶:galn:d-半乳糖胺)。具体实施方式除非另有说明,本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员所通常理解相同的含义。通常,本文使用的命名法和下述实验方法是本领域熟知和通常使用的。在一个方面,本发明涉及用于在制备人参属形成层分生细胞(cmc)或其提取物中增加人参皂苷rh2和一种或多种选自以下的人参皂苷的含量的方法:rg3、rk1、rg5、rk2、rh3和ppd,所述方法包括在85℃-160℃的温度对所培养的人参属形成层分生细胞(cmc)或其提取物进行热处理。本发明还涉及用于在制备人参提取物中增加人参皂苷rh2和一种或多种选自以下的人参皂苷的含量的方法:rg3、rk1、rg5、rk2、rh3和ppd,所述方法包括在85℃-160℃的温度对人参提取物进行热处理。根据本发明可通过对所培养的人参属形成层分生细胞或其提取物进行热处理的方法而非通过常规方法即蒸制或用酸、酶或微生物处理来显著增加稀有人参皂苷特别是rh2的含量。本文使用的术语“源自人参属形成层分生细胞”是指分离自人参属的形成层组织的先天未分化的细胞,其特征在于其为同质细胞,尚未分化成胼胝体且具有分生连续性。本发明的发明人首次分离了源自人参属形成层分生细胞,其为来自植物形成层的先天未分化的细胞,这与去分化的胼胝体是不同的。用于分离人参属形成层分生细胞的方法详细描述在韩国专利号1064518中,其可通过引用的方式并入本文中。在本发明中使用的形成层分生细胞可为例如白参、野生人参或林下栽培的人参的形成层分生细胞,尽管形成层分生细胞所源自的人参的类型不受到具体的限制,只要细胞是以下人参属形成层分生细胞,所述细胞为先天未分化的同质细胞,尚未分化成胼胝体且具有分生连续性。可在本发明中使用的人参属的来源不受到具体的限制。例如,在本发明中使用的人参属可为韩国、美国、日本、喜马拉雅、越南或中国的人参。可在本发明中使用的人参属形成层分生细胞的实例包括但不限于完整的分生细胞或其粉末、浓缩物或提取物。在本发明的一个实施方案中,粉末或提取物(常见人参皂苷提取物)可主要用于将其人参皂苷转化成稀有人参皂苷,但是本领域一般市售的任何形式也可在实施本发明中使用。分生细胞提取物或人参提取物可通过本领域一般使用的任何方法制备。例如,提取物可如下制备:将1重量份分生细胞或干燥的人参与10-500重量份蒸馏水混合,然后在50℃-100℃的温度提取。本发明由此发现在使用红参、林下栽培的人参或所培养的野生人参不定根的情况下,即使当使用本发明的方法时,也不能预期稀有人参皂苷例如rh2的含量可增加至所需程度,但是人参属形成层分生细胞中稀有人参皂苷例如rh2的含量可通过简单的操作即对所培养的人参属形成层分生细胞进行热处理来显著增加。人参皂苷例如rg3、rk1、rg5、rh2、rk2、rh3或ppd是以非常小的量包含在没有根据本发明处理的未经加工的人参中或不存在或几乎不存在于未经加工的人参中的稀有人参皂苷。然而,根据本发明的方法通过热处理操作将主要包含在未经加工的人参提取物、人参属形成层分生细胞或其提取物中的人参皂苷例如rg1、re、rb1、rb2、rc、rd、绞股蓝皂苷xvii或f2(以下称为常见人参皂苷)转化成稀有人参皂苷。因此,稀有人参皂苷rh2和一种或多种选自以下的稀有人参皂苷的含量与未经加工的(未经热处理的)人参提取物相比是增加的:rg3、rk1、rg5、rk2、rh3和ppd。在一些情况下根据本发明,人参属形成层分生细胞或其提取物中的rh2、rg3、rg5和ppd或rh2、rg3、rk1、rg5、rk2、rh3和ppd(称为“稀有人参皂苷”)中的全部可为增加的。另外,人参提取物中rh2、rg3、rg5和ppd的含量与未经特别处理的未经加工的(未经热处理的)人参提取物相比是增加的。稀有人参皂苷的含量的增加可指通过本发明的方法将常见人参皂苷转化成稀有人参皂苷。具体地,其可意为rh2和一种或多种选自以下的人参皂苷按人参皂苷的总重量计以80-100wt%或90-98wt%的量包含在根据本发明的方法制备的人参提取物、人参属形成层分生细胞或其提取物中:rg3、rk1、rg5、rk2、rh3和ppd。若稀有人参皂苷例如rh2和一种或多种选自以下的人参皂苷以80-100wt%的量被包含:rg3、rk1、rg5、rk2、rh3和ppd,则常见人参皂苷例如rg1、re、rb1、rb2、rc、rd、绞股蓝皂苷xvii或f2的含量可为20-0wt%。若稀有人参皂苷按人参皂苷的总重量计以100wt%的量被包含,则其可指处理前包含在人参提取物、人参属形成层分生细胞或其提取物中的常见人参皂苷完全转化成稀有人参皂苷。在本文中,稀有人参皂苷为rh2和一种或多种选自以下的稀有人参皂苷:rg3、rk1、rg5、rk2、rh3和ppd。在本文中,rh2可按rg3、rk1、rg5、rh2、rk2、rh3和ppd的总重量计以10-35wt%或11-33wt%的量被包含。已发现即使当使用本发明的方法时,rh2在人参、林下栽培的人参或所培养的野生人参不定根中的含量也仅为稀有人参皂苷在根据本发明制备的人参提取物、人参属形成层分生细胞或其提取物中的含量的3-8%。人参属形成层分生细胞可根据韩国专利号1064518公开的方法分离。所分离的分生细胞可通过用于增殖的培养步骤(增殖培养)或用于生产的培养步骤(生产培养)培养。用于增殖培养的培养基可为包含3%蔗糖的ms培养基(murashigeandskoog’s,1962)。可将人参属形成层分生细胞接种在培养基中且然后在适于培养的空气流量条件下培养约13天。用于生产培养的培养基可为包含3%红糖的经改良的ms培养基。可将人参属形成层分生细胞在增殖培养后接种在培养基中且然后用引发剂处理并在适于培养的空气流量条件下培养约11天。引发剂的实例包括选自以下的任何物质:茉莉酸甲酯、真菌提取物、细菌提取物、酵母提取物、壳聚糖、葡甘露聚糖、葡聚糖、苯丙氨酸、苯甲酸、水杨酸、花生四烯酸、sts、甲羟戊酸、n-苯甲酰基甘氨酸、aba、snp、ipp、bht、ccc、乙烯利、马尿酸、硝酸铈铵、agno3、硫酸氧钒、对氨基苯甲酸、油菜素类固醇、藻酸钠和乙酸钠。优选地,茉莉酸甲酯可用作引发剂。在该情况下,用作引发剂的茉莉酸甲酯可按50-200μm的量使用。在通过增殖培养和生产培养过程培养的人参属形成层分生细胞中,常见人参皂苷例如rg1、re、rb1、rb2、rc、rd、绞股蓝皂苷xvii或f2可存在,而稀有人参皂苷例如rg3、rk1、rg5、rh2、rk2、rh3或ppd可检测不到。本发明的方法包括在85℃-160℃的温度对所培养的人参属形成层分生细胞或其提取物进行热处理的步骤。通过该步骤可制备人参属形成层分生细胞或其提取物,其包含增加量的稀有人参皂苷作为将常见人参皂苷转化成稀有人参皂苷的结果。在一个实施方案中,根据本发明的方法还可包括在热处理步骤前将所培养的人参属形成层分生细胞分散在蒸馏水中的步骤。在一些情况下,可在分散在蒸馏水中前还进行冷冻干燥。通过冷冻干燥可便利地控制并储存细胞且可除去存在于水中的细胞和微生物等中的一部分水,微生物通过细胞中的水发生的增殖可受到抑制。用于分散人参属形成层分生细胞的蒸馏水可按1-200重量份或30-200重量份每重量份干燥的人参属形成层分生细胞的量使用。当使用分生细胞而不进行干燥时,蒸馏水可按2-15重量份或2.5-10重量份每重量份未干燥的形成层分生细胞的量使用。当蒸馏水的量与人参属形成层分生细胞的量的比例在上述范围内增加时,稀有人参皂苷的含量可增加同时常见人参皂苷的含量减少。本发明的方法还可包括在分散步骤后对分散在蒸馏水中的人参属形成层分生细胞进行静置培养而不震摇的步骤。静置培养可如下进行:使与蒸馏水混合的人参属形成层分生细胞在静置状态中在例如1-35℃或10-24℃的温度保持1-15天或2-10天。已发现通过包括该步骤的方法制备的人参属形成层分生细胞包含很少或不包含常见人参皂苷且包含显著增加量的稀有人参皂苷。具体地,已发现当静置时间在上述范围内增加时,稀有人参皂苷中rh2的含量大幅增加。在另一个实施方案中,根据本发明的方法还可包括在热处理步骤前对所培养的人参属形成层分生细胞进行热风干燥的步骤。已发现通过包括该步骤的方法制备的人参属形成层分生细胞包含很少或不包含常见人参皂苷且包含显著增加量的稀有人参皂苷。具体地,已发现稀有人参皂苷中rh2的含量大幅增加。热风干燥可在热风干燥机中在例如45-75℃或50-70℃的温度进行。热风干燥在该情况下可持续例如24-72小时或30-60小时。已发现通过在上述范围内进行热风干燥制备的人参属形成层分生细胞包含显著增加量的稀有人参皂苷。具体地,已发现稀有人参皂苷中rh2的含量大幅增加。根据本发明的方法包括在静置培养或热风干燥后对人参属形成层分生细胞进行热处理。热处理可指使用蒸馏水在85-160℃的温度进行热水提取。由于这些细胞在静置培养前处于分散在蒸馏水中的状态,因此可在静置培养后立即在85-160℃的温度对人参属形成层分生细胞进行热处理。另外,还可在热风干燥后将人参属形成层分生细胞分散在蒸馏水中并进行热处理。在本文中,蒸馏水可按1-200重量份每重量份干燥的人参属形成层分生细胞或30-200重量份每重量份人参属形成层分生细胞的量使用。热处理可如下进行:在85-160℃或85-115℃或95-115℃的温度对形成层分生细胞进行加热。根据本发明已确定适于将常见人参皂苷转化成稀有人参皂苷的温度范围且已发现稀有人参皂苷的含量在上述温度范围内是增加的。当热处理温度在上述范围内增加时,稀有人参皂苷的含量可增加同时常见人参皂苷的含量减少或常见人参皂苷可完全转化成稀有人参皂苷。热处理可进行例如10分钟至72小时或24小时至72小时或48小时至72小时。本发明已确定了适于将常见人参皂苷转化成稀有人参皂苷的热处理时间范围。具体地,在经上述时间范围热处理的人参属形成层分生细胞中检测到稀有人参皂苷。当热处理时间在上述时间范围内增加时,稀有人参皂苷的含量可增加同时常见人参皂苷的含量减少或常见人参皂苷可完全转化成稀有人参皂苷。热处理可在大气压下进行,但是压力也可随温度增加而增加。当使用在上述温度范围内的热时,热处理可例如在正常压力(范围为0.57-6.1atm)下进行。本发明的方法还可包括在热处理期间进行搅拌。在本文中,搅拌可按例如10-200rpm或30-180rpm进行。当在该条件下进行搅拌时,稀有人参皂苷的含量与不进行搅拌的情况相比可进一步增加。另外,当进行搅拌时,稀有人参皂苷的含量可增加或常见人参皂苷转化成稀有人参皂苷所需要的时间可减少。在另一个方面,本发明涉及人参属形成层分生细胞或其提取物,其通过上述方法制备且特征在于稀有人参皂苷rh2和一种或多种选自以下的人参皂苷的含量与热处理前相比是增加的:rg3、rk1、rg5、rk2、rh3和ppd。另外,本发明涉及通过上述方法制备且具有增加的人参皂苷rh2和一种或多种选自以下的人参皂苷的含量的人参提取物:rg3、rk1、rg5、rk2、rh3和ppd。与稀有人参皂苷或其含量相关的上述构型同样可应用于与人参属形成层分生细胞、其提取物和人参提取物相关的发明。在另一个方面,本发明涉及用于预防或治疗糖尿病的组合物,其包含作为活性成分的上述分生细胞或其提取物或人参提取物。本发明还涉及用于预防或治疗糖尿病的方法,所述方法包括向受试者给药上述人参属形成层分生细胞或其提取物或人参提取物或包含其的组合物。已发现根据本发明的包含增加量的稀有人参皂苷的人参属形成层分生细胞、其提取物或人参提取物显示出显著的葡萄糖耐量,这表明其显示出抗糖尿病作用。另外,本发明涉及用于改善血液循环的组合物,其包含作为活性成分的上述分生细胞或其提取物或人参提取物。另外,本发明涉及用于改善血液循环的方法,所述方法包括向受试者给药上述人参属形成层分生细胞或其提取物或人参提取物或包含其的组合物。已发现根据本发明的包含增加量的稀有人参皂苷的人参属形成层分生细胞、其提取物或人参提取物显示出有效抑制血小板聚集的能力,这表明其在改善血液循环方面具有显著的作用。上述血液循环可不但通过包括血细胞比容、粘度、由血液诱导的剪切应力等在内的物理因素来控制,而且可通过血液甘油三酯组成、血细胞(血小板)等的变化来控制。稳态在正常条件下良好维持,但是当血液循环调节功能被疾病状态例如糖尿病、药物、吸烟等扰乱时,血浆、血小板、红细胞等将过度聚集且将发生异常凝血,由此干扰血流。另外,已知当活化的血小板聚集受到促进时,血流稳态将被破坏且因此血流紊乱将引起动脉硬化、中风、心血管疾病、缺血性心脏病和脑血管疾病的发病。根据本发明用于改善血液循环的组合物可抑制血栓形成以有助于改善血液循环且因此预防细胞和各个器官的老化并促进细胞的生长和再生。具体地,其可改善血流以由此预防或治疗血液循环障碍例如动脉硬化、脑出血、中风和/或脑梗塞和/或外周血流紊乱、冷肢、由头皮血液循环紊乱引起的脱发症状。另外,本发明涉及用于改善肝脏功能的组合物,其包含作为活性成分的上述人参属形成层分生细胞或其提取物或人参提取物。另外,本发明涉及用于改善肝脏功能的方法,所述方法包括向受试者给药上述人参属形成层分生细胞或其提取物或人参提取物或包含其的组合物。在本发明中,改善肝脏功能可包括例如预防或治疗脂肪肝疾病。脂肪肝疾病可为酒精性脂肪肝疾病、非酒精性脂肪肝疾病、营养性脂肪肝疾病、饥饿性脂肪肝疾病、由肥胖引起的脂肪肝疾病、糖尿病性脂肪肝疾病或脂肪性肝炎。另外,对肝脏功能的改善可包括预防或治疗肝病例如肝硬化、酒精性肝硬化、脂肪肝、中毒性肝病和急性或慢性肝炎。已发现根据本发明的具有增加含量的稀有人参皂苷的人参属形成层分生细胞、其提取物或人参提取物在改善肝炎和缓解非酒精性脂肪肝方面显示出显著的作用。本发明的组合物可按包含单独的人参属形成层分生细胞、其提取物或人参提取物或其与至少一种药用载体、赋形剂或稀释剂的组合的药物组合物形式提供。另外,药物组合物可取决于疾病种类及其严重性、患者年龄、体重、健康状况和性别、给药途径和治疗时段以药物有效量给药。本发明的组合物基于此类因素的确定取决于本领域技术人员的水平。通常,组合物可按0.0001mg/kg至2,000g/kg的每日剂量给药。本文使用的术语“药用”是指当给药至人类时是生理上可接受的且不引起胃部不适、变态反应例如胃肠不适或眩晕或类似反应的组分。所述载体、赋形剂或稀释剂的实例可包括乳糖、右旋糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藓醇、麦芽醇、淀粉、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、硬脂酸镁和矿物油。本发明的药物组合物还可包含填料、抗聚集剂、润滑剂、润湿剂、香料、乳化剂和防腐剂。另外,本发明的药物组合物可使用本领域熟知的方法配制,从而使其在给药至哺乳动物后可提供活性成分的快速、持续或延迟释放。可将本发明的药物组合物配制成粉末剂、颗粒剂、片剂、乳剂、糖浆剂、气雾剂、软或硬明胶胶囊剂、无菌注射溶液剂、无菌粉末剂等形式。根据本发明的人参属形成层分生细胞可按例如功能性食品形式提供。本文使用的术语“功能性食品”是指所标称的功能是由于包含人参属形成层分生细胞作为活性成分而显示出疾病预防或治疗作用的食品。功能性食品可呈例如粉末、颗粒、片剂、胶囊或饮料形式。另外,功能性食品还可包含作为可接受的食品添加剂的各种营养物、维生素、矿物质(电解质)、矫味剂例如合成矫味剂和天然矫味剂、着色剂和改进剂、果胶酸及其盐、藻酸及其盐、有机酸、保护性胶体增稠剂、ph控制剂、稳定剂、防腐剂、甘油、醇或碳酸化剂。实施例以下将参照实施例进一步详细描述本发明。对于本领域技术人员显而易见的是,这些实施例仅用于说明性目的,而不应该被理解为是对本发明范围的限制。实施例1:包含由常见人参皂苷转化的稀有人参皂苷的人参提取物1.包含由常见人参皂苷转化的稀有人参皂苷的人参提取物的制备添加人参(panaxginsengc.a.meyer)根提取物粉末(xianlvsenbiotechnologyco.,ltd.)并以30:1的比例溶解在蒸馏水中(0.033%浓度)且然后在120℃在正常压力下热处理48小时。冷却提取物并仅收集所形成的析出物。冷冻干燥所收集的析出物。2.hplc分析在以下条件下使用agilenthplc1260dad系统和zorbaxeclipseplusc18(4.6×100mm,3.5μm)柱(agilent)以对稀有人参皂苷进行分析:dad检测器的检测波长:uv203nm;柱温度:30℃;流动相:包含0.05%三氟乙酸的水和乙腈;和流速:1ml/min。在对常见人参皂苷和稀有人参皂苷进行的分析中调整流动相的比例。在分析中使用的人参皂苷标准品购自chromadex(usa)、sigma-aldrich(usa)和amboinstitute(korea)。由于稀有人参皂苷rk2和rh3的标准品不存在,因此没有对rk2和rh3进行定量分析且仅通过lc/ms鉴定了rk2和rh3。在分析中使用的溶剂为乙腈(merck,germany)、甲醇(j.tbaker,usa)或三氟乙酸(daejung,korea)。使用变化的甲醇/水比例由每个样品提取人参皂苷并通过0.2μm过滤器过滤提取物且然后进行分析。对向稀有人参皂苷的转化进行分析且分析结果显示在下表1中。表1:人参提取物中转化的稀有人参皂苷*每个数值表示1g人参提取物粉末中人参皂苷的含量(mg)。实施例2:包含由常见人参皂苷转化的稀有人参皂苷的野生人参形成层分生细胞(cmc)粉末的制备1.野生人参cmc的培养由人参(野生人参,gangwon-do,korea)形成层分离野生人参cmc。对野生人参cmc的培养逐渐由250ml烧瓶放大至3l生物反应器、20l生物反应器和250l生物反应器。在一般植物细胞培养中,2,4-二氯苯氧基乙酸或萘乙酸用作细胞生长调节剂以诱导细胞分裂。然而,在所建立的增殖培养条件下在不存在生长调节剂的情况下培养野生人参cmc。就用于保持野生人参cmc的鲜重的增殖培养条件而言,使用包含3%蔗糖的ms培养基(murashigeandskoog’s,1962)并将ms培养基的ph调节至5.8并培养13天。增殖培养结束后,用100μm茉莉酸甲酯处理11天后,在包含3%红糖的经改良的ms培养基中进行生产培养。在相同的培养室中进行增殖培养和生产培养且将培养室在黑暗条件下维持在21±1℃的温度。2.包含由常见人参皂苷转化的稀有人参皂苷的cmc的制备通过增殖培养和生产培养获得生物质和常见人参皂苷(rb1、rb2、rc和rd)后,将细胞在培养室中在空气关闭条件下静置培养5天。在提取器中对细胞进行热处理以获得包括rg3、rk1、rg5、rh2、ppd等在内的稀有人参皂苷。通过热处理操作将常见人参皂苷转化成稀有人参皂苷(rg3、rk1、rg5、rh2、rk2、rh3和ppd)后,收集生物质且然后干燥(冷冻干燥或热风干燥)。3.hplc分析以与实施例1所述相同的方式对野生人参cmc中的稀有人参皂苷进行分析。实验实施例1:根据在提取中使用的各种水比例对向稀有人参皂苷转化的比例进行比较在实施例2-1后的实施例2-2期间,将1重量份干燥的野生人参cmc和20-200重量份蒸馏水的混合物在提取器中在85℃热处理24小时以确定适于将常见人参皂苷转化成稀有人参皂苷的cmc/蒸馏水比例。表285℃/24h对照1:301:501:1001:1501:200rb115.614.420.280.250.000.00rc4.951.400.720.150.000.00rb22.521.280.580.120.000.00rd1.854.573.111.050.510.29绞股蓝皂苷xvii0.146.133.951.000.430.25f200.860.890.850.810.72rg3026.1930.8333.9534.1031.19rk107.147.557.637.417.00rg5013.9115.5015.7915.3214.44rh2015.9219.1822.9823.9122.57总和25.181.882.683.882.576.5*每个数值表示1g干燥的野生人参cmc中人参皂苷的含量(mg)。由上表2可知在热处理温度为85℃且热处理时间为24小时的条件下,野生人参cmc中大部分常见人参皂苷的含量随蒸馏水比例增加而减少。实验实施例2:根据热处理温度对向稀有人参皂苷转化的比例进行比较在实施例2-1后的实施例2-2期间,将1重量份干燥的野生人参cmc和100重量份蒸馏水的混合物在提取器中在范围为85℃-115℃的温度热处理24小时以确定适于将常见人参皂苷转化成稀有人参皂苷的温度。表3*每个数值表示1g干燥的野生人参cmc中人参皂苷的含量(mg)。由上表3可知在cmc/水比例为1:100且热处理时间为24小时的条件下,野生人参cmc中大部分常见人参皂苷的含量随热处理温度增加而减少。实验实施例3:根据热处理时间对向稀有人参皂苷转化的比例进行比较在实施例2-1后的实施例2-2期间,将1重量份干燥的野生人参cmc和100重量份蒸馏水的混合物在提取器中在85℃热处理24-72小时以确定适于将常见人参皂苷转化成稀有人参皂苷的时间。表41:100/85℃对照24h48h72hrb115.610.250.000.00rc4.950.150.000.00rb22.520.120.000.00rd1.851.050.000.00绞股蓝皂苷xvii0.141.000.000.00f200.850.000.00rg3033.9537.7938.65rk107.638.839.15rg5015.7917.7918.11rh2022.9828.6332.00总和25.183.893.097.9*每个数值表示1g干燥的野生人参cmc中人参皂苷的含量(mg)。由上表4可知在cmc/水比例为1:100且热处理温度为85℃的条件下,野生人参cmc中的大部分常见人参皂苷随热处理时间增加而几乎不存在。实验实施例4:根据是否进行静置培养对稀有人参皂苷的生产率进行比较以与实施例2-2所述相同的方式制备额外的野生人参cmc,不同的是在热处理前不进行静置培养。在热处理前静置培养5天所获得的结果与不进行静置培养所获得的结果的比较显示在图1和2中。由图1和2可知当进行静置培养时,稀有人参皂苷中rh2和ppd的含量是增加的(参见图1),这与不进行静置培养的情况(参见图2)是不同的。实验实施例5:根据静置时间对稀有人参皂苷的生产率进行比较以与实施例2-2所述相同的方式制备野生人参cmc(在95℃热处理48小时)且各种静置时间所获得的稀有人参皂苷的含量显示在图3和下表5中。由图3和表5可知稀有人参皂苷中rh2的含量随静置时间增加而增加。表5实验实施例6:根据是否进行搅拌对稀有人参皂苷的生产率进行比较在实施例2中,将1重量份(按鲜重计)野生人参cmc和2.5-10重量份蒸馏水(50-200重量份蒸馏水每干燥重量份cmc)的混合物以30-180rpm搅拌同时将其在95℃热处理48小时并检查稀有人参皂苷的含量是否由于搅拌操作而变化。由图4和下表6可知当进行搅拌时,稀有人参皂苷例如rg3、rh2、rg5和ppd的含量高于不进行搅拌的情况。表6实施例3:进行热风干燥和热处理以与实施例2-1所述相同的方式制备野生人参cmc。将所制备的cmc在hk-06h(koreatechnologyeng,co.,ltd.)中在60℃热风干燥48hr且然后粉末化(120目筛),然后将1重量份粉末添加至100重量份蒸馏水中并在95℃热水提取48小时。另外,在与上述相同的条件下还对人参、红参、林下栽培的人参和所培养的野生人参不定根进行了热处理。结果显示在图5和6及下表7和8。表7表8由图5和上表7可知热风干燥的野生人参cmc中常见人参皂苷例如绞股蓝皂苷xvii和f2的含量高于其它人参产品和进行热处理的情况,野生人参cmc中rh2的含量显著高于其它人参产品。另外,除红参外,人参、林下栽培的人参和所培养的野生人参不定根以未干燥(新鲜)状态购买且在与上述相同的条件下热风干燥,但是可观察不到可对稀有人参皂苷rh2的产生有影响的常见人参皂苷例如绞股蓝皂苷xvii和f2的含量的增加且可观察到即使进行热处理,其中稀有人参皂苷rh2的含量也是非常低的。这似乎是因为如绞股蓝皂苷xvii和f2那样的其中一个葡萄糖分子与c-3碳位置连接的结构就获得rh2而言是有利的。具体地,在绞股蓝皂苷xvii和f2中,两个葡萄糖分子与c-20碳位置连接且一个葡萄糖分子与c-3碳位置连接。明显的是,当与c-20碳位置连接的两个葡萄糖分子易于通过热而除去且仅一个葡萄糖分子保持与c-3碳位置连接时获得rh2。因此,获得上述结果。另外,如图6和表8所示,根据本发明的热处理方法可将大部分常见人参皂苷转化成稀有人参皂苷。将未干燥(新鲜)的野生人参cmc在细胞水平加热,而对于冷冻干燥和热风干燥的野生人参cmc来说以粉末状态进行加热且因此具有高的传热效率且在转化成稀有人参皂苷方面具有优势。例如,红参如下制备:在保持新鲜人参的特征形式的情况下蒸制新鲜人参。由此可知红参中最稀有的人参皂苷的含量是低的且常见人参皂苷的含量是高的。然而,当对新鲜人参进行粉末化且使用根据本发明的热处理方法时,可观察到大部分常见人参皂苷转化成稀有人参皂苷且稀有人参皂苷rg3的含量也是高的。如上所述,与常见的红参、新鲜人参、林下栽培的人参或所培养的野生人参不定根不同的是,通过本发明的方法获得的野生人参cmc具有含量显著增加的包括rh2在内的稀有人参皂苷。由于在野生人参cmc或干燥后经研磨或粉末化的产品的具有数百纳米至数十微米的粒度的细胞水平进行热处理,因此传热效率是高的。这导致与苷元ppd的c-20碳位置连接的糖分子易于除去。已作出各种尝试以增加稀有人参皂苷的含量。然而,当使用红参、新鲜人参、林下栽培的人参或所培养的野生人参不定根时,其在组织水平经历各种处理(用热、酶、酸、碱等进行处理)。因此明显的是,由c-20位置除去糖的效率是非常低的且稀有人参皂苷的含量的增加是非常低的。实施例4:包含由常见人参皂苷转化的稀有人参皂苷的野生人参cmc提取物1.包含由常见人参皂苷转化的稀有人参皂苷的野生人参cmc提取物的制备将1干燥重量份干燥的野生人参cmc和50-200重量份蒸馏水的混合物在75℃提取18小时。将提取物与野生人参cmc分离并通过0.2μm过滤器过滤,由此制备野生人参cmc提取物。将所制备的野生人参cmc提取物在高压釜(msr-3l-150/250-md-s6-sys,phos-entech,co.,ltd.)中在140℃、150℃或160℃在正常压力下热处理60分钟。冷却野生人参cmc提取物并收集所形成的析出物并冷冻干燥。2.hplc分析以与实施例1所述相同的方式对野生人参cmc提取物中的稀有人参皂苷进行分析。对向稀有人参皂苷的转化进行分析且分析结果显示在下表9中。表9:野生人参cmc提取物中转化的稀有人参皂苷的含量实验实施例7:野生人参cmc的抗糖尿病作用通过口服葡萄糖耐量测试(ogtt)对实施例2制备的野生人参cmc的抗糖尿病作用进行检验。将野生人参cmc在95℃热处理48小时且口服给药通过用70%乙醇提取cmc获得的提取物。c57bl/6j小鼠(8周龄,雄性)禁食过夜。对c57bl/6j小鼠的体重和血糖水平进行测量且然后向小鼠口服给药2g/kgd-葡萄糖。小鼠在此时用饮用水饲喂,但是不进食。以2小时间隔历时2小时测量血糖水平的变化。测量结果显示在图7和下表10中。当口服给药d-葡萄糖时,与正常组不同的是,糖尿病组显示出很小的葡萄糖耐量或没有显示出葡萄糖耐量。对野生人参cmc提取物与在抗糖尿病领域中已知作为健康补剂的抗性麦芽糖糊精(rmd)和红参提取物(rg-200)进行比较。结果表明野生人参cmc(野生人参cmc-200)显示出与已知作为健康补剂的样品相当的葡萄糖耐量(抗糖尿病作用)。表10:血糖水平(mg/dl)时间正常dmrmdrg-200野生人参cmc-20001183541692392143038660048548648960255567350372368120152547282279315dm:未经治疗的糖尿病组;rmd:用抗性麦芽糖糊精(2g/kg)治疗的糖尿病组;rg-200:用红参提取物(200mg/kg)治疗的糖尿病组;野生人参cmc-200:用野生人参cmc提取物(200mg/kg)治疗的糖尿病组。实验实施例8:野生人参cmc在改善血液循环方面的作用对实施例2制备的野生人参cmc进行抗血小板测定。在95℃热处理48小时的野生人参cmc用70%乙醇提取并口服给药野生人参cmc提取物。制备3.2%枸橼酸三钠并以1:9(v/v)的比例与由腹主动脉获得的血液混合。将混合物在辊式混合器中放置10分钟且然后以1000rpm在室温离心10分钟且然后收集上清液(血小板富集血浆;prp)。使用ppp对prp的血小板数目进行计数并以250-400×103个血小板/ml的浓度稀释prp并将稀释液在辊式混合器中放置5分钟。在聚集计(chrono-log,usa)中将prp或添加有样品的prp预加热至37℃且然后将诱导血小板聚集的激动剂(adp、胶原等)滴入到prp中。然后使用ppp作为对照测量浊度的变化以确定聚集率(%)(100:最高聚集;0:最低聚集)。可将抑制百分比表示为以下方程式。抑制(%)=(对单独prp的抑制(%)-对prp/样品混合物的抑制(%))/对单独prp的抑制(%)×100结果显示在图8和表11中。使用在血液循环改善领域中已知作为健康补剂的银杏叶提取物(gb-40)和红参提取物(rg-50)作为对照。与对照进行比较的结果表明与已知作为健康补剂的样品相比,野生人参cmc提取物(野生人参cmc-20和野生人参cmc-50)具有优异的血液循环作用。表11:对血小板聚集的抑制百分比gb-40rg-50野生人参cmc-20野生人参cmc-50抑制%18.520.128.537.8gb-40:银杏叶提取物(40mg/kg)治疗组;rg-50:红参提取物(50mg/kg)治疗组;野生人参cmc-20:野生人参cmc提取物(20mg/kg)治疗组;野生人参cmc-50:野生人参cmc提取物(50mg/kg)治疗组。实验实施例9:野生人参cmc在改善肝脏功能方面的作用1.对抗由galn诱导的肝炎的肝脏功能改善作用将冷冻干燥的野生人参cmc溶解在无菌盐水中并经由探条口服给药。7周龄雄性sprague-dawley大鼠禁食18小时并向大鼠腹膜内给药galn(700mg/kgpbs)。24小时后,由大鼠提取血液和肝脏组织并测量血清alt和ast活性。在给药galn前历时14天在相同的指定时间将测试样品每天一次口服给药至大鼠。在给药galn当天在给药前2小时和在给药galn后6小时口服给药测试样品。图9表明用75、150和300mg/kg野生人参cmc治疗2周的由galn诱导的模型中血清alt和ast的水平与用阳性对照水飞蓟素治疗的组相比是被显著抑制的。2.在改善非酒精性脂肪肝方面的作用将野生人参cmc混悬在蒸馏水中且然后经由探条口服给药10周。历时10周向57bl/6小鼠(22-26g)给予高脂肪膳食以诱导脂肪肝。每个动物组随意获得固体饲料即高脂肪膳食饲料(researchdiets,inc.,newbrunswick,nj,usa)和水。由表12可知野生人参cmc的给药大幅降低了体重、血清和肝甘油三酯水平及血清alt活性。表12:野生人参cmc对用高脂肪膳食饲喂的小鼠的体重、甘油三酯水平和血清alt活性的作用8-10只小鼠/组。alt:丙氨酸氨基转移酶;hfd:高脂肪膳食;nfd:正常脂肪膳食;tc:总胆固醇;tg:甘油三酯;hfd75:hfd+野生人参cmc75mg/kg;hfd150:hfd+野生人参cmc150mg/kg;hfd300:hfd+野生人参cmc300mg/kg;hfdsily:hfd+水飞蓟素100mg/kg。尽管已参照具体特征对本发明进行了详细描述,但是对于本领域技术人员显而易见的是,本说明书仅针对优选的实施方案且不限制本发明的范围。因此,本发明的实质范围将通过所附权利要求书及其等同形式来限定。工业实用性如上所述,根据本发明的方法可通过简单的操作有效地制备以下人参属形成层分生细胞、其提取物或人参提取物,其包含增加量的选自以下的一种或多种稀有人参皂苷:高药理活性的rg3、rk1、rg5、rh2、rk2、rh3和ppd。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1