抗肿瘤组合物和方法与流程
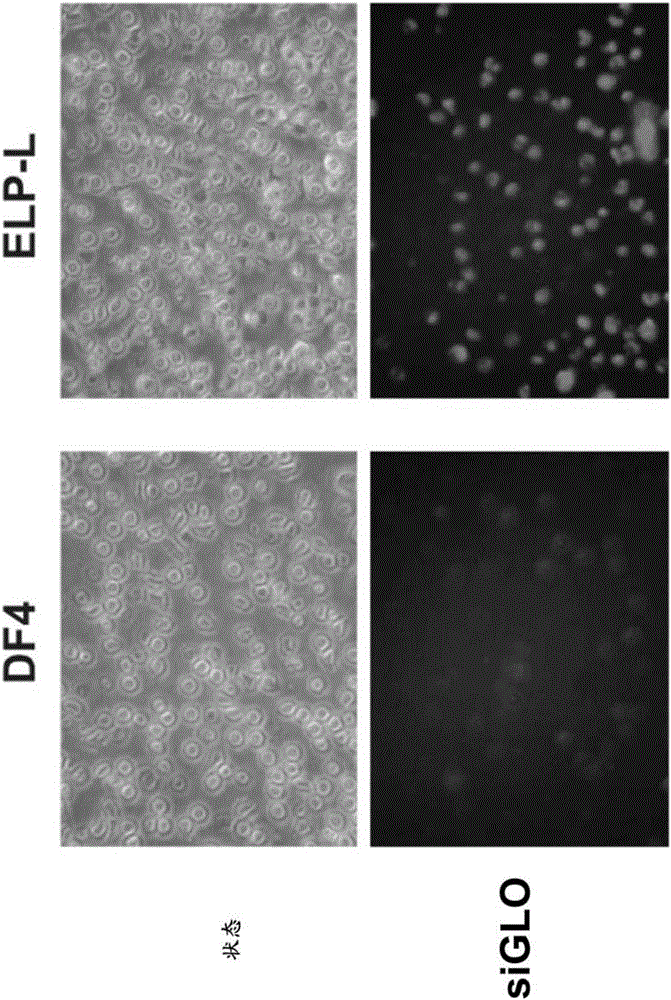
本发明一般涉及医学和分子生物学领域。特别地,本发明涉及当靶向肿瘤时在人或动物中激活抗肿瘤先天免疫应答的寡核苷酸及其使用方法。发明背景一些小的干扰RNA(siRNA)可以引起多种非特异性副作用,包括刺激干扰素和细胞因子产生、蛋白质合成的全面关闭、mRNA的非特异性降解和脱靶效应,其导致基因表达的非特异性降低(Robbins等人,2009)。对于许多siRNA应用,优选特异性基因沉默,并且在施用siRNA后受试者中先天免疫的激活认为是不期望的副作用。然而,在癌症治疗中,这些免疫刺激性siRNA或“isRNA”可以用作有力的免疫调节剂,用于激活在癌细胞中期望的有益效果,其包括增殖阻断,分化和凋亡。因此,先天免疫系统可以充当肿瘤抑制剂(Shankaran等人,2001;Bui和Schreiber,2007;Koebel等人,2007),并且免疫刺激剂可以用于抗肿瘤治疗。然而,仍然需要有效的技术,其能够将先天免疫应答的isRNA激活限于肿瘤细胞并且通常不在人或动物中的非肿瘤细胞中。发明概述申请人在此公开了用于将isRNA复合物特异性递送至人或动物中的肿瘤细胞的组合物和方法。一旦将这些复合物递送至肿瘤细胞,isRNA复合物可以在肿瘤细胞中特异性地激活受试者的特异性先天免疫应答,从而诱导有益效果,其包括但不限于增殖阻断,分化和凋亡等。一方面,本文公开了用于靶向和抑制肿瘤细胞生长的组合物。在某些实施方案中,该组合物包含分离的寡核苷酸,其能够激活肿瘤内的先天免疫应答;肿瘤细胞靶向部分;和其药学上可接受的盐。一方面,本文公开了用于靶向和抑制肿瘤细胞生长的组合物,其包含能够激活肿瘤内的先天免疫应答的分离的寡核苷酸。在一个实施方案中,组合物的寡核苷酸包含SEQIDNO:1的核酸序列。在另一个实施方案中,寡核苷酸包含SEQIDNO:2的核酸序列。在某些实施方案中,寡核苷酸是双链的。在一个实施方案中,寡核苷酸是双链的,并且一条链包含SEQIDNO:1的核酸序列,而一条链包含SEQIDNO:2的核酸序列。在另一个实施方案中,寡核苷酸是双链的,并且一条链包含SEQIDNO:3的核酸序列,而一条链包含SEQIDNO:4的核酸序列。在另一个实施方案中,寡核苷酸是双链的,并且一条链包含SEQIDNO:5的核酸序列,而一条链包含SEQIDNO:6的核酸序列。在一些实施方案中,组合物的寡核苷酸包含一个或多个UG基序。在一些实施方案中,组合物的寡核苷酸的核酸序列包含一个或多个UG基序或者是富含UG的。在其它实施方案中,所公开的用于靶向和抑制肿瘤细胞生长的组合物的寡核苷酸包含至少一种经修饰的核苷酸,其促进细胞中先天免疫系统的活化。在一个实施方案中,经修饰的核苷酸包括经修饰的核糖。在另一个实施方案中,经修饰的核苷酸包含O-甲基或氟修饰。在某些实施方案中,经修饰的核苷酸位于从所公开的组合物的寡核苷酸的5’端起的第二个位置。在另一方面,本文公开了用于靶向和抑制肿瘤细胞生长的组合物,其包含肿瘤细胞靶向部分。在某些实施方案中,肿瘤细胞靶向部分是蛋白质、肽或适体。在某些实施方案中,肿瘤细胞靶向部分包含如美国专利号8,680,045中公开的任何细胞靶向部分或结构域,其通过引用整体并入本文以用于任何目的。在另一方面,如本文公开的用于靶向和抑制肿瘤细胞生长的组合物还包含纳米颗粒。在一些实施方案中,纳米颗粒包含脂质,环糊精,壳聚糖,糖水化合物聚合物,弹性蛋白样聚合物(ELP),磷酸钙聚合物或其组合。在一个实施方案中,纳米颗粒是聚乙二醇化的。在一个具体实施方案中,纳米颗粒是ELP-L。在另一个实施方案中,如本文公开的靶向和抑制肿瘤细胞生长的组合物包囊在脂质体中。在一个实施方案中,脂质体是聚乙二醇化的。在另一方面,本文公开了药物组合物,其包含所公开的用于靶向和抑制肿瘤细胞生长的组合物。在某些实施方案中,药物组合物包含本文公开的组合物和药学上可接受的载体、赋形剂或佐剂。在其它实施方案中,药物组合物包含本文公开的组合物和化疗药物或试剂。在其它实施方案中,药物组合物包含本文公开的组合物和免疫性检查点抑制剂(checkpointinhibitor)。在另一方面,本文公开了一种用于抑制肿瘤细胞生长的方法。在某些实施方案中,所述方法包括提供包含寡核苷酸的组合物,并且使所述肿瘤细胞接触足以抑制肿瘤细胞生长的量的所述组合物,所述寡核苷酸苷酸能够激活肿瘤细胞中的先天免疫应答。在一些实施方案中,组合物是如本文公开的用于靶向和抑制肿瘤细胞生长的组合物。在另一方面,本文公开了一种用于在受试者的肿瘤细胞中特异性激活受试者的先天免疫应答的方法。在一些实施方案中,所述方法包括获得能够激活肿瘤细胞中的先天免疫应答的寡核苷酸;使所述寡核苷酸与肿瘤细胞靶向部分接触以形成组合物,使得组合物将寡核苷酸特异性地递送至该受试者中的肿瘤细胞;和向所述受试者施用药学有效量的所述组合物。在某些实施方案中,任何所公开的方法中的肿瘤细胞是人膀胱细胞、人乳腺细胞、人结肠细胞、人肝细胞、人肺细胞、人神经母细胞瘤细胞、人卵巢细胞、人胰腺细胞、人前列腺细胞或人皮肤细胞。附图简述图1描述了siRNA与toll样受体(TLR)的相互作用和RNA干扰基因沉默途径。描绘了各种TLR。TLR7和TLR8识别单链RNA(ssRNA)基序,但也可识别双链RNA(dsRNA)中的某些基序。TLR3结合dsRNA并且通过与TLR7和TLR8不同的途径发出信号。RIG-1识别含有三磷酸的RNA。逃离内体的siRNA可以进入RNAi途径,其中两条链之一被选择作为引导链并指导互补RNA的序列特异性信使降解。图2描述当与DF4或ELP-L复合时,siGLO被摄取到外周血单核细胞(PBMC)中。使用DharmaFECT(DF4)或ELP-L纳米颗粒以50nM用siGLO,对照转染PBMC达16小时。图3描述了在用与DF4或ELP-L复合的isRNA或siGLO处理后与外周血单核细胞(PBMC)共培养的SKOV-3GL3细胞(稳定表达萤光素酶的卵巢癌细胞系)的存活力。在将PBMC加入到SKOV-3GL3细胞(共培养)后4天,测量SK-OV-3GL3细胞的萤光素酶活性(RLU;相对光单位)(图3,图A)。作为对照,在相同条件下但不添加PBMC细胞,测量SK-OV-3GL3细胞的萤光素酶活性(图3,图B)。在4天时间点通过T检验测定经siGLO处理的和经isRNA处理的共培养物的平均存活力之间的显著性,P=0.05。**在4天时间点,通过T检验测定经siGLO处理的和经isRNA处理的共培养物的平均存活力之间的显著性,P=0.0005。图4描绘了在用与DF4或ELP-L复合的isRNA或siGLO处理后与外周血单核细胞(PBMC)共培养的Panc1GL3细胞(稳定表达萤光素酶的胰腺癌细胞系)的存活力。在将PBMC加入到Panc1GL3细胞(共培养)后4天,测量Panc1GL3细胞的萤光素酶活性(RLU;相对光单位)(图4,图A)。作为对照,在相同条件下但不添加PBMC细胞,测量Panc1GL3细胞的萤光素酶活性(图4,图B)。图5描述了逆转录聚合酶链式反应(RT-PCR)实验,其使用用isRNA或siGLO复合物处理的PBMC进行。从共培养的SK-OV-3GL3/PBMC细胞纯化RNA,并测量每个样品的INF-α和IL-6表达。测量β-肌动蛋白作为标准化对照。图6证实了isRNA:ELP-L纳米复合物在小鼠模型中对卵巢肿瘤生长的功效。在无胸腺小鼠(Balb/c)中由经注射的SK-OV-3GL3细胞发展的肿瘤的生长通过小鼠中的生物发光测量,对所述小鼠用媒介物(VEH;5%右旋糖)或2mg/kg或10mg/kgisRNA/ELP-L(isRNA,n=10)每周两次给药,持续4周。部分A显示在2mg/kg给药方案的第28天时,存活小鼠中肿瘤的生物发光。部分B显示了2mg/kg给药方案的每7天的平均生物发光的图。数据显示针对每个点n=10的平均值。*在28天时间点,通过T检验确定VEH和isRNA之间的显著性,P=0.005。**在28天时间点,通过T检验确定VEH和isRNA之间的显著性,P=0.001。图7描述了从用媒介物(VEH),2mg/kg或10mg/kgisRNA:ELP-L给药的小鼠切除的肿瘤的重量(图A)和数量(图B)。图8显示了来自用isRNA:ELP-L或5%右旋糖(媒介物)处理的小鼠肿瘤样品的细胞因子表达的RT-PCR。在注射后28天从小鼠切除肿瘤样品,并测量每个样品的INF-α和IL-6的表达。测量β-肌动蛋白作为标准化对照。发明详述在一个方面,本文公开了能够激活肿瘤细胞中的先天免疫应答的寡核苷酸。如本文所用,术语“先天免疫应答”是指人或动物的细胞和组织中的非抗原特异性应答,优选在肿瘤细胞中差异或优先地诱导。它还指细胞变化,其影响细胞作为抗原呈递细胞起作用和/或调节抗原特异性适应性免疫应答的能力。在一个实施方案中,先天免疫应答包括激活自然杀伤(NK)细胞活性。NK细胞参与针对病原体的第一道防线。在另一个实施方案中,所述先天免疫应答包括一种或多种细胞因子或生长因子的产生和/或分泌,诸如在非限制性实例中为IFN-α,IFN-γ,IL-1,IL-6,IL-10,IL--12和TNF-α。先天免疫可以进一步包括巨噬细胞,树突细胞和单核细胞的参与。免疫系统能够鉴定和消除肿瘤细胞,基于它们通过细胞应激诱导的肿瘤特异性抗原或分子的表达。然而,肿瘤细胞可以逃避肿瘤免疫监视,并且目前正在开发靶向增强抗肿瘤免疫的治疗(Swann和Smyth2007)。在某些实施方案中,本文所述的isRNA寡核苷酸是化学合成的寡核糖核苷酸的双链体。这些isRNA双链体对免疫系统具有有益的作用。虽然不意图受任何特定理论或机制的限制,但是认为本文公开的寡核苷酸通过激活肿瘤细胞上和肿瘤细胞内的Toll样受体(TLR)来激活先天免疫应答。一旦被激活,细胞因子和其它细胞毒性酶从树突细胞,单核细胞/巨噬细胞和自然杀伤细胞释放。通常,该作用被视为在临床实践中的不良事件,特别是涉及将常规siRNA分子尤其作为治疗剂施用时。哺乳动物先天免疫系统识别许多核酸种类为潜在病原体的签名(signature)。在小鼠和人两者中已经鉴定识别双链RNA(TLR3)(Alexopoulou,Holt等人2001)和单链RNA(ssRNA)(TLR7和TLR8)(Diebold,Kaisho等人2004;Heil,Hemmi等人2004;Lund,Alexopoulou等人2004)的特异性TLR。这些核酸感测性TLR在细胞内定位并且在激活后诱导I型干扰素,如IFN-α和炎性细胞因子。TLR7通常由浆细胞样(plasmacytoid)树突细胞和B细胞表达,并且被富含鸟苷和尿苷的ssRNA病毒和合成ssRNA激活。TLR7和TLR8通常在不同的免疫细胞类型上表达,但这些TLR识别相似的核酸。鼠TLR8不响应常规的TLR7/8配体,并且直到最近认为在小鼠中是无功能的(Diebold,Kaisho等人2004)。RNA还可以通过TLR和dsRNA依赖性蛋白激酶(PKR)-不依赖性机制产生干扰素应答,所述机制包括细胞质RNA受体RIG-1和Mda-5(Yoneyama,Kikuchi等人,2004)。当配体结合TLR时,信号被传递到细胞核,并且表达编码细胞内调节分子的合成的基因(Ulevitch2004)。通过TLR激活免疫系统引起促炎细胞因子和干扰素的快速产生,所述促炎细胞因子和干扰素调配(orchestrate)针对感染的先天和适应性免疫应答的发展。这些途径的异常或过度刺激认为是许多炎性和自身免疫性疾病的基础。例如,系统性红斑狼疮中的RNA和DNA相关的自身抗原已经显示通过TLR7和TLR9激活驱动病理性自身抗体和干扰素产生(Lau,Broughton等人2005;Vollmer,Tluk等人,2005;Christensen,Shupe等人,2006;Pisitkun,Deane等人,2006;Subramanian,Tus等人,2006)。TLR3是已知的双链RNA的受体。TLR3在树突细胞,成纤维细胞,巨噬细胞和上皮细胞上表达(Matsumoto,Funami等人2004)。TLR3的衔接头分子(adaptormolecule)是TICAM-1,其中TLR3与TICAM-1的结合诱导多重信号传导级联,其最终导致I型干扰素(IFN-αβ)的产生(Matsumoto,Funami等人2004)。干扰素是细胞因子,其诱导未感染的细胞产生能够降解RNA的酶,从而防止病毒复制。干扰素还激活对防御重要的多种细胞,包括细胞毒性T淋巴细胞,巨噬细胞和NK细胞。单链RNA的识别在小鼠中由Toll样受体7介导,并且在人类中由TLR-8介导。在小鼠中,TLR7结合衔接头MyD88并导致IFN-α的激活。Diebold等人(Diebold,Kaisho等人2004)显示流感病毒RNA,聚尿苷酸和体外合成的mRNA全部诱导IFN-α在浆细胞样树突细胞中的产生。Heil等人(Heil,Hemmi等人2004)显示具有硫代磷酸酯末端的20个残基的富含鸟嘌呤和尿苷的RNA寡核苷酸刺激树突细胞和巨噬细胞分泌INF-α和促炎性和调节性细胞因子。使用TLR缺陷小鼠,这些作者还显示小鼠TLR-7和人TLR-8负责结合单链RNA。人TLR-7也被鸟嘌呤核苷酸类似物激活(Lee,Chuang等人2003)。双链RNA还可以通过与被称为PKR的遍在表达的丝氨酸/苏氨酸蛋白激酶相互作用来激活先天免疫系统。PKR是TLR4级联的一部分,所述TLR4级联由细菌LPS结合TLR4而激活。PKR由干扰素诱导并被dsRNA,细胞因子,生长因子和应激信号激活。PKR在与dsRNA结合时被自体磷酸化和被激活。激活导致通过eIF2a磷酸化对蛋白质合成的抑制,并且还通过不同转录因子激活的PKR依赖性信号传导诱导炎性基因的转录(Williams1999)。PKR通过其抑制剂IkB的磷酸化上调NF-κB表达(Kumar,Haque等人,1994)。少至11个碱基对的dsRNA可以结合PKR并诱导活性,但最大激活需要至少30个碱基对(Manche,Green等人,1992)。本文所述的isRNA试剂可通过已知结合核酸或核苷酸类似物的受体之一激活先天性免疫系统。已经报道siRNA双链体在某些条件下能够在人细胞中触发免疫应答。Sledz等人(Sledz和Williams2003)报道了用所测试的六种不同siRNA双链体中的每一种诱导干扰素系统。Bridge等人(Bridge,Pebernard等人2003)报道使用病毒载体递送的一些shRNA诱导干扰素刺激基因的表达。这两个报道显示siRNA双链体激活PKR。相比之下,Kariko等人的数据暗示TLR3途径和TLR3激活是浓度依赖性的(Kariko,Bhuyan等人2004)。先天免疫应答的激活在范围从病毒感染到癌症的疾病中是有利的(Whitmore,DeVeer等人2004)。isRNA试剂应激活先天免疫,这继而应定形(shape)适应性免疫应答。一些isRNA序列和修饰可能比其他的isRNA序列和修饰更好地激活先天免疫应答。这种激活可以通过已知结合核酸的任何下述Toll样受体途径来到:TLR3,双链RNA的受体;TLR8,单链RNA的受体;或PKR,由dsRNA激活的蛋白激酶。已知这些蛋白质中的每一种结合类似于所述isRNA试剂的分子。本文进一步公开了isRNA寡核苷酸试剂,其是未修饰或经修饰以便对受试者的免疫系统具有效应或特异性避免对受试者的免疫系统的效应。虽然不希望受理论束缚,但是认为免疫系统活性的调节可以由isRNA试剂与免疫系统的组分的相互作用产生,其中所述相互作用破坏或刺激所述组分的活性。这些效应独立于RISC介导的基因沉默,如在siRNA分子用于RNAi应用的传统用途中那样。相比之下,认为本文公开的isRNA分子通过单链或双链RNA与免疫系统的蛋白质组分的相互作用而起作用。在本公开的另一方面,能够激活肿瘤内的先天免疫应答的寡核苷酸包含特异性核苷酸序列。用于证实isRNA双链体特异性递送至肿瘤细胞的效应的寡核苷酸序列显示于下表1中,其中表1序列中出现的“m”表示所示核苷碱基的2’核糖位置的修饰,并且dT表示脱氧核糖胸苷。表1.sRNA寡核苷酸序列在某些实施方案中,将本文公开的寡核苷酸退火以形成isRNA的双链体。在一个实施方案中,本文公开的双链寡核苷酸包含含有SEQIDNO:1的核酸序列的链和含有SEQIDNO:2的核酸序列的链。在另一个实施方案中,本文公开的双链寡核苷酸包含含有SEQIDNO:3的核酸序列的链和含有SEQIDNO:4的核酸序列的链。在另一个实施方案中,本文公开的双链寡核苷酸包含含有SEQIDNO:5的核酸序列的链和含有SEQIDNO:6的核酸序列的链。本文公开的分离的寡核苷酸和isRNA双链体可以通过常规分子生物学技术产生。例如,可以通过化学合成方法或通过重组核酸技术进行主题dsRNA(例如siRNA)的生产。如本文所用的术语“dsRNA”是指能够进行RNA干扰(RNAi)的双链RNA分子,包括siRNA。形成双链RNA双链体的方法和其他RNA制备技术公开在Judge2006中,其通过引用整体并入本文。经处理的细胞的内源性RNA聚合酶可在体内介导转录,或克隆的RNA聚合酶可用于体外转录。如本文所用,本申请的dsRNA或siRNA分子不需要受限于仅含有RNA的那些分子,而是可以进一步包含经化学修饰的核苷酸和非核苷酸。例如,本文公开的dsRNA可包括对磷酸-糖主链或核苷的修饰,例如以降低对细胞核酸酶的易感性,改善生物利用度,改善制剂特性和/或改变其它药代动力学性质。为了说明,天然RNA的磷酸二酯连接可以修饰为包括氮或硫杂原子中的至少一个。可调整RNA结构中的修饰以允许特异性遗传抑制,同时避免对dsRNA的全身响应。同样,可以修饰碱基以尤其阻断腺苷脱氨酶活性。dsRNA可以酶促地或通过部分或全部有机合成产生,其中任何经修饰的核糖核苷酸可以通过体外酶促合成或有机合成引入。化学修饰RNA分子的方法可以适用于修饰dsRNA。仅举例说明,dsRNA或siRNA的主链可以用硫代磷酸酯,氨基磷酸酯,二硫代磷酸酯,嵌合甲基膦酸酯-磷酸二酯,肽核酸,含5-丙炔基-嘧啶的寡聚物或糖修饰(例如,2’-取代的核糖核苷,α-构型)。在某些情况下,本申请的dsRNA缺少含有2’-羟基(2’-OH)的核苷酸。在某些实施方案中,siRNA分子包含硫代磷酸酯有义链。在某些实施方案中,siRNA分子包含磷酸二酯反义链。产生经修饰的RNA分子的一个示例性方法公开于Robbins,2008中,其全部内容通过引用并入本文。除非另有说明,本文描述的序列遵循惯例,其中单链多核苷酸序列的左手端为5’端;将双链多核苷酸序列的左手方向称为5’方向。新生RNA转录物的5’至3’添加的方向被称为转录方向;具有与RNA相同的序列并且在RNA转录物的5’端5’的DNA链上的序列区称为“上游序列”;具有与RNA相同的序列并且在RNA转录物的3’端3’的DNA链上的序列区称为“下游序列”。如本文所用的术语“多核苷酸”是指长度为至少10个碱基的核苷酸的聚合形式。在某些实施方案中,碱基可以是核糖核苷酸或脱氧核糖核苷酸或任一类型的核苷酸的修饰形式。该术语包括DNA或RNA的单链和双链形式。如本文所用的术语“寡核苷酸”包括天然存在的和经修饰的核苷酸,它们通过天然存在的和/或非天然存在的寡核苷酸连接来连接。寡核苷酸是通常包含不超过200个核苷酸的多核苷酸亚组。在某些实施方案中,寡核苷酸的长度为10至60个核苷酸。在某些实施方案中,寡核苷酸长度为12,13,14,15,16,17,18,19,20,21或30至40个碱基。寡核苷酸可以是单链的,例如用作反义RNA,或是双链的,作为小干扰RNA(siRNA)或小(或短)发夹RNA(shRNA)。寡核苷酸可以包括可检测标记物,如放射性标记物,荧光标记物,抗原性标记物或半抗原。术语“获得”是指物理上拥有生理标本。获取材料的方式不限于任何特定的过程。术语“天然存在的核苷酸”包括脱氧核糖核苷酸和核糖核苷酸。术语“经修饰的核苷酸”包括具有经修饰的或取代的糖基等的核苷酸。术语“寡核苷酸连接”包括寡核苷酸连接,如磷酸酯,硫代磷酸酯,二硫代磷酸酯,硒代磷酸酯,二硒代磷酸酯,phosphoroanilothioate,phoshoraniladate,氨基磷酸酯等。参见例如,LaPlanche等人1986,Nucl.AcidsRes.14:9081;Stec等人1984,J.Am.Chem.Soc.106:6077;Stein等人1988,Nucl.AcidsRes.16:3209;Zon等人1991,Anti-CancerDrugDesign6:539;Zon等人1991,OligonucleotidesandAnalogues:APracticalApproach,(F.Eckstein,ed.),OxfordUniversityPress,OxfordEngland,pp.87-108;Stec等人U.S.Pat.No.5,151,510;Uhlmann和Peyman,1990,ChemicalReviews90:543,其各自的公开内容出于任何目的通过引用并入本文。如本文所用,术语“分离的多核苷酸”或“分离的寡核苷酸”是指基因组,cDNA或合成来源的多核苷酸或其组合,凭借其来源,“分离的多核苷酸”(1)不与其中在自然界中发现“分离的多核苷酸”的多核苷酸的全部或一部分相关,(2)与天然不与其连接的多核苷酸连接,或(3)不作为较大序列的一部分天然存在。术语“转染”用于指通过细胞摄取外来或外源核苷酸,并且当将外源核苷酸导入细胞内时,细胞已是“转染”的。许多转染技术是本领域公知的并且在本文中公开。参见例如Graham等人1973,Virology52:456;Sambrook等人2001,MolecularCloning:ALaboratoryManual,3ded.,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,N.Y.;Davis等人1986,BasicMethodsinMolecularBiology(Elsevier);和Chu等人1981,Gene13:197。在某些实施方案中,本文公开的寡核苷酸可以包含用于施用至受试者的递送媒介物,其包括脂质体和纳米颗粒;载体和稀释剂及其盐;并且所述寡核苷酸可以存在于药物组合物中。在一个具体的实施方案中,isRNA与ELP-L纳米颗粒结合递送,如美国专利号8,680,045中所公开的,其通过引用整体并入本文。用于递送核酸分子的方法描述于例如在Akhtar等人1992,TrendsCellBio.2:139;DeliveryStrategiesforAntisenseOligonucleotideTherapeutics编Akhtar,1995,Maurer等人1999,Mol.Membr.Biol.16:129-140;HoflandandHuang,1999,Handb.Exp.Pharmacol.,137:165-192;和Lee等人2000,ACSSymp.Ser.752:184-192中,将其全部通过引用并入本文。Beigelman等人,美国专利号6,395,713和Sullivan等人,PCTWO94/02595进一步描述了用于将核酸分子递送到细胞和组织中的一般方法。可以利用这些方案用于将几乎任何核酸分子递送到细胞中。核酸分子可以通过本领域技术人员已知的多种方法施用于细胞,所述方法包括但不限于,在脂质体中的包囊,通过离子透入法(iontophoresis),或通过掺入其它递送媒介物,如水凝胶,环糊精,可生物降解的纳米胶囊和生物粘附微球,或通过蛋白质性质的(proteinaceous)载体(参见例如O’Hare和Normand,国际PCT公开号WO00/53722)。本文公开的纳米颗粒通常是化学基础的壳结构,其结合核苷酸或药剂并稳定血液中的分子。纳米颗粒通常包含糖,葡聚糖,磷酸钙,壳聚糖,肽和/或塑料聚合物。用于癌症药物递送的装载有药剂的纳米颗粒优选具有以下性质:1)易于在几个步骤中以高产量和纯度合成;2)装配成单分散的装载有药物的纳米颗粒,具有100nm以下的尺寸;3)允许包囊多种药物;4)表现出有利的药代动力学和肿瘤积聚;5)以受控的和可调谐的动力学释放药物;6)导致治疗反应;和7)降解为无毒组分,以使得能够从机体清除而没有不利的毒性。虽然已经提出了用于癌症治疗的许多不同的纳米级递送系统,但大多数不满足这些标准,所述标准对于将这些系统移入临床实践中是至关重要的。由于由肿瘤血液和淋巴脉管系统的异常导致的增强的渗透性和保留(EPR)效应,认为ELP药物递送纳米颗粒特异性地进入肿瘤。通过使用本文公开的ELP纳米颗粒,先天免疫系统仅在肿瘤内激活,并且防止了先天性免疫系统的系统性激活。然而,本发明不限于ELP-纳米颗粒。本发明的其它实施方案可以利用脂质体,聚葡聚糖或其它聚合物,所述聚合物(1)可以携带核苷酸分子,(2)可以携带或不携带常规化疗剂,和(3)可以适应靶向特定肿瘤类型的肽分子。或者,核酸/媒介物组合可以通过直接注射或通过使用输注泵局部递送。本发明的核酸分子的直接注射,无论皮下注射,肌内注射或真皮内注射,都可以使用标准针头和注射器方法,或通过例如在Conry等人1999,Clin.CancerRes.5:2330-2337和Barry等人,国际PCT公开号WO99/31262中所描述的无针技术进行。本领域的许多实例描述了通过渗透泵进行的寡核苷酸递送方法(参见Chun等人1998,NeuroscienceLetters257:135-138,D'Aldin等人1998,Mol.BrainResearch55:151-164,Dryden等人1998,J.Endocrinol.157:169-175,Ghirnikar等人1998,NeuroscienceLetters247:21-24)或直接输注(Broaddus等人1997,Neurosurg.Focus3,article4)。其他递送途径包括但不限于口服递送(例如以片剂或丸剂形式)和/或鞘内递送(Gold,1997,Neuroscience76:1153-1158)。核酸递送和施用的更详细描述在Sullivan等人,PCTWO94/02595,Draper等人,PCTWO93/23569,Beigelman等人,PCTWO99/05094和Klimuk等人,PCTWO99/04819中提供,将它们全部通过引用并入本文。在某些实施方案中,本文公开的组合物包含寡核苷酸和细胞靶向部分(也称为细胞靶向结构域或CTD)。在某些实施方案中,细胞靶向部分是多肽。示例性细胞靶向多肽公开在美国专利号8,680,045中,将其通过引用以其整体并入本文。CTD不限于任何特定的多肽序列。它可以设计成靶向任何所需的生物分子。在具体实施方案中,生物分子在所需细胞类型中特异性表达。可以选择任何细胞以用于靶向。在某些实施方案中,靶细胞是真核细胞,更优选哺乳动物细胞,最优选啮齿动物或人细胞。在具体实施方案中,靶细胞是肿瘤细胞。本发明考虑的肿瘤细胞的非限制性实例包括肿瘤细胞,其是人膀胱细胞,人乳腺细胞,人结肠细胞,人肝细胞,人肺细胞,人神经母细胞瘤细胞,人卵巢癌细胞,人胰腺细胞,人前列腺细胞或人皮肤细胞。此外,可以基于疾病或状况来选择靶细胞,所述疾病或状况影响要通过本发明的方法治疗的患者。一方面,如本文所公开的CTD设计为在肿瘤细胞中表达但在非肿瘤细胞中不表达的靶向生物分子(例如肿瘤细胞靶向部分)。本文公开的寡核苷酸设计为使用展示细胞靶向部分的纳米颗粒被特异性递送到肿瘤中。在某些实施方案中,多肽的CTD包含对肿瘤细胞特异的肽配体。这些细胞靶向部分可以赋予纳米颗粒对肿瘤细胞表面上的受体的特异性结合,并允许通过胞吞作用,胞饮作用或其它细胞膜参与机制将纳米颗粒特异性地摄取到肿瘤细胞中。在一个实施方案中,CTD包含结合L1细胞粘附分子(L1CAM)的肽配体。靶向特定肿瘤细胞是有利的,这是因为通过在肿瘤寻求型ELP纳米颗粒中递送的药物的特异性靶向减少癌症治疗的副作用。如本文所公开的,CTD与isRNA分子一起的使用可以降低先天免疫应答在非肿瘤细胞中的激活,从而减少用isRNA施用的受试者中的不希望的副作用。在其他实施方案中,纳米颗粒可以缩合(condense)使得纳米颗粒对细胞膜是可渗透的。在这样的备选实施方案中,纳米颗粒可以接触细胞内部的生物分子,如内体中的TLR和细胞质中的其他先天免疫激活剂。在本发明的另一个实施方案中,另外的靶向配体与含有药剂的脂质体或纳米颗粒结合,所述药剂靶向指定用于凋亡破坏的肿瘤细胞上的受体。脂质体也可以用聚乙二醇涂覆(即被聚乙二醇化),以延长循环中脂质体的寿命。类似地,可以如此涂覆纳米颗粒。靶向分子可以是称为适体的有机化学接头,其特异性结合靶细胞表面上的受体。适体可以共价连接到脂质体的脂质或纳米颗粒的聚合物。可用于将脂质体或纳米颗粒靶向肿瘤细胞的其它分子是针对肿瘤细胞表面上的特定受体的肽,蛋白质或抗体。在某些实施方案中,本文公开了药物组合物,其包含治疗有效量的如本文提供的寡核苷酸,纳米颗粒和/或药剂,以及药学上可接受的稀释剂,载体,增溶剂,乳化剂,防腐剂和/或佐剂。如本文所用的术语“药物组合物”是指当适当地施用于患者时能够诱导所需的治疗效果的组合物,其包含药学上可接受的载体,赋形剂或稀释剂和本文所述的化合物,肽或组合物。术语“治疗有效量”是指确定为在哺乳动物中产生治疗反应的本发明的药物组合物或在本发明的筛选方法中鉴定的化合物的量。这样的治疗有效量容易由本领域普通技术人员并使用如本文所述的方法确定。本发明还提供了药物组合物,其包含如本文提供的寡核苷酸,多肽,纳米颗粒或药剂。具体地,isRNA寡核苷酸和其他药剂与ELP纳米颗粒,例如ELP-L纳米颗粒结合递送。可接受的制剂材料优选在所利用的剂量和浓度下对接受者无毒。药物组合物可以含有制剂材料,用于改良,维持或保持例如组合物的pH,渗透性,粘度,澄清度,颜色,等张性,气味,无菌性,稳定性,溶出或释放速率,吸附或渗透。合适的制剂材料包括但不限于氨基酸(如甘氨酸,谷氨酰胺,天冬酰胺,精氨酸或赖氨酸);抗微生物剂;抗氧化剂(如抗坏血酸,亚硫酸钠或亚硫酸氢钠);缓冲剂(例如硼酸盐,碳酸氢盐,Tris-HCl,柠檬酸盐,磷酸盐或其他有机酸);膨胀剂(bulkingagent)(例如甘露醇或甘氨酸);螯合剂(例如乙二胺四乙酸(EDTA));络合剂(例如咖啡因,聚乙烯吡咯烷酮,β-环糊精或羟丙基-β-环糊精);填充剂;单糖,二糖和其它糖类(例如葡萄糖,甘露糖或糊精);蛋白质(例如血清白蛋白,明胶或免疫球蛋白);着色剂,调味剂和稀释剂;乳化剂;亲水性聚合物(例如聚乙烯吡咯烷酮);低分子量多肽;成盐抗衡离子(salt-formingcounterion)(如钠);防腐剂(例如苯扎氯铵,苯甲酸,水杨酸,硫柳汞,苯乙醇,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯,氯己定,山梨酸或过氧化氢);溶剂(例如甘油,丙二醇或聚乙二醇);糖醇(例如甘露醇或山梨醇);悬浮剂;表面活性剂或湿润剂(例如普郎尼克类(pluronics),聚乙二醇(PEG),脱水山梨糖醇酯,聚山梨醇酯如聚山梨醇20和聚山梨醇80,Triton,三甲基胺,卵磷脂,胆固醇或泰洛沙泊(tyloxapal));稳定性增强剂(例如蔗糖或山梨醇);张力增强剂(例如碱金属卤化物,优选氯化钠或氯化钾,甘露醇或山梨醇);递送媒介物;稀释剂;赋形剂和/或药用辅料(pharmaceuticaladjuvant)。参见例如Remington'sPharmaceuticalSciences,18thEdition,(A.R.Gennaro,ed.),1990,MackPublishingCompany。在另一方面,本文公开的isRNA寡核苷酸也可以与第二治疗剂联合使用,所述第二治疗剂可以是化疗剂,抗生素或第二RNA剂。在某些实施方案中,本文公开的isRNA寡核苷酸与免疫检查点抑制剂组合用于药物组合物中。药物的这种组合能够去除通过免疫检查点抑制剂赋予的免疫应答在肿瘤细胞中的阻断,而本文公开的isRNA激活先天免疫系统。因此,可以使用这种试剂的组合观察对免疫应答激活的协同效应。示例性免疫检查点靶标列于表2中。表2.免疫检查点靶标免疫检查点抑制剂可以是例如治疗性抗体,抑制性核苷酸或小分子抑制剂。例如,本领域已知充当免疫检查点抑制剂的许多抗体,如派姆单抗(pembrolizumab)(MK-3475,Merck),纳武单抗(nivolumab)(BMS-936558,Bristol-MyersSquibb),pidilizumab(CT-011,CureTechLtd.),AMP-224(Merck),MDX-1105(Medarex),MEDI4736(MedImmune),MPDL3280A(Genentech),BMS-936559(Bristol-MyersSquibb),ipilimumab(Bristol-MyersSquibb)和tremelimumab(Pfizer)。抑制免疫系统的其它化合物也可用于治疗癌症,包括破坏PKR途径的化合物。(Pikarsky等人,Nature,2004,431,461-466;Huber等人,J.Clin.Invest,2004,114,569-581)。另外的药物组合物对于本领域技术人员是明显的,包括涉及在持续递送制剂或受控递送制剂中的本发明的纳米颗粒或化合物的制剂。用于配制各种其它持续递送或受控递送的手段,如脂质体载体,生物可蚀解微粒或多孔珠和储库注射(depotinjection)的技术也是本领域技术人员已知的。参见例如PCT申请号PCT/US93/00829,其描述了用于递送药物组合物的多孔聚合物微粒的受控释放。持续释放制剂可包括以成型制品形式的半渗透性聚合物基质,如薄膜或微胶囊,聚酯,水凝胶,聚丙交酯(美国专利3,773,919和EP058,481),L-谷氨酸和γ乙基-L-谷氨酸的共聚物(Sidman等人,1983,Biopolymers22:547-556),聚(2-羟乙基-甲基丙烯酸酯)(Langer等人1981,J.Biomed.Mater.Res.15:167-277)和Langer,1982,Chem.Tech.12:98-105),乙烯乙酸乙烯酯(Langer等人同上)或聚D(-)-3-羟基丁酸((EP133.988)。持续释放组合物还可以包括脂质体,其可以通过本领域已知的几种方法中的任何一种制备。参见例如Eppstein等人,1985,Proc.Natl.Acad.Sci.USA82:3688-3692;3688-3692;EP036,676;EP088,046和EP143,949。实施例通过以下实施例进一步说明本发明,这些实施例不应解释为进一步限制。序列表,图和在本申请中引用的所有参考文献,专利和公开的专利申请的内容通过引用明确地并入本文。此外,根据本发明,可以使用本领域技术内的常规分子生物学,微生物学和重组DNA技术。这些技术在文献中充分解释。参见例如Sambrook,Fritsch&Maniatis,MolecularCloning:ALaboratoryManual,第二版(1989)ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NewYork(herein“Sambrooketal.,1989”);DNACloning:APracticalApproach,VolumesIandII(D.N.Glovered.1985);OligonucleotideSynthesis(M.J.Gaited.1984);NucleicAcidHybridization[B.D.Hames&S.J.Higgins编(1985)];TranscriptionAndTranslation[B.D.Hames&S.J.Higgins编(1984)];AnimalCellCulture[R.I.Freshney编(1986)];ImmobilizedCellsAndEnzymes[IRLPress,(1986)];B.Perbal,APracticalGuideToMolecularCloning(1984);F.M.Ausubel等人(编),CurrentProtocolsinMolecularBiology,JohnWiley&Sons,Inc.(1994)。实施例1:isRNA递送和摄取至外周血单核细胞(PBMC)的评估购买来自全血的外周血单核细胞(PBMC)(Allcells,Alameda,CA),并在6孔板中培养。通常,PBMC由淋巴细胞(包括T细胞,B细胞,NK细胞等)和单核细胞组成。为了评价isRNA对PBMC中的摄取,将荧光标记的非靶向siGLO对照siRNA(Dharmacon)与DharmaFect4(DF4)(Dharmacon),商业脂质体制剂或与ELP-L,基于多肽的纳米颗粒一起缩合,所述ELP-L描述于美国专利号8,680,045,其通过引用以其整体并入本文用于任何目的。通过在室温下将100pmol(1.33μg)的isRNA与增加浓度的ELP-L蛋白温育30分钟确认isRNA:ELP-L纳米复合物。然后,将产物在1%琼脂糖凝胶上在1XTAE缓冲液中以120V进行电泳分离30分钟。isRNA特异性结合到ELP-L纳米颗粒中使其大小从35,000道尔顿增加大约500倍。因此,由于其高分子量,通过在琼脂糖凝胶的孔内观察到纳米复合物的保留,证实了isRNA/ELP-L纳米复合物的形成(数据未显示)。以这种方式配制isRNA/ELP-L纳米复合物用于所有的体外和体内研究。通过流式细胞术定量经缩合的siGLOsiRNA对PBMC中的摄取,并使用OlympusIMT-2荧光显微镜在40X放大率下观察。如图2所示,暴露于ELP-L纳米复合物的细胞中的siGLO的摄取远远大于暴露于DF4的那些。实施例2.isRNA对由PBMC激活的人卵巢癌细胞的影响。使用常规分子生物学技术从pGL-3质粒(Promega)产生稳定表达萤火虫萤光素酶的SKOV-3细胞系(人卵巢癌细胞)。在以下研究中使用来自该细胞系的萤光素酶表达(称为SKOV-3GL3)作为细胞存活力的替代物。isRNA双链体由Dharmacon(Lafayette,CO)产生。简言之,合成根据SEQIDNO:1和SEQIDNO:2的寡核苷酸并转化为2’-羟基形式,退火、脱盐、透析和无菌过滤,从而产生isRNA双链体。关于双链RNA双链体的形成和其他RNA制备技术的其它细节公开在Judge2006中,其通以其整体通过引用并入本文。使用MALDI-TOF质谱确认双链体的身份。然后如上所述将isRNA双链体与DF4或ELP-L以及作为对照siRNA分子的siGLO进行缩合。使用DharmaFECT(DF4)或ELP-L纳米颗粒以50nM与DF4或ELP-L络合的isRNA或siGLO处理PBMC16小时。将SKOV-3GL3细胞以24孔板的每孔2,000个细胞的密度接种,并温育16小时,之后以每孔20,000个细胞密度加入经处理的PBMC。在共培养4天后测量SK-OV-3GL3细胞的萤光素酶活性。(图3,图A)。使用萤光素酶表达作为替代物,这些研究表明缩合的isRNA双链体能够减少与PBMC共培养的SKOV-3细胞的细胞存活力。这种存活力的降低表明使用ELP-L纳米颗粒递送的isRNA寡核苷酸能够激活PBMC,其产生能够降低或消除共培养的肿瘤细胞的存活力的种类。如图3(图A)所示,与暴露于对照siGLOsiRNA的细胞相比,与暴露于50nMisRNA双链体的PBMC共培养16小时的SK-OV-3GL-3细胞表达显著更低量的萤光素酶。具体来说,与暴露于isRNA:DF4复合物的PBMC共培养的SK-OV-3GL-3细胞比与暴露于siGLO:DF4复合物的PBMC共培养的SK-OV-3GL-3细胞产生少95%的RLU,并且暴露于isRNA:ELP-L复合物的细胞比暴露于siGLO:ELP-L复合物的细胞产生少30%的RLU。作为对照,在没有PBMC共培养的情况下对暴露于50nMisRNA:DF4或50nMsiGLO:DF4双链体的SKOV-3GL3细胞中的萤光素酶活性没有影响(图3,图B)。实施例3.isRNA对由PBMC激活的人胰腺癌细胞的影响使用人胰腺癌细胞系(Panc1)重复前述实施例(实施例2)的实验。使用常规分子生物学技术从pGL-3质粒(Promega)产生稳定表达萤火虫萤光素酶的Panc1细胞系,并因此在本文中称为Panc1GL3。isRNA施用和PBMC共培养的时间过程与实施例2中使用的相同。将来自Panc1GL3细胞系的萤光素酶表达用作基本上如上在实施例2中阐述的那样进行的以下研究中的细胞存活力的替代物。如图4(图A)所示,与暴露于50nMisRNA双链体的PBMC共培养16小时的Panc1GL-3细胞表达比与暴露于50nM对照siGLOsiRNA的PBMC共培养的Panc1GL-3细胞显著更低量的萤光素酶。作为对照,在没有PBMC共培养的情况下对暴露于50nMisRNA:DF4或50nMsiGLO:DF4双链体的Panc1GL3细胞中的萤光素酶表达没有影响。(图4,图B)。这些结果证实了用本文提供的isRNA试剂处理后在PBMC中诱导的肿瘤细胞杀伤能力的普遍性,并且在实施例2中显示的抗肿瘤效应不仅限于人卵巢癌细胞。实施例4.通过RT-PCR测量经处理的PBMC中细胞因子的表达PBMC产生和释放细胞因子,其激活先天免疫系统的天然杀伤(NK)细胞、树突细胞和单核细胞以及细胞毒性T细胞,以从受试者中去除癌细胞。为了评价isRNA复合物是否激活PBMC以产生细胞因子,对共培养的细胞进行RT-PCR以评估响应TLR激活的代表性细胞因子的产生。选择IL-6和干扰素α(INF-α)作为用于RT-PCR分析的代表性细胞因子。使用GeneJETRNA纯化试剂盒(Fermentas)纯化来自如实施例2和3中列出的用isRNA复合物处理的共培养的PBMC的RNA并定量。将来自每个样品的约100ngRNA用于第一链cDNA合成,其使用VersocDNA合成试剂盒(ThermoFisherScientificInc.,MA)进行。将第一链cDNA的小部分(约1/25的样品)用于用正向和反向引物进行的PCR,其使用DreamTaqGreenMix(Fermentas)扩增IL-6或INF-α。β-肌动蛋白的表达也被扩增并作为标准化对照测量。还对用作为另外的对照的siGLO处理的PBMC进行所述的RT-PCR。用于IL-6、INF-α和β-肌动蛋白cDNA的PCR扩增的引物列于以下的表3中。表3.用于细胞因子表达的RT-PCR测量的序列如图5所示,与经siGLO处理的PBMC相比,在经isRNA处理的PBMC中观察到INF-α和IL-6mRNA的增加的表达。这些结果表明,isRNA增加了PBMC中的细胞因子产生,这表明先天免疫系统细胞诸如NK细胞、树突细胞和单核细胞以及细胞毒性T细胞的增加的激活。实施例5.isRNA对肿瘤结节尺寸和数目的影响。为了测试isRNA在体内的作用,用SKOV-3GL3细胞(表达萤光素酶的人卵巢癌细胞)注射无胸腺Balb/c小鼠,并允许肿瘤生长4周。然后,用媒介物(5%右旋糖)或2mg/kg(约0.4mg/剂量)或10mg/kg(约1.2mg/剂量)的浓度的与ELP-L缩合的isRNA双链体对小鼠每周给药两次持续4周。如上所述制备isRNA:ELP-L复合物。如图6(A部分)所示,在活的小鼠中测量萤光素酶发光。定量生物发光,并显示在最后一剂后生物发光的大于50%的减少(图6,B部分)。从小鼠切除肿瘤,计数和称重。结果显示在表4和图7中。如所显示的,肿瘤的重量(图7,图A)和肿瘤结节的数量(图7,图B)以剂量依赖性方式降低。这些结果表明,如实施例1中制备的与ELP-L缩合的isRNA双链体在体内显示出抗肿瘤活性。表4.用各种浓度的isRNA施用的小鼠的肿瘤结节的重量和数量。剂量结节重量(g)结节数目媒介物0.63122mg/kg0.40610mg/kg0.234实施例6.测量在用isRNA双链体处理肿瘤后小鼠中细胞因子的表达为了确定当施用给小鼠时,isRNA双链体是否可以激活先天免疫应答,使用RT-PCR测量从以10mg/ml的isRNA双链体处理的小鼠切除的肿瘤中的IL-6和INF-α的表达。还测量了从用媒介物(5%右旋糖)给药的小鼠切除的肿瘤中IL-6和INF-α的表达作为对照。如先前在实施例4中所述进行RT-PCR。如图8所示,接受10mg/ml的isRNA双链体给药方案的小鼠显示INF-α的增加的表达。在该特定实验中,在两组之间没有观察到IL-6表达的显著差异。实施例7.在接受isRNA处理的小鼠中评估肝脏和肾脏损伤通过测量肝脏和肾脏功能的常规生物标志物来进行给药了isRNA和媒介物的小鼠中肝脏和肾脏损伤的评价。结果显示在下表5中。相比于给药媒介物的小鼠,接受10mg/kg的isRNA给药方案的小鼠显示出约67%的平均AST增加和约128%的平均ALT增加(参见表5,第1-2栏)。尽管增加,以10mg/kgisRNA给药的小鼠的AST和ALT数目落入正常可接受范围内。血液尿素氮(BUN)与肌酐的比率在isRNA给药组和媒介物给药组之间未显示任何显著增加(参见表5,第3-5列)。肝脏和肾脏毒性的缺乏表明isRNA成功地递送到肿瘤细胞,但不影响正常健康的细胞。这些结果与使用ELP-L纳米颗粒递送isRNA一致,是一种安全且有效的抗肿瘤剂。表5.在28天给药方案后小鼠中的血液化学。所有结果显示为平均值±SEM。已经详细并且通过参考其具体实施方案描述了本发明,显而易见的是,在不脱离所附权利要求中限定的本发明的范围的情况下,修改和变化是可能的。更具体地,尽管认为在本文中本发明的一些方面是特别有利的,但是预期本发明不必限于本发明的这些特定方面。引用文献Alexopoulou,L.,A.C.Holt,etal.(2001)."Recognitionofdouble-strandedRNAandactivationofNF-kappaBbyToll-likereceptor3."Nature413(6857):732-738.Bridge,A.J.,S.Pebernard,etal.(2003)."InductionofaninterferonresponsebyRNAivectorsinmammaliancells."NatGenet34(3):263-264.Cekaite,L.,G.Furset,etal.(2007)."Geneexpressionanalysisinbloodcellsinresponsetounmodifiedand2'-modifiedsiRNAsrevealsTLR-dependentandindependenteffects."JMolBiol365(1):90-108.Christensen,S.R.,J.Shupe,etal.(2006)."Toll-likereceptor7andTLR9dictateautoantibodyspecificityandhaveopposinginflammatoryandregulatoryrolesinamurinemodeloflupus."Immunity25(3):417-428.Diebold,S.S.,T.Kaisho,etal.(2004)."InnateantiviralresponsesbymeansofTLR7-mediatedrecognitionofsingle-strandedRNA."Science303(5663):1529-1531.Elbashir,S.M.,J.Harborth,etal.(2001)."Duplexesof21-nucleotideRNAsmediateRNAinterferenceinculturedmammaliancells."Nature411(6836):494-498.Fire,A.,S.Xu,etal.(1998)."Potentandspecificgeneticinterferencebydouble-strandedRNAinCaenorhabditiselegans."Nature391(6669):806-811.Heil,F.,H.Hemmi,etal.(2004)."Species-specificrecognitionofsingle-strandedRNAviatoll-likereceptor7and8."Science303(5663):1526-1529.Hornung,V.,M.Guenthner-Biller,etal.(2005)."Sequence-specificpotentinductionofIFN-alphabyshortinterferingRNAinplasmacytoiddendriticcellsthroughTLR7."NatMed11(3):263-270.Jackson,A.L.,J.Burchard,etal.(2006)."WidespreadsiRNA"off-target"transcriptsilencingmediatedbyseedregionsequencecomplementarity."RNA12(7):1179-1187.Janssens,S.andR.Beyaert(2003)."RoleofToll-likereceptorsinpathogenrecognition."ClinMicrobiolRev16(4):637-646.Judge,A.D.,G.Bola,etal.(2006)."DesignofnoninflammatorysyntheticsiRNAmediatingpotentgenesilencinginvivo."MolTher13(3):494-505.Judge,A.D.,V.Sood,etal.(2005)."Sequence-dependentstimulationofthemammalianinnateimmuneresponsebysyntheticsiRNA."NatBiotechnol23(4):457-462.Kariko,K.,P.Bhuyan,etal.(2004)."ExogenoussiRNAmediatessequence-independentgenesuppressionbysignalingthroughtoll-likereceptor3."CellsTissuesOrgans177(3):132-138.Kawai,T.andS.Akira(2006)."Innateimmunerecognitionofviralinfection."NatImmunol7(2):131-137.Kim,D.H.,M.Longo,etal.(2004)."InterferoninductionbysiRNAsandssRNAssynthesizedbyphagepolymerase."NatBiotechnol22(3):321-325.Kim,D.H.andJ.J.Rossi(2007)."StrategiesforsilencinghumandiseaseusingRNAinterference."NatRevGenet8(3):173-184.Kleinman,M.E.,K.Yamada,etal.(2008)."Sequence-andtarget-independentangiogenesissuppressionbysiRNAviaTLR3."Nature452(7187):591-597.Kumar,A.,J.Haque,etal.(1994)."Double-strandedRNA-dependentproteinkinaseactivatestranscriptionfactorNF-kappaBbyphosphorylatingIkappaB."ProcNatlAcadSciUSA91(14):6288-6292.Lau,C.M.,C.Broughton,etal.(2005)."RNA-associatedautoantigensactivateBcellsbycombinedBcellantigenreceptor/Toll-likereceptor7engagement."JExpMed202(9):1171-1177.Lee,J.,T.H.Chuang,etal.(2003)."Molecularbasisfortheimmunostimulatoryactivityofguaninenucleosideanalogs:activationofToll-likereceptor7."ProcNatlAcadSciUSA100(11):6646-6651.Lund,J.M.,L.Alexopoulou,etal.(2004)."Recognitionofsingle-strandedRNAvirusesbyToll-likereceptor7."ProcNatlAcadSciUSA101(15):5598-5603.Manche,L.,S.R.Green,etal.(1992)."Interactionsbetweendouble-strandedRNAregulatorsandtheproteinkinaseDAI."MolCellBiol12(11):5238-5248.Matsumoto,M.,K.Funami,etal.(2004)."Toll-likereceptor3:alinkbetweentoll-likereceptor,interferonandviruses."MicrobiolImmunol48(3):147-154.Michels,S.,U.Schmidt-Erfurth,etal.(2006)."Promisingnewtreatmentsforneovascularage-relatedmaculardegeneration."ExpertOpinInvestigDrugs15(7):779-793.Pardoll,D.M.(2012)."Theblockadeofimmunecheckpointsincancerimmunotherapy."NatRevCancer12(4):252-264.Pisitkun,P.,J.A.Deane,etal.(2006)."AutoreactiveBcellresponsestoRNA-relatedantigensduetoTLR7geneduplication."Science312(5780):1669-1672.Poeck,H.,R.Besch,etal.(2008)."5'-Triphosphate-siRNA:turninggenesilencingandRig-Iactivationagainstmelanoma."NatMed14(11):1256-1263.Robbins,M.,A.Judge,etal.(2008)."MisinterpretingthetherapeuticeffectsofsmallinterferingRNAcausedbyimmunestimulation."HumGeneTher19(10):991-999.Robbins,M.,A.Judge,etal.(2007)."2'-O-methyl-modifiedRNAsactasTLR7antagonists."MolTher15(9):1663-1669.Rossi,J.J.(2009)."InnateimmunityconfoundstheclinicalefficacyofsmallinterferingRNAs(siRNAs)."GeneTher16(5):579-580.Sioud,M.(2005)."Inductionofinflammatorycytokinesandinterferonresponsesbydouble-strandedandsingle-strandedsiRNAsissequence-dependentandrequiresendosomallocalization."JMolBiol348(5):1079-1090.Sledz,C.A.andB.R.Williams(2003)."RNAinterferenceandinterferon."DiscovMed3(18):30-31.Subramanian,S.,K.Tus,etal.(2006)."ATlr7translocationacceleratessystemicautoimmunityinmurinelupus."ProcNatlAcadSciUSA103(26):9970-9975.Swann,J.B.andM.J.Smyth(2007)."Immunesurveillanceoftumors."JClinInvest117(5):1137-1146.Topalian,S.L.,F.S.Hodi,etal.(2012)."Safety,activity,andimmunecorrelatesofanti-PD-1antibodyincancer."NEnglJMed366(26):2443-2454.Ulevitch,R.J.(2004)."Therapeuticstargetingtheinnateimmunesystem."NatRevImmunol4(7):512-520.Vollmer,J.,S.Tluk,etal.(2005)."ImmunestimulationmediatedbyautoantigenbindingsiteswithinsmallnuclearRNAsinvolvesToll-likereceptors7and8."JExpMed202(11):1575-1585.Whitmore,M.M.,M.J.DeVeer,etal.(2004)."Synergisticactivationofinnateimmunitybydouble-strandedRNAandCpGDNApromotesenhancedantitumoractivity."CancerRes64(16):5850-5860.Williams,B.R.(1999)."PKR;asentinelkinaseforcellularstress."Oncogene18(45):6112-6120.Wolchok,J.D.,H.Kluger,etal.(2013)."Nivolumabplusipilimumabinadvancedmelanoma."NEnglJMed369(2):122-133.Yoneyama,M.,M.Kikuchi,etal.(2004)."TheRNAhelicaseRIG-Ihasanessentialfunctionindouble-strandedRNA-inducedinnateantiviralresponses."NatImmunol5(7):730-737.序列表<110>Peptimed,Inc.Primiano,ThomasChang,Bey-Dih<120>抗肿瘤组合物和方法<130>14-1633-WO<150>US62/070,495<151>2014-08-27<160>12<170>PatentInversion3.5<210>1<211>19<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>1aauucuccgaacgugucac19<210>2<211>19<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>2gugacacguucggagaauu19<210>3<211>21<212>DNA<213>人工序列<220><223>合成的寡核苷酸<220><221>misc_feature<222>(2)..(2)<223>2’-核糖位置的修饰<220><221>misc_feature<222>(20)..(20)<223>脱氧核糖胸腺嘧啶核苷<220><221>misc_feature<222>(21)..(21)<223>脱氧核糖胸腺嘧啶核苷<400>3aauucuccgaacgugucactt21<210>4<211>21<212>DNA<213>人工序列<220><223>合成的寡核苷酸<220><221>misc_feature<222>(2)..(2)<223>2’-核糖位置的修饰<220><221>misc_feature<222>(20)..(20)<223>脱氧核糖胸腺嘧啶核苷<220><221>misc_feature<222>(21)..(21)<223>脱氧核糖胸腺嘧啶核苷<400>4gugacacguucggagaauutt21<210>5<211>21<212>DNA<213>人工序列<220><223>合成的寡核苷酸<220><221>misc_feature<222>(2)..(2)<223>2’核糖位置的修饰<220><221>misc_feature<222>(3)..(3)<223>2’核糖位置的修饰<220><221>misc_feature<222>(4)..(4)<223>2’核糖位置的修饰<220><221>misc_feature<222>(6)..(6)<223>2’核糖位置的修饰<220><221>misc_feature<222>(9)..(9)<223>2’核糖位置的修饰<220><221>misc_feature<222>(13)..(13)<223>2’核糖位置的修饰<220><221>misc_feature<222>(14)..(14)<223>2’核糖位置的修饰<220><221>misc_feature<222>(15)..(15)<223>2’核糖位置的修饰<220><221>misc_feature<222>(16)..(16)<223>2’核糖位置的修饰<220><221>misc_feature<222>(20)..(20)<223>脱氧核糖胸腺嘧啶核苷<220><221>misc_feature<222>(21)..(21)<223>脱氧核糖胸腺嘧啶核苷<400>5aauucuccgaacgugucactt21<210>6<211>21<212>DNA<213>人工序列<220><223>合成的寡核苷酸<220><221>misc_feature<222>(1)..(1)<223>2’核糖位置的修饰<220><221>misc_feature<222>(2)..(2)<223>2’核糖位置的修饰<220><221>misc_feature<222>(3)..(3)<223>2’核糖位置的修饰<220><221>misc_feature<222>(8)..(8)<223>2’核糖位置的修饰<220><221>misc_feature<222>(9)..(9)<223>2’核糖位置的修饰<220><221>misc_feature<222>(10)..(10)<223>2’核糖位置的修饰<220><221>misc_feature<222>(12)..(12)<223>2’核糖位置的修饰<220><221>misc_feature<222>(13)..(13)<223>2’核糖位置的修饰<220><221>misc_feature<222>(15)..(15)<223>2’核糖位置的修饰<220><221>misc_feature<222>(18)..(18)<223>2’核糖位置的修饰<220><221>misc_feature<222>(19)..(19)<223>2’核糖位置的修饰<220><221>misc_feature<222>(20)..(20)<223>脱氧核糖胸腺嘧啶核苷<220><221>misc_feature<222>(21)..(21)<223>脱氧核糖胸腺嘧啶核苷<400>6gugacacguucggagaauutt21<210>7<211>20<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>7gaactccttctccacaagcg20<210>8<211>20<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>8aatccagattggaagcatcc20<210>9<211>20<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>9ttcagcacagaggactcatc20<210>10<211>20<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>10aggcacaagggctgtatttc20<210>11<211>23<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>11gggaaatcgtgcgtgacattaag23<210>12<211>22<212>DNA<213>人工序列<220><223>合成的寡核苷酸<400>12tgtgttggcgtacaggtctttg22当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1