用于治疗失眠的组合物和方法与流程
发明领域
本发明涉及用于治疗失眠的组合物和方法。本申请要求基于2014年10月23日在美国提交的美国专利申请号62/067,443的优先权,其内容通过引用结合在此。
发明背景
食欲素受体是主要存在于脑中的g蛋白偶联受体。它们的内源性配体:食欲素-a和食欲素-b,由位于下丘脑中的神经元表达。食欲素-a是由33个氨基酸组成的肽;食欲素-b由28个氨基酸组成(樱井(sakurait.)等人,《细胞》(cell),1998,92573-585)。存在两种亚型的食欲素受体,食欲素受体1(在下文中称为ox1)和食欲素受体2(在下文中称为ox2);ox1优先结合食欲素-a,而ox2结合食欲素-a和-b。食欲素刺激大鼠的食物消耗,并且已经表明食欲素信号传导可以在用于调节摄食行为的中央反馈机制中发挥作用(樱井等人,同上)。还观察到食欲素控制醒睡条件(凯麦力(chemellir.m)等人,《细胞》,1999,98,437-451)。食欲素也可以在与类鸦片依赖和尼古丁依赖(伯格兰德(s.l.borgland)等人,《神经元》(neuron),2006,49,598-601;温斯洛(c.j.winrow)等人,《神经药理学》(neuropharmacology),2010,58,185-194),以及乙醇依赖(夏布洛克(j.r.shoblock)等人,《精神药理学》(psychopharmacology),2011,215,191-203)相关的大脑变化中发挥作用。另外,已经表明食欲素在一些应激反应中发挥作用(艾达(t.ida)等人,《生物化学与生物物理学研究通讯》(biochem.biophys.res.commun.),2000,270,318-323)。化合物例如:(1r,2s)-2-(((2,4-二甲基嘧啶-5-基)氧基)甲基)-2-(3-氟苯基)-n-(5-氟吡啶-2-基)环丙烷甲酰胺(在下文中称为化合物a)已被发现是有效的食欲素受体拮抗剂,并且可用于治疗睡眠障碍例如失眠,以及用于其他治疗用途。
化合物a的化学式
关于催眠剂,当每晚服用一次的药物配制品中的活性药物成分(在下文中称为api)的剂量太高时,其具有引起次日残余睡意的潜能,而即使患者能够使用催眠剂入睡,单次剂量不足可能导致患者在正常睡眠期间醒来。因此,与仅考虑副作用和功效之间的平衡相比,难以通过考虑易于入睡开始和避免残余睡意之间的敏感平衡来设定适当剂量。此外,即使知道用于失眠的某种药物的剂量、api的物理化学性质和给药后的药代动力学(在下文中称为pk)曲线,这样的信息也不适用于用于失眠的其他api,因为它很可能受许多因素影响,包括作用机制、给药途径、吸收速率、生理化学性质如每种api在血浆中的溶解度和稳定性或其他因素。实际上,残余睡意和催眠剂的特征之间的关系并不总是一致的(《中枢神经系统药物》(cnsdrugs)2004;18(5):297-328)。对于化合物a,pk曲线和睡意效应(例如入睡开始或残余睡意)之间的关系还是未知的。
本领域需要更有效的治疗失眠的方法,以便在整个睡眠期间实现快速入睡开始以及睡眠维持,而避免残余睡意和/或次日障碍,该方法包括口服给予催眠剂的固体剂型。此外,本领域需要一种药物组合物,该药物组合物包括催眠剂和至少一种药学上可接受的赋形剂,用于治疗失眠,以便在整个睡眠期间实现快速入睡开始以及睡眠维持,而避免残余睡意和/或次日障碍。
发明概述
本发明的一个目的是提供治疗失眠的方法,该方法包括口服给予固体剂型的药物化合物a。
本发明的另一个目的是提供一种药物组合物,该药物组合物包括治疗有效量的化合物a。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是在从约1mg至约15mg范围内的单次每日剂量。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是在从约2mg至约15mg范围内的单次每日剂量。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是在从约2mg至约10mg范围内的单次每日剂量。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是选自约2mg、2.5mg、4mg、5mg、8mg、10mg或15mg的单次每日剂量。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该单次每日剂量提供从约3.0ng/ml至约7.2ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是在从约1mg至约15mg范围内的单次每日剂量,并且其中在对人类受试者单次剂量给予后,对于每1mg的化合物a,所述单次每日剂量达到从约3.0ng/ml至约7.2ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次剂量达到在5.3ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在16ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在23ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在36ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该单次每日剂量达到从约15.9ng*hr/ml至约23.8ng*hr/ml的平均auc(0-24)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在17ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在57ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在95ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在159ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该单次每日剂量达到从约19.1ng*hr/ml至约51.1ng*hr/ml的平均auc(0-t)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在19ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在128ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在284ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该单次每日剂量达到从约19.8ng*hr/ml至约53.1ng*hr/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在20ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在149ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在另外的实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在311ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是在从约1mg至约15mg范围内的单次每日剂量,并且其中在对人类受试者单次剂量给予后的8至10小时,所述单次每日剂量提供约20ng/ml或更少的平均血浆化合物a浓度。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是在从约1mg至约15mg范围内的单次每日剂量。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的药物,该单次每日剂量达到从约3.0ng/ml至约7.2ng/ml的平均最大血浆浓度(cmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在5.3ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在16ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在23ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在36ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的药物,所述单次每日剂量提供从约15.9ng*hr/ml至约23.8ng*hr/ml的平均auc(0-24)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在17ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在57ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在95ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在159ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的药物,该单次每日剂量提供从约19.1ng*hr/ml至约51.1ng*hr/ml的平均auc(0-t)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在19ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在128ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在284ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后,对于每1mg的药物,该单次每日剂量提供从约19.8ng*hr/ml至约53.1ng*hr/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次1mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在20ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次2.5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次5mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在149ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在另外的实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次10mg每日剂量,并且其中在对人类受试者单次剂量给予后,所述单次每日剂量达到在311ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
在某些实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是在从约1mg至约15mg范围内的单次每日剂量,并且其中在对人类受试者单次剂量给予后的8至10小时,所述单次每日剂量提供约20ng/ml或更少的平均血浆化合物a浓度。
在某些实施例中,本发明涉及一种口服药物剂型,其包括药学上可接受的赋形剂和用于治疗失眠的有效量的化合物a,在溶出研究开始的30分钟内,根据日本药典16版(jp16)中的6.10溶出试验(dissolutiontest)或美国药典37版(usp37)中的<711>溶出(dissolution)中关于速释剂型的程序,使用装置2(桨叶装置,桨速;75rpm),该剂型在溶出介质(含有0.5%聚山梨醇酯80的0.1mol/l盐酸,900ml,37℃±0.5℃)中提供85%或更高的溶出速率。
在某些实施例中,本发明涉及一种口服药物剂型,其包括药学上可接受的赋形剂和用于治疗失眠的有效量的化合物a,在溶出研究开始的15分钟内,根据日本药典16版中的6.10溶出试验或美国药典37版中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置,桨速;50rpm),该剂型在溶出介质(0.1mol/l盐酸,900ml,37℃±0.5℃)中提供85%或更高的溶出速率。
在某些实施例中,本发明涉及一种口服药物剂型,其包括作为药学上可接受的赋形剂的乳糖。
在某些实施例中,本发明涉及一种口服药物剂型,其包括作为药学上可接受的赋形剂的低取代羟丙基纤维素。
在某些实施例中,本发明涉及一种口服药物剂型,其包括作为药学上可接受的赋形剂的乳糖和低取代羟丙基纤维素。
根据本发明的方法具有治疗失眠且易于入睡开始的潜在用途,而避免了残余睡意和/或次日障碍。
根据本发明的药物组合物具有口服固体剂量来治疗失眠的潜在用途。
详细说明
i.定义
为了能够更充分地理解本文所述的发明,为了本披露的目的而提供以下定义:
术语“有效量”是指能够在对其有需要的人类受试者中实现治疗作用的药物化合物a的量。
术语“药物化合物a”应意指(1r,2s)-2-(((2,4-二甲基嘧啶-5-基)氧基)甲基)-2-(3-氟苯基)-n-(5-氟吡啶-2-基)环丙烷甲酰胺或其药学上可接受的盐、水合物、溶剂化物、多晶型物、游离碱或其任何组合。
术语“人类受试者”应意指正常健康的男性或女性志愿者,和/或表现出失眠的临床体征和症状、或表现出引起失眠的任何疾病或障碍的任何个体。
如在此使用的术语“失眠”应意指由美国精神病学会(americanpsychiatricassociation)出版的第5版(2013)精神障碍诊断与统计手册(diagnosticandstatisticalmanualofmentaldisorders)(下文称为dsm-v)中的所有描述。
dsm-v列出了失眠的诊断标准如下:
a.主要不适是对与以下一种(或多种)症状相关的睡眠量或睡眠质量不满意:
1.难以入睡(在儿童中,这可能表现为在没有照顾者干预的情况下难以入睡。)
2.难以维持睡眠,其特征在于频繁觉醒或在觉醒后难以继续入睡。(在儿童中,这可能表现为在没有照顾者干预的情况下难以继续入睡。)
3.清晨觉醒后无法继续入睡。
b.睡眠障碍造成临床上显著的痛苦或障碍,其可发生在社交、工作、教育、学术、行为或其他重要的功能领域。
c.每周至少3晚出现睡眠困难。
d.睡眠困难存在至少3个月。
e.尽管有足够的睡眠时间,仍出现睡眠困难。
f.失眠无法通过另外的睡眠-觉醒障碍(例如昏睡病、与呼吸有关的睡眠障碍、昼夜节律睡眠-觉醒障碍、异常睡眠)过程来更好地解释,并且排他性地不在该另外的睡眠-觉醒障碍过程中发生。
g.失眠不是归因于物质的生理学效应(例如滥用药物、药物治疗)。
h.并存的精神障碍和医学症状不能充分解释失眠的主要不适。
失眠应意指由以下症状表征的睡眠障碍,这些症状包括但不限于入睡困难、保持睡眠困难、间歇性觉醒和/或过早醒来。该术语还包括日间症状,例如睡意、焦虑、注意力不集中、记忆力受损和易激惹。适于用本发明的组合物来治疗的失眠类型包括但不限于短期性失眠和慢性失眠。术语“短期性失眠”是指持续约2周至约4周的失眠。术语“慢性失眠”是指持续至少一个月或更长时间的失眠。
表述“生物等效的”或“生物等效性”是本领域的术语,并且旨在根据由美国卫生和人类服务部(u.sdepartmentofhealthandhumanservices)出版的第34版《具有治疗等效性评价的经批准药物产品》(approveddrugproductswiththerapeuticequivalenceevaluations)(通常被称为“橙皮书”)来定义。相同药品的不同配制品的生物等效性涉及药物吸收的速率和程度的等效性。将测试配制品的吸收程度和速率与参考配制品进行比较,以便确定两种配制品是否是生物等效的。标准生物等效性研究以交叉方式通过广泛测试进行,包括给予多名志愿者(通常为12至24名健康正常成人)单次剂量的测试药物和参考药物,然后随时间测量药物的血液或血浆水平。用于建立具有参考配制品的生物等效性的配制品的详细指南已由美国食品药品管理局通用药品办事处(fdaofficeofgenericdrugs)的生物等效性部门(divisionofbioequivalence)出版。
其pk参数(例如cmax、auc或tmax)相差-20%/+25%或更小的两种配制品通常被认为是“生物等效的”。另一种平均生物等效性的方法涉及测试产品和参考产品的测量值的平均值(群体几何平均值)比率的90%置信区间的计算。为了建立be,计算的置信区间通常应该在产品平均值比率的80%-125%之间。除了这种一般方法,其他方法包括(1)药代动力学数据的对数转换,(2)评估序列效应的方法和(3)评估异常值数据的方法,可能有助于建立生物等效性。例如,在上述(1)中,置信区间通常应该在对数转换的pk参数的平均值的差的80%-125%之间。
术语“睡眠时间”是指受试者用于睡眠的时间。睡眠时间可以是连续的或不连续的。
“睡眠效率”是指受试者在床上时间内得到的总睡眠时间。睡眠效率通过以下等式测量:100*(总睡眠时间(tst)/总床上时间)。
短语“残余睡意”是指患者在觉醒时主观感觉到睡意或镇静,通常发生在前一天晚上给予催眠药后的第二天早晨。“次日障碍”是指损害需要警觉性的活动(包括驾驶)的患者行为,这发生在他们第二天早晨醒来时,但是他们血液中的失眠药物的水平保持足够高。卡罗林斯卡嗜睡量表(karolinskasleepinessscale,kss)是用于评价主观睡意的多种工具之一。kss最初被开发以构成一维的睡意量表,并且针对α和θ脑电图(eeg)活动以及慢速眼动眼电图(eog)活动(阿克尔斯泰特
术语“剂型”或“药物剂型”应意指给予药物物质(活性药物成分(api))的方式,或者促进药物向患者和其他哺乳动物给药、给予和递送的方式。剂型根据给药途径和施用部位进行分类,包括例如口服、局部、直肠、阴道、静脉内、皮下、肌内、眼部、鼻部、耳部和吸入给药。可替代地,剂型根据物理形式进行分类,例如固体、半固体或液体。此外,剂型根据它们的形式、功能和特征进行细分,包括但不限于片剂、胶囊剂或注射剂,如在日本药典16版(japanesepharmacopoeia,jp16)或美国药典37版-nf(u.s.pharmacopoeia-nf,usp37)中的通则(generalchapter)<1151>药物剂型(pharmaceuticaldosageforms)的专论中所述。
术语“赋形剂”应意指典型地非活性成份,其用作载体(例如水、胶囊壳等)、稀释剂或构成剂型或药物组合物(包含药物例如治疗剂)的组分。该术语还包括典型地非活性成份,其赋予组合物凝聚功能(即粘合剂)、崩解功能(即崩解剂)、润滑功能(润滑剂)和/或其他功能(即溶剂、表面活性剂等)。
术语“平均值”是指几何平均值。药代动力学参数例如“平均cmax”或“平均auc”是指cmax或auc的几何平均值。
本申请中使用的术语的缩写和定义的列表如下。
auc:血浆浓度-时间曲线下面积
auc(0-x):给药后时间从0至x小时的血浆浓度-时间曲线下面积
auc(0-t):从时间零到最后可计量浓度时间的血浆浓度-时间曲线下面积
auc(0-inf):从时间零到无穷大的血浆浓度-时间曲线下面积
ancova:协方差分析
ci:置信区间
cmax:最大药物浓度
cx:给药后x小时的血浆浓度
cv:变异系数
dsst:数字符号替换测验
ecg:心电图
eeg:脑电图
emg:肌电图
eog:眼电图
kss:卡罗林斯卡嗜睡量表
lc-ms/ms:液相色谱-质谱/质谱
lps:持续睡眠潜伏期,从关灯到psg记录(期)到20个连续的非觉醒期的前30秒的持续时间
ls:最小二乘法
mad:多次递增剂量
mtd:最大耐受剂量
pd:药效学
pk:药代动力学
psg:多导睡眠图
pvt:精神运动警觉测试
rem:快速眼动
rt:反应时间
se:睡眠效率,tst除以床上时间(分钟)乘以100
sad:单次递增剂量
sd:标准差
t1/2:末端消除半衰期
tmax:给药后达到最大(峰值)浓度的时间
tst:总睡眠时间,床上时间(tib)内的快速眼动(rem)+非快速眼动(non-rem,nrem)的睡眠持续时间
waso:入睡开始后醒来,从持续睡眠(lps)开始到开灯的觉醒持续时间
附图简要说明
图1显示化合物a的1mg和50mg胶囊剂的溶出曲线
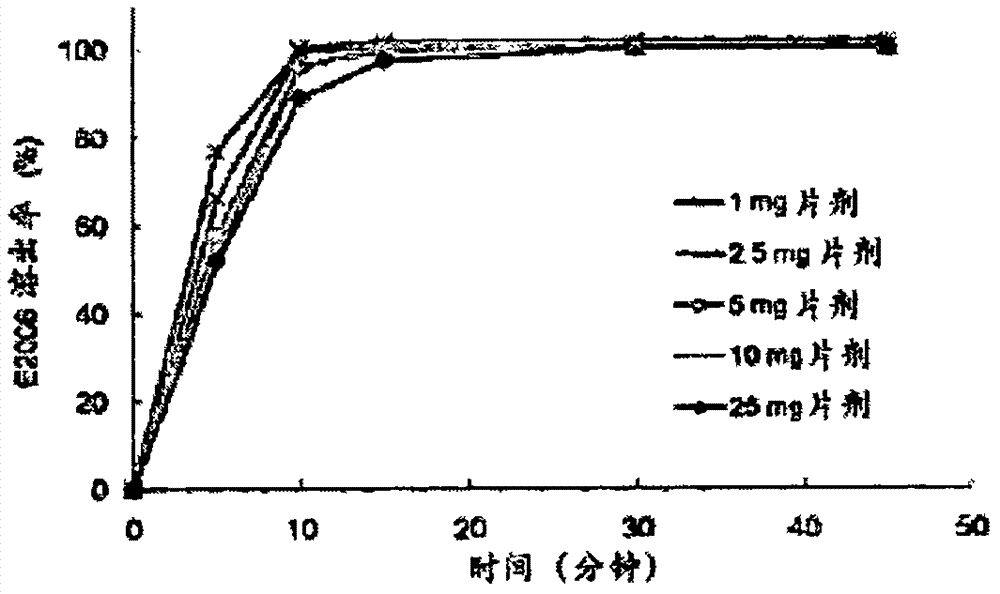
图2显示化合物a的1mg、2.5mg、5mg、10mg和25mg片剂的溶出曲线
图3显示在条件i中获得的化合物a的胶囊剂和片剂的对比溶出曲线
ii.实施例的描述
在某些实施例中,本发明涉及一种治疗失眠的方法,包括口服给予从约1mg至约15mg量的化合物a的单次每日剂量,并且其中所述单次剂量提供易于入睡开始,而避免了残余睡意和/或次日障碍。
在某些实施例中,本发明涉及一种治疗失眠的方法,包括口服给予从约1mg至约15mg量的化合物a的单次每日剂量,以达到从约3.0ng/ml至约108ng/ml的平均最大血浆浓度(cmax)。单次每日剂量给予达到从约15.9ng*hr/ml至约356.4ng*hr/ml的平均auc(0-24);从约19.1ng*hr/ml至约766.5ng*hr/ml的平均auc(0-t);从约19.8ng*hr/ml至约796.5ng*hr/ml的平均auc(0-inf);从约12.7至约60小时的平均t1/2;并且达到从约1至约3.25小时的达到最大血浆浓度的平均时间(tmax)。
在另一个实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约3.0ng/ml至约7.2ng/ml的平均最大血浆浓度(cmax)。单次每日剂量给予对于每1mg的化合物a,达到从约15.9ng*hr/ml至约23.8ng*hr/ml的平均auc(0-24);对于每1mg的化合物a,从约19.1ng*hr/ml至约51.1ng*hr/ml的平均auc(0-t);对于每1mg的化合物a,达到从约19.8ng*hr/ml至约53.1ng*hr/ml的平均auc(0-inf)。
当给予人类受试者单次1mg每日剂量的化合物a时,达到约5.3ng/ml的平均最大血浆浓度(cmax);约17.2ng*hr/ml的平均auc(0-24);约19.1ng*hr/ml的平均auc(0-t);约19.8ng*hr/ml的平均auc(0-inf);约12.7小时的平均t1/2;和约1小时的达到最大血浆浓度的平均时间(tmax)。
当给予人类受试者单次2.5mg每日剂量的化合物a时,达到从约10ng/ml至约18ng/ml的平均最大血浆浓度(cmax);约57ng*hr/ml至约60ng*hr/ml的平均auc(0-24);从约80ng*hr/ml至约95ng*hr/ml的平均auc(0-t);从约80ng*hr/ml至约103ng*hr/ml的平均auc(0-inf);从约30至约37小时的平均t1/2;和从约1至2小时的达到最大血浆浓度的平均时间(tmax)。
当给予人类受试者单次5mg每日剂量的化合物a时,达到从约19ng/ml至约23ng/ml的平均最大血浆浓度(cmax);从约95ng*hr/ml至约110ng*hr/ml的平均auc(0-24);约128ng*hr/ml的平均auc(0-t);约150ng*hr/ml的平均auc(0-inf);约31小时的平均t1/2;和从约1至约2小时的达到最大血浆浓度的平均时间(tmax)。
当给予人类受试者单次10mg每日剂量的化合物a时,达到从约30ng/ml至约58ng/ml的平均最大血浆浓度(cmax);从约160ng*hr/ml至约190ng*hr/ml的平均auc(0-24);从约280ng*hr/ml至约510ng*hr/ml的平均auc(0-t);从约310ng*hr/ml至约530ng*hr/ml的平均auc(0-inf);从约56至约60小时的平均t1/2;和从约1至约3.25小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,当给予人类受试者单次1mg每日剂量的化合物a时,达到(1)在5.3ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在17ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在19ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在19ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.0小时的约80%至约125%范围内的达到最大血浆浓度的平均时间(tmax)。
在另一个实施例中,当给予人类受试者单次2.5mg每日剂量的化合物a时,达到(1)在16ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在57ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在80ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在80ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.0小时的约80%至约125%范围内的达到最大血浆浓度的平均时间(tmax)。
在另一个实施例中,当给予人类受试者单次5mg每日剂量的化合物a时,达到(1)在23ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在95ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在128ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在149ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.6小时的约80%至约125%范围内的达到最大血浆浓度的平均时间。
在另一个实施例中,当给予人类受试者单次10mg每日剂量的化合物a时,达到(1)在36ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在159ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在284ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在311ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.0小时的约80%至约125%范围内的达到最大血浆浓度的平均时间。
在某些实施例中,当在约14天的时间内给予单次2.5mg每日剂量时,达到约15ng/ml的平均最大血浆浓度(cmax);约120ng*hr/ml的平均auc(0-24);约44小时的平均t1/2;和约2小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,当在约14天的时间内给予单次5mg每日剂量时,达到约24ng/ml的平均最大血浆浓度(cmax);约190ng*hr/ml的平均auc(0-24);约46小时的平均t1/2;和约1小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,当在约14天的时间内给予单次10mg每日剂量时,达到约47ng/ml的平均最大血浆浓度(cmax);约360ng*hr/ml的平均auc(0-24);约55小时的平均t1/2;和约2小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后8至10小时,该单次每日剂量提供约20ng/ml或更少的平均血浆化合物a浓度。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后8至10小时,该单次每日剂量提供约18ng/ml或更少的平均血浆化合物a浓度。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后8至10小时,该单次每日剂量提供约15ng/ml或更少的平均血浆化合物a浓度。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后8至10小时,该单次每日剂量提供约9.0ng/ml或更少的平均血浆化合物a浓度。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者单次剂量给予后8至10小时,该单次每日剂量达到从约0.4ng/ml至约9.0ng/ml的平均血浆化合物a浓度。
在某些实施例中,本发明提供治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是在从约2.5mg至约10mg范围内的单次每日剂量,并且其中在对人类受试者单次剂量给予后8小时,所述单次每日剂量达到从约1.8ng/ml至约9.0ng/ml的平均血浆化合物a浓度;或在对人类受试者单次剂量给予后9小时,所述单次每日剂量达到从约1.5ng/ml至约5.0ng/ml的平均血浆化合物a浓度;或在对人类受试者单次剂量给予10小时后,所述单次每日剂量达到从约2.0ng/ml至约8.0ng/ml的平均血浆化合物a浓度。
在某些实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是在从约1mg至约15mg范围内的单次剂量,并且其中所述单次剂量提供易于入睡开始,而避免了残余睡意和/或次日障碍。
在对人类受试者单次剂量给予后,本发明的剂型达到:1)从约3.0ng/ml至约108ng/ml的平均最大血浆浓度(cmax);2)从约15.9ng*hr/ml至约356.4ng*hr/ml的平均auc(0-24);3)从约12.7至约60小时的平均t1/2;和4)从约1至约3.25小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该剂型提供从约3.0ng/ml至约7.2ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,该剂型包括1mg的化合物a,并且在对人类受试者单次剂量给予后,提供约5.3ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,该剂型包括2.5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约10ng/ml至约18ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,该剂型包括5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约19ng/ml至约23ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,该剂型包括10mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约30ng/ml至约58ng/ml的平均最大血浆浓度(cmax)。
在某些实施例中,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该剂型提供从约15.9ng*hr/ml至约23.8ng*hr/ml的平均auc(0-24)。
在某些实施例中,该剂型包括1mg的化合物a,并且在对人类受试者单次剂量给予后,提供约17ng*hr/ml的平均auc(0-24)。
在某些实施例中,该剂型包括2.5mg的化合物a,并且在对人类受试者单次剂量给予后,提供约57ng*hr/ml至约60ng*hr/ml的平均auc(0-24)。
在某些实施例中,该剂型包括5mg的化合物a,并且在对人类受试者单次剂量给予后,提供约95ng*hr/ml至约110ng*hr/ml的平均auc(0-24)。
在某些实施例中,该剂型包括10mg的化合物a,并且在对人类受试者单次剂量给予后,提供约160ng*hr/ml至约190ng*hr/ml的平均auc(0-24)。
在另外的实施例中,在对人类受试者单次剂量给予后,该剂型提供从约19.1ng*hr/ml至约766.5ng*hr/ml的平均auc(0-t)。
在另外的实施例中,该剂型包括从1mg至15mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约19.1ng*hr/ml至约766.5ng*hr/ml的平均auc(0-t)。
在某些实施例中,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该剂型提供从约19.1ng*hr/ml至约51.1ng*hr/ml的平均auc(0-t)。
在某些实施例中,该剂型包括1mg的化合物a,并且在对人类受试者单次剂量给予后,提供约19ng*hr/ml的平均auc(0-t)。
在某些实施例中,该剂型包括2.5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约80ng*hr/ml至约95ng*hr/ml的平均auc(0-t)。
在某些实施例中,该剂型包括5mg的化合物a,并且在对人类受试者单次剂量给予后,提供约128ng*hr/ml的平均auc(0-t)。
在某些实施例中,该剂型包括10mg的化合物a并且在对人类受试者单次剂量给予后,提供从约280ng*hr/ml至约510ng*hr/ml的平均auc(0-t)。
在另外的实施例中,在对人类受试者单次剂量给予后,该剂型提供从约19.8ng*hr/ml至约796.5ng*hr/ml的平均auc(0-inf)。
在某些实施例中,该剂型包括从约1mg至约15mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约19.8ng*hr/ml至约796.5ng*hr/ml的平均auc(0-inf)。
在某些实施例中,在对人类受试者单次剂量给予后,对于每1mg的化合物a,该剂型提供从约19.8ng*hr/ml至约53.1ng*hr/ml的平均auc(0-inf)。
在某些实施例中,该剂型包括1mg的化合物a,并且在对人类受试者单次剂量给予后提供约19.8ng*hr/ml的平均auc(0-inf)。
在某些实施例中,该剂型包括2.5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约80ng*hr/ml至约103ng*hr/ml的平均auc(0-inf)。
在某些实施例中,该剂型包括5mg的化合物a,并且在对人类受试者单次剂量给予后,提供约150ng*hr/ml的平均auc(0-inf)。
在某些实施例中,该剂型包括10mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约310ng*hr/ml至约530ng*hr/ml的平均auc(0-inf)。
在某些实施例中,在对人类受试者单次剂量给予后8至10小时,该剂型提供约20ng/ml或更少的的平均血浆化合物a浓度。
在某些实施例中,在对人类受试者单次剂量给予后8至10小时,该剂型提供约18ng/ml或更少的的平均血浆化合物a浓度。
在某些实施例中,在对人类受试者单次剂量给予后8至10小时,该剂型提供约15ng/ml或更少的的平均血浆化合物a浓度。
在某些实施例中,在对人类受试者单次剂量给予后8至10小时,该剂型提供约9.0ng/ml或更少的的平均血浆化合物a浓度。
在某些实施例中,在对人类受试者单次剂量给予后8至10小时,该剂型提供从约0.4ng/ml至约9.0ng/ml的平均血浆化合物a浓度。
在另外的实施例中,该剂型包括治疗有效量的化合物a和至少一种药学上可接受的载体或赋形剂,其中所述治疗有效量是在从约2.5mg至约10mg范围内的单次每日剂量,并且其中在对人类受试者单次剂量给予后8小时,所述单次剂量达到从约1.8ng/ml至约9.0ng/ml的平均血浆化合物a浓度;或在对人类受试者单次剂量给予后9小时,所述单次剂量达到从约1.5ng/ml至约5.0ng/ml的平均血浆化合物a浓度;或在对人类受试者单次剂量给予后10小时,所述单次剂量达到从约2.0ng/ml至约8.0ng/ml的平均血浆化合物a浓度。
在某些实施例中,该剂型包括1mg的化合物a,并且在对人类受试者单次剂量给予后,提供约12.7小时的消除半衰期(t1/2)。
在某些实施例中,该剂型包括2.5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约30至37小时的消除半衰期(t1/2)。
在某些实施例中,该剂型包括5mg的化合物a,并且在对人类受试者单次剂量给予后,提供约31小时的消除半衰期(t1/2)。
在某些实施例中,该剂型包括10mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约56至60小时的消除半衰期(t1/2)。
在某些实施例中,该剂型包括1mg的化合物a,并且在对人类受试者单次剂量给予后,提供约1小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,该剂型包括2.5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约1至约2小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,该剂型包括5mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约1至约2小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,该剂型包括10mg的化合物a,并且在对人类受试者单次剂量给予后,提供从约1至约3.25小时的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到(1)在5.3ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在17ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在19ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在19ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.0小时的约80%至约125%范围内的达到最大血浆浓度的平均时间(tmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到(1)在16ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在57ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在80ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在80ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.0小时的约80%至约125%范围内的达到最大血浆浓度的平均时间(tmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到(1)在23ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在95ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在128ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在149ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.6小时的约80%至约125%范围内的达到最大血浆浓度的平均时间(tmax)。
在另一个实施例中,本发明提供一种用于治疗失眠的口服剂型,其包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到(1)在36ng/ml的约80%至约125%范围内的平均最大血浆浓度(cmax);(2)在159ng*hr/ml的约80%至约125%范围内的平均auc(0-24);(3)在284ng*hr/ml的约80%至约125%范围内的平均auc(0-t);(4)在311ng*hr/ml的约80%至约125%范围内的平均auc(0-inf);和/或(5)在1.0小时的约80%至约125%范围内的达到最大血浆浓度的平均时间(tmax)。
在某些实施例中,本发明涉及一种口服药物剂型,其包括药学上可接受的赋形剂和用于治疗失眠的有效量的化合物a,其中在溶出研究开始的45分钟内,根据日本药典16版(jp16)中的6.10溶出试验或美国药典37版(usp37)中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置),该剂型提供85%或更高的溶出速率。该溶出介质(900ml,37℃±0.5℃)选自0.1mol/l盐酸或含有0.5%聚山梨醇酯80的0.1mol/l盐酸。该桨速选自50rpm或75rpm。
在某些实施例中,本发明涉及一种口服药物剂型,其包括药学上可接受的赋形剂和用于治疗失眠的有效量的化合物a,其中在溶出研究开始的30分钟内,根据日本药典16版(jp16)中的6.10溶出试验或美国药典37版(usp37)中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置),该剂型提供85%或更高的溶出速率。该溶出介质(900ml,37℃±0.5℃)选自0.1mol/l盐酸或含有0.5%聚山梨醇酯80的0.1mol/l盐酸。该桨速选自50rpm或75rpm。
在某些实施例中,本发明涉及一种口服药物剂型,其包括药学上可接受的赋形剂和用于治疗失眠的有效量的化合物a,其中在溶出研究开始的15分钟内,根据日本药典16版(jp16)中的6.10溶出试验或美国药典37版(usp37)中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置),该剂型提供85%或更高的溶出速率。该溶出介质(900ml,37℃±0.5℃)选自0.1mol/l盐酸或含有0.5%聚山梨醇酯80的0.1mol/l盐酸。该桨速选自50rpm或75rpm。
在某些实施例中,本发明涉及一种口服药物剂型,其包括药学上可接受的赋形剂和用于治疗失眠的有效量的化合物a,其中在溶出研究开始的15分钟内,根据日本药典16版(jp16)中的6.10溶出试验或美国药典37版(usp37)中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置,桨速;50rpm),该剂型在溶出介质(ph1.2,900ml,37℃±0.5℃)中提供85%或更高的溶出速率。
在某些实施例中,本发明涉及一种口服药物剂型,其包括作为药学上可接受的赋形剂的乳糖。
在某些实施例中,本发明涉及一种口服药物剂型,其包括作为药学上可接受的赋形剂的低取代羟丙基纤维素。
在某些实施例中,本发明涉及一种口服药物剂型,其包括作为药学上可接受的赋形剂的乳糖和低取代羟丙基纤维素。
在本发明中,化合物a可以处于以下形式:游离碱、药学上可接受的盐、水合物、溶剂化物、多晶型物或前述的任何组合。
药学上可接受的盐可以包括但不限于,
无机酸盐(例如,硫酸盐、硝酸盐、高氯酸盐、磷酸盐、碳酸盐、碳酸氢盐、氢氟酸盐、盐酸盐、氢溴酸盐、氢碘酸盐);有机羧酸盐(例如,乙酸盐、草酸盐、马来酸盐、酒石酸盐、富马酸盐、柠檬酸盐);有机磺酸盐(例如,甲磺酸盐、三氟甲磺酸盐、乙磺酸盐、苯磺酸盐、甲苯磺酸盐、樟脑磺酸盐);氨基酸盐(例如,天冬氨酸盐、谷氨酸盐);季胺盐;碱金属盐(例如,钠盐、钾盐);以及碱土金属盐(例如,镁盐、钙盐)。
本发明的治疗失眠的方法包含治疗有效量的化合物a,当根据本发明的教导进行给药时其用于治疗失眠。该有效量是在从0.5mg至100mg、从1mg至15mg、从2mg至15mg、或从2mg至10mg范围内的单次每日剂量。
配制品
本发明的剂型包含治疗有效量的化合物a,当根据本发明的教导进行给药时其用于治疗失眠。剂型中有效量的单位剂量为从0.5mg至100mg、从1mg至15mg、从2mg至15mg、或选自2mg、2.5mg、4mg、5mg、8mg、10mg或15mg。单位剂量不受单次剂量的剂型类型或剂型数量的限制。
本发明的剂型可以构成一种或多种药物组合物,其包含化合物a连同药学上可接受的赋形剂。
在此使用的术语“组合物”包括含有处于特定量的特定成分的产物以及由特定量的多种特定成分的组合所直接或间接引起的任何产物。与药用组合物相关的这样的术语旨在包括含有活性成分以及构成载体的惰性成分的产物,并且包括由任何两种或多种成分的组合、络合或聚集,或一种或多种成分的的解离、其他类型的反应或相互作用而直接或间接引起的每一种产物。因此,本发明的药用组合物包括通过混合本发明的化合物与药学上可接受的载体而制备的每种组合。使用术语“药学上可接受的”来表示载体、稀释剂或媒介物与制剂的其他成分必须是相容的并且对接受者必须是无毒的。
剂型是不限于如前所述,优选固体剂型;更优选口服固体剂型;进一步优选速释口服剂型。
在溶出研究开始的45分钟内、优选30分钟内、更优选15分钟内,根据日本药典16版(jp16)中的6.10溶出试验或美国药典37版(usp37)中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置,桨速),化合物a的剂型的溶出速率超过85%。该溶出介质(900ml,37℃±0.5℃)选自0.1mol/l盐酸或含有0.5%聚山梨醇酯80的0.1mol/l盐酸。桨速选自50rpm或75rpm。
本发明的术语“速释”应意指溶出曲线,即在溶出研究开始的15分钟内,根据日本药典16版(jp16)中的6.10溶出试验或美国药典37版(usp37)中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置,桨速;50rpm),在溶出介质(ph1.2,900ml,37℃±0.5℃)中化合物a的剂型的溶出速率超过80%、优选超过85%。
固体剂型包括胶囊剂、颗粒剂、锭剂、微丸、丸剂、粉剂、悬浮液、片剂,优选胶囊剂、颗粒剂、微丸、丸剂、片剂。
可以使用本领域通常已知的标准技术和制造方法来制备本发明的药物组合物。参见例如日本药典(japanesepharmacopoeia)16版或美国药典-nf(u.s.pharmacopoeia-nf)(37)中的通则(generalchapter)<1151>药物剂型(pharmaceuticaldosageforms)的专论。
可以制备本发明的固体剂型的药物组合物,例如通过干混组分制备粉剂。例如,将化合物a、一种或多种稀释剂、一种或多种任选的赋形剂(例如粘合剂和/或崩解剂、以及其他另外的任选的赋形剂)混合在一起。混合之前的共混物的组分、或共混物本身可以通过筛网,例如400-700μm的筛网。然后将可以经过筛选的润滑剂加入到共混物中,继续混合直到获得作为颗粒剂的均匀混合物。然后将该混合物压制成片剂。可替代地,可以采用湿法制粒技术。例如,通过使用颗粒机将活性剂和一种或多种赋形剂混合在一起,并且将粉末混合物用少量体积的净化水制粒。将所得湿颗粒干燥并通过碾磨机,得到颗粒剂。此外,将崩解剂和润滑剂加入到经碾磨的颗粒中,并且在混合后将所得均匀混合物压制成片剂。可替代地,将例如胶囊壳的载体用粉剂或颗粒剂填充来获得胶囊剂。应当理解,可以根据本领域公知的原理进行干混和湿法制粒技术的改进,包括添加组分的顺序以及在压缩成片剂之前的筛选和共混。
在生产片剂或颗粒剂的情况下,如果需要,可以例如通过喷雾包衣来进行水基膜包衣。
在此使用的稀释剂的实例包括乳糖、玉米淀粉以及结晶纤维素等。在此使用的粘合剂的实例包括羟丙基纤维素、羟丙甲纤维素等。在此使用的崩解剂的实例包括低取代羟丙基纤维素、羧甲基纤维素钙、交联羧甲基纤维素钠等。在此使用的润滑剂的实例包括硬脂酸镁、硬脂酸钙等。在此使用的着色剂的实例包括氧化钛等。在此使用的包衣剂的实例包括羟丙基纤维素、羟丙甲纤维素、甲基纤维素等。然而,不用说,上述试剂的实例并不局限于此。
优选实施例的详细说明
实例
以下实例说明本发明的各个方面。这些实例不应被解释为以任何方式限制权利要求。
实例1
单次剂量研究(001研究)
这是一项随机、双盲、安慰剂和活性对照的、按顺序、单次-剂量研究。该研究由两部分组成,a部分(健康受试者)和b部分(具有原发性失眠但其他方面健康的受试者)。
本研究的主要目的是评价早晨给予健康受试者单次口服剂量的化合物a的安全性和耐受性,并且评价与10mg唑吡坦和安慰剂相比,在睡眠期之前约30分钟的晚上单次口服给药化合物a,关于具有原发性失眠的受试者的剂量反应的选择的药效学(pd)参数(例如,多导睡眠描记法定义的睡眠测量)。
次要目的是评价单次口服剂量的化合物a在原发性失眠受试者和具有原发性失眠但其他方面健康的受试者中的安全性和耐受性,并且评估给予健康受试者和原发性失眠受试者单次口服剂量后的化合物a的药代动力学(pk)。
该研究的两个部分都具有两个阶段,即随机化前阶段和随机化阶段。随机化前阶段持续长达21天,并由筛选期(第21天至第3天)和基线期(第2天至第1天)组成,在此期间确定每个受试者的研究资格,并在第2天进行基线评估。在随机化阶段,受试者随机化接受单次口服剂量的化合物a或匹配安慰剂(a部分)的化合物a和/或唑吡坦或唑吡坦匹配的安慰剂(b部分)。
计划筛选约160名健康受试者和250名具有原发性失眠但其他方面健康的受试者,以专门针对a部分和b部分分别纳入64名和60名受试者。对160名健康受试者和281名具有原发性失眠但其他方面健康的受试者进行实际筛选,以分别在a部分和b部分纳入64名和58名受试者。
对于a部分,64名健康受试者以逐步剂量递增方式依次纳入群组,接受化合物a或安慰剂,并按性别分层。每一群组包含六名化合物a治疗的受试者和两名安慰剂治疗的受试者。由于测试剂量,所有研究药物使用一种或多种化合物a的胶囊剂或化合物a匹配的安慰剂胶囊剂作为单次剂量给予。筛选后,受试者在第2天进行基线程序和随机化。在过夜禁食后的第1天早晨,在开灯后1小时,进行受试者给药。在预先指定的时间点收集pk血液样品,并进行pd评估。在第2至6天每天早晨,在给药前第1天和在给药后2至12小时每2小时进行受试者给药。
这些评估包括:卡罗林斯卡嗜睡量表(kss)、数字符号替换测验(dsst)、和精神运动警觉性测试(pvt),以评估日间睡意、警觉性水平和集中注意力的能力。在第1天至第6天的每天早晨在pd评估后进行唤醒时间调查问卷(waketimequestionnaires)。在第1天和第2天记录小睡的时间和持续时间。在整个研究中监测安全性。
a部分的剂量为:1mg、2.5mg、5mg、10mg、25mg、50mg、100mg和200mg的化合物a。不会发生升级到下一个更高的剂量水平,除非:1)以盲检方式审查了来自最新完成的群组的安全性、耐受性(包括实验室和心电图[ecg])和可用pk数据,和2)该可用数据支持增加到下一剂量。
对于b部分,58名具有原发性失眠但其他方面健康的受试者在三个群组中随机分组,并按性别分层。b部分还包括活性对照(唑吡坦)和匹配的安慰剂。在每个群组中,在化合物a/唑吡坦匹配的安慰剂组中有大约12名受试者,在唑吡坦/化合物a匹配的安慰剂组中大约有4名受试者,在化合物a匹配的安慰剂/唑吡坦匹配的安慰剂组中大约4名受试者。b部分给药发生在晚上,在睡眠期之前30分钟。b部分的起始剂量为3个剂量水平,其确定为a部分中的安全性和良好耐受性。b部分中的后续剂量水平基于b部分和pd中第一群组的pd结果和来自a部分中至少3个完成的更高剂量群组的安全性结果来确定。b部分中的每个群组被分成至少两组,每组的给药交错至少2天。
在初始筛选调查之后,合格的受试者被安排在筛选期间返回诊所2天以进行筛选/基线psg。这两天发生在初始筛选调查和后至少3天以及从第7天至第6天(±2天)的窗口内。第一psg用于筛选睡眠呼吸暂停和睡眠周期性肢体运动(periodiclimbmovementsinsleep,plms),并且用作第一基线psg。第二psg用作第二基线psg。使用特定psg变量来确定受试者是否符合psg入选标准,并且将来自这两种psg的psg变量的平均值用作该pd测量的基线。符合psg入选标准的受试者在第1天返回诊所,以进行另外的基线程序和随机化。不允许受试者在第1天小睡。在第1天晚上,在禁食至少3小时后,在受试者的习惯性就寝时间(熄灯)之前的30分钟内给予研究药物,如在筛选期间从第一psg的睡眠日记所计算。在预先指定的时间点收集pk血液样品,并进行pd评估。给药后,在第1天记录psg。在第1天至第6天的每天早晨对受试者给予另外的pd评估。这些评估包括kss、dsst、和pvt,以评估日间睡意、警觉性水平和集中注意力的能力。在即将熄灯前,在第1天的给药前5分钟和给药后25分钟给予kss和dsst。在第1天至第6天,在pd评估后开灯的15分钟内给予唤醒时间调查问卷(waketimequestionnaires)。在第2天记录小睡的时间和持续时间。
药代动力学:
对于a部分的受试者,在第1天给药前和口服给予化合物a后的0.25(15分钟)、0.5(30分钟)、1、2、3、4、5、6、9、12、24、48、72、96、120、168和240小时收集用于测定化合物a的血浆浓度的血液样品,但是在前三个群组(1、2.5和5mg化合物a组)中收集长达72小时。pk样品优先通过在最初12小时留置静脉导管,然后通过直接静脉穿刺来收集。
对于b部分的受试者,通过在第1天给药前和给药后0.5、9、12、24、36、60、84、108、156和228小时进行直接静脉穿刺来采集用于测定化合物a的血浆浓度的血液样品。
对化合物a计算的非房室血浆pk参数(作为允许数据)包括但不限于:cmax(最大药物浓度);tmax(给药后达到最大(峰值)浓度的时间)auc(0-24h)(从时间零到时间24小时的浓度×时间曲线下面积);auc(0-t)(从时间零到最后可测量的浓度的时间的浓度×时间曲线下的面积);auc(0-inf)(从时间零到无穷大的浓度×时间曲线下面积);t1/2(末端消除半衰期);cl/f(血管外给药后药物的表观总体清除率);和v/f(表观分布容积)。
使用经验证的液体层析-质谱/质谱(lc-ms/ms)测定法测量化合物a的血浆浓度。
a部分中受试者的化合物a的pk参数总结于表1中。在b部分中,浓度-时间曲线近似与a部分中的相应剂量组。
表1a部分受试者的化合物a的pk参数
药效学:
在第1天开始给药后30分钟,然后在第2至6天给药后12小时的每2小时和开灯后开始30分钟,给予a部分受试者kss、dsst和pvt。在pd评估之后的第1天至第6天的早晨在给予唤醒时间调查问卷(waketimequestionnaires)。
在a部分中,睡意测量(kss、dsst、pvt)表明了一般剂量-反应关系。这些测量的药效学反应通常在给药后2小时最大,与cmax一致。效应持续时间与剂量相关,即,使用更高剂量的效应更长。
在第1天至第6天的每个早晨,在开灯后15分钟内,给予唤醒时间调查问卷(waketimequestionnaires)后以特定顺序给予b部分受试者kss、dsst和pvt。在第1天(即将熄灯前),在给药前5分钟和给药后25分钟,也给予kss和dsst。
此外,在第7天和第6天(±2天)的筛选期间和在给药后第1天进行psg。从受试者的习惯性就寝时间开始进行由脑电图(eeg)、眼电图(eog)、肌电图(emg)、心电图(ecg),腿电极和呼吸功能测量(气流、呼吸努力和氧饱和)组成的8小时诊断psg,该习惯性就寝时间如在第7天(±2天)的第一次psg之后的3晚的睡眠日记确定。来自这晚的psg变量用于筛选睡眠呼吸暂停和plms。在第6天(±2)和给药后第1天,进行标准psg(即,不包括腿电极或除氧饱和之外的呼吸功能测量)。在筛选期间进行的这两个psg的特定psg变量用于确定受试者是否符合psg入选标准。在筛选期间进行的这两个psg的psg变量平均值用作基线psg值。已经从所有psg记录中获得了关键的pd参数,例如psglps、tst、se和waso。
多导睡眠图结果表明化合物a的初步功效。在2.5mg和10mg剂量时,lps减少了近30分钟,在25mg时,lps相对于基线减少了约45分钟。在2.5mg和10mg剂量时,waso减少约30分钟,在25mg时,waso相对于基线减少超过45分钟。相对于唑吡坦,2.5mg和10mg剂量的化合物a对lps和waso显示出相似的效应幅度。相对于基线,2.5mg剂量的化合物a的se提高了11%,10mg剂量的se提高了13%,而25mg剂量的se提高了18%。安慰剂治疗与唑吡坦相比,se分别相对于基线变化了3%和13%。给予单次剂量的25mg的化合物a后,se增加至约90%。然而,pd评估表明该剂量的一些个体在次日残余睡意测量上展现出相对于基线的增加。
任何剂量的化合物a、唑吡坦或安慰剂对kss、dsst或pvt没有临床上显著的次日效应。
实例2
多次递增剂量研究(002研究)
这是一项单中心、随机、双盲、安慰剂对照的、按顺序、多次-剂量研究。
本研究的主要目的是评价每天一次、持续14天在晚上口服多次剂量的化合物a在健康成年受试者中的安全性、耐受性和药代动力学(pk)。此外,本研究的目的是鉴定化合物a的最大耐受剂量(mtd)或足够高的耐受剂量,以提供相对于预期治疗剂量的安全裕度。
将总共48名健康成年受试者(18至55岁)以逐步剂量递增方式依次纳入到6个群组中的1个中,并且在晚上、3小时禁食后、习惯性就寝时间之前的30分钟内、连续14天随机化接受化合物a或化合物a匹配的安慰剂。每个群组包含6名化合物a治疗的受试者和2名安慰剂治疗的受试者。收集血液样品用于在预先指定的时间点进行pk分析,并进行pd评估。
该研究具有两个阶段,即随机化前阶段和随机化阶段。随机化前阶段持续长达21天,并由筛选期(第21天至第3天)和基线期(第2天至第1天)组成,在此期间确定每个受试者的研究资格,并在第2天进行基线评估。随机化阶段(第1-28天)由3个时期组成:治疗(第1-14天)、在此期间受试者被随机化并接受每日口服剂量的化合物a或化合物a匹配的安慰剂,住院随访(第15-19天)和门诊随访(第20-28天)、在此期间进行pk评估和安全性评估。
给予所有受试者pd评价,包括卡罗林斯卡嗜睡量表(kss)、数字符号替换测验(dsst)和精神运动警觉性测试(pvt),以便评估在给药和就寝时间之间的间期的急性睡意、次日残余睡意和警觉性水平和集中注意力的能力。此外,每日给予唤醒时间调查问卷,以便评估前一天晚上的睡眠质量。
本研究的起始剂量是基于实例1的研究中的结果。不会发生升级到下一个更高的剂量水平,除非:审查了来自最新完成的群组的安全性、耐受性(包括实验室和心电图[ecg])和可用pk数据,并且该可用数据支持增加到下一剂量。
在以下时间收集用于测定化合物a的血浆浓度的血液样品:第1天:给药前、和给药后0.5(30分钟)、1、1.5、2、3、4、5、6、8、10和12小时;第2-13天:给药前;第14天:给药前、和给药后0.5(30分钟)、1、1.5、2、3、4、5、6、8、10和12小时;第15天:第14天给药后24小时;第16至19天:第14天给药后36、60、84和108小时;第21、24、26、28天:在第14天给药后尽可能接近156、228、276和324小时。以与实例1中所述相同的方式测量化合物a的血浆浓度,并计算化合物a的上述非房室血浆pk参数。
通过用kss、dsst和pvt评价给药后和次日功能和在唤醒时间调查问卷上自陈报告睡眠质量来评估pd效应。该kss、dsst和pvt在以下时间进行:开始第1天的习惯性就寝时间前15分钟;在第1至15天的习惯性唤醒的15分钟内和在习惯性唤醒后的1、2、4、8和12小时,以及在第1至14天的15分钟给药前和15分钟给药后。在第2天的就寝时间前30分钟和在第14天的即将给药前开始24小时的霍尔特(holter)记录。从这些记录中提取用于进行ecg分析,包括hpqt分析。在第1天至19天给予唤醒时间调查问卷(waketimequestionnaires)。
在每个治疗日的晚上的给药前和给药后给予kss、pvt和dsst,以评估化合物a对睡意的急性效应。对于这些时间点,kss、dsst和pvt的每日给药15分钟后值作为该天给药后15分钟值的基线(每日基线)。还在每个给药晚上后的整个日间小时内给予kss、pvt和dsst,以评估化合物a对次日残余睡意的效应。对于这些时间点,在第1天的习惯性唤醒后的15分钟和1、2、4、8和12小时进行评估,这些评估基线用作在第2天至第15天的习惯性唤醒时间之后的相应时间进行评估的基线(时间匹配基线)。在第1天至第19天的早晨时间给予唤醒时间调查问卷(waketimequestionnaires)。第1天的初始剂量值用作基线。计算在每个时间点的安慰剂和每个剂量的化合物a的基线变化的差,用95%的置信区间(ci)。允许将潜在剂量-反应和时间趋势作为数据进行探索。
化合物a的胶囊剂和化合物a匹配的安慰剂胶囊剂的可用强度为2.5mg、10mg和50mg。由于该测试剂量,使用一种或多种化合物a胶囊剂或化合物a匹配的安慰剂胶囊剂来给予每日剂量的所有研究药物。
药代动力学
第1天和第14天的pk参数分别汇总在表2和表3中。
表2第1天的pk参数
表3第14天的pk参数
基于剂量-标准化数据的图形评估,对于第1天和第14天评估来讲,与跟剂量成比例地增加相比,cmax的增加略低。基于剂量-标准化数据,与跟剂量成比例地增加相比,第1天的auc(0-24h)的增加略低,但是基于第14天的评价,auc(0-24h)的增加接近于跟剂量成比例地增加。2.5mg和5mg剂量的末端半衰期相似,平均约45小时。在10mg和更高的剂量下,最后一天即第14天给药后,平均末端半衰期约为55小时。累积低于预期的末端半衰期。基于累积,对于在2.5mg至25mg范围的剂量,有效半衰期为16.9至24.7小时;对于50mg和75mg剂量,有效半衰期为28.0和39.3小时。
药效学
次日残余睡意效应:通过kss、pvt和dsst测量,次日残余睡意的幅度和持续时间具有剂量相关的增加。在2.5mg和5mg剂量组中,在任何治疗日的相对于唤醒时间的任何时间的任何评估中,次日残余睡意组与安慰剂组没有指示增加的有意义的差。在第2天至第4天的根据kss的唤醒时间后2小时内的时间点,观察到10mg剂量组与安慰剂组相比具有轻微差异。在25mg剂量组中,次日残余睡意的增加更加一致,并且比10mg剂量组稍大。该效果也是限于唤醒时间后2小时内的时间点,但是在kss上能观察到该效果,并且在一定程度上可以通过pvt失误和pvt平均rrt观察到。与所有其他治疗天相比,与安慰剂组相比的差异在第2天和第15天最一致且更大。50mg和75mg剂量组在所有睡意评估中与安慰剂组一致并且具有相对大的差异。这些差异在唤醒时间2小时内的时间点的幅度更大,但在仍然能在唤醒时间后4小时和8小时观察到,特别是pvt平均rrt。唤醒时间后12小时,在任何一天、任何剂量组中的任何睡眠测量值与安慰剂组没有差异。对于观察到次日残余睡意的剂量组(即10mg和更高剂量的组),在第2至4天比第5至15天的睡意相对更大。尽管化合物a在血浆中积累,但是通常在治疗日可以观察到这种减轻睡意的模式。
唤醒时间调查问卷中的项目没有显示任何剂量组或安慰剂组的夜间睡眠的系统模式的变化,除了睡眠质量表显示更多安慰剂组和化合物a组中的受试者报告“不安”或“非常不安”睡眠的趋势,相对于其他时间,该趋势在第2天、特别是在第15天发生。
药代动力学-药效学
对于次日残余睡意的pk-pd探索性分析来说,在第1天晚上给药后8、9和10小时的群体pk模型衍生的化合物a血浆浓度分别与在第2天上午的唤醒时间之后15分钟、1小时和2小时的kss、pvt失误和dsst的基线变化相关。在所有时间点,观察到随着化合物a浓度的增加,kss和pvt失误相对于基线增加得更多。在给药后9-10小时后,对应于晨醒后1-2小时的低于30ng/ml(其发生于25mg剂量时)的浓度与kss、pvt失误或dsst相对于基线的最小变化或没有变化相关。
实例3
片剂与胶囊剂配制品的相对生物利用度的交叉研究(005研究)
进行单中心、开放标注的随机交叉研究,以在健康成年受试者中评价2.5mg、10mg和25mg的单次固体口服剂量的化合物a的片剂配制品和胶囊剂配制品的生物利用度。该研究的另一个目的是评价在健康成年受试者中2.5mg、10mg和25mg的化合物a的片剂配制品的安全性和耐受性。将约36名受试者随机分配到三个群组中的一个(约12名受试者/群组)并且接受单次剂量的化合物a的胶囊配制品和片剂配制品,以随机顺序,以1∶1的比例。这些剂量为2.5mg、10mg和25mg。
该研究有两个阶段:随机化前阶段和随机化阶段。随机化前阶段持续长达21天,并且包括筛选期和基线期a,在此期间建立资格并且在第一次配制品给药发生之前进行基线评估。随机化阶段由基线期b分隔的两个治疗期(a和b)组成。在治疗期a的第一天,受试者接受第一次单次口服剂量的配制品。接受第一次配制品剂量后,在整个治疗期a中获得药代动力学(pk)和安全评估,并且受试者完成20天清洗。在第二次给予配制品之前,受试者完成基线期b评估。然后受试者继续进入治疗期b,并接受第二次单次口服剂量的配制品。在整个治疗期b中获得药代动力学和安全评估。
在以下时间收集用于测定化合物a的血浆浓度的血液样品:治疗期a(第1天至第15天):在给药前后0.5(30分钟)、1、1.5、2、3、4、5、6、8、12、24、48、72、120、168、240和336小时;治疗期b(第22天至第36天):在给药前后0.5(30分钟)、1、1.5、2、3、4、5、6、8、12、24、48、72、120、168、240和336小时。
使用经验证的液体层析-串联质谱(lc-ms/ms)测定法来测量化合物a的血浆浓度。
使用非房室方法计算化合物a的以下血浆pk参数:从给药后时间零至8小时的血浆浓度-时间曲线下面积(auc(0-8)),从给药后时间零至72小时的血浆浓度-时间曲线下面积(auc(0-72)),从时间零至最后可计量浓度时间的血浆浓度-时间曲线下面积(auc(0-t)),从时间零外推到无穷时间的血浆浓度-时间曲线下面积(auc(0-inf)),观察到的最大血浆药物浓度(cmax)、末端消除半衰期(t1/2)、吸收滞后时间(tlag)和给药后达到最大(峰值)血浆浓度的时间(tmax)。主要pk参数为auc(0-inf)和cmax。化合物a的个体pk参数通过配制品(片剂或胶囊剂)和剂量(2.5mg、10mg或25mg)在数据列表中呈现。使用描述性统计:受试者数量、平均值、sd、变异系数、几何平均值、中值、最小值和最大值,通过配制品和剂量来总结除tmax和tlag之外的pk参数。使用以下描述性统计:中值、最小值、最大值和中值点估计的90%置信区间(ci),通过配制品和剂量来总结参数tmax和tlag。将化合物a的自然对数(1n)转化的pk参数(auc(0-inf)、cmax、auc(0-8)、auc(0-72)和auc(0-t))与剂量分开比较,其中混合效应模型具有作为固定效应的序列、治疗周期和配置品,并且嵌套在序列内的受试者作为随机效应。通过ls平均差的取幂和相应的90%ci来计算几何最小二乘法(ls)平均值(片剂配制品作为测试/胶囊配制品作为参考)和相应的90%ci的比率。
化合物a的pk参数总结在表4中。
表4化合物a的pk参数(片剂对比胶囊剂)
auc(0-8)、auc(0-72)、auc(0-t)和auc(0-inf)在所有剂量水平的配制品(治疗a[片剂]相比于治疗b[胶囊剂])中的差异均小于13%。在所有剂量水平的cmax中,片剂和胶囊剂之间的差异均小于16%。在给予所有剂量水平的片剂和胶囊剂配制品之后1至1.5小时观察到中值tmax。在较高剂量下观察到与片剂配制品(治疗a)相比,胶囊配制品(治疗b)的中值tmax具有30分钟延迟的趋势。在任一剂量水平的两种配制品中没有观察到吸收滞后。
总的来说,结果表明,片剂给药后的化合物a的吸收速率和程度与所有测试强度的参考胶囊剂相当。片剂与胶囊剂治疗相比,衍生的pk参数的可变性也类似。这些结果支持这样的结论,即片剂在2.5mg、10mg和25mg的强度下的相对生物利用度类似于胶囊剂的相应强度。因此,可以在没有调整剂量的情况下,相对于胶囊剂进行到片剂配制品的临床转变。
实例4(201研究)
这是一个对患有失眠的受试者进行的、多中心、随机、双盲、适应性设计、剂量-反应研究。将受试者随机化分给予6个剂量(1mg、2.5mg、5mg、10mg、15mg和25mg)的化合物a中的1个或安慰剂。
研究的主要目的是:
1.通过使用复合效用函数以及在第2天和第3天给药后早晨唤醒时间后1小时的睡眠效率(se)的基线变化和卡罗林斯卡嗜睡量表(kss)从基线的变化来比较6个剂量的化合物a与安慰剂的效果,从而在治疗开始时确定对于患有慢性失眠的受试者来说使功效最大化和次日残余睡意最小化的化合物a的剂量。
2.在慢性失眠的受试者中,通过在第15天和第16天早晨唤醒时间后1小时的kss来比较6个剂量的化合物a与安慰剂,以在治疗开始时确定使功效最大化和次日残余睡意最小化的化合物a的剂量与治疗结束时次日残余睡意的治疗不可接受水平无关。
本研究的另外目标是评价:
1.治疗开始时的功效:
总的来说:比较每个剂量水平的化合物a与安慰剂从在基线处的平均se到第1天和第2天给药后的平均se的变化
睡眠诱导:比较每个剂量水平的化合物a与安慰剂从在基线处的平均持续睡眠潜伏期(lps)到第1天和第2天给药后的平均lps的变化
睡眠维持:比较每个剂量水平的化合物a与安慰剂从在基线处的睡眠开始后的平均觉醒(waso)到第1天和第2天给药后的平均waso的变化
2.治疗结束时的功效:总体来说:比较每个剂量水平化合物a与安慰剂从在基线处的平均se到在第14天和第15天给药后的平均se的变化
睡眠诱导:比较每个剂量水平的化合物a与安慰剂从在基线处的平均lps到第14天和第15天给药后的平均lps的变化
睡眠维持:比较每个剂量水平的化合物a与安慰剂从在基线处的平均waso到第14天和第15天给药后的平均waso的变化
3.从治疗开始到结束的潜在习惯化功效:
总体来说:对每个剂量水平的化合物a与安慰剂从在基线处的平均se到第1天和第2天给药后的平均se的变化,和每个剂量水平的化合物a与安慰剂从在基线处的平均se到第14天和第15天给药后的平均se的变化来进行比较。
睡眠诱导:对每个剂量水平的化合物a与安慰剂从在基线处的平均lps到第1天和第2天给药后的平均lps的变化,和每个剂量水平的化合物a与安慰剂从在基线处的平均lps到第14天和第15天给药后的平均lps的变化来进行比较。
睡眠维持:对每个剂量水平的化合物a与安慰剂从在基线处的平均waso到第1天和第2天给药后的平均waso的变化,和每个剂量水平的化合物a与安慰剂从在基线处的平均waso到第14天和第15天给药后的平均waso的变化来进行比较。
筛选了总共616名受试者,其中291名被随机分入研究;56名给予安慰剂、32名给予1mg、27名给予2.5mg、38名给予5mg、32名给予10mg、56名给予15mg并且50名给予25mg。291名受试者包含在全分析集、安全性分析集和pd分析集中。在活性剂量组(在所有剂量上大致相等,90%至100%)中有222名受试者,在安慰剂组中有51名(91.1%),完成了计划的治疗方案。
该研究有两个阶段:随机化前阶段和随机化阶段。随机化前阶段持续长达21天,并且由筛选期(第21天至第2天)和基线期(第1天)组成。在基线期之后,所有合格的受试者在治疗期(第1至15天)以双盲方式随机化接受化合物a或安慰剂15晚。然后在反跳性失眠评估期(第16至18天),所有受试者以单盲方式接受安慰剂,持续2晚(第16至17天)。受试者在随访期(第19至30天)没有接受研究药物。所有受试者来到诊所进行筛选程序。在筛选期,受试者每天完成睡眠日记。在第9天和第3天之间的连续2晚的筛选期测量多导睡眠图。8小时多导睡眠图(psg)开始于根据睡眠日记中的反应计算的中值习惯性就寝时间,其中睡眠日记在第一晚psg之前完成了7天。这些记录作为资格筛选psg和基线psg。受试者可以在筛选/基线psg夜晚之间离开诊所。
所有受试者在第1天返回诊所进行基线期程序。他们留在诊所直到第3天。第1天的早晨评估提供了kss、数字符号替换测试(dsst)和反应时间指数(rti)的基线值。唤醒时间后6小时的评估提供了唤醒功能电池(wakingfunctionbattery,wfb)的基线值和情绪状态曲线(profileofmoodstates-brief,poms-b)。然后将受试者在接下来的15天中随机化接受6个剂量的化合物a中的1个或安慰剂。研究药物是1mg、2.5mg、5mg或10mg的片剂,这些片剂含有化合物a匹配的安慰剂或化合物a,并且在根据筛选期的睡眠日记反应计算的中值习惯性就寝时间之前30分钟摄取。在前两个治疗夜(第1天和第2天)记录8小时psg,该8小时psg开始于与用于筛选和基线psg相同的就寝时间。每天在诊所继续完成睡眠日记,并在诊所对受试者进行失眠严重程度(isi)、次日残余睡意效应(kss、dsst和rti)的评估。在指定的研究日,受试者在诊所觉醒后的早晨、在即将给药之前的波谷时来评估化合物a的血浆浓度。
受试者在其预期的、自选择的就寝时间之前30分钟继续服用化合物a或安慰剂,并且在治疗期在家每天继续完成睡眠日记。在治疗期的第14天,受试者返回诊所。他们留在诊所4个晚上,直到第18天。每天晚上在诊所记录8小时psg,其开始于从在第3至13天完成的睡眠日记中的反应来计算的中值习惯性就寝时间。每天在诊所继续完成睡眠日记,并且在日间时间的预定时间点给予isi、kss、dsst、rti。
在治疗期结束后,所有受试者在最后2晚中以单盲方式在诊所接受安慰剂(第16和17天)。在这两个晚上,记录8小时psg以评估反跳性失眠(反跳性失眠评价期),该8小时psg开始于与第14天和第15天相同的就寝时间。
在治疗期,每天晚上(除第1天外)在给药前30分钟内在诊所获得化合物a的血浆浓度的血液样品,并且每天在诊所在早上醒来的1小时内获得血液样品。使用经验证的液体层析-串联质谱(lc-ms/ms)测定法来测量化合物a的血浆浓度。
kss用于在预先指定的时间点测量次日残余效应。在这项测试中,受试者使用kss(9分口头锚定量表)来评估他们的睡意。类别和分数范围从“极度警觉”(分数=1)、“警觉”(3)、“既不警觉也不困倦”(5)、“困倦但不难保持清醒”(7)到“极其困倦”(9)。kss的关键结果参数是从1到9的分数。
除了用于主要终点的贝叶斯(bayesian)方法外,所有统计学检验均基于5%的显著性水准。统计方法和分析的细节是由统计分析计划(sap)和临床研究报告的主体来指定。
安全性分析集是接受至少1个剂量的研究药物并且具有至少1个给药后安全性评价的受试者组。全分析集(fas)是接受至少1个剂量的研究药物并且具有至少1次给药后主要功效测量的随机受试者组。pk分析集是接受至少1个剂量的化合物a并具有至少1种可计量的化合物a浓度的随机受试者组。pd分析集是具有足够的pd数据以导出至少1个pd参数的受试者组。pk/pd分析集是接受至少1个剂量的化合物a或安慰剂并且具有至少1种可计量的化合物a浓度(活性受试者)和至少1次给药后pd评估的随机受试者组。
与安慰剂相比,至少6%的在第1天和第2天的平均se的基线变化被认为是最小临床显著差异(csd)。
使用kss评估每个剂量的次日残余睡意。在效用函数中并入小于4个单位的平均差,该平均差是在第2天和第3天唤醒时间后1小时进行的kss基线变化的平均差。如果对于化合物a的一种剂量,其相对于安慰剂,在第15天和第16天的唤醒时间后1小时的kss基线变化的平均差小于4个单位,则该剂量被认为在第15天和第16天具有可接受的kss。在操作上,将第15天和第16天的可接受的kss定义为小于4个单位(相对于安慰剂,在该剂量下唤醒时间后1小时的kss相对于基线的平均差)的90%置信区间(ci)的下边界。
效用函数:剂量下的效用是se和kss的函数,通过为每个终点指定1维分量然后将它们用乘法组合而构造。足够的效用被定义为:pr(效用>1)。
最大效用剂量(dumax):产生最大效用分数的剂量,即即由上述效用判断的功效和残余睡意的最佳组合。
pk/pd分析集用于评价化合物a浓度和选择的pd参数之间的关系。暴露于化合物a和所选的pd终点(例如kss、dsst、rti)之间的关系以图形方式进行了研究,并且可以进行群体pk/pd建模。使用非线性混合效应模型(nonmem)7.2版本或更高版本来分析在给药前(波谷)和早晨唤醒时间后1小时内的化合物a的血浆浓度、与选择的pd参数之间的关系。
结果
表5显示se基线变化的汇总统计。相对于安慰剂,对于第1/2天平均值的基线变化,所有化合物的所有剂量具有统计学显著性。相对于安慰剂,对于从第14/15天的平均值的基线变化,化合物a的2.5mg及以上剂量具有统计学显著性。对于相比于第14/15天的第1/2天的平均值的基线变化,没有se增加或减少的统计学证据,这表明没有治疗效果的损失。
在表5中,“基线”定义为在随机化的9至3天内筛选psg1和2的平均值。“ls平均差”是指安慰剂与每个化合物a剂量的ls平均值之间的差,“95%ci”是指ls平均差的95%ci。使用具有基线作为协变量的协方差(ancova)分析来分析“p-值”。
表5se基线变化的汇总统计(%)
表6显示在唤醒时间后1小时的kss中的基线变化的汇总统计。安慰剂和化合物a的1mg至15mg剂量之间的ls平均差在第2/3天的平均值上没有统计学显著性。只有安慰剂和化合物a的25mg剂量之间的ls平均差在第2/3天的平均值(ls平均差0.47;p=0.0393)上具有统计学显著性,这表明测评的受试者比安慰剂受试者更差。该结果与第15/16天的唤醒时间后1小时的平均值相似。对于化合物a的15mg和25mg剂量,第2/3天平均值的唤醒时间后2小时的评估显示统计学显著性,而第15/16天的平均值对于化合物a的25mg剂量具有统计学显著性。在唤醒时间点后15分钟没有观察到统计学显著性差异。
在表6中,“基线”定义为第1天的时间匹配值。“ls平均差”是指安慰剂与每个化合物a剂量的ls平均值之间的差,“95%ci”是指ls平均差的95%ci。使用具有基线作为协变量的协方差(ancova)分析来分析“p-值”。
表6唤醒时间后1小时的kss中基线变化的总结统计
表7显示lps中基线变化的汇总统计。作为非正态分布的结果,使用如上所述的ancova对数据进行对数转换和分析。对于第1/2天的平均值的基线变化,安慰剂和化合物a1mg之间的几何平均比没有统计学显著性。对于第1/2天的平均值的基线变化,安慰剂和所有其他活性化合物a之间的几何平均比显示了具有统计学显著性的证据。第14/15天的平均值的基线变化显示了相似的结果。10mg化合物a显示相比于第14/15天的第1/2天的平均值基线变化的统计学差异,这显示lps随时间的进一步改善。在除10mg化合物a以外的所有其他剂量中,对于相比于第14/15天的第1/2天的平均值的基线变化,没有lps增加或减少的统计学证据。
在表7中,“基线”定义为在随机化的9至3天内筛选psg1和2的平均值。使用具有基线作为协变量的协方差(ancova)分析来分析“p-值”。
表7lps的基线变化的汇总统计(分钟)
表8显示waso基线变化的汇总统计。相对于安慰剂,对于第1/2天的平均值的基线变化,所有化合物的10mg及以上剂量具有统计学显著性。相对于安慰剂,对于第14/15天的平均值的基线变化,化合物a的15mg及以上剂量具有统计学显著性。对于相比于第14/15天的第1/2天的平均值的基线变化,没有waso增加或减少的统计学证据。
在表8中,“基线”定义为在随机化的9至3天内筛选psg1和2的平均值。“ls平均差”是指安慰剂与每个化合物a剂量的ls平均值之间的差,“95%ci”是指ls平均差的95%ci。使用具有基线作为协变量的协方差(ancova)分析来分析“p-值”。
表8waso基线变化的汇总统计(分钟)
化合物a的pk最好用2-房室模型(从中央室开始进行消除)来描述。化合物a的表观清除率与剂量和时间无关,表明pk具有线性。化合物a的pd效应的测量包括kss、rti、dsst、wfb(rti、快速视觉处理[rvp]和空间跨度[ssp])、poms、褪黑激素水平和dlmo。由于lps基线变化的高变异性和非正态分布,不可能可靠地模拟化合物a的pk参数与lps之间的浓度-反应关系。尽管如此,化合物a的较高血浆浓度与lps的较大减少相关,高达约10ng/ml。该发现与功效结果一致,其中lps在2.5mg和更高的剂量下降低。高于该浓度,该关系似乎达到渐近线,这表明在睡眠开始方面没有更高的化合物a浓度的明显的另外的益处。当建模时,waso数据最好用与观察到的最大浓度(cmax)的对数线性关系描述。waso的暴露-反应关系显示与cmax的对数线性关系,使得在cmax的化合物a的较高浓度与waso的较大减少相关。用于次日残余睡意评估(kss,dsst和rti)的pk/pd分析没有显示与时间匹配的化合物a血浆浓度的任何明显的关系。然而,在醒来后1小时化合物a血浆浓度大于20ng/ml的受试者在kss上具有略微更大的增加,并且嗜睡的ae的发生率更高。该浓度预计通过大多数受试者接受大于10mg的剂量来实现。
实例5(配制品)
用于实施例1、2和3的胶囊剂由2号羟丙甲纤维素胶囊剂组成,这些2号羟丙甲纤维素胶囊剂含有1mg、2.5mg、10mg或50mg的化合物a的药物物质。化合物a的25mg胶囊剂也仅制备用于溶出评估,并且化合物a的25mg胶囊剂由2号羟丙甲纤维素胶囊剂组成,这些2号羟丙甲纤维素胶囊剂饱含25mg化合物a的药物物质。安慰剂由含有10mg微结晶纤维素的2号羟丙甲纤维素胶囊剂组成。
用于实例3和4的片剂的组分和组成示于表9中。
表9化合物a片剂的组分和组成
用常规的湿法制粒方法来制备化合物a薄膜包衣片剂。通过混合、湿法制粒、干燥、上浆、润滑、压片和薄膜包衣方法制备化合物a的薄膜包衣片剂。使用混合器混合化合物a、乳糖一水合物和低取代羟丙基纤维素。使用混合器,并且逐渐加入适量的羟丙基纤维素水溶液,对混合物进行湿法制粒。使用干燥器干燥湿颗粒。使用筛分机将干燥的颗粒通过1.0mm筛。根据颗粒的产量称取低取代羟丙基纤维素和硬脂酸镁。将颗粒、低取代羟丙基纤维素和硬脂酸镁在混合器中一起润滑。将相当于一片片剂的润滑颗粒用压片机压成双凸片。使用包衣机对片芯片剂进行包衣,并喷洒欧巴代(opadry)红色水性悬浮液。
测试实例
根据日本药典(jp)中的“6.10”、美国药典(usp)中的“<711>”和欧洲药典(ph.eur)中的“2.9.3”使用装置2(桨叶装置)进行实例5中制备化合物a胶囊剂和片剂的溶出试验。2.9.3.在900ml的含有0.5%聚山梨醇酯80的0.1mol/l盐酸中以75rpm的浆转速(条件i)来测试胶囊剂和片剂。此外,在900ml的0.1mol/l盐酸中以50rpm的桨转速测试片剂(条件ii)。在胶囊剂的测试中使用螺旋钢丝沉降片。在规定的时间点通过过滤器(孔径:0.45μm)取出等分试样的培养基以制备样品溶液。制备标准溶液以使化合物a的浓度对应于标称浓度水平的样品溶液的浓度。与标准溶液相比,释放的化合物a的量由色谱确定。溶出条件和hplc条件提供于表10中。在6个胶囊剂/片剂上进行测试,并且在每种情况下表示它们的平均值。在条件i中获得的化合物a的1mg和50mg胶囊剂的溶出曲线示于图1和表11中。在条件ii中获得的化合物a的1mg、2.5mg、5mg、10mg和25mg片剂的溶出曲线示于图2和表12中。在条件i中获得的化合物a的胶囊剂和片剂之间的比较溶出曲线示于图3和表13中。观察到的胶囊剂和片剂之间的溶出曲线的差异是由胶囊剂崩解的滞后时间引起的。
表10溶出条件和hplc条件
表11条件i中获得的化合物a的1mg和50mg胶囊剂的溶出速率
表12条件ii中获得的化合物a的1mg、2.5mg、5mg、10mg和25mg片剂的溶出速率
表13条件i中获得的化合物a的胶囊剂和片剂的溶出速率
权利要求书(按照条约第19条的修改)
1.一种治疗失眠的方法,包括口服给予治疗有效量的化合物a的剂型,其中所述治疗有效量是单次每日剂量,在对人类受试者给予后,对于每1mg的化合物a,该单次每日剂量达到从约3.0ng/ml至约7.2ng/ml的平均cmax,并且所述化合物a是由以下化学式表示的(1r,2s)-2-(((2,4-二甲基嘧啶-5-基)氧基)甲基)-2-(3-氟苯基)-n-(5-氟吡啶-2-基)环丙烷甲酰胺:
2.如权利要求1所述的方法,其中所述单次每日剂量在从约1mg至约15mg的范围内。
3.如权利要求1所述的方法,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在5.3ng/ml的约80%至约125%范围内的平均cmax。
4.如权利要求1所述的方法,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在16ng/ml的约80%至约125%范围内的平均cmax。
5.如权利要求1所述的方法,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到在23ng/ml的约80%至约125%范围内的平均cmax。
6.如权利要求1所述的方法,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在36ng/ml的约80%至约125%范围内的平均最大cmax。
7.如权利要求1所述的方法,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约15.9ng*hr/ml至约23.8ng*hr/ml的平均auc(0-24)。
8.如权利要求1所述的方法,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在17ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
9.如权利要求1所述的方法,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述每日单次剂量达到在57ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
10.如权利要求1所述的方法,其中所述治疗有效量是单次5mg每日剂量,并且其中所述每日单次剂量达到在95ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
11.如权利要求1所述的方法,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在159ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
12.如权利要求1所述的方法,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约19.1ng*hr/ml至约51.1ng*hr/ml的平均auc(0-t)。
13.如权利要求1所述的方法,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在19ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
14.如权利要求1所述的方法,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
15.如权利要求1所述的方法,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到在128ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
16.如权利要求1所述的方法,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在284ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
17.如权利要求1所述的方法,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约19.8ng*hr/ml至约53.1ng*hr/ml的平均auc(0-inf)。
18.如权利要求1所述的方法,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在20ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
19.如权利要求1所述的方法,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
20.如权利要求1所述的方法,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到在149ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
21.如权利要求1所述的方法,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在311ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
22.如权利要求1所述的方法,其中在对人类受试者单次剂量给予后8至10小时,所述单次每日剂量提供约20ng/ml或更少的平均血浆化合物a浓度。
23.一种用于治疗失眠的口服剂型,包括治疗有效量的化合物a和至少一种药学上可接受的赋形剂,其中所述治疗有效量是单次每日剂量,在对人类受试者给予后,对于每1mg的化合物a,该单次每日剂量达到从约3.0ng/ml至约7.2ng/ml的平均cmax,并且所述化合物a是由以下化学式表示的(1r,2s)-2-(((2,4-二甲基嘧啶-5-基)氧基)甲基)-2-(3-氟苯基)-n-(5-氟吡啶-2-基)环丙烷甲酰胺:
24.如权利要求23所述的剂型,其中所述单次每日剂量在从约1mg至约15mg的范围内。
25.如权利要求23所述的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在5.3ng/ml的约80%至约125%范围内的平均cmax。
26.如权利要求23所述的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在16ng/ml的约80%至约125%范围内的平均cmax。
27.如权利要求23所述的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次剂量达到在23ng/ml的约80%至约125%范围内的平均cmax。
28.如权利要求23所述的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在36ng/ml的约80%至约125%范围内的平均cmax。
29.如权利要求23所述的剂型,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约15.9ng*hr/ml至约23.8ng*hr/ml的平均auc(0-24)。
30.如权利要求23所述的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在17ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
31.如权利要求23所述的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在57ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
32.如权利要求23所述的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到在95ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
33.如权利要求23所述的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在159ng*hr/ml的约80%至约125%范围内的平均auc(0-24)。
34.如权利要求23所述的剂型,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约19.1ng*hr/ml至约51.1ng*hr/ml的平均auc(0-t)。
35.如权利要求23所述的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在19ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
36.如权利要求23所述的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
37.如权利要求23所述的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到在128ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
38.如权利要求23所述的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在284ng*hr/ml的约80%至约125%范围内的平均auc(0-t)。
39.如权利要求23所述的剂型,其中所述治疗有效量是单次每日剂量,对于每1mg的化合物a,该单次每日剂量达到从约19.8ng*hr/ml至约53.1ng*hr/ml的平均auc(0-inf)。
40.如权利要求23所述的剂型,其中所述治疗有效量是单次1mg每日剂量,并且其中所述单次每日剂量达到在20ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
41.如权利要求23所述的剂型,其中所述治疗有效量是单次2.5mg每日剂量,并且其中所述单次每日剂量达到在80ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
42.如权利要求23所述的剂型,其中所述治疗有效量是单次5mg每日剂量,并且其中所述单次每日剂量达到在149ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
43.如权利要求23所述的剂型,其中所述治疗有效量是单次10mg每日剂量,并且其中所述单次每日剂量达到在311ng*hr/ml的约80%至约125%范围内的平均auc(0-inf)。
44.如权利要求23所述的剂型,其中在对人类受试者单次剂量给予后8至10小时,所述每日剂量提供约20ng/ml或更少的平均血浆化合物a浓度。
45.如权利要求23所述的剂型,其中在溶出研究开始的30分钟内,根据日本药典16版中的6.10溶出试验或美国药典37版中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置,桨速;75rpm),在溶出介质(含有0.5%聚山梨醇酯80的0.1mol/l盐酸,900ml,37℃±0.5℃)中,所述剂型提供85%或更高的溶出速率。
46.如权利要求23所述的剂型,其中在溶出研究开始的15分钟内,根据日本药典16版中的6.10溶出试验或美国药典37版中的<711>溶出中关于速释剂型的程序,使用装置2(桨叶装置,桨速;50rpm),在溶出介质(0.1mol/l盐酸,900ml,37℃±0.5℃)中,所述剂型提供85%或更高的溶出速率。
47.如权利要求23所述的剂型,其中所述剂型包括作为药学上可接受的赋形剂的乳糖。
48.如权利要求23所述的剂型,其中所述剂型包括作为药学上可接受的赋形剂的低取代羟丙基纤维素。
49.如权利要求23所述的剂型,其中所述剂型包括作为药学上可接受的赋形剂的乳糖和低取代羟丙基纤维素。
- 还没有人留言评论。精彩留言会获得点赞!