包含辛波莫德和拉喹莫德的用于治疗多发性硬化症的组合的制作方法
本发明涉及包含辛波莫德和拉喹莫德的组合和药物组合物,还涉及所述组合和/或组合物作为用于治疗多发性硬化症的药物的应用。
技术背景
多发性硬化症:复发和进展型
多发性硬化症(ms)是一种在全世界影响超过一百万人的神经疾病。它是在年轻和中年人中导致神经失能的最常见原因,并对患者及其家属、朋友和健康护理机构造成重大的生理、心理、社会和财政影响。
普遍认为,ms起初由可能因感染触发并叠加遗传倾向性的一些自身免疫过程引起。它是一种损伤中枢神经系统(cns)的髓磷脂的慢性炎症。ms发病机理的特征是来自循环系统的指向髓磷脂抗原的淋巴细胞(即自身反应性t细胞)浸润到cns中。除了ms中的炎性时期以外,还在病程早期出现轴突损失并会随时间扩大,导致随后发生进展性、永久性、神经损伤,并常常导致严重失能。与该疾病相关的症状包括疲劳、强直、运动失调、虚弱、膀胱和肠扰动、性机能障碍、疼痛、震颤、发作表现、视觉损伤、心理问题和认知机能障碍。
在“多发性硬化症治疗学(multiplesclerosistherapeutics)”(duntiz编,rudickandgoodkin,伦敦:taylor&francis,1999)中描述了各种ms疾病阶段和/或种类。其中,复发缓解型多发性硬化症(rrms)是初始诊断时的最常见类型。在诊断时,ms患者的80-90%为rrms。这种类型的ms的特征是神经症状的反复复发即急性发作和随后的恢复期间(缓解)。约80%的rrms的患者中会在发病约19年后从这种类型发展成继发进展型多发性硬化症(spms)。
当患者已发展成spms时,病程的进展伴有或不伴有复发,这些复发之间有轻微缓解或无缓解,其症状特征是失能的持续恶化,且与复发(若存在)无关。指示向spms转变的症状包括虚弱和不协调的稳定增加;僵硬紧绷的腿部肌肉;肠和膀胱问题;更多疲劳、抑郁和思维问题。一般来说,炎性浸润的数量减少,同时神经退化成为spms的更突出特点。
但是最近发现,脑发炎不仅出现在rrms患者中、而且也出现在spms患者中。而且,在spms患者中可发现脑脊膜的炎症。这些免疫聚集体是t细胞和b细胞丰富的结构。与这些结构相邻的皮质组织显示显著增加的病理(serafini等,2004)。已经发现脑脊膜中的炎性程度与神经退化的量相关;而且据报告这些结构只出现在spms患者中——在rrms或ppms患者中没有观察到(magliozzi等,2007)。具有死后解剖鉴别的cns聚集体的spms患者为早发病、更快转向进展型ms并且快速死亡(howell等,2011)。因此,至少在一些患者中,炎症似乎驱动组织退化。
虽然rrms是不可预测的,但明显发病、随后恢复的模式通常是一致的。对于spms,复发往往较不明显,并且(取决于许多因素)较少出现复发或根本不出现复发。但是,当spms患者的确出现复发时,他们的恢复通常不如rrms患者完全。
虽然已知有若干药物用于治疗rrms,但一般来说spms更难治疗。
用于ms的市售单一疗法
目前已有一些经批准用于复发型ms(rms)的疾病减缓药物。这些药物包括非口服药物干扰素β1-a(如
其他治疗途径包括症状治疗(指用于改善因疾病引起的症状的所有疗法)和用皮质类固醇治疗急性复发。虽然类固醇不影响ms随时间的进程,但能使一些对象的发病持续时间缩短和严重性减轻。
正在开发的ms单一疗法示例
辛波莫德
辛波莫德属于被称为1-磷酸鞘氨醇(s1p)受体调节剂的药物种类。所述种类的另一成员是芬戈莫德
辛波莫德已进行二期试验(phaseiitrial),以0.25毫克、0.5毫克、1.25毫克、2毫克和10毫克剂量口服给药治疗rrms(即bold试验)时,显示剂量依赖性功效。
已知s1p受体调节剂会阻断白细胞从淋巴结迁移到外周血中的能力。它会把淋巴细胞隔绝在淋巴结中,防止它们移动到中枢神经系统中用于多发性硬化症中的自身免疫反应。
但是,辛波莫德跨越血脑屏障并还能对cns中的细胞产生直接有益影响。据报告,s1p受体调节剂会刺激胶质细胞和前体细胞在受伤之后的修复过程(alejandrohorga等,expertrevneurother8(5),699-714,2008)从而形成治疗spms的功效基础。
拉喹莫德
已提出将拉喹莫德用作治疗rrms的口服制剂。经两项三期试验测试,在24个月的周期内以0.6毫克剂量每天一次口服给药时,其显示治疗rrms的功效(即bravo试验和allegro试验)。
在例如us6077851中描述了拉喹莫德及其钠盐形式。拉喹莫德的作用机理尚未完全理解。
疾病减缓药物的组合疗法
给予两种药物来治疗给定病症如ms导致产生许多潜在问题。两种药物之间的体内相互作用很复杂。任意单独药物的效果与其吸收、分布和排出相关。向人体引入两种药物时,每种药物都会影响另一种药物的吸收、分布和排出,并因此改变另一种药物的效果。例如,一种药物会抑制、激活或诱导参与另一种药物的排出的新陈代谢途径的酶的产生。
在wo2013055907中,在rrms动物模型(即小鼠c57bi/6种中的mog-诱导的实验性自身免疫脑脊髓炎(eae))中测试了包含实验性药物拉喹莫德和市售药物芬戈莫德的组合。这种模型是用于测试药物作为治疗rrms的预防剂的功效的现成模型。10毫克/千克拉喹莫德和0.3毫克/千克芬戈莫德的组合显示出预防疾病变严重的协同功效。
但是在药物组合的其他示例中,观察到缺乏协同或甚至拮抗作用的现象,且有报告其他不利的副作用。
已显示芬戈莫德和干扰素的组合给药会消除芬戈莫德或干扰素任一疗法的临床效果(brod等,annalsofneurology,47,127-131,2000)。在另一个实验中,报告了在与干扰素β的组合疗法中加入强的松会拮抗其正调节剂效果(salama等,multiplesclerosis,9,28-31,2003)。
在一个实例中,观察到那他珠单抗和干扰素β1-a的组合会增加预料之外的副作用的风险(rudick等,newenglandjournalofmedicine,354,911-923,2006;kleinschmidt-demasters,newenglandjournalofmedicine,353,369-379,2005;langer-gould,newenglandjournalofmedicine,353,369-379,2005)。
因此,当给予两种药物治疗同一病症时,很难预测每种药物在对象体内对另一种药物的治疗作用是起到补充、还是没有影响、或是干扰。两种药物之间的相互作用不仅会影响每种药物的预期治疗作用,还会增加毒性代谢物的水平。这种相互作用还会增加或减轻每种药物的副作用。因此,给予两种药物治疗疾病时,难以预测每种药物的负面作用情况会产生何种改变。而且,难以准确地预测两种药物之间的相互作用的效果何时会显现。例如,药物之间的代谢相互作用的显现可能在初始给予第二种药物时,当两种药物达到稳态浓度之后或当停止一种药物时。
因此,在提交申请时本领域的情况是,在得到组合研究的结果之前,两种特定药物(尤其是辛波莫德和拉喹莫德)的组合疗法的效果不可预测。
需要提供用于治疗自身免疫疾病如spms的有效药物。
技术实现要素:
出人意料地,辛波莫德和拉喹莫德的组合疗法在治疗、预防、或延缓自身免疫疾病、尤其是spms进展中提供了显著的益处。
出人意料地发现,包含辛波莫德和拉喹莫德的组合能有效治疗受损的cns中的ms(例如在发生疾病爆发/复发之后)并协同减少淋巴细胞数量。因此发明人预计,例如包含辛波莫德和拉喹莫德的该组合(i)能减轻spms患者的cns中的炎性事件,如脑脊膜的炎症,和/或(ii)能有效减少spms患者的复发数量和/或减轻复发严重性。
出人意料地发现不存在药物-药物相互作用的迹象。本发明组合疗法的协同作用表现为加强的生物响应。
出人意料地发现,与使用辛波莫德或拉喹莫德的单一疗法相比,包含辛波莫德和拉喹莫德的组合的治疗效果起效更快。
附图说明
图1:使用辛波莫德和拉喹莫德减少mog/cfa/百日咳毒素免疫的c57/bi6小鼠中的淋巴细胞。
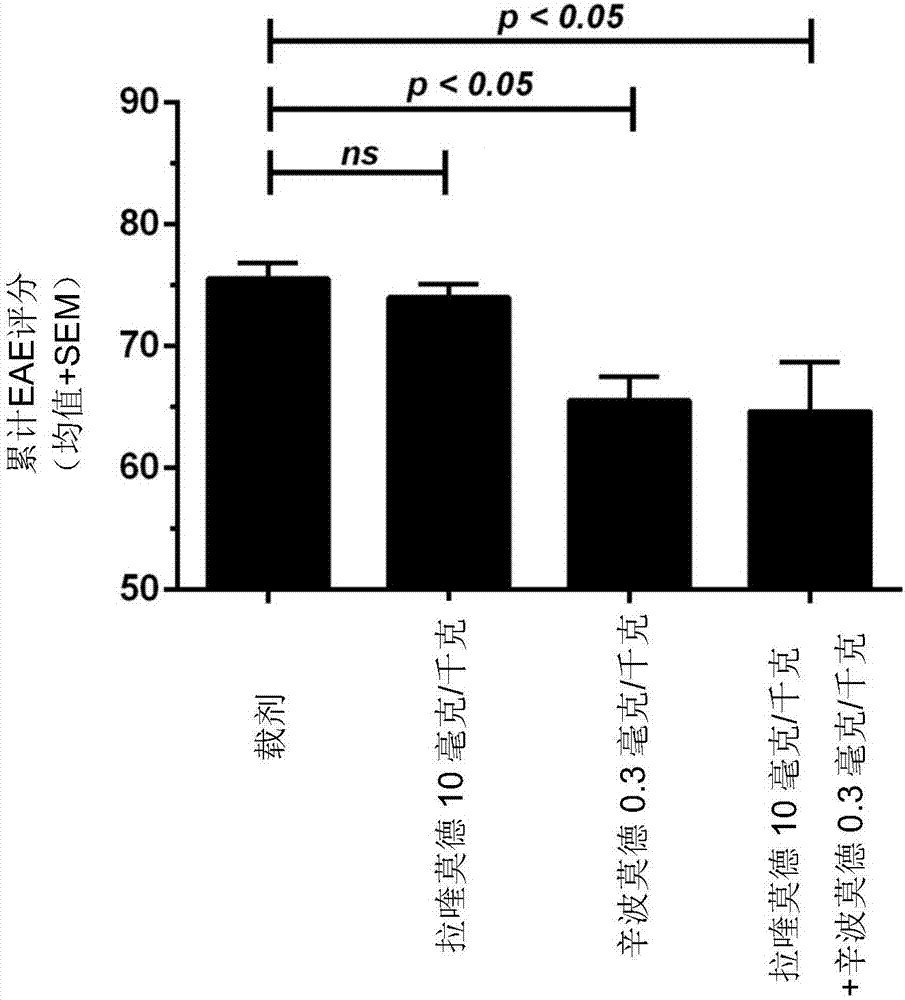
图2:使用辛波莫德和拉喹莫德治疗c57/bi6小鼠中mog/cfa/百日咳毒素诱导的实验性自身免疫脑脊髓炎(eae)。在严重cns损伤之后开始治疗,该损伤通过例如下肢瘫痪表征。
图3:在c57/bi6小鼠实验性自身免疫脑脊髓炎(eae)期间的血液和脑组织中的辛波莫德和拉喹莫德含量。没有药物-药物相互作用的迹象。
图4:使用辛波莫德和拉喹莫德治疗c57/bi6小鼠中的mog/cfa/百日咳毒素诱导的实验性自身免疫脑脊髓炎(eae)。在cns损伤正在进行的过程中开始治疗(例如在疾病爆发之后)。
发明详述
本发明提供了包含辛波莫德和拉喹莫德的组合,用于治疗、预防或延缓继发进展型多发性硬化症进展。
本发明的另一方面涉及包含辛波莫德和拉喹莫德的组合,用作药物。
本发明的另一方面涉及包含辛波莫德和拉喹莫德的组合。
本发明的另一方面涉及包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的药物组合物。
本发明的另一方面涉及用于在有需要的对象中治疗、预防或延缓继发进展型多发性硬化症进展的方法,该方法包括给予所述对象治疗有效量的包含辛波莫德和拉喹莫德的组合。
本发明的另一方面涉及用于在有需要的对象中治疗、预防或延缓继发进展型多发性硬化症进展的方法,该方法包括
(i)诊断所述对象中的所述继发进展型多发性硬化症,和
(ii)给予所述对象治疗有效量的包含辛波莫德和拉喹莫德的组合。
为避免疑问,发明人在此申明,之前在本申请书“技术背景”标题下公开的信息与本发明相关,应作为本发明公开内容的一部分阅读。
如本文所用,除非另外指明,以下每个术语应具有以下列出的含义。
在本说明书和权利要求书中,术语“包含”、“包括”及其变体表示“包括但并不限于”,不意图也并未排除其他部分、添加剂、组分、整数或步骤。
在本说明书和权利要求书中,除非上下文中有另外的要求,单数形式包括复数的情况。具体来说,当使用不定冠词时,除非上下文中有另外的要求,申请书(该术语包括说明书和权利要求书)应理解为同时考虑到复数和单数的情况。
结合本发明具体方面、实施方式或实施例描述的特性、整数、性状、化合物、化学部分或基团应理解为可应用于本文描述的任意其他的方面、实施方式或实施例,除非不相容。本申请书(包括任何附随权利要求书、摘要和附图)中公开的所有特性、和/或如公开的任何方法或过程的所有步骤,能以任何组合的方式进行组合,除非在一些组合中这些特性和/或步骤中至少一些互相排除。本发明延伸到本申请书(包括任何附随权利要求书、摘要和附图)中公开的任意一种新颖特性或特性的任意新颖组合,或延伸到如公开的任意方法或过程的任意一种新颖步骤或步骤的任意新颖组合。
如本文所用,“辛波莫德”理解为包括式(i)的化合物
及其药学可接受盐、多晶型物、溶剂化物和/或水合物。如本文所用,辛波莫德具有iupac化学名1-{4-[1-((e)-4-环己基-3-三氟甲基-苄基氧亚氨基)-乙基]-2-乙基-苄基}-氮杂环丁烷-3-羧酸(baf312)。在本发明的一种优选实施方式中,辛波莫德以辛波莫德游离碱或辛波莫德盐形式存在。辛波莫德的药学可接受盐的示例包括无机酸盐,例如盐酸盐、氢溴酸盐和硫酸盐;有机酸盐,例如醋酸盐、富马酸盐、半富马酸盐、马来酸盐、苯甲酸盐、柠檬酸盐、苹果酸盐、甲磺酸盐和苯磺酸盐;或者合适的带金属如钠、钾、钙和铝的盐;胺盐如三乙胺盐;以及二元氨基酸如赖氨酸的盐。在一种优选的实施方式中,辛波莫德是辛波莫德半富马酸盐。
如本文所用,“拉喹莫德”理解为包括式(ii)的化合物
及其药学可接受盐、多晶型物、溶剂化物和/或水合物。如本文所用,拉喹莫德具有iupac化学名5-氯-n-乙基-4-羟基-1-甲基-2-氧代-n-苯基-1,2-二氢喹啉-3-甲酰胺。在本发明的一种优选的实施方式中,拉喹莫德以拉喹莫德游离酸或拉喹莫德盐的形式存在。拉喹莫德的药学可接受盐的示例包括带金属如钠、钾、钙和铝的盐。在一种实施方式中,拉喹莫德是拉喹莫德钠。
如本文所用,以毫克计量的辛波莫德或拉喹莫德的“量”或“剂量”是指不考虑制剂形式,在制剂中存在的辛波莫德游离碱或拉喹莫德游离酸的毫克。“0.6毫克拉喹莫德的剂量”表示制剂中拉喹莫德游离酸的量为0.6毫克,不考虑该制剂的形式。因此,在盐形式中,例如拉喹莫德钠,提供0.6毫克拉喹莫德游离酸的剂量所必须的盐重量将大于0.6毫克(例如0.64毫克),因为存在额外的盐离子。类似地,当辛波莫德为盐形式时,例如辛波莫德半富马酸盐,提供0.5毫克辛波莫德游离碱的剂量所必须的盐重量将大于0.5毫克,因为存在额外的盐离子。
如本文所用,“单位剂量”和“单位剂量形式”表示单一药物给予实体。
如本文所用,在数值或范围上下文中的“约”表示所引用或要求保护的数值或范围的±10%。
应理解,当提供参数范围时,本发明同样提供了在该范围内的所有整数及其十分位小数。例如,“0.1-2.5毫克/天”包括0.1毫克/天、0.2毫克/天、0.3毫克/天等直至2.5毫克/天。
组合:
本发明涉及供同时、分开或顺序使用的包含辛波莫德和拉喹莫德的组合,例如组合的制剂或药物组合物。
如本文所用,术语“组合的制剂”在具体定义为“成套药盒”,意指辛波莫德和拉喹莫德可独立给药,以分开的形式或通过使用有独立量的活性成分的不同固定组合。在组合的制剂中,待给药的拉喹莫德的量相对于辛波莫德的量的比值可以变化,例如以满足待治疗的患者亚群的需求或单独患者的需求,这些需求因患者年龄、性别、体重等而各不相同。“成套药盒”的各部分可同时或按时间顺序交错给予,例如对于“成套药盒”的任意部分,在不同的时间点以及以相同或不同的时间间隔给予。
该组合还可用作追加(add-on)疗法。如本文所用,“追加”或“追加疗法”表示疗法中所用的试剂集合,接受该疗法的对象在开始一种或多种试剂的第一治疗方案之后开始该第一治疗方案以外的一种或多种不同试剂的第二治疗方案,因此该疗法中所用的所有试剂并非都在相同时间开始。例如,向已接受辛波莫德疗法的患者追加拉喹莫德疗法。
与仅使用包含辛波莫德和拉喹莫德的组合中所用活性成分其一的单一疗法相比,给予包含辛波莫德和拉喹莫德的组合产生有益的例如协同的治疗效果,或者其他出人意料的有益效果,例如更少和/或更轻的副作用。
特别地,包含辛波莫德和拉喹莫德的组合,其包含亚有效(subeffective)剂量的辛波莫德和拉喹莫德,能实现与有效剂量的任意单独化合物相同的效果。
特别地,对于不响应拉喹莫德的患者,包含辛波莫德和拉喹莫德的组合能实现比单独使用辛波莫德的单一疗法更高的治疗效果。
特别地,对于不响应辛波莫德的患者,包含辛波莫德和拉喹莫德的组合能实现比单独使用拉喹莫德的单一疗法更高的治疗效果。
进一步的益处在于,与仅使用拉喹莫德或辛波莫德的单一疗法相比,可使用更低剂量的辛波莫德和拉喹莫德。例如,所用剂量可不仅更小,使用频率还可更低。而且,副作用发生可降低,和/或对于基于拉喹莫德或辛波莫德的疗法的响应率可提高。所有这些都与待治疗患者的期望和要求一致。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中辛波莫德和拉喹莫德以治疗有效量存在。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中辛波莫德和拉喹莫德以产生协同治疗效果的量存在。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.1-10毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.1-2.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.1-1.2毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.1-0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.2-0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为1.2毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.6毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.3毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的拉喹莫德量为0.25毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中拉喹莫德为拉喹莫德钠。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为0.1-10毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为0.1-2.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为0.25-1.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为0.5-1.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为2.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为1.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为1.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中该组合中的辛波莫德量为0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德的组合,其中辛波莫德为辛波莫德半富马酸盐。
包含辛波莫德和拉喹莫德的药物组合物:
本发明还涉及包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的药物组合物。
“药学可接受载剂”是指适用于人类和/或动物、没有过度的不良副作用(例如毒性、刺激、和过敏反应)、同时具有合理的效益/风险比的载剂或赋形剂。其可为药学可接受溶剂、悬浮剂或载体(vehicle),用于递送该化合物至对象。
根据本发明的药物组合物优选适用于肠给药,例如口服或直肠给药;或肠胃外给药,例如肌肉内、静脉内、经鼻或透皮给药,至温血动物(人类和动物),其包含治疗有效量的活性成分和一种或多种合适的药学可接受载剂。
优选用于口服给药的组合物。
用于肠或肠胃外给药的组合物是,例如,单位剂量形式,例如片剂、胶囊、栓剂或安瓿。
单独剂量中的活性成分单位含量本身不需要为治疗有效量,因为这种量可通过给予多个剂量单位达到。根据本发明的组合物可包含例如活性成分治疗有效量的约10-100%。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.1-10毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.1-2.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.1-1.2毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.1-0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.2-0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为1.2毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.6毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.3毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的拉喹莫德量为0.25毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中拉喹莫德为拉喹莫德钠。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为0.1-10毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为0.1-2.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为0.25-1.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为0.5-1.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为2.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为1.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为1.0毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中该组合物中的辛波莫德量为0.5毫克。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的组合物,其中辛波莫德为辛波莫德半富马酸盐。
如果没有另外指明,根据本发明的药物组合物以本身已知的方式制备,例如通过常规混合、制粒、包衣、溶解或冻干工艺的方式。在制备用于口服剂型的组合物时,可采用任何常用的药物介质,例如水、乙二醇、油、乙醇;载剂,例如淀粉、糖、或微晶纤维素;稀释剂;制粒剂;润滑剂;粘结剂;崩解剂等。由于容易给药,片剂和胶囊是最有利的口服单位剂型,这时显然采用固体药学载剂。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的药物组合物,其中该组合物是片剂或胶囊。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的药物组合物,其中该组合物是片剂。
在一种实施方式中,本发明提供了包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的药物组合物,其中该组合物是胶囊。
使用包含辛波莫德和拉喹莫德的组合物治疗自身免疫疾病如spms:
出人意料地发现,在治疗性eae模型中,包含辛波莫德和拉喹莫德的组合物能有效地改善疾病负担并协同地减少淋巴细胞数量,即通过mog/cfa/百日咳毒素注射诱导eae并显示临床症状之后向c57/bi6小鼠给药。
由于这种模型是用于向受损cns(例如发生疾病爆发/复发之后)给予ms治疗的模型,这种模型特别与后期rrms患者或spms患者相关,而非临床正常患者的复发预防。因此,与仅使用辛波莫德的疗法相比,包含辛波莫德和拉喹莫德的组合能减轻炎性事件,例如spms患者的cns中的脑脊膜的炎症,和/或(ii)有效减少spms患者的复发数量和/或减轻复发严重性。
包含辛波莫德和拉喹莫德的组合物可用于治疗自身免疫疾病,例如多发性硬化症(ms),例如复发缓解型ms(rrms)、原发进展型ms(ppms)、继发进展型ms(spms)和复发型spms。本发明的辛波莫德优选用于治疗rrms和/或spms,最优选用于治疗spms。
“spms”定义为“初始复发缓解型病程随后伴有或不伴有偶发复发、轻微缓解、和平台的进展”(lublin,f.d.,reingold,s.c.(1996)定义多发性硬化症的临床病程(definingtheclinicalcourseofmultiplesclerosis),neurology,46:907-911)。2010版修订麦克唐纳标准(2010revisedmcdonaldcriteria)定义了具有初始复发缓解病程的ms的诊断(polmanch,reingolds,banwellb等(2011)。用于多发性硬化症的诊断标准:2010版修订麦克唐纳标准(diagnosticcriteriaformultiplesclerosis:2010revisionstothemcdonaldcriteria),annneurol;68:292-302)。进展指示至少持续6个月的神经受损连续恶化(rovarism.,confavreuxc.,furlanr.等(2006)继发进展型多发性硬化症:当前认知和今后挑战(secondaryprogressivemultiplesclerosis:currentknowledgeandfutrechallenges),lancetneurology5:343-354)且不能由复发的不完全恢复解释(lublin,f.d.,baier,m.,cutter,g.(2003)多发性硬化症中复发对余存残损发展的影响(effectofrelapsesondevelopmentonresidualdeficitinmultiplesclerosis),neurology,51:1528-1532)。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合用于治疗特征为无复发或与复发无关的持续至少6个月的进展性失能增加的spms患者。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合用于治疗失能状态edss评分为2.0-8.0、更优选2.5-7.0、最优选3.0-6.5的spms患者。
“edss”代表kurtzke扩展失能状态量表(expandeddisabilitystatusscale),其为对多发性硬化症中的失能进行量化的方法(表1)。edss按8个功能系统(fs)对失能进行量化,允许神经学家对每个系统指派一个功能体系统评分(fss)。kurtzke如下定义了功能系统:锥骨、小脑、脑干、感官、肠和膀胱、视觉、大脑、其他。
功能系统(fs)按0(低问题程度)至5(高问题程度)的量表评分,从而最佳地反映临床观察到的失能程度。“其他”条目不按数值评估,而是衡量与特定问题相关的失能,例如运动丧失。
相比之下,总edss评分由两个因素决定:步态和fs评分。edss评分低于4.0仅由fs评分决定。edss评分大于等于4.0的人具有一定程度的步态损伤。4.0-9.5之间的评分为同时由步态能力和fs评分两者决定。
表1-kurtzke扩展失能状态表
如本文所用,术语“治疗”包括:(1)在可能罹患或易患病况、病症或病状但尚未经历或呈现该病况、病症或病状的临床或亚临床症状的动物(尤其为哺乳动物且尤其为人类)中,预防或延迟所述病况、病症或病状的临床症状的出现;(2)抑制该病况、病症或病状(例如阻滞、减轻或延迟该疾病的发展或其复发(在维持治疗的情况下)或其至少一种临床或亚临床症状);及/或(3)减轻病状(即导致病况、病症或病状或其临床或亚临床症状中的至少一者的消退)。对所治疗的患者的益处在统计上显著或至少可被患者或被医师察觉。然而,应了解,当向患者施用药剂以治疗疾病时,结果可能不总为有效治疗。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合能有效减轻rrms或spms、优选spms的症状。在一种实施方式中,症状是mri监测的多发性硬化症疾病活动、失能进展、脑萎缩、神经机能障碍、神经损伤、神经退化、视觉功能退化、活动性受损、认知损伤、脑量减少、总体健康状态、功能状态和/或生活质量恶化。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合能延迟spms患者的失能进展,例如通过edss评估。
在一种实施方式中,治疗包括使spms患者至3个月确认失能进展的时间(通过edss测定)相对于未治疗患者有所增加。通过edss测定的失能进展通常定义为从基线增加至少1点(对于基线edss评分为3.0-5.0的患者)或至少0.5点(对于基线edss评分为5.5-6.5的患者)。要确认该进展保持,这个增加必须在3个月之后的访问时存在。
在一种实施方式中,至3个月确认失能进展的时间增加至少10%。
在一种实施方式中,至3个月确认失能进展的时间增加至少25%。
在一种实施方式中,至3个月确认失能进展的时间增加20-75%。
在一种实施方式中,至3个月确认失能进展的时间增加10-75%。
在另一种实施方式中,至3个月确认失能进展的时间增加25-50%。
在另一种实施方式中,至3个月确认失能进展的时间增加25-40%。
在一种实施方式中,包含本发明的辛波莫德和拉喹莫德的组合能延迟spms患者的活动能力受损的恶化,例如通过计时25英尺行走测试(t25-fw)评估。
t25-fw是一种基于计时25英尺行走的量化活动能力和腿功能效能测试。将患者引导至清楚标记的25英尺路线的一端,令其尽可能快速安全地行走25英尺。时间自指令起始时开始计算,且当患者到达25英尺标记时结束。紧接着使患者返回行走相同距离再次重复任务。t25-fw是多发性硬化症功能复合表(msfc)的三个部分之一,msfc是一项评估上肢功能、走动和认知功能的复合测试(fisherjs等人.forthenationalmssocietyclinicaloutcomesassessmenttaskforce(1999),多发性硬化症功能复合测试:对ms临床结果评估的综合方法(themultiplesclerosisfunctionalcompositemeasure:anintegratedapproachtomsclinicaloutcomeassessment),multscler;5:244-250)。
在一种实施方式中,治疗包含使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患者延迟。
在一种实施方式中,使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患者增加至少10%。
在一种实施方式中,使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患者增加至少25%。
在一种实施方式中,使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患者增加10%至80%。
在一种实施方式中,使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患者增加20%至80%。
在另一实施方式中,使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患者增加25%至70%。
在另一实施方式中,使达到t25-fw自基线的3个月确认恶化至少20%的时间比未经治疗的患增加25%至50%。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合使spms患者的t2病变体积自基线的增加比未经治疗的患者减少,例如在2年治疗内由磁共振成像(mri)所量测的增加。t2病变使用突出t2对比度的mr影像侦测。t2病变表示新的发炎性活动。
在一种实施方式中,t2病变体积在2年治疗内自基线的增加比未经治疗的患者减小至少10%。
在一种实施方式中,t2病变体积在2年治疗内自基线的增加比未经治疗的患者减小至少25%。
在一种实施方式中,t2病变体积在2年治疗内自基线的增加比未经治疗的患者减小10%至100%。
在一种实施方式中,t2病变体积在2年治疗内自基线的增加比未经治疗的患者减小20%至100%。
在另一实施方式中,t2病变体积在2年治疗内自基线的增加比未经治疗的患者减小25%至90%。
在另一实施方式中,t2病变体积在2年治疗内自基线的增加比未经治疗的患者减小30至80%。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合能减轻或抑制spms患者的脑体积减少,通过脑体积变化百分来测定。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合能改善spms患者的总体健康状态或延迟总体健康状态的恶化,该状态通过eq-5d定义。eq-5d是一种用于测定总体健康状态的标准化问卷。其测定五个领域(活动能力、自理、普通活动、疼痛/不适、焦虑/抑郁)。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合能提高spms患者的健康相关生活质量或延迟生活质量的降低,通过多发性硬化症影响量表(msis-29)测定,它是测定多发性硬化症的身体(20项)和心理(9项)影响的手段。
在一种实施方式中,包含辛波莫德和拉喹莫德的组合降低了spms患者的年化复发率。如本文所用,术语“复发率”是指单位时间内确认的复发数量。如本文所用,术语“年化复发率”是指每个患者的确认复发数量乘以365并除以该患者服药天数的平均值。
如本文所用,术语“对象”优选是指人类,尤其是被诊断患有ms如spms的患者。
如本文所用,术语“治疗有效量”通常是指当给予对象时足以提供治疗益处,例如足以治疗、预防或延迟spms进展的活性成分或活性成分组合的量(例如提供症状改善的量)。
对于上述适应症(病症和疾病),活性成分的合适剂量将根据例如所用化合物的固体形式、患者(host)、给药模式以及待治疗病症的性质和严重程度而变化。
对于人类,就拉喹莫德所指日常剂量在约0.1-10毫克范围内,例如约0.1-约2.0毫克或约0.1-约1.2毫克便于给药的拉喹莫德,例如以独立剂量多至每日四次给药(例如每天四次给予包含辛波莫德和拉喹莫德的组合的相同单位剂型)。
对于人类,就辛波莫德所指日常剂量在约0.1-10毫克范围内,例如约0.1-约2.0毫克或约0.25-约1.5毫克便于给药的辛波莫德,例如以独立剂量多至每日四次给药(例如每天四次给予包含辛波莫德和拉喹莫德的组合的相同单位剂型)。
具有普通技能的医师或临床医生能容易地确定并处方合适的剂量方案。
拉喹莫德的单位剂型可包含0.1-1.0毫克拉喹莫德口服
辛波莫德的单位剂型可包含0.1-10毫克辛波莫德口服
包含辛波莫德和拉喹莫德的组合在治疗上述疾病如spms中的有效性可通过包括下述的一系列标准试验确认。
实施例
实施例1:来自动物模型的数据
实施例1.1:小鼠脑脊髓液(csf)中的辛波莫德含量
c57bi/6雌性小鼠每天给予3毫克/千克辛波莫德,口服,持续8天。最后给药8小时后处死动物,测定血液、脑和csf中的辛波莫德含量。
数据归纳在下表1中。显示3-5只动物的平均值和平均值的标准误差(括号中)。
表1:
这显示,有临床价值的辛波莫德的剂量(小鼠中3毫克/千克)导致csf中暴露超过s1p1(0.4nm)和s1p5(1nm)的ec50。
实施例1.2:使用辛波莫德、拉喹莫德及其组合减少经mog/cfa/百日咳毒素处理的c57/bi6小鼠中的淋巴细胞
用cfa中的200微克重组mog1-125对c57bi/6雌性小鼠进行皮下免疫,然后腹腔内注射一次100纳克百日咳毒素。两天后给予一次追加腹腔内注射100纳克百日咳毒素。第一次出现临床症状三天后,将小鼠随机分为载剂、0.3毫克/千克辛波莫德、10毫克/千克拉喹莫德、或0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德,每天以所述剂量处理,持续29天。quancard等描述了c57/bi6小鼠中的mog/cfa/百日咳毒素诱导的实验性自身免疫脑脊髓炎模型(chembiol.19(9):1142-51,2012)。
结果显示在图1中。用10毫克/千克拉喹莫德处理没有明显减少淋巴细胞。用0.3毫克/千克辛波莫德处理减少了淋巴细胞。0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德的组合显示了对淋巴细胞减少的协同效果。统计显著性p<0.05。
实施例1.2:使用辛波莫德、拉喹莫德及其组合治疗c57/bi6小鼠中的mog/cfa/百日咳免疫的实验性自身免疫脑脊髓炎(eae)
用cfa中的200微克重组mog1-125对c57bi/6雌性小鼠进行皮下免疫,然后腹腔内注射一次100纳克百日咳毒素。两天后给予一次追加腹腔内注射100纳克百日咳毒素。第一次临床症状出现三天后,将小鼠随机分为载剂、0.3毫克/千克辛波莫德、10毫克/千克拉喹莫德、或0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德,并每天以所述剂量处理,持续30天。在出现严重cns神经疾病和组织损伤之后开始治疗。更具体来说在已经出现严重cns损伤之后,其特征为下肢瘫痪。
结果显示在图2中。用10毫克/千克拉喹莫德治疗没有明显改善疾病负担(累计eae评分)。用0.3毫克/千克辛波莫德治疗减轻了疾病负担(累计eae评分)。0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德的组合显示相对于载剂处理的动物的疾病负担的显著改善(累计eae评分)。统计显著性p<0.05。
实施例1.3:在实验性自身免疫脑脊髓炎(eae)期间c57/bi6小鼠血液和脑组织中的辛波莫德和拉喹莫德含量
用cfa中的200微克重组mog1-125对c57bi/6雌性小鼠进行皮下免疫,然后腹腔内注射一次100纳克百日咳毒素。两天后给予一次追加腹腔内注射100纳克百日咳毒素。给予小鼠载剂,0.3毫克/千克辛波莫德、10毫克/千克拉喹莫德、或0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德,最长达21天。在免疫细胞进入cns导致瘫痪和局域性组织损伤之后开始治疗。
结果显示在图3中。组合疗法没有明显改变辛波莫德或拉喹莫德的血液或脑浓度。没有药物-药物相互作用的迹象。组合疗法的功效体现加强的生物响应。无统计显著性p>0.05。
实施例1.4:使用辛波莫德、拉喹莫德及其组合治疗c57/bi6小鼠中的mog/cfa/百日咳毒素免疫的实验性自身免疫脑脊髓炎(eae)
使用cfa中的200微克重组mog1-125对c57bi/6雌性小鼠进行皮下免疫,随后腹腔内注射一次100纳克百日咳毒素。两天后给予一次追加腹腔内注射100纳克百日咳毒素。待免疫细胞浸润进入cns中引起组织损伤之后,将小鼠随机分为载剂、0.3毫克/千克辛波莫德、10毫克/千克拉喹莫德、或0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德,每天以所述剂量处理,持续21天。
结果显示在图4中。用10毫克/千克拉喹莫德治疗没有明显改善日常疾病严重程度。用0.3毫克/千克辛波莫德治疗暂时地减轻了神经瘫痪(免疫后第18-21天),但是动物最终进入慢性非缓解期。0.3毫克/千克辛波莫德+10毫克/千克拉喹莫德的组合显示疾病负担相比载剂处理的动物的有显著改善。自神经瘫痪的恢复明显大于拉喹莫德或辛波莫德单一疗法。统计显著性p<0.05。
实施例2:临床研究
多中心、随机、双盲、平行组、安慰剂对照的可变治疗持续时间的研究,其评估辛波莫德和拉喹莫德的组合对继发进展型多发性硬化症患者的功效和安全性。
1.研究目标
a)主要目标
主要目标是证明辛波莫德和拉喹莫德的组合相对于安慰剂在延迟spms患者至通过edss测定的3个月确认失能进展的时间中的功效。
b)关键二级目标
第一关键二级目标是证明辛波莫德和拉喹莫德的组合相对于安慰剂在延迟计时25英尺行走测试(t25-fw)中自基线至3个月确认恶化至少20%的时间中的功效。
第二关键二级目标是证明辛波莫德和拉喹莫德的组合相对于安慰剂在减小自基线至研究结束时t2病变体积增加中的功效。
c)其他二级目标包括
·评价辛波莫德和拉喹莫德的组合相对于安慰剂在延迟至通过edss测定的6个月确认失能进展的时间中的功效
·评价辛波莫德和拉喹莫德的组合相对于安慰剂在减小通过年化复发率(arr)评价的确认复发频率中的功效,以及评价至第一次复发的时间和无复发患者的比例
·评价辛波莫德和拉喹莫德的组合相对于安慰剂对患者报告的多发性硬化症行走量表(msws-12)结果的影响
·评价辛波莫德和拉喹莫德的组合相对于安慰剂对炎性疾病活动和疾病负担的功效,通过常规mri(t1gd-加强病变,新的或增大的t2病变,脑体积)测定
·评价辛波莫德和拉喹莫德的组合相对于安慰剂的安全性和耐受性
d)探索性目标包括
·评价辛波莫德和拉喹莫德的组合相对于安慰剂对以下患者报告的结果的影响:
·通过多发性硬化症影响表(msis-29)测定的健康相关的生活质量(qol)
·通过eq-5d测定的健康相关的生活质量(qol)
·探索辛波莫德和拉喹莫德的组合相对于安慰剂对规定的认知测试的功效:
●分步听力连续加法测试(pacedauditoryserialadditiontest)(pasat)
·符号数字模式测试(symboldigitmodalitiestest)(sdmt)
·简单视觉空间记忆测试-修订版(briefvisuospatialmemorytestrevised)(bvmtr)
·评价辛波莫德和拉喹莫德的组合相对于安慰剂对mri显示的急性损伤向慢性黑洞演化的功效
·评价辛波莫德和拉喹莫德的组合相对于安慰剂对msfcz-评分的功效
·评价辛波莫德和拉喹莫德的组合相对于安慰剂在延迟以下时间中的功效:
·计时25英尺行走测试(t25w)从基线至3个月确认恶化至少20%,或
·至通过edss评分测定的3个月确认失能进展,或
·任一手(惯用或非惯用)的9孔柱测试(9-hpt)自基线至3个月确认恶化至少20%
·探索失能进展终点与药物浓度/淋巴细胞计数之间的关系
·探索选择的安全性参数和药物浓度/淋巴细胞计数之间的关系
·评价辛波莫德和拉喹莫德的药物动力学
2.群体
研究群体由edss评分为3.0-6.5、年龄为18-60岁、具有ms诊断为继发进展型ms病程(spms)的能走动的患者组成。
3.研究设计
这是在spms患者中进行的随机、多中心、双盲、安慰剂对照的平行组研究。患者随机分组接受辛波莫德和拉喹莫德的组合或安慰剂。
以下是本发明的其他实施方式:
实施方式1:包含辛波莫德和拉喹莫德的组合用于治疗、预防或延迟继发进展型多发性硬化症的进展。
实施方式1.1:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.1-10毫克。
实施方式1.2:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.1-2.0毫克。
实施方式1.3:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.1-1.2毫克。
实施方式1.4:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.1-0.5毫克。
实施方式1.5:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.2-0.5毫克。
实施方式1.6:根据实施方式1的组合,其中该组合中的拉喹莫德量为1.2毫克。
实施方式1.7:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.6毫克。
实施方式1.8:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.5毫克。
实施方式1.9:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.3毫克。
实施方式1.10:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.25毫克。
实施方式1.11:根据实施方式1-1.10中任一项的组合,其中拉喹莫德为拉喹莫德钠。
实施方式1.12:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为0.1-10毫克。
实施方式1.13:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为0.1-2.0毫克。
实施方式1.14:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为0.25-1.5毫克。
实施方式1.15:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为0.5-1.0毫克。
实施方式1.16:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为2.0毫克。
实施方式1.17:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为1.5毫克。
实施方式1.18:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为1.0毫克。
实施方式1.19:根据实施方式1-1.11中任一项的组合,其中该组合中的辛波莫德量为0.5毫克。
实施方式1.20:根据实施方式1-1.19中任一项的组合,其中辛波莫德为辛波莫德半富马酸盐。
实施方式2:包含辛波莫德和拉喹莫德的组合用作药物。
实施方式2.1:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.1-10毫克。
实施方式2.2:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.1-2.0毫克。
实施方式2.3:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.1-1.2毫克。
实施方式2.4:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.1-0.5毫克。
实施方式2.5:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.2-0.5毫克。
实施方式2.6:根据实施方式2的组合,其中该组合中的拉喹莫德量为1.2毫克。
实施方式2.7:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.6毫克。
实施方式2.8:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.5毫克。
实施方式2.9:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.3毫克。
实施方式2.10:根据实施方式2的组合,其中该组合中的拉喹莫德量为0.25毫克。
实施方式2.11:根据实施方式2-2.10中任一项的组合,其中拉喹莫德为拉喹莫德钠。
实施方式2.12:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为0.1-10毫克。
实施方式2.13:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为0.1-2.0毫克。
实施方式2.14:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为0.25-1.5毫克。
实施方式2.15:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为0.5-1.0毫克。
实施方式2.16:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为2.0毫克。
实施方式2.17:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为1.5毫克。
实施方式2.18:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为1.0毫克。
实施方式2.19:根据实施方式2-2.11中任一项的组合,其中该组合中的辛波莫德量为0.5毫克。
实施方式2.20:根据实施方式2-2.19中任一项的组合,其中辛波莫德是辛波莫德半富马酸盐。
实施方式3:包含辛波莫德和拉喹莫德的组合。
实施方式3.1:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.1-10毫克。
实施方式3.2:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.1-2.0毫克。
实施方式3.3:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.1-1.2毫克。
实施方式3.4:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.1-0.5毫克。
实施方式3.5:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.2-0.5毫克。
实施方式3.6:根据实施方式3的组合,其中该组合中的拉喹莫德量为1.2毫克。
实施方式3.7:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.6毫克。
实施方式3.8:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.5毫克。
实施方式3.9:根据实施方式3的组合,其中该组合中的拉喹莫德量为0.3毫克。
实施方式3.10:根据实施方式1的组合,其中该组合中的拉喹莫德量为0.25毫克。
实施方式3.11:根据实施方式3-3.10中任一项的组合,其中拉喹莫德为拉喹莫德钠。
实施方式3.12:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为0.1-10毫克。
实施方式3.13:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为0.1-2.0毫克。
实施方式3.14:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为0.25-1.5毫克。
实施方式3.15:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为0.5-1.0毫克。
实施方式3.16:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为2.0毫克。
实施方式3.17:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为1.5毫克。
实施方式3.18:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为1.0毫克。
实施方式3.19:根据实施方式3-3.11中任一项的组合,其中该组合中的辛波莫德量为0.5毫克。
实施方式3.20:根据实施方式3-3.19中任一项的组合,其中辛波莫德为辛波莫德半富马酸盐。
实施方式4:包含辛波莫德和拉喹莫德和至少一种药学可接受载剂的药物组合物。
实施方式4.1:根据实施方式4的药物组合物,其中该组合物用于口服给药。
实施方式4.2:根据实施方式4的药物组合物,其中该组合物是用于口服给药的固体组合物。
实施方式4.3:根据实施方式4的药物组合物,其中该组合物是片剂或胶囊。
实施方式4.4:根据实施方式4-4.3中任一项的药物组合物,其中该组合物中的拉喹莫德量为0.1-10毫克。
实施方式4.5:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.1-2.0毫克。
实施方式4.6:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.1-1.2毫克。
实施方式4.7:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.1-0.5毫克。
实施方式4.8:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.2-0.5毫克。
实施方式4.9:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为1.2毫克。
实施方式4.10:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.6毫克。
实施方式4.11:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.5毫克。
实施方式4.12:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.3毫克。
实施方式4.13:根据实施方式4-4.3中任一项的组合,其中该组合物中的拉喹莫德量为0.25毫克。
实施方式4.14:根据实施方式4-4.13中任一项的组合,其中拉喹莫德是拉喹莫德钠。
实施方式4.15:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为0.1-10毫克。
实施方式4.16:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为0.1-2.0毫克。
实施方式4.17:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为0.25-1.5毫克。
实施方式4.18:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为0.5-1.0毫克。
实施方式4.19:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为2.0毫克。
实施方式4.20:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为1.5毫克。
实施方式4.21:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为1.0毫克。
实施方式4.22:根据实施方式4-4.13中任一项的组合,其中该组合物中的辛波莫德量为0.5毫克。
实施方式4.21:根据实施方式4-4.19中任一项的组合,其中辛波莫德为辛波莫德半富马酸盐。
实施方式5:药盒,其包含
(a)拉喹莫德,
(b)辛波莫德,
(c)在治疗继发进展型多发性硬化症时同时、分开或依序使用其的指令,和
(d)至少一个用于容纳组分(a)和(b)的容器。
实施方式6:药物包装,其包含包括辛波莫德和拉喹莫德的组合和在治疗继发进展型多发性硬化症时同时、分开或依序使用其的书面指令。
实施方式7:包含辛波莫德和拉喹莫德的组合在治疗、预防或延迟继发进展型多发性硬化症的进展中的应用。
实施方式8:包含辛波莫德和拉喹莫德的组合在制造治疗、预防或延迟继发进展型多发性硬化症的进展的药物中的应用。
实施方式9:在有需要的对象中治疗、预防或延迟继发进展型多发性硬化症的进展的方法,其包括给予所述对象治疗有效量的包含辛波莫德和拉喹莫德的组合。
实施方式10:在有需要的对象中治疗、预防或延迟继发进展型多发性硬化症的进展的方法,其包括
(i)在所述对象中诊断所述继发进展型多发性硬化症,和
(ii)给予所述对象治疗有效量的包含辛波莫德和拉喹莫德的组合。
提供以上实施方式用于说明而非限制本发明。
- 还没有人留言评论。精彩留言会获得点赞!