用于增强干细胞功能的内含抑制素纳米粒子制剂、以及含有其的功能增强干细胞及其制备方法与流程
本发明涉及内含抑制素的纳米粒子,尤其涉及用于增强细胞功能的内含抑制素纳米粒子制剂。另外,本发明还涉及含有内含抑制素纳米粒子的干细胞及其制备方法。
背景技术:
抑制素(statin)作为抑制肝脏中胆固醇生物合成的限速酶即hmg-coa还原酶的化合物为人所知。通过抑制素可使血液中的胆固醇值下降,因此被用于高胆固醇血症的治疗药物。另外,临床试验还表明,除了高胆固醇血症以外,抑制素因其抗炎作用而对心绞痛、心肌梗死之类的缺血性心脏病、以及动脉硬化等疾病也有效。
迄今为止,为了提高抑制素对上述疾病的治疗效果、降低副作用进行了各种研究,例如专利文献1中公开了通过将抑制素包覆在纳米粒子内,并对患者局部给予该内含抑制素纳米粒子,能够用比以往更少量的抑制素促进血管生成。
另外,近年来还进行了使用具有多潜能性、可分化成心肌细胞的干细胞,治疗缺血性心脏病的研究。非专利文献1中公开了通过对心肌梗死模型小鼠的心肌直接给予脂肪组织源性干细胞,可实现心脏功能的改善和梗死尺寸的减小。
现有技术文献
专利文献
专利文献1:日本特开2012-21002号公报
非专利文献
非专利文献1:masaakiiietal.,laboratoryinvestigation(2011)91,539-552
技术实现要素:
发明要解决的问题
为了治疗心肌梗死等缺血性心脏病,在给予例如上述专利文献1所公开的内含抑制素的纳米粒子的情况下,如上所述,通过对患者局部给予内含抑制素的纳米粒子,利用比以往更少量的抑制素可实现有效性,但需要对患部进行局部给药,给药不便,还期待有效性的进一步提高。另外,在不采用局部给药而采用静胍给药等的情况下,需要更多容量,还有可能产生副作用。
另一方面,非专利文献1公开了在使用干细胞治疗心肌梗死等缺血性心脏病的情况下,也需要干细胞对患部的局部给药,例如在对小鼠的心肌进行给药时,为了获得治疗效果,所需的细胞量为5×105细胞/小鼠(cells/mouse)。作为干细胞,例如可使用间充质来源的成体干细胞(somaticstemcell),此类干细胞可从骨髓或脂肪组织中获得,但一次所得干细胞量有限,因此将干细胞用于上述治疗等时,最好使用较少的细胞数。由此,为了利用更少数量的干细胞来获得优异的治疗效果,需要使该干细胞的各种功能提高。
本发明是鉴于上述问题而完成的,其目的在于可提高该干细胞的功能,以提高用作细胞制剂的干细胞对疾病的治疗效果、抑制副作用。
用于解决问题的方案
为了达成上述目的,本发明人进行了深入研究,结果发现通过使干细胞中含有将抑制素包覆在纳米粒子内而成的内含抑制素纳米粒子,可增强该干细胞的功能,将抑制素高效地传递至所需患部,在缺血性心脏病等各种疾病的治疗中显示出良好的效果,从而完成了本发明。即,本发明涉及的内含抑制素纳米粒子制剂特征在于,包含将抑制素包覆在含有生物吸收性聚合物(bioabsorbablepolymer)的纳米粒子内而成的内含抑制素纳米粒子,该纳米粒子的个数平均粒径小于1000nm,用于增强干细胞的功能。
本发明涉及的内含抑制素纳米粒子制剂通过对干细胞进行处理,可增强该处理后的干细胞的功能,通过对生物体内给予该干细胞,显示出各种有效性。具体而言,若用本发明涉及的内含抑制素纳米粒子制剂对干细胞进行处理,则处理后的干细胞通过吞噬作用而摄取内含抑制素纳米粒子,摄取了内含抑制素纳米粒子的干细胞,其迁移能力(migratorycapacity)、增殖能力和血管生成因子产生能力增强。因此,通过对患有例如缺血性心脏病的患者体内给予经本发明涉及的内含抑制素纳米粒子处理的可分化成心血管系统细胞的干细胞,干细胞集聚于缺血部位而增殖并释放出血管生成因子,从而促进缺血部位的血管生成。进而,该集聚并增殖的干细胞分化成心肌从而促进心肌的再生。另外,通过本发明涉及的摄取了内含抑制素纳米粒子的干细胞的给药,促使存在于心外膜附近的细胞在心肌梗死部位分裂增殖,从而促进心肌的再生。其结果,显示出优异的缺血性心脏病的治疗效果。另外,该干细胞可以缓慢释放出被其摄取的抑制素,由此,还可获得抑制素本身的血管生成效果等抑制素所特有的各种效果,因此对以缺血性心脏病为代表的各种疾病的治疗有益。进而,通过从集聚于患部的干细胞释放出的抑制素,可使体内的干细胞、骨髓源性血管内皮祖细胞(epc)的集聚亢进,其结果,在例如缺血性心脏病的情况下,可进一步促进缺血部分的心肌再生。另外,抑制素等化合物在单纯静胍给药时,会随着血流而被运送至患部,但在心肌梗死等缺血性心脏病中,血流受阻,难以正常到达患部,而本发明所述的抑制素被迁移性增强的干细胞摄取并运送,因此即便血流受阻也能到达患部。即,可形成良好的药物传递系统,从而能够减少应给药的细胞数。通过上述作用,可对心肌梗死等缺血性心脏病的治疗发挥极好的效果。应予说明,为了使干细胞通过上述吞噬作用高效地摄取内含抑制素纳米粒子,上述纳米粒子的个数平均粒径小于1000nm。
本发明涉及的内含抑制素纳米粒子制剂中,作为生物吸收性聚合物,可以使用聚乳酸聚合物(polylacticacid:pla)或聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid):plga)。
通过pla和plga在体内水解,可将所包覆的抑制素释放,另外,pla通过水解而分解成乳酸,plga通过水解而分解成乳酸和乙二醇,最终分别成为水和二氧化碳,对人和动物无害,因此特别优选将pla或plga用作纳米粒子材料。
本发明涉及的内含抑制素纳米粒子制剂优选为用于增强作为上述干细胞的脂肪源性干细胞的制剂。
脂肪源性干细胞可如下获得:采集脂肪组织,对所采集的组织进行胶原酶处理后,利用离心比重法(centrifugalspecificgravitymethod)仅采集单核细胞,将所采集的单核细胞用培养板培养4日左右,选取并分离出粘附的细胞作为脂肪源性干细胞。另外,还可以使用celution系统(cytoritherapeutics,inc.制)等简便而大量地从脂肪组织中提取、分离培养脂肪源性干细胞。脂肪源性干细胞属于间充质干细胞,具有优异的多潜能性,另外,如上所述,由于脂肪源性干细胞能够简便而大量地采集,因此有利于用于各种疾病的治疗。
另外,本发明涉及的功能增强干细胞特征在于,含有将上述抑制素包覆在生物相容性纳米粒子内而成的内含抑制素纳米粒子。
这种本发明涉及的功能增强干细胞含有上述内含抑制素纳米粒子,因此如上所述,可通过该内含抑制素纳米粒子来增强细胞功能,对以缺血性心脏病为代表的各种疾病的治疗发挥优异效果。另外,本发明涉及的功能增强细胞能够缓慢释放出抑制素,该释放出的抑制素可使骨髓干细胞、骨髓源性血管内皮祖细胞(epc)的集聚亢进,因此有利于缺血性心脏病等的治疗。
由于上述理由,本发明涉及的功能增强干细胞优选为上述脂肪源性干细胞,还优选为了治疗心肌梗死等缺血性心脏病而给予患者的干细胞。
另外,本发明涉及的功能增强干细胞还可以与药学上可接受的溶剂和赋形剂混合制成细胞制剂。本发明涉及的干细胞对生物体内的给药优选无需开胸等手术的给药,还优选制成静胍给药用细胞制剂。由此,本发明涉及的干细胞可以简便地对患者给药。另外,如上所述,本发明涉及的功能增强干细胞起到优异的药物传递系统的作用,可将干细胞集聚在所需患部并缓慢释放抑制素,因此无需局部给药,即使采用静胍给药也能够以较少容量获得良好的效果。
本发明涉及的功能增强干细胞的制备方法特征在于,包括用上述内含抑制素纳米粒子对干细胞进行处理的步骤。特别是,在上述用内含抑制素纳米粒子对干细胞进行处理的步骤中,优选向培养有干细胞的培养基中添加内含抑制素纳米粒子使其浓度达到20μg/ml~100μg/ml,处理时间为30分钟~2小时。
由此,通过向培养有干细胞的培养基中添加内含抑制素纳米粒子这一简便的步骤,能够得到上述功能增强干细胞。另外,通过以上述浓度和时间进行处理,可将内含抑制素纳米粒子高效地摄入干细胞内。
由于上述理由,在本发明涉及的功能增强干细胞的制备方法中,优选使用脂肪源性干细胞作为干细胞,另外还优选使用用于治疗缺血性心脏病的干细胞。
发明的效果
根据本发明涉及的内含抑制素纳米粒子、以及含有该内含抑制素纳米粒子的功能增强干细胞及其制备方法,能够增强干细胞的功能,通过对生物体内给予该干细胞,对以缺血性心脏病为代表的各种疾病的治疗有效。
附图说明
图1是示出向脂肪源性干细胞的培养基中添加终浓度达到20μg/ml、50μg/ml、80μg/ml或100μg/ml的内含罗丹明红荧光染料(rhodamineredfluorescentdye)的pla纳米粒子,1小时后或2小时后用激光共聚焦荧光显微镜(confocallaserfluorescencemicroscope)观察干细胞所得结果的照片。
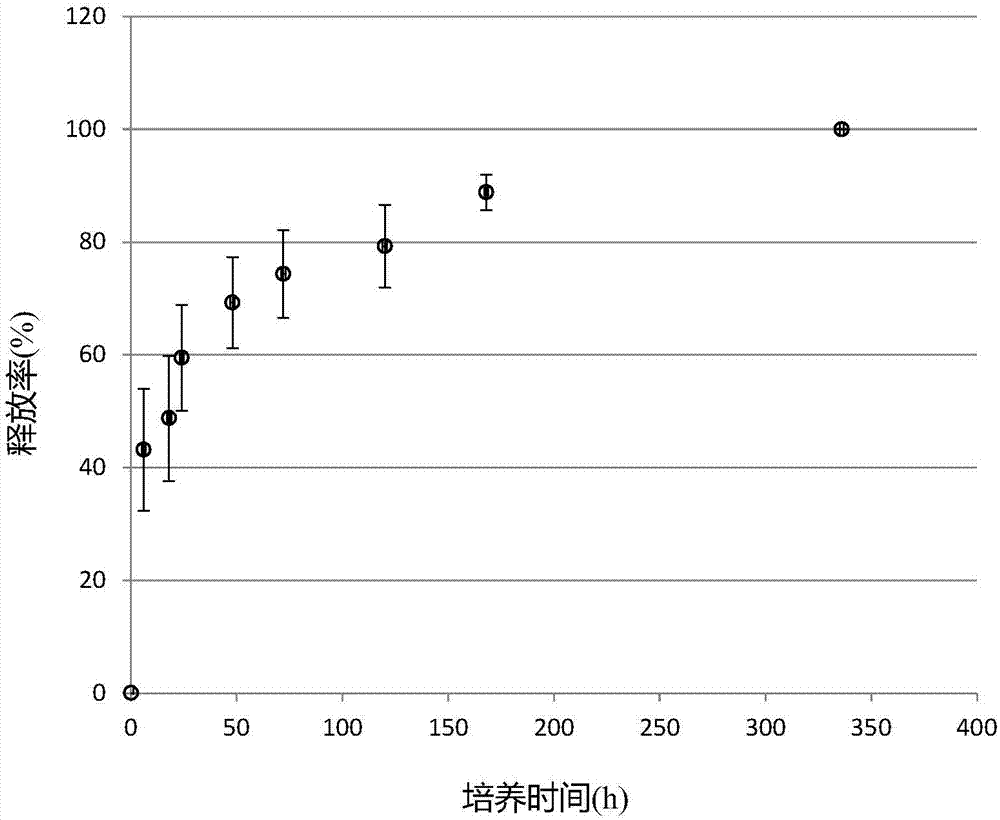
图2是示出以100μg/ml的浓度用内含辛伐他汀的pla纳米粒子对脂肪源性干细胞进行1小时处理后,对从脂肪源性干细胞释放到培养基中的辛伐他汀量进行测定所得结果的图表。
图3(a)是示出经pla纳米粒子或内含抑制素的pla纳米粒子处理后的脂肪源性干细胞的迁移性测定结果的图表,(b)是示出经内含抑制素的pla纳米粒子处理后的脂肪源性干细胞的增殖性测定结果的图表。
图4是示出使用定量pcr法对经内含抑制素纳米粒子处理后的脂肪源性干细胞中的血管生成因子的mrna表达进行测定所得结果的图表,示出作为血管生成因子的(a)vegf-a、(b)vegf-c、(c)fgf-2的rna表达的测定结果。
图5是示出给予pbs、内含抑制素纳米粒子、脂肪源性干细胞、或者摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠心脏的超声诊断结果的图表,(a)表示左室射血分数(ef),(b)表示左室缩短分数(fs),(c)表示左室舒张末期内径(lvdd),(d)表示左室收缩末期内径(lvds)。
图6是示出给予pbs、或者摄取了内含抑制素纳米粒子的脂肪源性干细胞28日后,心肌梗死模型小鼠心脏的照片。
图7(a)是示出给予pbs、内含抑制素纳米粒子、摄取了不含抑制素的纳米粒子的脂肪源性干细胞、或者摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经马松三色染色(massontrichromestain)所得结果的照片,(b)是示出各切片中纤维化部分的长度的图表,(c)是示出各切片中纤维化部分的心肌壁厚的图表。
图8示出给予pbs、内含抑制素纳米粒子、摄取了不含抑制素的纳米粒子的脂肪源性干细胞、或者摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经马松三色染色所得的结果,是将纤维化部分放大的照片。
图9(a)是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞60日后,心肌梗死模型小鼠心脏的照片,(b)~(e)是示出沿(a)所示的(b)~(e)各线切出的切片经马松三色染色所得结果的照片。
图10是示出给予pbs、内含抑制素纳米粒子、摄取了不含抑制素的纳米粒子的脂肪源性干细胞、或者摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经同工凝集素b4或抗smα肌动蛋白抗体(anti-smαactinantibody)进行免疫染色所得结果的照片。
图11示出给予pbs、内含抑制素纳米粒子、摄取了不含抑制素的纳米粒子的脂肪源性干细胞、或者摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经同工凝集素b4染色,测量血管密度所得的结果,(a)示出将切片染色后的显微镜照片,(b)是示出测出的血管密度的图表。
图12是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经同工凝集素b4和抗ki67抗体进行免疫染色所得结果的照片。
图13是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经抗smα-肌动蛋白抗体和抗ki67抗体进行免疫染色所得结果的照片。
图14是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞14日后,上述心肌梗死模型小鼠的心脏梗死部分的切片经抗wt1抗体和上述抗ki67抗体进行免疫染色所得结果的照片。
图15是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经抗gata4抗体和抗αmhc抗体进行免疫染色所得结果的照片。
图16是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经抗nkx2.5抗体和抗αmhc抗体进行免疫染色所得结果的照片。
图17是示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,心肌梗死模型小鼠的心脏梗死部分的切片经抗ctn-1抗体或抗smα肌动蛋白抗体、以及抗人线粒体抗体(anti-humanmitochondriaantibody)进行免疫染色所得结果的照片。
图18是示出对从tie2/lacz转基因小鼠接受骨髓移植的心肌梗死小鼠给予摄取了内含抑制素纳米粒子的脂肪源性干细胞之后,该心肌梗死模型小鼠的心脏梗死部分的切片经抗ctn-1抗体、抗smα肌动蛋白抗体或同工凝集素b4、以及抗β-gal(β-半乳糖苷酶)抗体进行免疫染色所得结果的照片。
具体实施方式
以下,根据附图对本发明的实施方式进行说明。以下的优选实施方式的说明本质上仅是示例,并不意图限制本发明、本发明的适用方法、或者本发明的用途。
本发明涉及的内含抑制素纳米粒子制剂中所用的内含抑制素纳米粒子,是将抑制素包覆在含有聚乳酸-羟基乙酸共聚物的纳米粒子内而成的内含抑制素纳米粒子,用于增强干细胞的功能。本发明涉及的内含抑制素纳米粒子制剂除了上述内含抑制素纳米粒子以外,还可包含稳定剂、保存剂、缓冲剂、ph调整剂、赋形剂等常用于制剂的添加剂。
本发明中,抑制素包括所有3-羟基-3-甲戊二酸单酰辅酶a(hmg-coa)还原酶抑制剂类化合物,例如可列举出:辛伐他汀、瑞舒伐他汀、匹伐他汀、阿托伐他汀、西立伐他汀、氟伐他汀、普伐他汀、洛伐他汀、以及美伐他汀等。如上所述,已知抑制素具有降低胆固醇的作用,而除此之外通过大规模临床试验明确了抑制素可使心血管事件的发生及发展风险降低。另外,对于来源于血管内皮细胞或骨髓的血管内皮祖细胞介导的血管生成促进作用也多有报道。
本发明中,纳米粒子只要是可包覆抑制素的生物吸收性聚合物则其材料没有限定,优选使用含有聚乳酸聚合物(polylacticacid:pla)或聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid):plga)的纳米粒子。pla在体内水解而分解成乳酸,plga在体内水解而分解成乳酸和乙二醇,最终分别成为水和二氧化碳,因此对体内无害而优选。
本发明中,从干细胞的摄取效率的观点出发,内含抑制素纳米粒子的制备方法只要是能够将其加工成用光散射法测定时粒径小于1000nm、优选为约100nm~400nm、更优选为200nm~400nm的纳米粒子的方法,则可以采用任意方法进行制备,优选采用球晶制粒技术(sphericalcrystallizationtechnique)制备。球晶制粒技术作为可以通过对化合物合成的最终工序中结晶的生成、生长过程进行控制来设计球状晶粒,从而直接控制其物性进行加工的方法而广为人知。公知的乳化溶剂扩散法(esd法)为该球晶制粒技术中的一种。
乳化溶剂扩散法使用可将用于包覆抑制素的上述pla或plga等生物吸收性聚合物溶解的良溶剂、以及不能溶解该聚合物的不良溶剂这两种有机溶剂来进行。首先,将pla或plga等聚合物溶解于良溶剂中,向良溶剂中添加抑制素溶液而不让该聚合物析出,进行混合。若将所得混合液滴入搅拌下的不良溶剂中,则良溶剂与不良溶剂急速地相互扩散,因此有机溶剂相与水相的界面紊乱,良溶剂自乳化,形成亚微米尺寸的乳液滴。然后,良溶剂和不良溶剂的相互扩散进一步发展,乳液滴内的pla或plga等聚合物以及抑制素的溶解度下降,其结果,生成内含抑制素的球形晶粒聚合物纳米粒子。
本发明中,干细胞是具有全能性、多潜能性(multipotency)或多能性(pluripotency)的细胞,例如可列举出胚胎干细胞(es细胞)、诱导多能干细胞(ips细胞)和间充质干细胞等成体干细胞。本发明中,从更简便且大量地获得很多干细胞的观点出发,优选使用从骨髓组织、脂肪组织等得到的间充质干细胞。其中,特别优选使用脂肪源性干细胞。已知脂肪源性干细胞已在临床进行细胞单独给药,分化成脂肪、骨、肝脏、心脏等。脂肪源性干细胞可从脂肪组织中获得,该脂肪组织可使用吸脂等微创技术从皮下脂肪等而容易地获得。脂肪源性干细胞可以通过使用celution系统(cytoritherapeutics,inc.制、)等从上述所得的脂肪组织中提取和分离而大量采集。因此,用作本发明涉及的干细胞极为有利。
本发明涉及的内含抑制素纳米粒子对干细胞的处理可通过例如添加到培养有该干细胞的培养基中而进行。由此,干细胞通过吞噬作用而将内含抑制素纳米粒子摄入细胞内,因此无需使用特别的试剂等即可简便地使干细胞中含有内含抑制素纳米粒子。
经本发明涉及的内含抑制素纳米粒子处理后的干细胞,迁移能力、增殖能力和血管生成因子产生能力特别增强,从而对心肌梗死等缺血性心脏病的治疗效果特别增强。具体而言,如果对缺血性心脏病患者静脉给予经本发明涉及的内含抑制素纳米粒子处理后的上述脂肪源性干细胞,则由于迁移性和增殖性增强,脂肪源性干细胞通过血流及其迁移性而到达心脏,在缺血性损伤心肌部分集聚并增殖,分化成心血管系统细胞。另外,所集聚的包含内含抑制素纳米粒子的脂肪源性干细胞可促进血管生成因子的产生和释放,从而通过大量血管生成因子促进心肌组织的再生。
另外,如上所述,脂肪源性干细胞通过在细胞内对所摄取的内含抑制素纳米粒子进行水解,将其所包覆的抑制素缓慢释放,因此对体内给予脂肪源性干细胞的情况下,给药后在缺血性损伤心肌缓释出抑制素,通过释放出的抑制素促进骨髓干细胞、骨髓源性血管内皮祖细胞(epc:endothelialprogenitorcell)的集聚,也促进骨髓干细胞向心血管系统细胞的分化,从而促进组织的再生。已知epc是存在于骨髓内的血细胞类造血干细胞中的一个细胞分离部分(fraction),而且虽然数量少但也存在于末梢循环血液中,集聚于缺血组织而分化成构成毛细血管的内皮细胞,对新生血管的形成也起作用,作为缺血性疾病中用于血管生成的细胞治疗资源还广泛进行了临床试验。进而,还报道了epc不但会分化成血管内皮细胞,还会分化成心肌细胞。本发明涉及的含有内含抑制素纳米粒子的干细胞,可将具有上述功能的epc集聚于缺血性损伤心肌部分,因此对其治疗极为有利。进而,通过本发明涉及的含有内含抑制素纳米粒子的干细胞的给药,存在于心外膜附近的细胞在心肌梗死部分一边分裂增殖一边生成肉芽,从而促进心肌的再生。其结果,有利于心肌梗死的治疗。应予说明,本发明涉及的含有内含抑制素纳米粒子的干细胞不但能够治疗缺血性心脏病,在干细胞可分化的心脏以外的其他脏器的损伤中,也可获得抑制素的效果、以及干细胞和epc的再生功能所产生的治疗效果。
[实施例]
以下,示出为了对本发明涉及的用于增强干细胞功能的内含抑制素纳米粒子制剂、以及含有该纳米粒子制剂的功能增强干细胞及其制备方法进行详细说明的实施例。
首先,对内含抑制素纳米粒子的制备方法进行说明。此处,特别使用辛伐他汀作为抑制素,使用含有聚乳酸聚合物(pla)的纳米粒子作为纳米粒子。
将pla(wakopurechemicalindustriesltd.,pla0020,重均分子量20000)50mg和辛伐他汀2.5mg溶解于丙酮2ml、乙醇0.5ml的混合溶解中,制成聚合物溶液。将该聚合物溶液滴入室温下、以500rpm搅拌的2wt%pva溶液10ml中,得到内含辛伐他汀的pla纳米粒子悬浮液。接着,在室温下、一边以500rpm继续搅拌一边蒸馏除去有机溶剂(丙酮、乙醇)。经过约5小时将溶剂蒸馏除去后,将悬浮液在4℃下、以60000g离心分离30分钟,将沉淀物回收并再悬浮于蒸馏水中。该离心分离和再悬浮于蒸馏水中的操作共进行3次。然后,将悬浮液冷冻干燥一夜,得到内含辛伐他汀的pla纳米粒子。1mg纳米粒子中包覆有24.94μg辛伐他汀。以下试验中,使用该内含辛伐他汀的pla纳米粒子。
接着,为了讨论用如上所得的内含抑制素纳米粒子对干细胞进行处理时的最适处理浓度,进行以下试验。
为了进行该试验,首先,采用利用胶原酶处理和离心比重法的公知方法,从人脂肪组织获得人脂肪源性干细胞(adiposederivedstemcell:adsc)。该方法详细说明如下。首先,配制含有dnasei(0.1mg/ml,roche,1284932)和3mmcacl2的胶原酶1型(1mg/ml,wako035-17604)/1%bsahbss溶液作为胶原酶溶液。然后,用手术刀将人脂肪组织(约1g~2g)切碎,与约3倍于其组织体积的上述胶原酶溶液一起加入15ml试管中,37℃下振荡培养60分钟。然后,向培养后的15ml试管内加入室温的5mmedta/pbs(将edta(0.5medta,ph8.0,lifetechnologies,am9260g),10xdpbs,ca(-),mg(-)(gibco,14200-166)稀释而制成),取约15ml的细胞悬浮液进行300g×5min的离心后,吸去上清(包含脂肪层),添加5mmedta/pbs至20ml。将所得的细胞悬浮液一边过细胞筛(70μm,bd)一边回收到新的50ml试管中。向两根15ml试管中加入室温的histopaque10774ml,每个试管中平稳地加入10ml上述回收的细胞溶液,使该细胞溶液分层而不混合。将两根试管在室温下以800g×20min(无间歇(breakless))进行离心,离心后用带有18g针的2.5ml注射器仅将单核细胞层回收,移入新的15ml试管中,添加冷却的5mmedta/pbs至14ml。然后,以200g×10min进行离心(有间歇(withabreak)),弃去上清。然后,用1ml冷却的5mmedta/pbs将细胞悬浮,定容至14ml后,以200g×10min进行离心,弃去上清。将所得的细胞团块(cellpellet)用初代培养用培养基(10%fbs/dmemf12,sigmad8042+antibiotic-antimycotic,gibco15240-062)悬浮后以约3×104/cm2~4×104/cm2的细胞密度接种于培养皿中。然后,用5%co2培养箱培养4~5日,将粘附细胞作为人细胞源性干细胞用于实验中。
如此得到人细胞源性干细胞后,采用上述乳化溶剂扩散法,通过代替抑制素而将罗丹明红荧光染料包覆在pla纳米粒子中,得到内含罗丹明红荧光染料的pla纳米粒子。将所得的内含罗丹明红荧光染料的pla纳米粒子添加到上述脂肪源性干细胞的培养基中,使该pla纳米粒子的终浓度达到20μg/ml、50μg/ml、80μg/ml或100μg/ml。1小时后(1h)或2小时后(2h),使用激光共聚焦荧光显微镜,对内含罗丹明红荧光染料的pla纳米粒子的摄取进行观察。应予说明,核的染色使用dapi按照常法进行。其结果示于图1。
如图1所示,可知内含罗丹明红荧光染料的pla纳米粒子在所有浓度下均能被脂肪源性干细胞摄取。但是,脂肪源性干细胞对内含罗丹明红荧光染料的pla纳米粒子的摄取量呈处理浓度依赖性增大。而且还可知,与处理时间为1小时的情况相比,在处理时间为2小时的情况下脂肪源性干细胞对内含辛伐他汀的pla纳米粒子的摄取量较多。特别确认了,在以100μg/ml的浓度用内含罗丹明红荧光染料的pla纳米粒子对脂肪源性干细胞进行处理的情况下,干细胞摄取了大量内含罗丹明红荧光染料的pla纳米粒子。
接着,为了讨论摄取了内含辛伐他汀的pla纳米粒子的脂肪源性干细胞在此后要花费多长时间从细胞内释放出抑制素,对释放到培养基中的抑制素的量进行测定。此处,与上述试验相同,以100μg/ml的浓度用内含辛伐他汀的pla纳米粒子对脂肪源性干细胞进行1小时处理后,更换培养基,测定从更换培养基起6小时后、18小时后、以及24小时、48小时、72小时、120小时、168小时和336小时后释放到培养基中的辛伐他汀的量。具体而言,该测定采用hplc(high-pressureliquidchromatography)法进行。其测定结果示于图2。
如图2所示,自测定开始24小时后从脂肪源性干细胞中释放出约60%左右的抑制素,释放出所有抑制素需要花费约336小时的时间。从此结果可知,被脂肪源性干细胞摄取的抑制素不是从脂肪源性干细胞中急速释放,而是缓慢释放。因此,脂肪源性干细胞在到达缺血心肌之前不会将大部分的抑制素释放,而是能够在到达患部之后经过长时间释放出抑制素,因此可期待良好的治疗效果。
接着,为了讨论由上述内含辛伐他汀的纳米粒子引起的脂肪源性干细胞的迁移能力、增殖能力和血管生成因子产生能力这些功能的增强,进行以下试验。
首先,使用迁移性试验试剂盒(transwell(注册商标))对脂肪源性干细胞的迁移能力进行讨论。具体而言,在transwell板(transwellplate)各孔的多孔膜上以5×104细胞/孔(cells/well)接种脂肪源性干细胞,向培养基中添加不含抑制素的pla纳米粒子使其浓度达到20μg/ml,或者添加内含辛伐他汀的pla纳米粒子使其浓度达到20μg/ml、50μg/ml和100μg/ml,16~18小时后对通过transwell的膜的细胞数进行计数。其结果示于图3(a)。
如图3(a)所示,在用20μg/ml不含抑制素的pla纳米粒子进行处理的情况(pla20)、以及用20μg/ml内含辛伐他汀的pla纳米粒子进行处理的情况(pla-st20)下,与未处理的对照组(control)相比,脂肪源性干细胞的迁移性无变化,而在用50μg/ml内含辛伐他汀的pla纳米粒子进行处理的情况(statin50)下,脂肪源性干细胞的迁移性增大。另外,在用100μg/ml内含辛伐他汀的pla纳米粒子进行处理的情况(statin100)下,结果导致脂肪源性干细胞的迁移性降低。此结果表明,虽然为最适处理浓度,但内含辛伐他汀的pla纳米粒子可使脂肪源性干细胞的迁移能力亢进。
接着,使用mtt比色(mttassay)讨论内含辛伐他汀的纳米粒子对脂肪源性干细胞增殖性的提高,对其结果进行说明。
首先,将脂肪源性干细胞以5000细胞/孔的细胞数接种在96孔板中,添加内含辛伐他汀的pla纳米粒子使其浓度达到20μg/ml、50μg/ml或100μg/ml,48小时后更换培养基,向各孔中添加mtt溶液,2小时后使用分光光度计测定450nm的吸光度。其结果示于图3(b)。
如图3(b)所示,在用内含辛伐他汀的纳米粒子以20μg/ml(statin20)、50μg/ml(statin50)和100μg/ml(statin100)的浓度进行处理的情况下,与未处理的对照组(control)相比,均出现脂肪源性干细胞的增殖,特别在以50μg/ml的浓度进行处理的情况下,与对照组相比,可见增殖性的显著增加。此结果表明,通过内含辛伐他汀的pla纳米粒子,能够使脂肪源性干细胞的增殖能力亢进。
接着,为了讨论内含辛伐他汀的纳米粒子对脂肪源性干细胞的血管生成因子产生能力的效果,使用定量pcr法对脂肪源性干细胞内的血管生成因子的mrna表达量进行解析。此处,作为血管生成因子测定vegf-a、vegf-c和fgf-2的细胞内mrna表达量。
首先,向培养有脂肪源性干细胞的培养基中添加内含辛伐他汀的pla纳米粒子使其浓度达到20μg/ml、50μg/ml或100μg/ml,24小时后将以各浓度进行处理的细胞回收,使用nucleospinrna试剂盒(takarabioinc.)提取这些细胞的rna。然后,使用与vegf-a、vegf-c和fgf-2的dna序列相关的引物,通过定量pcr法对各细胞内vegf-a、vegf-c和fgf-2的mrna表达量进行测定。测定如下进行:使用revertraaceqpcrrt试剂盒(toyobo)提取rna,由提取出的rna合成cdna,将所合成的cdna与ssofastevagreenmastermix试剂(bio-rad)和引物(vegf-a:f-ttactctcacctgcttct,r-ctgcttcttccaacaatg,vegf-c:f-tcaaggacagaagagacta,r-ccacatctatacacacctc,fgf-2:f-ttcttccaatgtctgctaa,r-gaccaattatccaaactgag)一起用热循环仪(cfxconnectbio-rad)进行反应(95℃30秒进行1循环、95℃5秒/56℃5秒进行40循环)。
其测定结果示于图4。应予说明,结果示出以gapdh的mrna表达量为基准的上述各因子的表达量的比率(上述各因子的表达量/gapdh的mrna表达量)。
如图4(a)所示,在以20μg/ml(statin20)、50μg/ml(statin50)和100μg/ml(statin100)的任意浓度用内含辛伐他汀的纳米粒子进行处理的情况下,vegf-a的mrna表达量与未处理的对照组(control)相比增大,特别在以100μg/ml的浓度用内含辛伐他汀的纳米粒子进行处理时呈现显著增大。
另外,如图4(b)所示,在以20μg/ml(statin20)、50μg/ml(statin50)和100μg/ml(statin100)的任意浓度用内含辛伐他汀的纳米粒子进行处理的情况下,vegf-c的mrna表达量与未处理的对照组(control)相比也增大,特别在以50μg/ml或100μg/ml的浓度用内含辛伐他汀的纳米粒子进行处理时呈现显著增大。
同样地,如图4(c)所示,在以20μg/ml(statin20)、50μg/ml(statin50)和100μg/ml(statin100)的任意浓度用内含辛伐他汀的纳米粒子进行处理的情况下,fgf-2的mrna表达量与未处理的对照组(control)相比也增大,特别在以50μg/ml或100μg/ml的浓度用内含辛伐他汀的纳米粒子进行处理时呈现显著增大。以上结果表明,通过内含辛伐他汀的pla纳米粒子使脂肪源性干细胞的血管生成因子产生能力亢进。
如上所述,由内含抑制素纳米粒子引起的脂肪源性干细胞的迁移能力、增殖能力和血管生成因子产生能力这些功能的增强的讨论结果为,通过内含抑制素纳米粒子可增强脂肪源性干细胞的功能。这些功能是在脂肪源性干细胞在生物体内给药后集聚于缺血心肌部分,有利于该部分的再生的功能,通过使这些功能增强,脂肪源性干细胞对心肌梗死等缺血性心脏病的治疗极为有利。
接着,使用心肌梗死模型小鼠,对本发明涉及的内含抑制素纳米粒子以及含有该纳米粒子的干细胞的心肌梗死治疗效果进行讨论。
首先,对12周龄雄balb/c裸鼠进行缺血诱发(冠状动脉前降支结扎模型),同时进行心脏超声图像诊断(第0日),3日后(第3日),尾静胍给予pbs(磷酸缓冲生理盐水)、如上所述分别得到的摄取了不含抑制素pla纳米粒子的脂肪源性干细胞、摄取了内含抑制素pla纳米粒子的脂肪源性干细胞、或者内含抑制素pla纳米粒子。应予说明,作为摄取了内含抑制素pla纳米粒子的脂肪源性干细胞,使用以100μg/ml的浓度用内含抑制素纳米粒子对脂肪源性干细胞进行1小时处理所得的干细胞。脂肪源性干细胞的给药量为1×104细胞/小鼠,内含抑制素pla纳米粒子的给药量为50μg/小鼠。另外,在同一日(第3日)内还进行心脏超声图像诊断。经过11日后(第14日),再次进行心脏超声图像诊断。经过14日后(第28日),再次进行心脏超声图像诊断,然后解剖进行心脏的组织学解析。在心脏超声图像诊断中,测定左室射血分数(ef)、左室缩短分数(fs)、左室舒张末期内径(lvdd)和左室收缩末期内径(lvds)。作为组织学解析,对毛细血管密度、纤维化面积率、脂肪源性干细胞的存活率(takingrate)和脂肪源性干细胞的分化频率进行解析。心脏超声图像诊断的结果示于图5,第28日从上述小鼠中摘出的心脏示于图6,组织学解析的结果示于图7、图8、图10~17。另外,从给予上述摄取了内含抑制素pla纳米粒子的脂肪源性干细胞后第60日的小鼠中摘出的心脏、及其不同部分的切片示于图9。
如图5(a)和(b)所示,第3日在所有组中ef和fs降低,心脏功能恶化,然后在第14日和第28日,未处理的对照组(pbs:●)中未见改善,但在摄取了不含抑制素pla纳米粒子的脂肪源性干细胞的给药组(pla+adsc:▲)、以及内含抑制素pla纳米粒子的给药组(statin/pla:
另外,如图6所述,从外观也可确认,摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(右侧的照片)与对照组(左侧的照片)相比,心脏的扩大受到抑制。
另外,按照常法制作各组摘出心脏中梗死部分的切片,进行马松三色染色,对心肌壁切面面积进行评价,结果示于图7。图7(a)表示染色后切片的照片,箭头表示纤维化而染成蓝色的瘢痕部分。图7(b)表示以整周长度为100%时染成蓝色的纤维化部分的长度(图7(a)箭头方向的长度)所占的比例,图7(c)表示以正常心肌壁厚为100%时染成蓝色的纤维化部分的心肌壁厚所占的比例。
如图7(a)和(b)所示,与未处理的对照组(control)、摄取了不含抑制素pla纳米粒子的脂肪源性干细胞的给药组(pla+adsc)、以及内含抑制素pla纳米粒子的给药组(stain/pla)相比,在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(adsc+statin/pla)中,纤维化而染成蓝色的瘢痕部分的长度较短。进而,如图7(a)和(c)所示,摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组与其他组相比,心肌壁厚也较厚,意味着促进了心肌部分的再生。
图8示出各组切片中纤维化部分的放大照片。如图8所示,对照组(control)中呈现出几乎全染成蓝色的平滑外观,另外,摄取了不含抑制素pla纳米粒子的脂肪源性干细胞的给药组(pla+adsc)、以及内含抑制素pla纳米粒子的给药组(statin/pla)虽然微有染成红色的部分,但与对照组相比未见大差异。另一方面,摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(adsc+statin/pla)中,纤维化的心肌壁向外侧膨出,出现染成红色的部分。该部分在其他组中未见,推测该部分处于通过摄取了内含抑制素纳米粒子的脂肪源性干细胞而再生为新心肌的过程中。
另外,图6~8中示出给予摄取了内含抑制素纳米粒子的脂肪源性干细胞28日后小鼠的心脏,为了确认此后是否有进一步的治疗效果,对给予摄取了内含抑制素纳米粒子的脂肪源性干细胞60日后小鼠心脏的外观进行观察,并对该心脏不同部分的切片进行上述同样的染色、观察。其结果示于图9。应予说明,图9(a)是示出该小鼠的心脏的照片,图9(b)~图9(e)是沿图9(a)所示的(b)~(e)各线切出的切片经马松三色染色所得结果的照片。应予说明,图9(b)的曲线箭头表示通过上述染色而染成蓝色的区域。
如图9(a)所示,给予摄取了内含抑制素纳米粒子的脂肪源性干细胞60日后,在28日后出现的梗死(纤维化)部分有进一步缩小的趋势。另外,如图9(b)~(e)所示,梗死部分的各切片中心肌壁增厚,另外,除了图9(b)所示的结扎部分以外大部分染成红色,因此可判断为促进了心肌部分的再生。此结果表明,给予摄取了内含抑制素纳米粒子的脂肪源性干细胞60日后,可见功能性心肌的再生治疗效果。
接着,为了对梗死部分的心肌组织内的血管生成进行讨论,使用与在血管内皮细胞中表达的糖蛋白、以及在血管平滑肌细胞中表达的蛋白分别结合的抗体等对上述切片进行免疫染色,结果示于图10。具体而言,使用与在血管内皮细胞中表达的糖蛋白结合的植物源性蛋白即fitc(fluoresceinisothiocyanate)标记的同工凝集素b4、以及与在血管平滑肌细胞中表达的蛋白即smα肌动蛋白结合的兔源性igg抗体作为上述抗体等,使用alexa488-羊源性抗兔igg抗体作为兔源性igg的二次抗体,进行染色。
如图10所示,在对照组(control(pbs))中,使用fitc-同工凝集素b4(isolectinb4)、以及抗smα肌动蛋白抗体(smα-actin)时均几乎未见染色,即几乎未检测出血管内皮细胞和血管平滑肌细胞,可判断为血管几乎不存在。另外,在内含抑制素纳米粒子的给药组(statin/plga)中,也几乎未检测出血管内皮细胞和血管平滑肌细胞,在摄取了不含抑制素纳米粒子的脂肪源性干细胞的给药组(pla-adsc)中,略微检测出血管内皮细胞和血管平滑肌细胞。于之相对,在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(statinpla-adsc)中,非常多的区域内可见染色,可判断是由血管生成所引起的。即,通过给予摄取了内含抑制素纳米粒子的脂肪源性干细胞,可促进心肌内血管组织的再生。
接着,对缺血边界区域内的血管密度进行讨论。具体而言,对于各组的纤维化部分,与上述解析同样用fitc-同工凝集素b4进行荧光染色,测定显微镜视野内染色区域的大小。另外,将该测定结果以血管密度制成图表。其结果示于图11。
如图11(a)和(b)所示,与对照组(control(pbs))相比,在摄取了不含抑制素pla纳米粒子的脂肪源性干细胞的给药组(pla+adsc)、以及内含抑制素pla纳米粒子的给药组(statin/pla)中,血管密度略有增大,另外与这些给药组相比,在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(stain/pla+adsc)中,可进一步确认血管密度增大。由其结果也可判断出,通过给予摄取了内含抑制素纳米粒子的脂肪源性干细胞,在梗死周围部分(缺血部分)促进了血管生成而有助于心肌组织再生。
接着,为了讨论缺血心肌组织的细胞增殖活性,使用与细胞增殖期内表达的ki67蛋白结合的抗体,对上述切片进行免疫染色,结果示于图12。具体而言,对于照组和摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组的纤维化部分,使用fitc-同工凝集素b4、兔源性抗ki67抗体、以及作为二次抗体的alexa594-羊源性抗兔igg抗体,对血管内皮细胞和增殖期的细胞进行免疫染色。
如图12所示,在未处理的对照组(control)中,无论使用何种抗体均未见染色,但在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(stain+adsc)中,不但与上述试验同样被fitc-同工凝集素b4染色,而且还出现被抗ki67抗体染色。此结果意味着,通过给予摄取了内含抑制素纳米粒子的脂肪源性干细胞,可促进缺血心肌组织的细胞增殖活性。另外,同工凝集素b4的染色部分与ki67的染色部分不同,所增殖的细胞与形成毛细血管的血管内皮细胞不同(间质的成纤维细胞等)。
另外,图13示出使用抗smα-肌动蛋白抗体和抗ki67抗体,与上述同样对切片进行免疫染色所得的结果。如图13所示,在此情况下,对照组(control)中无论使用何种抗体均几乎未见染色。另一方面,在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(statin+adsc)中,不但与上述试验同样被抗smα-肌动蛋白抗体染色,而且还出现被抗ki67抗体染色。另外,抗smα-肌动蛋白抗体的染色部分与抗ki67抗体的染色部分不同,所增殖的细胞与平滑肌细胞不同(间质的成纤维细胞等)。
另外,图14示出使用对心外膜细胞所具有的wt1蛋白进行染色的抗wt1抗体和上述抗ki67抗体,与上述同样对给予摄取了内含抑制素纳米粒子的脂肪源性干细胞14日后上述心肌梗死模型小鼠的心脏梗死部分的切片进行免疫染色所得的结果。如图14所示,心肌梗死部分中多见被抗wt抗体染色的心外膜细胞,另外,其最外部多见被抗wt1抗体和抗ki67抗体共同染色的增殖期细胞(箭头部分)。此结果意味着,在梗死部分,心外膜细胞一边向外侧增殖分裂一边生成肉芽,从而使心肌壁再次增厚而再生。因此,可推测出即使在例如从心肌梗死发病起经过1个月以上,梗死部分大多处于瘢痕状态的情况下,通过给予本发明所述的摄取了内含抑制素纳米粒子的脂肪源性干细胞,可使残留在瘢痕部分的心外膜细胞增殖,促进心肌的再生,从而治疗心肌梗死。
接着,为了讨论摄取了内含抑制素纳米粒子的脂肪源性干细胞对心肌的再生,使用与在心肌细胞中表达的蛋白结合的抗体进行免疫染色,结果示于图15。此处,作为与在心肌细胞中表达的蛋白结合的抗体,使用与也在未成熟心肌细胞中表达的gata4结合的兔源性igg抗体、作为二次抗体的alexa488羊源性抗兔igg抗体、与不在未成熟心肌细胞中表达而仅在成熟心肌细胞中表达的αmhc结合的小鼠源性igg抗体、以及作为二次抗体的alexa594羊源性抗小鼠igg抗体。
如图15所示,对上述gata4进行免疫染色的结果,在未处理的对照组(control)中几乎未被染色,而在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(statin+adsc)中检测出很多染色区域。另一方面,对上述αmhc进行免疫染色的结果为,在对照组几乎未见染色,而在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组中微有染色,但与抗gata4抗体的染色结果相比染色区域明显较少。
图16示出使用与gata4同样在未成熟心肌细胞中表达的nkx2.5的兔源性igg抗体、作为二次抗体的alexa488羊源性抗兔igg抗体、以及上述αmhc的抗体,与上述同样进行免疫染色的结果。如图16所示,与图15的结果相同,使用在未成熟心肌细胞中表达的nkx2.5进行免疫染色的结果为,在对照组(control)中几乎未见染色,而在摄取了内含抑制素纳米粒子的脂肪源性干细胞的给药组(statin+adsc)中检测出很多染色区域。
图15和图16所示的结果表明,给予摄取了内含抑制素纳米粒子的脂肪源性干细胞时,缺血心肌组织中出现未成熟心肌细胞。即,意味着通过摄取了内含抑制素纳米粒子的脂肪源性干细胞促进了心肌组织的再生。
在以上实验中,如上所述示出了以1×104细胞/小鼠对心肌梗死模型小鼠给予摄取了内含抑制素纳米粒子的脂肪源性干细胞时的结果,接着,对以5×104细胞/小鼠的量给药时心肌组织的再生进行讨论。为此,对与上述同样制成的心肌梗死模型小鼠进行缺血处理3日后,以5×104细胞/小鼠尾静胍给予摄取了内含抑制素纳米粒子的脂肪源性干细胞,25日后与上述同样进行解剖,制成心肌梗死部分的切片。使用与在心肌骨格肌细胞中表达的ctn-1(心肌型肌钙蛋白)结合的兔源性igg抗体和作为二次抗体的alexa488羊源性抗兔igg抗体、或者在平滑肌细胞中表达的与上述相同的抗smα肌动蛋白抗体、以及与人线粒体(hmtcd)结合的兔源性igg抗体和作为二次抗体的alexa594羊源性抗兔igg抗体,对该切片进行免疫染色。其结果示于图17。
如图17所示,在心肌梗死模型小鼠中,以5×104细胞/小鼠给予摄取了内含抑制素纳米粒子的脂肪源性干细胞时,在心肌组织的纤维化部分可见抗ctn-1抗体的染色(箭头部分),确认了心肌细胞的表达。另外,还可见hmtcd抗体的染色(箭头部分),即表明给予的人脂肪组织源性干细胞残留在心肌组织内。另外,将这些图像重合时,出现染色区域重叠的部分(箭头部分)。因此,意味着给予的人脂肪源性干细胞分化成心肌。应予说明,虽然也被smα肌动蛋白抗体染色,但该染色区域与hmtcd抗体的染色区域几乎不重叠。
以上结果意味着,以5×104细胞/小鼠的容量给予摄取了内含抑制素纳米粒子的脂肪源性干细胞时,在缺血心肌组织内发生给药细胞的集聚和残存,进而特别发生该细胞向心肌细胞的分化。
接着,对由摄取了内含抑制素纳米粒子的脂肪源性干细胞所释放出的抑制素而使骨髓源性血管内皮祖细胞(epc)向梗死部分集聚的效果进行讨论。如上所述,已知epc是存在于骨髓中的血细胞类造血干细胞中的一个细胞分离部分,可分化成构成毛细血管的内皮细胞、心肌细胞。另外,还已知epc是血管稳定化因子中的一种即血管生成素-1的受体,在被识别为内皮系细胞标记的tie2阳性细胞中含有大量epc。因此,将可通过基因重组利用β-gal(β-半乳糖苷酶)的免疫染色鉴定tie2阳性细胞的tie2/lacz转基因小鼠作为供体,从其骨髓中提取骨髓单核细胞。
tie2/lacz转基因小鼠可采用常法制作,具体而言可通过以下方式制作:将lacz基因结合在小鼠tie2启动子/增强子的内部,制成重组基因载体,然后从在细菌内扩增的上述重组基因载体中分离、纯化出小鼠tie2/lacz基因表达载体,将该小鼠tie2/lacz基因表达载体微注射到小鼠受精卵中。另外,骨髓单核细胞的提取如下进行。首先,小鼠处死后将股骨、胫骨、脊骨、髂骨分离,切碎后放入乳钵中,加入室温的5mmedta/pbs20ml,用研杵敲击(tapping)骨片制成细胞悬浮液。将该细胞悬浮液一边过细胞筛(40μm,bd)一边回收到新的50ml试管中,向两根15ml试管中加入室温的histopaque10834ml(sigma,10831),每个试管中平稳地加入10ml细胞溶液,使该细胞溶液分层而不混合。然后,将两根试管在室温下以800g×20min(无间歇)进行离心,离心后用带有18g针的2.5ml注射器仅将单核细胞层回收,移入新的15ml试管中,添加冷却的5mmedta/pbs至14ml。然后,以200g×10min进行离心(有间歇),弃去上清。之后,用1ml冷却的5mmedta/pbs将细胞悬浮,定容至14ml后,以200g×10min进行离心,弃去上清,制成骨髓单核细胞团块,用于以下所示的骨髓移植实验中。
作为骨髓移植如下进行:首先,对6~8周龄雄balb/c裸鼠照射x射线(以5gy照射2次),得到骨髓细胞完全破坏的小鼠作为受体小鼠,移植上述所得的供体小鼠的骨髓单核细胞。4周后,与上述试验同样对该受体小鼠进行缺血诱发(冠状动脉前降支结扎模型),该处理进行3日后,尾静胍给予内含抑制素pla纳米粒子。应予说明,脂肪源性干细胞的给药量为1×104细胞/小鼠。给药25日后进行解剖,按照常法制作心脏梗死部分的切片。然后,使用上述抗ctn-1抗体、抗smα肌动蛋白抗体或fitc-同工凝集素b4、以及兔源性igg的抗β-gal抗体和作为二次抗体的alexa594羊源性抗兔igg抗体,对该切片进行免疫染色。其结果示于图18。
如图18所示,使用抗ctn-1抗体、抗smα肌动蛋白抗体和fitc-同工凝集素b4时,与上述结果相同,在缺血心肌组织内心肌细胞和平滑肌细胞被染色。另外,使用β-gal抗体的时,也在缺血心肌组织内出现染色区域。即,可见来源于骨髓的epc集聚于缺血心肌组织。另外,将用抗ctn-1抗体或fitc-同工凝集素b4染色所得的图像与用抗β-gal抗体染色所得的图像重叠时,染色部分相互重叠(箭头部分),意味着从骨髓集聚的epc分化成心肌细胞。另一方面,将用smα肌动蛋白抗体染色所得的图像与用β-gal抗体染色所得的图像重叠时,染色部分几乎互不重叠。
该结果表明,对心肌梗死小鼠给予摄取了内含抑制素纳米粒子的脂肪源性干细胞时,通过集聚于缺血性损伤心肌部分的脂肪源性干细胞释放出抑制素,epc集聚到该缺血性损伤心肌部分,所集聚的epc促进血管生成,并且分化成心肌细胞促进缺血性损伤部分的治疗。
综上所述,本发明涉及的内含抑制素纳米粒子可增强干细胞的迁移性、增殖性和血管生成因子产生能力等功能,该功能增强干细胞集聚于梗死部分,在增殖的同时释放出血管生成因子,从而促进梗死部分的血管生成。进而,该集聚并增殖的干细胞分化成心肌,从而促进心肌的再生,其结果,显示出优异的心肌梗死等缺血性心脏病的治疗效果。另外,该干细胞能够将所摄取的抑制素缓慢释放,由此可得到抑制素本身的血管生成效果等抑制素所特有的各种效果,因此有益于以缺血性心脏病为代表的各种疾病的治疗。进而,通过从集聚于患部的干细胞释放出的抑制素,可使体内的干细胞、骨髓源性血管内皮祖细胞(epc)的集聚亢进,其结果,在例如缺血性心脏病的情况下,能够进一步促进梗死部分心肌的再生。另外,抑制素等化合物在单纯给药时,会随着血流被运送至患部,但在心肌梗死等缺血性心脏病中,血流受阻,难以正常到达患部,而本发明所述的抑制素被迁移性增强的干细胞摄取并运送,因此即便血流受阻也能到达患部,即可形成良好的药物传递系统,从而能够减少应给药的细胞数。通过上述作用,本发明对心肌梗死等缺血性心脏病的治疗可发挥极好的效果。
sequencelisting
<110>伊井正明,公益财团法人先端医疗振兴财团
<120>用于增强干细胞功能的内含抑制素纳米粒子制剂、以及含有其的功能增强干细胞及其制备方法
<130>cp00849pctcn
<140>jp2014-228409
<141>2014-11-10
<160>6
<170>patentinversion3.5
<210>1
<211>18
<212>dna
<213>人工序列
<220>
<223>vegf-a正向引物
<400>1
ttactctcacctgcttct18
<210>2
<211>18
<212>dna
<213>人工序列
<220>
<223>vegf-a反向引物
<400>2
ctgcttcttccaacaatg18
<210>3
<211>19
<212>dna
<213>人工序列
<220>
<223>vegf-c正向引物
<400>3
tcaaggacagaagagacta19
<210>4
<211>19
<212>dna
<213>人工序列
<220>
<223>vegf-c反向引物
<400>4
ccacatctatacacacctc19
<210>5
<211>19
<212>dna
<213>人工序列
<220>
<223>fgf-2正向引物
<400>5
ttcttccaatgtctgctaa19
<210>6
<211>20
<212>dna
<213>人工序列
<220>
<223>fgf-2反向引物
<400>6
gaccaattatccaaactgag20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种RNA抑制剂及其在肿瘤中的应用的制作方法与工艺
- 固氮鱼腥藻细胞受ALS抑制剂类除草剂损伤的修复方法与流程
- 一种修复细胞DNA损伤的抑制剂及其制作方法和应用与流程
- 一种修复细胞DNA损伤的抑制剂及其制作方法和应用与流程
- TLR3抑制剂在制备防治肿瘤转移产品中的应用的制作方法与工艺
- 一种提高酵母细胞对复合抑制剂耐受能力的方法与流程
- 免疫检查点抑制剂在中枢神经系统肿瘤中的用途的制造方法与工艺
- 作为MIDH1抑制剂用于治疗肿瘤的1‑环己基‑2‑苯基氨基苯并咪唑的制造方法与工艺
- 具有细胞渗透性的BCL‑XL抑制剂的抗体药物缀合物的制造方法与工艺
- 用于增强干细胞功能的内含抑制素纳米粒子制剂、以及含有其的功能增强干细胞及其制备方法与流程
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺