可吸收铁基合金植入医疗器械的制作方法
本发明涉及可吸收植入医疗器械领域,特别是涉及一种可吸收铁基合金植入医疗器械。
背景技术:
目前可吸收植入医疗器械基体应用最广泛的材料包括聚合物、镁基合金与铁基合金。聚合物中以聚乳酸应用最多,其优点为可完全降解吸收,降解产物为二氧化碳和水,其缺点是机械性能不足,相对金属基器械而言,若两者要满足相同的机械性能,聚合物基器械的尺寸需要比金属基器械大,这限制了聚合物基器械的应用。镁基合金和铁基合金的优点是易加工塑形,机械强度大,但镁基合金在人体内的腐蚀速度太快且伴随腐蚀会生成氢气,只能通过增大镁基合金器械的尺寸来满足植入早期的力学性能,同样会限制镁基合金器械的应用。
从临床应用的角度来说,当可吸收植入医疗器械完成了其预期用途,病变部位痊愈并恢复正常形态和功能(即痊愈)后,在不引起新的生物相容性问题的前提下,器械完全腐蚀或降解并被机体吸收的时间越短越好。根据临床上器械应用的部位不同,一般认为痊愈期为1-6个月,这段时间内器械需保持结构完整性和具有足够的力学性能。铁基合金的生物相容性良好,但铁基合金在体内腐蚀缓慢,导致铁基合金器械在痊愈期后仍需很长时间才能完全腐蚀,因此需加快其腐蚀速度以缩短铁基合金器械的腐蚀周期。
有研究表明在铁基合金表面涂覆可降解聚酯涂层,可提高铁基合金的腐蚀速度。该可降解聚酯涂层在体内的降解会使得器械植入位置附近的局部微环境的pH值下降,形成局部微酸性环境,铁基合金在此酸性环境中能更快地腐蚀,生成腐蚀产物铁盐和/或铁氧化物和/或铁氢氧化物。
对于预定规格的铁基合金器械,可降解聚酯涂层的用量、可降解聚酯种类和性质决定铁基合金的腐蚀速度以及最终是否可完全腐蚀。在选定可降解聚酯种类和性质并确定好足以使铁基合金基体完全腐蚀的可降解聚酯用量的情况 下,铁基合金腐蚀速度过快或局部腐蚀严重将会影响该铁基合金器械植入早期(1-6个月,即前文所述痊愈期)的结构完整性和力学性能,从而导致器械难以在植入早期满足临床应用的要求。这些缺陷具体表现在:(1)可降解聚酯涂层的降解产物呈酸性,且可降解聚酯往往有降解速度较快的小分子残留(如聚乳酸的单体残留标准为<2%),将导致铁基合金基体在植入早期腐蚀较快,比如植入冠脉后1-7天左右,腐蚀过快和腐蚀产物的积累导致器械内表面内皮化不完整,增加急性和亚急性血栓的风险;(2)可降解聚酯降解的不均匀性容易导致铁基合金基体的腐蚀不均匀,局部腐蚀过快有可能出现断裂,从而导致其难以满足早期结构完整性和力学性能的要求。虽可采用减少可降解聚酯涂层用量的方法来防止铁基合金器械植入早期过快腐蚀,但会延长铁基合金器械的腐蚀周期。因此,对于包括可降解聚酯的铁基合金器械,在可降解聚酯种类和性质、可降解聚酯与铁基合金的用量比确定的情况下,需探索在可降解聚酯形成的酸性环境中,如何降低铁基合金基体的早期腐蚀速度来保证器械植入早期的力学性能。
技术实现要素:
本发明的目的在于,提供可吸收铁基合金植入医疗器械,其在植入体内后1-6个月内腐蚀速度较慢甚或是完全不腐蚀,可在此段时间内满足临床上对器械植入早期的力学性能要求。
本技术方案提供的可吸收铁基合金植入医疗器械包括铁基合金基体和设于铁基合金基体表面的可降解聚合物,以及设于所述铁基合金基体表面的含锌保护体。
所述含锌保护体可以覆盖所述铁基合金基体的全部表面,也可以覆盖所述铁基合金基体的部分表面。当所述含锌保护体覆盖所述铁基合金基体的全部表面时,所述可降解聚合物覆盖所述含锌保护体的至少部分表面。当所述含锌保护体未覆盖所述铁基合金基体的全部表面时,会暴露出铁基合金基体的未覆盖区和对应的未覆盖区边缘线。所述未覆盖区内的任一点与所述边缘线在铁基合金基体表面的最短距离大于零且小于等于40毫米,所述含锌保护体的面积占比 ≥15%,或进一步地,所述面积占比≥50%,或更进一步地,所述面积占比≥90%。可以在选定前述3个含锌保护体的面积占比中的任一个含锌保护体面积占比的情况下,继续调小所述最短距离。例如,所述最短距离可以调至≤5毫米,或进一步地,所述最短距离可以调至≤1毫米,或再进一步地,所述最短距离可以调至≤0.12毫米,或更进一步地,所述最短距离可以调至≤0.05毫米。当含锌保护体未完全覆盖铁基合金基体表面时,所述可降解聚合物可仅覆盖所述含锌保护体的至少部分表面,也可与所述含锌保护体相互错开地覆盖所述铁基合金基体的不同表面,还可既覆盖所述含锌保护体的至少部分表面,又同时覆盖至少部分所述未覆盖区。
所述含锌保护体选自锌和/或锌合金,即选自锌、锌合金或两者的混合物。该含锌保护体还可选自锌和/或锌合金与可降解粘结剂的混合物,即锌与可降解粘结剂的混合物,或锌合金与可降解粘结剂的混合物,或锌与锌合金和可降解粘结剂的混合物。当含锌保护体包括可降解粘结剂时,锌和/或锌合金的重量百分比大于或等于20%且小于100%。
所述含锌保护体可与铁基合金基体电接触,即直接与铁基合金基体的表面接触,例如以含锌层的形式直接覆盖在铁基合金基体表面,或以块状或粒状镶嵌在铁基合金基体中。含锌保护体也可与铁基合金基体相互绝缘,此时本发明提供的器械还可包括设于所述铁基合金基体表面和铁基合金基体之间的绝缘层。
所述铁基合金基体可选自纯铁或碳含量不高于2.11wt.%的铁基合金,例如纯铁经渗氮和/或渗碳后的产物。
所述可降解聚合物降解后形成酸性环境,其内可混有活性药物,也可不混有活性药物。所述活性药物包括抗致敏的药物。所述抗过敏药物选自抗组胺类抗过敏药物、抗白三烯药物、肥大细胞膜稳定剂、糖皮质激素类抗过敏药物或调节免疫类抗过敏药物中的至少一种。例如,所述抗过敏药物可以选自氯苯吡胺、苯海拉明、盐酸异丙嗪、西替利嗪、氯雷他定、咪唑斯汀、依巴斯汀、阿司咪唑、特非那定、地氯雷他定、非索非那定、赛庚啶、酮替芬、左旋西替利嗪、氯苯甲嗪、乙氟利嗪、卡依巴斯丁、氮卓斯汀、去氯羟嗪、氯环利嗪、氨 来仙司、阿伐斯丁、阿扎他丁、甲喹吩嗪、左卡斯汀、赛他斯丁、斯喹那定、地普托品、苯噻啶、吡拉明、雷尼替丁、依美斯汀、依匹斯汀、异丙嗪、孟鲁司特、扎鲁司特、托卡司特、齐留通、氨来洛斯、伊布拉特、泊米司特、多塞平、维鲁司特、多西苯醌、色甘酸钠、色羟丙钠、尼多考米钠、曲尼司特、噻拉米特、瑞吡司特、丁氮菲酸、苯氮嘌呤酮、塔赞司特、奥萨格雷、瑞吡司特、地塞米松、甲基强的松龙、氢化可的松、曲安奈德、皮质类固醇、维他命C、钙剂、辅酶Q10或糜胰蛋白酶中的至少一种。
相比现有技术,本发明提供的可吸收铁基合金植入医疗器械包括含锌保护体。器械植入体内后,所述含锌保护体比铁基合金基体率先腐蚀并生成可防腐的物质避免铁基合金基体腐蚀,待所述含锌保护体腐蚀生成的防腐产物几乎完全被组织清除后铁基合金基体才开始快速腐蚀,由此确保了铁基合金体在植入早期满足临床上的力学性能要求。另外,本发明的可吸收铁基合金植入医疗器械具有更小的设计尺寸,植入后产生的腐蚀产物更少,完全吸收周期更短。
附图说明
图1是本发明一实施例提供的可吸收植入医疗器械沿其长度方向的剖面示意图,其中含锌保护体完全覆盖铁基合金基体的全部表面。
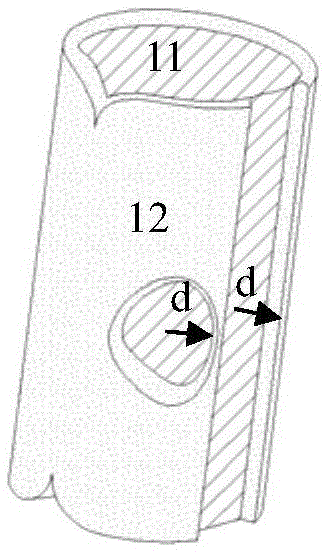
图2是本发明另一实施例提供的可吸收植入医疗器械除去可降解聚合物后的示意图,其中含锌保护体覆盖铁基合金基体的部分表面。
图3是图2所示可吸收植入医疗器械除去可降解聚合物后的外表面沿轴向剪开后展开的示意图。
图4是本发明再一实施例提供的可吸收植入医疗器械除去可降解聚合物后的示意图,其中含锌保护体沿铁基合金基体的厚度方向贯通所述基体。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的首选实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本 发明的公开内容更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本发明的可吸收植入医疗器械包括铁基合金基体和设于基体表面的含锌保护体,以及设于基体表面的可降解聚合物涂层。本发明的主要思想在于,在铁基合金基体表面增加含锌保护体,利用含锌保护体在可降解聚合物层形成的酸性环境中的率先腐蚀并生成具有防腐作用的磷酸锌来可控地延后铁基合金基体开始腐蚀的时间点,达成铁基合金基体在植入早期(1-6个月)不腐蚀而确保可吸收铁基合金植入器械早期的结构完整性和具有足够的力学性能,且不延长铁基合金基体的腐蚀周期。
由于含锌保护体可以延后铁基合金基体开始腐蚀的时间点,在含锌保护体的保护期内,铁基合金基体基本不腐蚀,其力学性能基本不会发生改变,故本发明的可吸收铁基合金植入医疗器械只需要保证植入前的初始力学性能达到临床上对植入早期的要求的下限即可,无需在超出痊愈期后仍具有较强的力学性能。因此,相对于现有技术,本发明的可吸收铁基合金植入医疗器械的设计尺寸更小,相应地减少了铁基合金的用量,进而减少了铁基合金的腐蚀产物。
请参见图1,本发明的可吸收铁基合金植入医疗器械包括铁基合金基体11、设置于所述铁基合金基体11上的含锌保护体12,和设于所述铁基合金基体11和含锌保护体12之上的可降解聚合物涂层13。所述含锌保护体12可以与铁基合金基体11电接触,也可以是相互绝缘,可以直接设于铁基合金基体11表面,也可以通过可降解绝缘层(图未示)与铁基合金基体11相互隔开。
所述的铁基合金基体11可以是纯铁或碳含量不高于2.11wt.%的铁基合金,例如纯铁经渗碳和/或渗氮后的产物。
所述的含锌保护体12的材质可以是纯锌和/或锌合金,也可以是锌和/或锌合金与可降解粘结剂的混合物。所述含锌和/或锌合金与所述粘结剂的混合物中,锌和/或锌合金的质量百分比大于或等于20%,但小于100%。所述粘结剂在器械植入体内后,可在短时间内降解或溶解而将锌和/或锌合金暴露出来。该粘结 剂可以是聚乙二醇、聚乙烯醇、淀粉、环糊精或水溶性无机盐。所述含锌保护体12可以通过电镀、喷射沉积法、气相沉积法(包括真空镀、溅射镀膜、离子镀膜、分子束外延镀膜和化学气相沉积)、化学镀、热镀、喷涂、浸涂、刷涂、静电纺丝、镶嵌等方法制备在铁基合金基体11上。可以理解的是,还可先在铁基合金基体11的表面采用前述方法制备额外的可降解绝缘层,例如卵磷脂或淀粉层,然后再将所述含锌保护体12制备在所述可降解绝缘层上,以使含锌保护体12与铁基合金基体11相互绝缘。可以理解的是,所述可降解绝缘层还可是本领域内常用的适用于植入体内的不导电性物质。
含锌保护体12与铁基合金基体11之间的位置关系有多种。作为一种实施方式,如图1所示,含锌保护体12完全直接覆盖铁基合金基体11的表面,可降解聚合物层也直接完全覆盖含锌保护体12。作为另一种实施方式,如图2和图3所示的器械除去可降解聚合物后的结构图,含锌保护体12覆盖铁基合金基体11的部分表面,暴露出部分铁基合金基体11的表面。作为再一种实施方式,如图4所示的器械除去可降解聚合物后的结构图,含锌保护体12镶嵌在铁基合金基体11中并沿铁基合金基体11的厚度方向贯通该基体,相应地,未被贯通的铁基合金基体11的部分称为未被覆盖的区域。可以理解的是,含锌保护体12还可以其他形式与铁基合金基体11连接,例如非贯通地镶嵌在铁基合金基体11中,其暴露出的端面可与铁基合金基体11的表面齐平,也可以凸出或低于所述铁基合金基体11的表面。当所述含锌保护体未完全覆盖铁基合金基体表面时,即无论是覆盖铁基合金的部分表面,还是通过镶嵌或其他形式与铁基合金基体接触,均会定义出覆盖区和相应的未覆盖区的边缘线。请一并参阅图2至图4,未覆盖区内的任一点与所述边缘线21沿铁基合金基体表面的最短距离定义为d,0<d≤40毫米。所述最短距离是指未覆盖区内的任意一点与该边缘线21上所有点的连线中最短的一条线段的长度。所述含锌保护体不管是全部覆盖还是部分覆盖铁基合金基体表面亦或是镶嵌在铁基合金基体中,其面积占比均≥15%。所述含锌保护体的面积占比的计算方法如公式(1)所示:
上述公式中,所述暴露出来的含锌保护体的表面积和暴露出来的铁基合金基体的表面积均是针对制备完含锌保护体但未含有可降解聚合物的铁基合金植入器械半成品计算,也即例如图2-4所示的本发明的可吸收铁基合金植入医疗器械除去可降解聚合物后得到的产物。
当含锌保护体12完全覆盖所述铁基合金基体11时,即含锌保护体12相对铁基合金基体11的分布满足d=0,含锌保护体12中的锌元素与体液接触后会生成锌离子Zn2+,Zn2+与体内的磷酸根PO43-反应生成难溶的磷酸锌Zn3(PO4)2,反应方程式如(2)和(3)所示:
Zn=Zn2+2e- (2)
Zn3(PO4)2具有防腐作用,其能在器械植入早期延后铁基合金腐蚀主要在于:一方面,磷酸锌离解生成磷酸离子,缩合磷酸离子与铁基合金基体11表面反应,形成有粘附性的Fe-Zn-P2O5化合物膜覆盖铁基合金基体11表面而使铁基合金基体11钝化,从而减缓铁基合金基体11腐蚀;另一方面,磷酸锌与由可降解聚合物电离产生的羧基发生反应,生成络合物,该络合物能与铁的腐蚀产物发生反应,在铁基合金基体11表面形成紧密的保护膜,从而隔绝铁基合金基体11与体内环境,遏制铁腐蚀。随着含锌保护体12被消耗,新生成的锌离子Zn2+减少,反应(3)的平衡左移,即磷酸锌逐渐被溶解,铁基合金基体11逐渐暴露出,此时铁基合金基体11开始缓慢腐蚀,直至磷酸锌消耗完,铁基合金基体11完全暴露于可降解聚合物降解形成的酸性环境中,开始快速腐蚀。由此可知,含锌保护体12完全覆盖所述铁基合金基体11时,其延缓铁基合金基体11的腐蚀机理并非是牺牲锌阳极保护铁基基体,本发明克服了现有技术偏见。
当含锌保护体12未完全覆盖铁基合金基体11表面,即含锌保护体12相对铁基合金基体11的分布满足0<d时,且含锌保护体12与铁基合金基体11之间为电接触时,含锌保护体12对铁基合金基体11的保护作用来自于两方面,即 两者形成电偶对带来的牺牲锌阳极保护和如前所述的腐蚀产物磷酸锌的保护。磷酸锌保护机制的优点在于锌量极低的情况下就能起到有效的保护作用,而通过形成电偶对带来的牺牲锌阳极保护需要消耗大量的锌。在体内环境下,当d值逐渐增大时,含锌保护体12对铁基合金基体11的保护机制将从磷酸锌保护机制起主导作用转变为牺牲锌阳极保护机制起主导作用。
本发明中,含锌保护体12相对铁基合金基体11的分布满足0<d≤40毫米,磷酸锌保护机制起主导作用。此外,当本发明的可吸收铁基合金植入医疗器械包括设于含锌保护体12与铁基合金基体11之间的可降解绝缘层时,含锌保护体12与铁基合金基体11之间并不能形成电偶对即不能构成牺牲锌阳极保护铁基合金基体11的条件时,该器械仍能在植入早期(1-6个月)几乎不腐蚀,说明含锌保护体12在与铁基合金基体11绝缘时仍能对铁基合金基体11起到保护作用,且原因在于产生了磷酸锌,由此进一步说明本发明的可吸收铁基植入医疗器械中,铁基合金基体在植入早期能被延缓腐蚀的机理与牺牲锌阳极保护铁基基体的机理不同,克服了现有技术偏见。
含锌保护体12的用量(重量或体积)与铁基合金基体11的用量(重量或体积)无关,与其自身的面积占比,最大d值以及可降解聚合物的种类、性质(例如结晶度、分子量和多分散系数)、厚度(或质量)有关。可根据器械的种类与规格、器械的临床性能要求和预期需保持结构完整和足够力学性能的时长,灵活选择含锌保护体12的用量来调节含锌保护体12起保护作用的时长大致与铁基合金基体11的预期需保持结构完整和足够力学性能的时间相匹配。
所述可降解聚合物层至少包括一种可降解聚合物,其降解后产生酸性的降解产物如羧酸,可选自可降解聚酯和/或可降解聚酸酐。该可降解聚酯选自聚乳酸、聚乙醇酸、聚乳酸乙醇酸、聚己内酯、聚羟基脂肪酸酯、聚丙烯酸酯、聚丁二酸酯、聚(β-羟基丁酸酯)、聚己二酸乙二醇酯中的任意一种,或者选自聚乳酸、聚乙醇酸、聚丁二酸酯、聚(β-羟基丁酸酯)、聚已内酯、聚己二酸乙二醇酯、聚乳酸-乙醇酸共聚物和聚羟基丁酸酯戊酸酯共聚物中的至少两种的物理共混物,或者选自由形成聚乳酸、聚乙醇酸、聚丁二酸酯、聚(β-羟基丁酸酯)、聚已内酯、聚己二酸乙二醇酯、聚乳酸-乙醇酸共聚物和聚羟基丁酸酯戊酸酯共聚物 的单体中的至少两种共聚而成的共聚物中的任一种;所述可降解聚酸酐选自聚1,3-双(对羧基苯氧基)丙烷-癸二酸、聚芥酸二聚体-癸二酸或聚富马酸-癸二酸中的至少一种;或者所述可降解聚合物为形成前述可降解聚酯与可降解聚酸酐的单体中的至少两种共聚而成的共聚物。
该可降解聚合物涂层还可包括活性药物,可在降解过程中释放治疗性药物。例如对于血管支架,该活性药物可抑制支架植入后的内膜过度增生,减少血管内再狭窄的发生率。活性药物可以是抑制血管增生的药物如紫杉醇、雷帕霉素及其衍生物,或抗血小板类药物选自西洛他唑,或抗血栓类药物如肝素,或抗炎症反应的药物如地塞米松,或抗致敏的药物,也可以是前述几种药物的混合物。
所述可降解聚合物层的制备可采用如下方法:先将可降解聚合物和药物溶解于有机溶剂(如乙酸乙酯、氯仿等)中形成混合溶液,随后将该混合溶液涂于已经制备了含锌保护体12的铁基合金基体11的整个表面或局部表面,干燥后成膜。采用的工艺可以是喷涂、浸涂、刷涂、静电纺丝,优选喷涂。
本发明的可吸收铁基合金植入医疗器械可以是血管支架、骨科植入物、妇科植入物、男科植入物、呼吸科植入物或骨科植入物。以下结合具体实施例,以铁基合金冠脉支架为例,对本发明作进一步详细说明,但是本发明保护的范围并不局限于此。
需要说明的是,以下各实施例采用动物实验的方式说明在含锌保护体的作用下,铁基合金支架能够在植入早期几乎不腐蚀,主要通过在支架植入动物体内后的不同观察时间点,诸如3个月、6个月、12个月等,对动物进行安乐处死,从其体内取出支架及其所在位置的组织,通过将支架连同支架所在的血管段进行径向支撑强度和质量损失测试来表征铁基合金支架的体内腐蚀状况以及是否满足早期力学性能要求。
所述径向支撑强度的测试使用MSI公司生产的径向支撑力测试仪进行,将植入动物体内的支架连同血管段取出,吸干表面水分后直接进行测试,即可得到支架植入后的不同时间点的径向支撑强度。
所述质量损失测试通过如下方式进行:将包括质量为M0的铁基合金基体(指未包括可降解聚合物的裸支架)的铁基合金支架(包括可降解聚合物)植入兔 子腹主动脉,在预定观察时间点将植入动物体内的铁基合金支架及其所在的组织截取出来,然后将组织连同支架浸泡在1mol/L氢氧化钠溶液中,使组织消解,如铁基合金基体表面有含锌保护体残留,则去除剩余的含锌保护体,然后从溶液中取出铁基合金支架或其碎片,将其放入一定浓度的溶液(如3%酒石酸溶液,和/或有机溶液)中超声,使其表面的腐蚀产物和聚合物层全部脱落或溶解于溶液中,取出溶液中剩余未腐蚀的铁基合金支架或其碎片,干燥称重,质量为Mt。质量损失率W用腐蚀清洗后支架杆重量损失的差值占铁基合金基体的重量的百分比来表示,如公式3所示:
W=(Mt-M0)/M0×100% (3)
W——质量损失率
Mt——腐蚀后剩余铁基合金支架基体的质量
M0——铁基合金支架基体的初始质量
其中,当铁基合金基体的质量损失率W<5%时,定义为不腐蚀;铁基合金支架基体的质量损失率W≥90%时,定义为完全腐蚀。
临床上,正常人的冠脉血管舒张压(低压)和收缩压(高压)范围为60-120mmHg,高血压病人的收缩压可达到175mm汞柱,即23.3kPa。发生冠脉痉挛时血管收缩压为400mmHg,即55kPa。心理应激状态、寒冷刺激、剧烈运动、冠脉粥样硬化、冠脉造影对冠脉的局部刺激以及一次性大量吸烟或酗酒均可诱发冠脉痉挛。故实现对冠脉血管的有效支撑是指支架至少能经受冠脉血管脉动时的收缩压23.3kPa,最好能经受血管痉挛时的收缩压55kPa。
以下各实施例提供的铁基合金支架的设计目标是需满足以下临床要求:自植入日起预定时间内(例如1个月内、2个月内、3个月或少于3个月的其他时长内),铁基合金基体几乎不腐蚀;在植入后能有效支撑3个月,植入3个月时的径向支撑强度≥55kPa,腐蚀周期大于6个月且小于或等于24个月。
以下各实施例中30008规格支架定义如下:支架在名义扩张压8atm作用下,扩开后的公称直径3mm,公称长度为8mm。30058规格支架定义如下:支架在名义扩张压8atm作用下,扩开后的公称直径3mm,公称长度为58mm。
需要指出的是,以下各实施例中,由于支架产品自身性能在设计许可范围 内的正常波动、动物个体差异、设计的取样点不够频密以及测试方法不可避免引入的系统误差,监测到的支架完全不腐蚀的时间点、径向强度数据以及完全腐蚀的时间点在实际测试中会在一定范围内波动。
实施例1
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入3个月内不腐蚀,制备方法如下:在原始径向支撑强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用真空蒸镀法镀厚度为800纳米的锌层完全覆盖铁支架表面。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖锌层表面,干燥后制得聚消旋乳酸涂层厚度为12μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,3个月后取出,质量损失测试表明支架未腐蚀,径向支撑强度为145kPa,符合植入早期3个月的力学性能要求。植入后12个月取出,质量损失测试表明支架完全腐蚀。
实施例2
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入1个月内不腐蚀,制备方法如下:在原始径向支撑强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用电镀法镀锌,锌层面积占比为90%,d≤0.02毫米,锌层厚600纳米。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖锌层表面和暴露出来的铁支架表面,干燥后得聚消旋乳酸涂层厚度为10μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,1个月后取出,质量损失测试表明支架未腐蚀;3个月后取出,测得支架径向支撑强度为80kPa,符合植入早期3个月的力学性能要求。植入后12个月后取出,质量损失测试表明支架完全腐蚀。
实施例3
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入2个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用电镀法镀锌,锌层面积占比为80%,d≤0.05毫米,锌层厚800纳米。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖锌层表面和暴露出来的铁支架表面,干燥后制得聚消旋乳酸涂层厚度为 12μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,2个月后取出,质量损失测试表明支架未腐蚀;3个月后取出,测得支架径向支撑强度为100kPa,符合植入早期3个月的力学性能要求。植入后10个月后取出,质量损失测试表明支架完全腐蚀。
实施例4
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入3个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用真空蒸镀法镀锌,锌层完全覆盖铁支架表面,锌层厚800nm。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯(-雷帕霉素)溶液完全覆盖锌层表面,干燥后制得聚消旋乳酸(-雷帕霉素)涂层厚度为15μm的可吸收铁基合金支架,其中聚消旋乳酸与雷帕霉素的质量比为4:1。将支架植入兔子腹主动脉,3个月后取出,质量损失测试表明支架未腐蚀,测得径向支撑强度为145kPa,符合植入早期3个月的力学性能要求。植入后13个月后取出,质量损失测试表明支架完全腐蚀。
实施例5
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入1个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用电镀法镀锌,锌层完全覆盖铁支架的外表面,锌层面积占比为25%,d≤0.12毫米,锌层厚6微米。随后喷涂分子量为20万的聚消旋乳酸溶液完全覆盖锌层表面和暴露出来的铁基合金支架表面,干燥后制得聚乳酸涂层厚度为8μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,1个月后取出,质量损失测试表明支架未腐蚀。3个月后取出测得径向支撑强度为80kPa,满足植入早期3个月的力学性能要求。植入后12个月后取出,质量损失测试表明支架完全腐蚀。
实施例6
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入2个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用真空蒸镀法镀锌,锌层面积占比为60%, d≤1毫米,锌层厚2微米。且在蒸镀的锌层和渗氮铁支架表面之间还设置有由卵磷脂制成的绝缘层,使锌层和渗氮铁支架之间无电接触。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖锌层表面和暴露出来的铁支架表面,干燥后制得聚消旋乳酸涂层厚度为6μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,2个月后取出,质量损失测试表明支架未腐蚀;3个月后取出,测得径向支撑强度为110kPa,表明满足植入早期3个月的力学性能要求。植入后24个月取出,质量损失测试表明支架完全腐蚀。
实施例7
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入1个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架杆上开槽,槽中镶嵌金属锌,所有镶嵌的锌的面积占比为35%,d≤5毫米,镶嵌的锌厚20微米。随后在支架的表面喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖暴露出来的镶嵌锌表面和暴露出来的铁基合金支架表面,干燥后制得聚消旋乳酸涂层厚度为8μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,1个月后取出,质量损失测试表明支架未腐蚀;3个月后取出,测得径向支撑强度为90kPa;18个月后取出,质量损失测试表明支架完全腐蚀。
实施例8
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入1个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为26-30mg的30058规格的渗氮铁支架杆上,设置通孔镶嵌金属锌,所有镶嵌的锌的面积占比为20%,d<=40毫米。随后在支架的表面喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖锌层表面和暴露出来的铁基合金支架表面,干燥后制得聚消旋乳酸涂层厚度为6μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,1个月后取出,质量损失测试表明支架未腐蚀;3个月后取出,测得径向支撑强度为90kPa;植入后18个月取出,质量损失测试表明支架完全腐蚀。
实施例9
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植 入2个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,将纳米锌粉与聚乙二醇(重均分子量6000)超声分散于乙醇溶液中得到悬浮液,锌粉与聚乙二醇质量比为1:1。随后,将悬浮液喷涂于整个铁支架表面,干燥后制得锌-聚乙二醇涂层厚度为2μm的可吸收铁基合金支架。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖锌-聚乙二醇涂层表面,干燥后制得聚消旋乳酸涂层厚度为12μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,2个月后取出,质量损失测试表明支架未腐蚀;3个月后取出,测得径向支撑强度为100kPa,满足植入早期3个月的力学性能要求;植入后10个月取出,质量损失测试表明支架完全腐蚀。
实施例10
一种可吸收铁基合金支架,其包括的含锌保护体可延缓铁基合金基体在植入1个月内不腐蚀,制备方法如下:在原始径向强度为145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面,采用电镀法镀锌,锌层覆盖铁支架的内表面和部分侧面,锌层面积占比为50%,d≤0.08毫米,锌层厚4微米。随后喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖暴露出来的铁基支架表面,干燥后制得聚乳酸涂层厚度为15μm的可吸收铁基合金支架。将支架植入兔子腹主动脉,1个月后取出,质量损失测试表明支架未腐蚀。3个月后取出测得径向支撑强度为80kPa,满足植入早期3个月的力学性能要求。植入后18个月后取出,质量损失测试表明支架完全腐蚀。
对比例1
本对比例提供一种30008规格的渗氮铁裸支架(即不包括可降解聚合物和含锌保护体的支架),其原始径向强度为145kPa、质量为4.5-5mg。将该支架植入兔子腹主动脉。3个月后取出,质量损失测试表明支架未腐蚀,测得支架径向支撑强度为140kPa,满足植入早期3个月的力学性能要求。植入后24个月后取出,质量损失测试表明支架未完全腐蚀,说明未设置可降解聚合物层的渗氮铁支架的腐蚀速度过慢,且腐蚀周期过长。
对比例2
本对比例提供一种可吸收铁基支架,其制备方法如下:在原始径向强度为 145kPa、质量为4.5-5mg的30008规格的渗氮铁支架表面上喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖整个支架表面,干燥后制得聚消旋乳酸涂层厚度为12μm的可吸收铁基合金支架。将该支架植入兔子腹主动脉,2个月后取出,支架杆腐蚀严重,多处断杆。3个月后取出,测得支架径向支撑强度小于55kPa,质量损失测试表明支架完全腐蚀,说明腐蚀过快,满足不了早期力学性能要求。
对比例3
本对比例提供一种可吸收铁基支架,其制备方法如下:在原始径向强度为175kPa、质量为5.5-6mg的30008规格的渗氮铁支架表面喷涂分子量为20万的聚消旋乳酸-乙酸乙酯溶液完全覆盖整个支架表面,干燥后制得聚消旋乳酸-乙酸乙酯涂层厚度为10μm的可吸收铁基合金支架。将该支架植入兔子腹主动脉,1个月后取出,支架杆有一定程度的腐蚀,3个月后取出,测得支架径向支撑强度为80kPa,满足植入早期3个月的力学性能要求;植入后12个月取出,质量损失测试表明支架完全腐蚀。
由以上各实施例可以看出,各实施例的可吸收铁基合金支架由于设置了含锌保护体,都实现了在含锌保护体起保护作用的期间内铁基体几乎不腐蚀,并都能满足早期植入3个月的力学性能要求。各实施例通过调节含锌保护体的用量,使其用量对应的在体内被消耗的时长大致与预期设定的铁基合金不腐蚀的时长匹配,实现了调节支架在植入早期不腐蚀的时长。与对比例1相比,实施例1-10提供的支架的腐蚀周期更短。与对比例2相比,实施例3提供的支架在植入早期的2个月内不腐蚀,在植入3个月时保持了结构完整性并具有足够的力学支撑。与对比例3相比,实施例2提供的支架在保证同样的腐蚀周期和3个月时足够的力学支撑的前提下,铁基体的用量更少,可以预期后续产生的腐蚀产物量更少,完全吸收的周期更短。
以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权 利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!