仿生肝脏及其制备方法与用途与流程
本发明属于生物工程技术领域,具体涉及一种仿生肝脏的制备方法和用途。
背景技术:
穿孔毒素(Pore-forming Toxins)是自然界中普遍存在的一类毒素,常见于动物叮咬和细菌感染,如α-溶血毒素和蜂毒肽等。穿孔毒素可以通过破坏细胞膜、引发细胞溶解从而有效地进入宿主细胞内部、破坏宿主细胞的完整性。体外解毒装置(如人工肝)是用于清除人体血液毒素的一种重要手段,它们是基于物理或生物的原理(如分子吸附再循环系统MARS、生物型人工肝),常常用于急性肝衰竭、肝肾综合症的治疗。但这些人工肝装置具有价格昂贵、选择性差以及可能导致机体水电解质失衡等缺点,目前针对血液中的穿孔毒素并没有有效的清除方法。
技术实现要素:
本发明要解决的技术问题是针对血液中的穿孔毒素提供有效的清除手段。
本发明解决技术问题的技术方案提供了一种可以选择性清除血液中穿孔毒素的仿生肝脏。该仿生肝脏是填充了聚乙二炔纳米颗粒的脱细胞肝脏支架。即该仿生肝脏为用聚乙二炔纳米颗粒填充从而激活脱细胞肝脏支架制得的PDA-DLS仿生肝装置。
其中,上述的仿生肝脏中,所述的聚乙二炔纳米颗粒(PDA)是由10,12-二十五碳二炔酸(PCDA)与改性的10,12-二十五碳二炔酸(PCDA-EDEA-SA-NHS)以质量比为150~200︰7~11混合后,在超声作用下通过自组装先形成纳米粒子,继而在254nm紫外光的照射下交联形成结构更为稳定的聚乙二炔纳米颗粒。
进一步,所述改性的10,12-二十五碳二炔酸的制备过程为:将N-羟基琥珀酰亚胺以及1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐加到含有PCDA的二氯甲烷中反应生成活化酯,此活化酯再与1,2-双(2-氨基乙氧基)乙烷反应过夜生成PCDA-EDEA(中间体),PCDA-EDEA再与丁二酸反应过夜得到改性的10,12-二十五碳二炔酸。
上述的仿生肝脏中所述的改性PDA纳米颗粒表面拥有离去基团N-羟基琥珀酰亚胺,此特殊的基团有利于PDA纳米颗粒与脱细胞肝脏中胶原纤维上的氨基发生反应。
其中,上述的仿生肝脏中,所述的PDA纳米颗粒为通过酰胺化反应与脱细胞肝脏支架中胶原连接。
其中,上述的仿生肝脏中,所述PDA纳米颗粒的粒径为80~100nm。
其中,上述的仿生肝脏中,所述的脱细胞肝脏支架是由离体肝脏经脱细胞处理得到的。离体肝脏的来源一般可为哺乳动物的肝脏。本发明在实施例中以大鼠肝脏为例,但显然脱细胞肝脏支架的来源不限于大鼠肝脏,比如可用兔、猴、猪、人等的离体肝脏。
本发明同时还提供了制备上述仿生肝脏的方法。该方法包括以下步骤:a、制备脱细胞肝脏支架;b、制备聚乙二炔纳米颗粒;c、将修饰的PDA纳米颗粒灌注入脱细胞肝脏支架,修饰的PDA纳米颗粒连在脱细胞肝脏支架的胶原纤维上,得到仿生肝脏。
其中,上述方法中,所述步骤a的操作步骤为:将大鼠肝脏门静脉和肝下下腔静脉插入铁氟龙插管扎紧,结扎肝上下腔静脉,将肝脏完整地取出;通过门静脉以2mL/min依次灌水4h、0.01%SDS(十二烷基硫酸钠)溶液12h、0.1%SDS溶液12h、1%SDS溶液12h,蒸馏水12h,制备得到脱细胞肝脏支架。
其中,上述方法中,所述步骤b的操作步骤为:在室温的环境下,将N-羟基琥珀酰亚胺以及1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐加到含有10,12-二十五碳二炔酸的二氯甲烷中,搅动2小时后得到活化酯;将合成的活化酯溶液滴加到1,2-双(2-氨基乙氧基)乙烷中,并在室温的环境下搅动过夜;然后通用真空蒸馏的方式将二氯甲烷去除,并将产物通过硅胶柱色谱法纯化后得到PCDA-EDEA;将PCDA-EDEA与丁二酸混合并搅动过夜,通过柱纯化后获得到PCDA-EDEA-SA-NHS;所述N-羟基琥珀酰亚胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、10,12-二十五碳二炔酸、1,2-双(2-氨基乙氧基)乙烷与丁二酸的质量比为9~10︰10~11︰6~7︰19~20︰2~3。
将PCDA和PCDA-EDEA-SA-NHS的混合物置于热水中,声波处理10min;于4℃存放过夜后,将254nm紫外照射10min产生蓝色PDA纳米颗粒;所述10,12-二十五碳二炔酸与改性的10,12-二十五碳二炔酸的质量比为150~200︰7~11;所述热水的温度为70~75℃。
其中,上述方法中,所述步骤c的操作步骤为:将DLS(脱细胞肝脏支架)通过门静脉套管连接到灌注设备,下腔静脉作为灌注出口;将聚乙二炔纳米粒以2mL/min的速度通过门静脉灌注到DLS中,直到脱细胞肝脏支架颜色不再变深。
本发明同时还提供了上述的仿生肝脏在清除血液中的穿孔毒素的应用。
本发明的有益效果在于:本发明所提供的仿生肝脏保留了肝脏本身复杂的血管网结构,所填充的纳米颗粒可以选择性捕获穿孔毒素,二者所组成的解毒装置能高效地去除血液中的穿孔毒素。且制备仿生肝脏的材料对血液成分没有明显的影响,不会诱导补体激活。本发明提供的仿生肝脏制备成本低廉,高效安全,显示出在针对穿孔毒素的解毒治疗中良好的应用前景。
附图说明
图1 聚乙二炔(PDA)纳米颗粒与DLS组成的仿生肝脏用于清除血液中穿孔毒素的示意图。
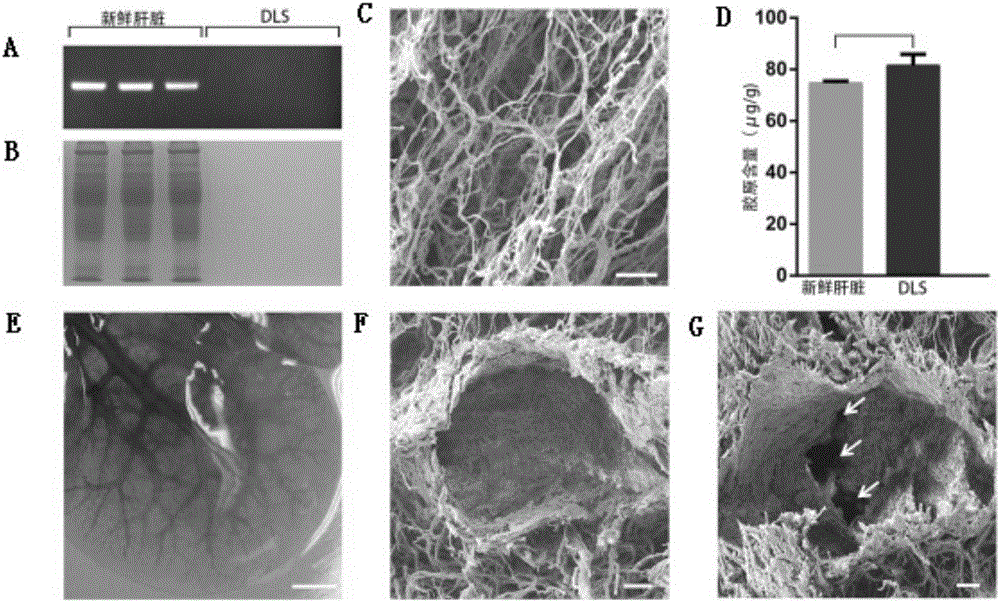
图2 DLS完全失去细胞但保持完整的胶原结构和血管床。(A,B):在新鲜肝脏中(FL)和脱细胞肝脏支架(DLS)中的总DNA(A)和细胞蛋白(B)量;(C):DLS中的胶原纤维扫描电镜图(SEM);(D):FL和DLS中胶原含量的生化定量(NS:无显著性差异);(E):灌注台盼蓝后DLS中间叶的血管树;(F,G):大血管的扫描电镜图(F)和汇管区(箭头所指)的扫描电镜图(G)。比例尺:10微米(C),5毫米(E),10微米(F,G)。
图3 PDA纳米颗粒的制备。(A):PCDA-EDEA-SA-NHS的合成方案示意图;(B):PDA纳米粒双层结构和其组装过程的原理示意图:PCDA和PCDA-EDEA-SA-NHS在超声作用下自组装形成无色的纳米颗粒,然后在254纳米的紫外光照射下通过1,4加成反应形成交替的二三键,从而发生聚合;(C):PDA纳米颗粒通过氨基化学连接到DLS内的胶原纤维上的示意图;(D,E):PDA纳米颗粒的粒度分布(D)和电位分布(E)图;(F):PDA纳米颗粒的透射电镜图像。比例尺:50纳米(F)
图4 PDA纳米颗粒在DLS中的固定。(A):PDA纳米颗粒在DLS中的固定效果(umPDA:未修饰的PDA纳米颗粒,n=3);(B,C):PDA纳米颗粒从DLS中的释放情况。灌注PDA纳米溶液至DLS中,24h后测定DLS中PDA纳米颗粒被蒸馏水冲洗出的量(B),将新鲜人血循环灌入(持续20分钟)含PDA纳米颗粒的DLS装置中,检测血液中PDA纳米颗粒的含量(C);(D):PDA-DLS装置的外形图。由于充满了蓝色的PDA纳米颗粒,该装置呈深蓝色;(E):PDA-DLS装置和DLS(右上角)扫描电镜的照片。比例尺:10毫米(D),200纳米(E)
图5 PDA-DLS装置的解毒能力。(A):100mm3新鲜肝脏或者PDA-DLS对不同浓度蜂毒肽溶液中和能力的定量评价,n=3;(B):定量评价分别用DLS、PDA-DLS装置单向灌流蜂毒肽溶液(10μg/mL)的解毒效果,n=3;(C):定量评价PDA-DLS装置对循环灌注的蜂毒肽溶液(10μg/mL)的解毒效果,n=3;(D):正常组、PDA-DLS组和蜂毒肽组三个组的溶血率测定,n=3;(E):正常组、PDA-DLS组和蜂毒肽组三组中总胆红素含量。n=3;(F):正常组、PDA-DLS组和蜂毒肽组三组中间接胆红素含量。n=3;(G):正常组(左)、PDA-DLS组(中)和蜂毒肽组(右)三组中红细胞的形态。棘红细胞(箭头所指)与溶血有紧密相关性。比例尺:10微米(G)
图6 PDA-DLS装置的安全性评价。(A,B):血液涂片瑞氏染色。正常血液中(A)和经PDA-DLS装置灌注后的血液中(B)的红细胞(单箭头所指)、淋巴细胞(双箭头所指)和中性粒细胞(三箭头所指);(C):经PDA-DLS灌注之前和灌注之后的红细胞数量,n=3;(D):经PDA-DLS灌注之前和灌注之后的白细胞数量,n=3;(E):经PDA-DLS灌注之前和灌注之后的血小板数量,n=3;(F,G):经PDA-DLS灌注之前和灌注之后的总蛋白(F)和白蛋白(G)的量,n=3;(H-J):C3(H),C4(I)和SC5b9(J)在未经任何处理的(NC)血液中、经过PDA-DLS装置(PDA-DLS)处理过的血液中和经过FL处理过的血液中的含量,n=3,NS:无显著性差异。比例尺:20微米(A,B)。
具体实施方式
肝脏是人体内最重要的解毒器官,活体肝脏的特殊微结构可帮助肝细胞高效地清除血液中的毒素,这为本发明设计用于有效解毒的类肝装置提供了思路。本发明创造性地采用PDA纳米颗粒填充动物的脱细胞肝脏,获得“再细胞化”动物的脱细胞肝脏的效果,构建了一个仿生肝装置来对血液中的靶毒素进行清除。本发明中使用的PDA纳米颗粒是由10,12-二十五碳二炔酸(PCDA)自组装而成的囊泡状纳米颗粒。PDA纳米颗粒表面是由二三键交替形成的π共轭主链构成的,它类似于细胞膜的表面,可以诱导、捕获及中和穿孔毒素。脱细胞肝脏支架(DLS)保留了肝脏原有的形状和三维结构,是一个天然精密的微流体系统。
而穿孔毒素具有细胞破坏能力,它们可以通过在细胞膜上形成孔洞改变细胞膜的通透性从而破坏细胞。由于PDA纳米颗粒具有尺寸微小及制备灵活等优点,可通过对其进行合理地设计从而用于毒素的捕获与清除,因此,本发明创造性地将将可回收的PDA纳米颗粒和流动的循环系统结合起来,达到激活脱细胞肝脏,选择性地清除血液中的穿孔毒素的目的,这种技术在穿孔毒素的解毒中具有很好的应用价值。
本发明提供的仿生肝脏是填充了聚乙二炔纳米颗粒的脱细胞肝脏支架。即是用聚乙二炔纳米颗粒填充从而激活脱细胞肝脏支架制得PDA-DLS仿生肝装置。
其中,上述的仿生肝脏中,所述的聚乙二炔纳米颗粒(PDA)是由10,12-二十五碳二炔酸(PCDA)与改性的10,12-二十五碳二炔酸(PCDA-EDEA-SA-NHS)以质量比为150~200︰7~11混合后,在超声作用下通过自组装先形成纳米粒子,继而在254nm紫外光的照射下交联形成结构更为稳定的聚乙二炔纳米颗粒。
进一步,上述改性的10,12-二十五碳二炔酸的制备过程为:将N-羟基琥珀酰亚胺以及1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐加到含有PCDA的二氯甲烷中反应生成活化酯,此活化酯再与1,2-双(2-氨基乙氧基)乙烷反应过夜生成PCDA-EDEA(中间体),PCDA-EDEA再与丁二酸反应过夜得到改性的10,12-二十五碳二炔酸。
上述的仿生肝脏中所述的改性PDA纳米颗粒表面拥有离去基团N-羟基琥珀酰亚胺,此特殊的基团有利于PDA纳米颗粒与脱细胞肝脏中胶原纤维上的氨基发生反应。所述的PDA纳米颗粒为通过酰胺化反应与脱细胞肝脏支架中胶原连接。
上述的仿生肝脏中,所述PDA纳米颗粒的粒径优选为80~100nm。
上述的仿生肝脏中,所述的脱细胞肝脏支架是由离体肝脏经脱细胞处理得到的。离体肝脏的来源一般可为哺乳动物的肝脏。本发明在实施例中以大鼠肝脏为例,但显然脱细胞肝脏支架的来源不限于大鼠肝脏,比如可用兔、猴、猪、人等的离体肝脏。
本发明同时还提供了制备上述仿生肝脏的方法。该方法包括以下步骤:a、制备脱细胞肝脏支架;b、制备聚乙二炔纳米颗粒;c、将修饰的PDA纳米颗粒灌注入脱细胞肝脏支架,修饰的PDA纳米颗粒连在脱细胞肝脏支架的胶原纤维上,得到仿生肝脏。
本发明仿生肝脏的制备方法,具体的可包括以下步骤:
a、制备脱细胞肝脏支架:将大鼠肝脏门静脉和肝下下腔静脉插入铁氟龙插管扎紧,结扎肝上下腔静脉,将肝脏完整地取出;通过门静脉以2mL/min依次灌水4h、0.01%SDS(十二烷基硫酸钠)溶液12h、0.1%SDS溶液12h、1%SDS溶液12h,蒸馏水12h,制备得到脱细胞肝脏支架;
b、制备聚乙二炔纳米颗粒:在室温的环境下,将N-羟基琥珀酰亚胺以及1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐加到含有10,12-二十五碳二炔酸的二氯甲烷中,搅动2小时后得到活化酯;将合成的活化酯溶液滴加到1,2-双(2-氨基乙氧基)乙烷中,并在室温的环境下搅动过夜;然后通用真空蒸馏的方式将二氯甲烷去除,并将产物通过硅胶柱色谱法纯化后得到PCDA-EDEA;将PCDA-EDEA与丁二酸混合并搅动过夜,通过柱纯化后获得到PCDA-EDEA-SA-NHS;将PCDA和PCDA-EDEA-SA-NHS的混合物置于热水中,声波处理10min;于4℃存放过夜后,将254nm紫外照射10min产生蓝色PDA纳米颗粒;
c、将DLS(脱细胞肝脏支架)通过门静脉套管连接到灌注设备,下腔静脉作为灌注出口;将聚乙二炔纳米粒以2mL/min的速度通过门静脉灌注到DLS中,直到脱细胞肝脏支架颜色不再变深,得到仿生肝脏。
其中,上述方法步骤b所述N-羟基琥珀酰亚胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、10,12-二十五碳二炔酸、1,2-双(2-氨基乙氧基)乙烷与丁二酸的质量比为9~10︰10~11︰6~7︰19~20︰2~3。所述10,12-二十五碳二炔酸与改性的10,12-二十五碳二炔酸的质量比为150~200︰7~11。所述热水的温度为70~75℃。
本发明的研究成果表明,由PDA纳米粒和DLS组合而成的仿生肝脏(称为PDA-DLS装置)可以在体外高效地清除血液中的穿孔毒素,且不影响血液成分及激活补体因子。此项工作能为今后临床体外解毒装置的研发及应用提供新方法和新技术。
本发明同时还提供了上述的仿生肝脏在清除血液中的穿孔毒素的应用。根据上述介绍的原理和下述的试验证据,显然本发明技术对α-溶血毒素和蜂毒肽等穿孔毒素都能有很好的清除效果。
以下通过具体的实施例对本发明做进一步的详细说明。
实施例1 PDA-DLS仿生肝装置的构建
首先采用脱细胞技术制备DLS,然后将PDA纳米颗粒灌注至DLS,PDA纳米颗粒通过与胶原纤维上的化学基团进行化学反应从而固定在DLS里面,最后获得PDA-DLS装置。
PDA纳米颗粒的制备步骤为:在室温的环境下,将N-羟基琥珀酰亚胺(920毫克,7.99毫摩尔)以及1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1020毫克,5.32毫摩尔)加到含有PCDA(500毫克)的二氯甲烷(100毫升)中,搅拌2小时后得到活化酯;将合成的活化酯溶液逐滴加入至1,2-双(2-氨基乙氧基)乙烷(1980毫克,13.35毫摩尔)中,并在室温的环境下搅拌过夜;采用真空蒸馏的方式将二氯甲烷去除,并将产物通过硅胶柱色谱法纯化后得到PCDA-EDEA;将其与丁二酸(230毫克)混合并搅拌过夜,通过柱纯化后获得PCDA-EDEA-SA-NHS;将PCDA(190毫克)和PCDA-EDEA-SA-NHS(10毫克)的混合物置于70℃的蒸馏水中,声波处理10分钟后,于4℃存放过夜,254纳米紫外照射10分钟得到蓝色的PDA纳米粒。
由大鼠肝脏通过从门静脉长时间灌注SDS,可得到透明的保留了肝脏形状的DLS。在DLS中未检测出残留的DNA和细胞蛋白(图2A,B),但保留了胶原纤维结构(图2C)和胶原成分(图2D)。将台盼蓝染料从门静脉注入,便可将DLS完整的微脉管系统展现出来(图2E)。在扫描电镜下也直观地观察到DLS中的大血管和小血管同于原肝脏中的门脉三联管(图2F,G)。由此表明,脱细胞过程可以选择性地清除肝脏中的细胞成分,并保留细胞外基质成分和DLS中完整的血管网络。
得到DLS后,用PDA纳米颗粒将其填充,PDA纳米粒可替代部分肝细胞的功能。通过往大鼠DLS中灌注50毫克的PDA纳米粒,制造出PDA-DLS装置,它的外观如图4D所示。
PDA纳米颗粒经过修饰,使其表面拥有离去基团N-羟基琥珀酰亚胺(NHS),它易和胶原上的氨基发生化学反应(图3C)。合成的纳米颗粒平均粒径约为100纳米(图3D),Zeta电势为-20mV(图3E)。在透射电镜下,纳米颗粒呈现出囊泡结构,粒径在80-100纳米(图3F)。
如果PDA纳米粒不经过修饰则不能有效地被DLS截留。用比色法检测流出液中PDA的含量发现修饰后的PDA纳米粒被100%保留在了DLS中(图4A)。PDA-DLS装置被蒸馏水或者血液进一步地冲洗,可以看到修饰过的PDA纳米粒不会被洗脱出来,而未经修饰的PDA纳米粒会被洗脱出来(图4B,C)。通过透射电镜可以观察到PDA纳米粒被保留在PDA-DLS中的胶原纤维上(图4E)。因此,PDA纳米粒的化学修饰对于将其高效地保留在DLS中是必不可少的步骤。
实施例2 PDA-DLS仿生肝装置的体外解毒能力
通过溶血实验证明实施例一中所制备得到的PDA-DLS装置对穿孔毒素的解毒能力。
以蜂毒肽作为模式穿孔毒素。以新鲜肝脏作为对照组,检测PDA-DLS装置对蜂毒肽溶液的解毒能力。首先,我们测试了PDA-DLS装置和新鲜肝脏在静置的蜂毒肽溶液中的解毒能力。PDA-DLS装置和新鲜肝脏分别被切成100mm3的小块,设置不同浓度的蜂毒肽(200μL)组,将切好的组织块与之分别孵育60分钟,然后将孵育的溶液离心后取上清液,将上清液加入到大鼠的红细胞液中进行红细胞裂解实验,孵育30分钟后离心,检测各组上清液的OD值。如图5A所示,PDA-DLS装置和新鲜肝脏对蜂毒肽的最大解毒浓度分别为80μg/mL和10μg/mL.因此,PDA-DLS对于蜂毒肽的解毒能力差不多是新鲜肝脏的8倍以上。
然后对PDA-DLS装置在灌流状态下对蜂毒肽溶液的解毒能力进行了评价。蜂毒肽溶液(10μg/mL,100mL)经门静脉以2mL/min的流速分别灌入PDA-DLS和DLS中。每隔5分钟收集一次从下腔静脉流出的液体,进行红细胞裂解实验,孵育30分钟后离心,检测各组上清液的OD值。结果发现PDA-DLS可以完全清除单向灌流溶液中的蜂毒肽,但DLS并不能明显地减少灌流液中的毒素。解毒能力比较如图5B所示。PDA-DLS装置在单向灌流蜂毒肽溶液中的解毒能力为100%,而DLS的解毒能力几乎为0。这一结果意味着PDA-DLS装置的解毒能力主要是通过PDA纳米颗粒的作用。
为了模拟生理条件下肝脏的解毒过程,我们考察了PDA-DLS装置对循环灌注的蜂毒肽溶液的解毒能力。将置于溶液池的蜂毒肽溶液(10μg/mL)由门静脉以2mL/min的流速灌入到PDA-DLS装置中,从下腔静脉流出的溶液又回收至溶液池,再次灌注入门静脉。每隔25分钟抽取溶液池中的蜂毒肽溶液进行红细胞裂解实验,如图5C所示,PDA-DLS可几乎将循环灌注的蜂毒肽完全清除。同时我们发现,循环灌注蜂毒肽溶液,75分钟后解毒效果可以达到100%(单向灌流时间的1.5倍)(图5C)。这一结果证明PDA-DLS可以高效中和循环灌注中的蜂毒肽的毒性。
实施例3 PDA-DLS仿生肝装置清除人血中穿孔毒素的能力
为了评价PDA-DLS对血液的解毒能力,将实施例一中制备的PDA-DLS进行血液中蜂毒肽的清除实验。
在正常人血中事先加入蜂毒肽(10μg/mL),经PDA-DLS循环灌注20分钟后,对正常人血(正常组)、经PDA-DLS循环后的血液(PDA-DLS组)、未经PDA-DLS循环的含有蜂毒肽的血液(蜂毒肽组)进行血常规和血生化相关指标检测。
红细胞计数结果表明PDA-DLS组的红细胞裂解率明显低于蜂毒肽组(图5D)。总胆红素和间接胆红素检测结果表明PDA-DLS装置组的裂解率远远低于蜂毒肽组(图5E,F)。同时,用血液涂片观察每个组的血细胞形态,正常红细胞有着光滑双面凹陷的形状,蜂毒肽将正常的红细胞变为棘状红细胞,与溶血有紧密的关联。在PDA-DLS装置组,棘状红细胞的比例明显低于蜂毒肽组(图5G)。由此说明PDA-DLS装置能有效地清除循环血液中的蜂毒肽,从而保护红细胞免受蜂毒肽破坏。
实施例4 PDA-DLS仿生肝装置的安全性评价
为了评估PDA-DLS仿生肝脏对正常人血的影响,将正常人血(100毫升)经门静脉以2mL/min的流速循环灌注到PDA-DLS装置中,结果发现灌注后的血细胞维持了正常的细胞形态(图6A,B),并且血细胞的数量没有明显变化(图6C,D,E)。另外,血生化分析显示血液中的总蛋白和白蛋白在灌注过程中也没有明显减少(图6F,G)。
对于补体的激活的能力,将PDA-DLS和新鲜大鼠肝脏作为对比,以正常血液做空白对照(NC组)。人的血液经大鼠新鲜肝脏灌注后,其中补体C3和C4明显减少,而补体SC5b9的含量升高,这意味着人血液中的补体被新鲜肝脏的异质性激活(图6H、I、J)。而经PDA-DLS灌注处理过的血液中补体C3、C4和SC5b9的含量和正常血液中的含量几乎一致(图6H、I、J)。因此,PDA-DLS在对血液中的穿孔毒素进行清除时,不会明显影响正常血液的成分以及激活补体因子。
- 还没有人留言评论。精彩留言会获得点赞!