一种抗体偶联药物及其制备方法和应用与流程
本发明涉及生物技术和药物领域,尤其涉及一种抗体偶联药物及其制备方法和应用。
背景技术:
B淋巴细胞抗原CD20是一类无糖基化的磷蛋白,且未发现其存在配对的自然配体(natural ligand)。除了前B细胞和成熟B细胞,它可在B细胞的所有阶段进行表达,并且几乎所有的B细胞肿瘤都表达CD20,因此它成为抗体治疗的理想靶点。
因此,各公司和研究机构针对CD20研发了诸多的抗CD20单克隆抗体,且有许多已被FDA批准上市,比如利妥昔单抗(Rituximab)、奥法木(Ofatumumab)单抗和obinutuzumab(商品名:Gazyva)等。它们主要通过细胞程序性死亡(programmed cell death,PCD),补体依赖细胞毒性(complement-dependent cytotoxicity,CDC)或抗体依赖细胞介导的细胞毒性(antibody-dependentcell-mediated cytotoxicity,ADCC),来治疗非霍奇金淋巴瘤(NHL)以及慢性淋巴细胞型白血病(CLL)。
然而,对于抗体偶联药物(Antibody-drug conjugates,ADCs),CD20却不被认为是理想的靶点,因为它在细胞表面不可调控且不能被内吞。ADC由抗体、药物和连接物(linker)组成,通过抗体的靶向能力将细胞毒药物运输至靶细胞,然后与抗原(受体)结合、被靶细胞内吞,最终在溶酶体内被组织蛋白酶等水解酶水解从而释放出细胞毒药物杀伤细胞。因此,CD20由于其内吞性差,未被看好成为ADC的理想靶点。
但是,仍有很多研究者尝试用抗CD20抗体制备ADC,比如阿霉素(Dox)、蓖麻毒素链A(Ricin A)和脂质体阿霉素等均曾被用于与抗CD20单抗偶联,结果不尽如人意,IC50均高于10μg/mL,不足以有效抑制肿瘤生长。
近年来,研究人员利用毒性更强的海兔毒素衍生物(monomethyl auristatin E,MMAE)和卡里奇霉素(calicheamicin)通过可水解连接物(linker)偶联抗CD20抗体,显著提高了ADC被肿瘤细胞的内吞量以及最终的抗肿瘤活性。这可能是由于综合了偶联药物后可以提高抗体的内吞性,以及药物在细胞内发挥作用后可弥散到肿瘤微环境继续杀伤这一bystander killing效应。
但是,这两类ADC的活性仍有提高空间,比如Rituximab-vcMMAE偶联物对于CD20阳性细胞Raji和Daudi的IC50仍在1μg/mL左右,仅有对Ramos细胞的IC50可以达到40ng/mL的水平。另外,这两类ADC均通过抗体上的巯基(SH)或氨基(NH2)进行随机偶联,因此无法控制药物抗体比(Drug-Antibody Ratio,DAR),导致偶联产物同质性差(产物由DAR=1~8的混合物),最终收窄药物的治疗窗口,限制其临床应用。
因此,目前FDA批准的抗CD20偶联物仅有Ibritumomab tiuxetan(商品名:Zavalin),而tiuxetan可螯合放射性同位素钇90(Y-90)和铟111(IN-111),因此并不需要被靶细胞内吞去发挥活性作用。另外,有研究报道ADC药物上偶联的药物个数越多,ADC在体内的稳定性越低,因此如何利用少量药物(如DAR=2)达到ADC的抗肿瘤效果是目前的一大挑战。
综上,现有抗CD20抗体偶联物存在的主要问题为内吞量低、活性不足以有效抑制肿瘤生长以及偶联物非定点修饰导致同质性低(DAR难以控制)。
Sortase A酶来源于金黄色葡萄球菌,它可特异性识别蛋白羧基末端的LPXTG(X为任意氨基酸)片段,通过其184位的半胱氨酸残基作为活性中心切断苏氨酸(T)和甘氨酸(G)之间的肽键,再与LPXTG序列中苏氨酸(T)的α-羧基形成硫酯中间体,然后,亲核基团(GGG最为常见)可攻击该中间体最终完成转肽反应(如LPXTGGG)。研究者们已成功应用Sortase A酶定点修饰单链抗体(scFv),Fab以及全抗体用于荧光标记、诊断等多种用途。Kornberger P等人利用Sortase A制备抗CD30的Fab偶联药物,而Beerli RR等人则利用Sortase A突变体制备抗人Her2单抗偶联药物。然而,两者针对的靶点均为易被靶细胞内吞的抗原,现有技术仍无法解决利用Sortase A制备针对不能内吞的受体或者抗原的抗体偶联药物(ADC)这一问题。而且内吞性差的抗原或受体包含了重要的抗体药物靶点,比如CD20、CD21和CD71等,这严重制约了抗体偶联药物的靶点范围。
此外,由于常用的偶联用药物水溶性差,比如海兔毒素衍生物Maleimidocaproyl-valine-citrulline-p-aminobenzoyloxycarbonyl-monomethyl auristatin E(简称vcMMAE),在它与抗体进行偶联反应时需要加入有机试剂以提高其溶解度,因此可能影响抗体结构、提高后续纯化难度。
综上所述,现有的针对CD20等不可内吞型靶点的ADC,其活性受内吞性制约,且由于采用抗体本身的半胱氨酸或赖氨酸残基偶联药物,致使其同质性低;化学偶联用的药物通常水溶性差,不利于后续生产、纯化。因此,亟需开发新类型的ADC药物及有效的制备方法。
技术实现要素:
本发明提供了一种抗体偶联药物及其制备方法和应用,该抗体偶联药物具有良好的抗肿瘤效应,还具有较高的均一性。
一种抗体偶联药物,由抗体和药物经连接臂连接而成,所述抗体为重链含有LPXTG序列的抗CD20单克隆抗体,所述药物为海兔毒素或其衍生物,所述连接臂包括连接所述抗体的短肽接头以及连接所述药物的自消去接头;所述短肽接头包含至少1~3个连续的甘氨酸。
进一步地,所述LPXTG序列位于抗CD20单克隆抗体重链的C末端。
作为优选,所述抗体的轻链氨基酸序列如SEQ ID NO.1所示,重链氨基酸序列如SEQ ID NO.2所示。
作为优选,所述短肽接头的氨基酸序列为GGG或GGGVC。
作为优选,所述抗体与药物的摩尔比为1:1~2。
具体地,所述自消去接头为对氨基苯甲酸(PAB)。
本发明还提供了一种所述抗体偶联药物的制备方法,包括:抗体和带连接臂的药物经Sortase酶催化,发生偶联反应,反应结束后,分离,获得抗体偶联药物。
上述带连接臂的药物是指已与连接臂连接的海兔毒素或其衍生物,其可以根据需要从生物制药公司进行订购。
现有技术中,通过化学法将抗CD20单克隆抗体与海兔毒素药物进行偶联,获得抗体偶联药物,该法的缺点在于无法进行定点偶联、药物抗体比率(Drug antibody ratio,DAR)和偶联反应需要有机试剂参与(溶解海兔毒素药物)等;本发明方法采用酶偶联法,能够避免上述缺点,获得具更强抗肿瘤活性且均一性高的抗体偶联药物。
Sortase A可特异性识别LPXTG序列,并通过催化反应与抗CD20单克隆抗体重链C末端的LPXTG序列(X指代任意氨基酸)形成抗CD20抗体-LPXT-Sortase A的中间体,然后带连接臂(如GGG)的药物可亲核攻击上述中间体,从而消去Sortase A,完成转肽反应,从而得到偶联产物(抗CD20抗体-LPXT-GGG-药物),以此达到定点偶联的目的。
实验结果表明,通过不同的连接臂可以控制抗体偶联药物(ADC)的偶联药物个数,从而实现药物抗体比率(Drug antibody ratio,DAR)的不同。例如:若连接臂中短肽的氨基酸序列采用GGG,即获得的带连接臂的海兔毒素为GGG-PAB-MMAE,那么在Sortase A的催化下仅能生成DAR为1的ADC;而若连接臂中短肽的氨基酸序列采用GGGVC,那么在Sortase A的催化下生成DAR为1和2的ADC。
作为优选,所述偶联反应的温度为37℃,时间为4~12h。整个反应过程是在pH 7.5的Tris-HCl缓冲溶液(含氯化钙)中进行的。
作为优选,所述抗体与带连接臂的药物的摩尔比为1:4~100;所述Sortase酶的浓度为25μM~100μM。
作为优选,所述Sortase酶的氨基酸序列如SEQ ID NO.3~6所示。
进一步优选,所述Sortase酶的氨基酸序列如SEQ ID NO.4或5所示。
上述Sortase酶可以为N端缺失25个氨基酸(包含跨膜区)的Sortase A(WT)(氨基酸序列如SEQ ID NO.3所示);也可为在此基础上进行四个氨基酸突变(P94S,D160N,D165A和K196T)的Sortase A(M4)(氨基酸序列如SEQ ID NO.4所示);或者,N端缺失59个氨基酸的Sortase A(△N59)(氨基酸序列如SEQ ID NO.5所示)。上述Sortase酶均在N端带有His标签便于纯化。
实验结果表明,不同氨基酸序列的Sortase酶对最终产物得率存在影响。更优选,所述Sortase酶的氨基酸序列如SEQ ID NO.5所示。
本发明还提供了一种所述抗体偶联药物在制备抗肿瘤药物中的应用。该抗肿瘤药物能够用于诱导细胞表面表达有CD20蛋白分子的肿瘤细胞的凋亡。
具体地,所述抗肿瘤药物为抗结肠癌药物、抗血癌药物、抗卵巢癌药物、抗胃癌药物、抗肺癌药物、抗乳腺癌药物或抗肝癌药物。
进一步地,所述抗肿瘤药物为抗淋巴瘤或白血病药物。
与现有技术相比,本发明具有以下有益效果:
(1)本发明抗体偶联药物能够以更少的载药量(DAR)达到比其他化学法制备的CD20靶向ADC更高的体内外抗肿瘤活性;针对Ramos细胞的IC50(半数抑制浓度)可达0.005纳克/毫升。
(2)本发明利用Sortase A酶法制备抗体偶联药物,采用水溶性极强的带连接臂的海兔毒素,避免了制备过程中有机试剂的使用,简化后续纯化、分离步骤。
(3)本发明利用Sortase A酶法制备抗体偶联药物,有效控制药物抗体偶联比(DAR)为1或者2,与化学法制备的CD20靶向ADC相比,在均一性方面有极大提升。
附图说明
图1为抗CD20单克隆抗体改造后的结构示意图以及野生型Sortase A活性中心的示意图;
其中,抗体重链C末端带有LPETG标签,该标签为Sortase A酶特异性识别片段;Sortase A酶中的Cys184位点为其活性中心。
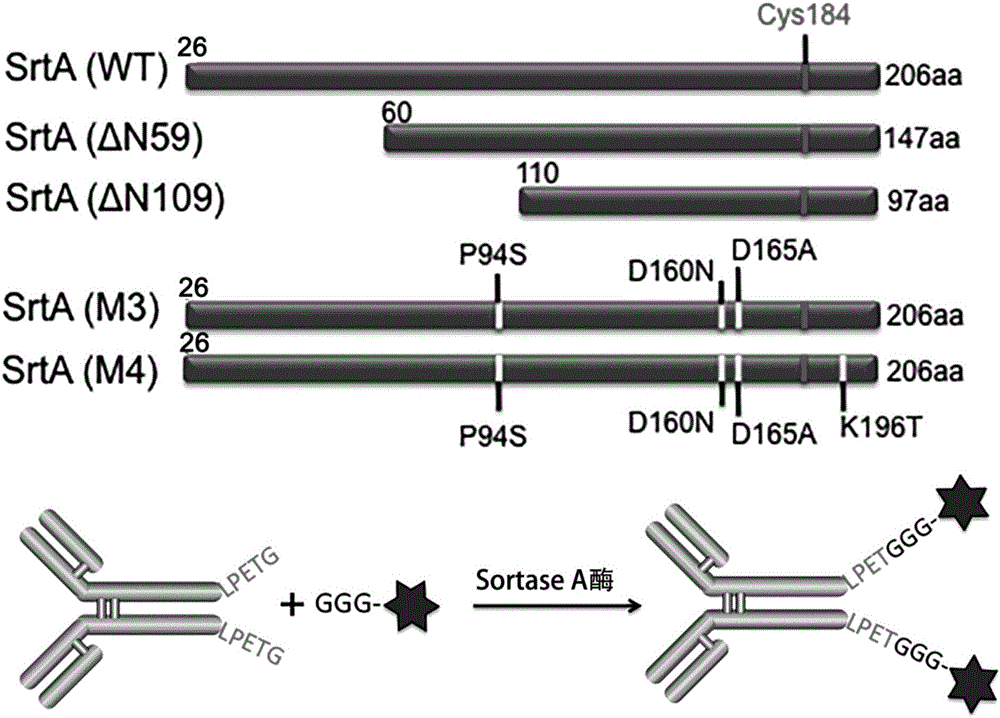
图2为不同长度Sortase A(SrtA)酶及突变体的示意图,及其催化抗体与小分子毒素反应的活性机制图;
其中,SrtA(WT)表示野生型Sortase A酶,它是全长Sortase A的N端25个氨基酸残基用His-tag(六个组氨酸)替代的版本,氨基酸序列见SEQ ID NO.3;
SrtA(△N59)为全长Sortase A酶的N端59个氨基酸残基用His-tag(六个组氨酸)替代的版本,氨基酸序列见SEQ ID NO.5;
SrtA(△N109)为全长Sortase A酶的N端109个氨基酸残基用His-tag(六个组氨酸)替代的版本,氨基酸序列见SEQ ID NO.6;
SrtA(M3)为含有P94S、D160N和D165A三个点突变的SrtA(WT),氨基酸序列见SEQ ID NO.7;
SrtA(M4)为含有P94S、D160N、D165A和K196T四个点突变的SrtA(WT),氨基酸序列见SEQ ID NO.4。
图3为两种带连接臂海兔毒素的化学结构式,GGG-PAB-MMAE和GGG-vc-PAB-MMAE;
其中,连接臂由三个甘氨酸和PAB自消去接头组成,也可以在两种之间再加缬氨酸-瓜氨酸(Val-Cit)二肽连接物;海兔毒素为单甲基auristatin E的别名。
图4为反相高效液相色谱法(RP-HPLC)分析不同长度Sortase A酶对抗CD20单克隆抗体的催化活性;
其中,所用色谱柱为Varian PLRP-S,所有抗体或偶联物样品上柱前经DTT或TCEP还原为轻重链;L0为未偶联的轻链,H0为未偶联的重链,H1为偶联一个海兔毒素的重链;OFA-HL是重链C末端含有LPETG标签的抗CD20单克隆抗体;不同长度Sortase A酶的解释见附图2的说明。
图5为RP-HPLC分析不同Sortase A酶突变体对抗CD20单克隆抗体偶联带连接臂海兔毒素的催化活性;
其中,不同Sortase A酶突变体的解释见附图2的说明。
图6为抗CD20单克隆抗体-海兔毒素偶联物(OFA-HL-MMAE)的一步纯化法洗脱图;其中,DAR1指药物抗体比率(Drug antibody ratio)为1。
图7为抗CD20单克隆抗体-海兔毒素偶联物(OFA-HL-vcMMAE)的一步纯化法洗脱图;其中,DAR1指药物抗体比率(Drug antibody ratio)为1,DAR2指药物抗体比率(Drug antibody ratio)为2。
图8为两种抗CD20单克隆抗体-海兔毒素偶联物的分子筛分析结果;
其中,OFA-HL是重链C末端含有LPETG标签的抗CD20单克隆抗体。
图9为两种抗CD20单克隆抗体-海兔毒素偶联物还原后的反相HPLC分析结果。;
其中,OFA-HL是重链C末端含有LPETG标签的抗CD20单克隆抗体。
图10为两种抗CD20单克隆抗体-海兔毒素偶联物的疏水作用层析(Hydrophobic Interactions Chromatography)结果。
图11为海兔毒素(GGG-vc-PAB-MMAE)的ESI-TOF质谱分析结果;其中,方框标记的峰为被选中的海兔毒素特征碎片。
图12为胰酶酶切后的为抗CD20单克隆抗体-海兔毒素偶联物(OFA-HL-vcMMAE)的ESI-TOF质谱分析结果;
其中,方框标记的峰为包含海兔毒素特征碎片信号的多肽片段。
图13为抗CD20单克隆抗体-海兔毒素偶联物(OFA-HL-vcMMAE)偶联部位的ESI-TOF质谱分析及排列结果。
图14为抗CD20单克隆抗体及其海兔毒素偶联物与Ramos细胞的亲和情况分析结果。
图15为抗CD20单克隆抗体-海兔毒素偶联物在多种CD20阳性肿瘤细胞上的体外活性结果。
图16为流式细胞仪检测抗CD20单克隆抗体-海兔毒素偶联物诱导CD20+的Ramos细胞凋亡活性。
图17为激光共聚焦显微镜分析抗CD20单克隆抗体-海兔毒素偶联物的内吞性结果;其中,DAPI为一种细胞核染色剂,FITC为二抗上带有的荧光标记,DIC为微分干涉差显微模式。
图18为抗CD20单克隆抗体-海兔毒素偶联物的体内抗肿瘤活性实验结果。
图19为抗CD20单克隆抗体-海兔毒素偶联物给药后荷瘤小鼠的体重变化结果。
图20为高剂量抗CD20单克隆抗体-海兔毒素偶联物下试验小鼠的关键器官切片分析结果。
具体实施方式
实施例1 OFA-HL抗体的制备
1、构建重链带LPETG标签的抗CD20单克隆抗体的表达载体
以重链带LPETG的抗CD20单克隆抗体(Ofatumumab-HeavyChain-LPETG,以下简写为OFA-HL)的表达载体构建携带抗CD20单克隆抗体基因的质粒,具体构建方法,参考中国发明专利ZL201310046396.9和ZL201310170344.2。
以上述质粒为模板,P1和P2为引物,利用PCR的方法,将LPETG的表达基因融合到抗体重链基因3’端,得到带有LPETG标签的抗CD20单克隆抗体重链基因。在双酶切后,将上述所得基因亚克隆至原来的pFUSE-CHIg-hG1表达载体中,得到表达OFA-HL重链的表达载体IgH-OFA-HL。表达OFA-HL轻链的载体按照上述专利构建,其序列与专利中所述的OFA轻链表达载体一致,简称为IgL-OFA-HL。
OFA-HL的结构示意图见附图1。
引物P1和P2的序列如下:
P1:5’-CGGAATTCCACCATGGAGAAAGACACACTCCTGCTATGGGTACTGCTGCT-3’;
P2:5’-ATAAGAATCGGCGGCCGCTTACTAACCTGTTTCTGGGAGTTTACCCGGAGACAGGGAG-3’。
2、OFA-HL的表达纯化
(1)OFA-HL表达载体稳定转染CHO细胞株
将OFA-HL轻重链表达载体IgL-OFA-HL和IgH-OFA-HL共转染至生长状态良好的CHO-K1细胞(购自上海细胞所)。
具体步骤如下:
选对数生长期细胞接种到6孔培养板上,约达到90%的融合;lipofectamine 2000脂质体8μl+F12k细胞培养基242μl,温育5min,轻、重链载体各2μg+F12k细胞培养基(共250μl,温育5min),混合两者,室温静止20min;将6孔板中的细胞用F12k细胞培养基冲洗两遍后,加入0.5ml F12k细胞培养基;将DNA与脂质体的混合液逐滴加入孔中,摇动培养板,轻轻混匀。在37℃,5%的CO2中孵育4小时;更换含有10%血清的F12k细胞培养液,在37℃,5%的CO2中孵育24h,用800μg/ml Zeocin、8μg/ml Blasticidin筛选,48h换一次液,筛选14天后铺96孔板挑选单克隆。
(2)OFA-HL高表达单克隆细胞株的筛选
单克隆生长至一定数量后,将其扩大到24孔板培养,收集上清。根据细胞长势用ELISA分两次检测抗体。挑出ELISA吸收高的组,换成无血清培养基EXCELL 302培养2天,培养基上清用SDS-PAGE检测抗体表达情况,从而挑选出表达量较高的细胞单克隆。
(3)表达OFA-HL抗体的单克隆CHO细胞无血清悬浮驯化
将高表达单克隆从含10%血清的培养基中直接传代到含5%血清的EX-CELL 302里。细胞长到90%融合度时,胰酶消化传代到含2.5%血清的EX-CELL 302中,等细胞长到80%融合度,胰酶消化继续在该条件下培养2代,血清再降到1%、0.5%,直到完全被无血清的EX-CELL 302(添加2mM L-glutamine,25mg/L硫酸葡聚糖)替代。此时细胞已经大部分悬浮,取悬浮细胞,8×105/ml接种于30ml EX-CELL 302,37℃摇床40rpm培养,4天左右时间换液,细胞在此过程中经历大量死亡又重新生长的过程,直到细胞长到约1.5×106/ml,以6×105/ml接种于60ml EX-CELL 302,80rpm培养直到稳定生长,最后密度达到3×106/ml。在无血清中表达3天纯化。
(4)OFA-HL抗体的纯化
离心收集悬浮培养的表达上清,加入10%体积比的0.5M Tris-HCl(pH 7.4)。GE Protein A亲和纯化柱用结合缓冲液50mM Tris-HCl,150mM NaCl(pH 7.4)平衡,流速1ml/min上样,上样结束后,继续用结合缓冲液冲洗亲和柱直至紫外吸收峰与基线接近。然后,用洗脱缓冲液1M醋酸钠(pH 3.0)洗脱,收集紫外吸收峰,即为纯化的抗体蛋白,收集后立刻用1M Tris-HCl(pH 7.4)调节洗脱液pH,然后SDS-PAGE检测抗体纯度。
实施例2抗CD20单克隆抗体-海兔毒素偶联物的制备和进一步纯化、分析
1、Sortase A酶及其突变体的表达纯化
首先,利用Takara细菌基因组提取试剂盒提取金黄色葡萄球菌的基因组,然后用PCR的方法,以下列引物(如表1所示)扩增出不同长度的Sortase A酶野生型。将不同Sortase A酶的基因插入至pET28(+)质粒上的NcoI和XhoI限制性酶切位点之间。
测序验证其序列正确后,利用Agilent公司的点突变试剂盒(QuikChange II Site-Directed Mutagenesis Kit)以pET28-SrtA(△N59)表达载体为模板,构建pET28-SrtA(M4)和pET28-SrtA(M3)表达载体,所用引物如下(如表1所示)。
不同长度Sortase A酶及其突变体的长度及突变的示意图,见附图2,所有的Sortase A酶均在N端带有His-tag以便于纯化。
将各Sortase A酶表达载体转化至Rosetta(DE3)(Novagen)感受态细胞,在LB培养基中培养单克隆,转速为220rpm,培养温度为37℃。当菌液OD600达到0.6~0.8时,加入0.5M IPTG诱导酶的表达,诱导持续至少4小时。诱导结束后,4000rpm离心30分钟收集菌体,并用French Pressure(Thermo Fisher)破碎菌体,8000rpm离心30分钟收集上清。
用Ni-NTA(HiTrap Ni-NTAcolumn,GE)亲和层析纯化Sortase A酶,洗脱后的酶用截留分子量为10kDa的超滤管(Amicon Ultra-10k,Millipore)将缓冲液置换为50mM Tris-HCl(pH 7.5),150mM NaCl,0.22μm膜过滤除菌后保存于-80℃备用。
2、Sortase A酶催化OFA-HL与带连接臂的海兔毒素偶联反应
带连接臂的海兔毒素(GGG-PAB-MMAE和GGG-vc-PAB-MMAE)购自南京联宁生物制药有限公司,它们的化学结构如附图3所示。
所有的Sortase A酶催化偶联反应均采用以下反应体系:50mM Tris-HCl,150mM NaCl,5mM CaCl2,pH 7.5;2uM抗CD20单克隆抗体(OFA-HL),8~200uM海兔毒素衍生物,25uM~100uM Sortase A酶,在37℃条件下反应4~12小时。
反应时间的增加有利于ADC的得率,但也有可能影响其结构稳定性。为检测酶促反应效率,将反应产物用过量DTT还原后,RP-HPLC检测偶联产物,具体步骤参考文献Pan L.Q.et al(2013)Novel conjugation of tumor-necrosis-factor-related apoptosis-inducing ligand(TRAIL)with monomethyl auristatin E for efficient antitumor drug delivery.Adv Mater 25:4718-4722。
比较不同长度的Sortase A酶的催化活性,在反应底物为OFA-HL和带连接臂的海兔毒素(GGG-PAB-MMAE),反应时间为4h时,结果如附图4所示,SrtA(WT),SrtA(△N59)和SrtA(△N109)都能催化OFA-HL的重链LPETG与海兔毒素衍生物发生反应,导致重链在HPLC谱图上发生偏移。根据偏移峰面积可知,SrtA(△N59)的催化活性最高。
比较不同Sortase A酶突变体的催化活性,反应底物为OFA-HL和带连接臂的海兔毒素(GGG-PAB-MMAE),反应时间为12h时,结果如附图5所示,SrtA(WT)和SrtA(M4)均具有催化活性,且SrtA(WT)的活性较高。而Srt(M3)不具有催化活性。
3、Sortase A酶制备的抗体偶联药物(即:抗CD20单克隆抗体-海兔毒素偶联物)的一步纯化法
选择催化活性较高的SrtA(△N59)催化制备抗CD20单克隆抗体-海兔毒素。
反应完成后,将反应液8000rpm离心30min去除少量沉淀,用等体积稀释缓冲液(50mM NaH2PO4,4M NaCl,pH 7.0)将其稀释两倍;利用疏水层析柱HiTrap Phenyl FF(Sub)分离已偶联和未偶联的抗CD20单克隆抗体。将层析柱用结合缓冲液(50mM NaH2PO4,2M NaCl,pH 7.0)平衡;将上述稀释后的反应液样品上疏水层析柱,上样完成后,继续用结合缓冲液洗涤柱子至紫外吸收峰趋于基线,充分洗去未反应的海兔毒素衍生物和未偶联的抗体等。然后用洗脱液(50mM NaH2PO4,pH 7.0,80%v/v;乙腈,20%v/v)梯度洗脱目的产物(ADC)。
抗CD20单克隆抗体OFA-HL与GGG-PAB-MMAE的反应液纯化过程如图6所示,大部分未反应的GGG-PAB-MMAE和Sortase A酶会流穿柱子,在梯度洗脱过程中,未反应的OFA-HL会首先出峰,然后是OFA-HL与GGG-PAB-MMAE的偶联产物(简称为OFA-HL-MMAE偶联物)紧接着出峰。可见仅需一个纯化步骤就可方便地将OFA-HL-MMAE偶联物从复杂的反应体系中分离出来。
抗CD20单克隆抗体OFA-HL与GGG-vc-PAB-MMAE的反应液纯化过程如图7所示,大部分未反应的GGG-vc-PAB-MMAE和Sortase A酶会流穿柱子,在梯度洗脱过程中,未反应的OFA-HL会首先出峰,然后是OFA-HL与GGG-vc-PAB-MMAE的偶联产物(简称为OFA-HL-vcMMAE偶联物)紧接着出峰。可见仅需一个纯化步骤就可方便地将OFA-HL-vcMMAE偶联物从复杂的反应体系中分离出来。
4、Sortase A酶制备的抗CD20单克隆抗体-海兔毒素偶联物的纯度分析
(1)分子筛分析
利用分子排阻色谱柱G3000SWXL(7.8mm×30cm dimension,5μm粒径,孔径)(Tosoh Bioscience LLC,USA)分析偶联物的纯度。
流动相为50mM NaH2PO4(pH 7.2),300mM NaCl,流速0.6ml/min,上样体积为20μl,检测波长为280nm。
结果如图8所示,纯化后的偶联物在分子筛图谱中呈现单一峰,未见聚集物。表明偶联物纯度高,且较为稳定。
(2)RP-HPLC分析
利用PLRP-S反相色谱柱分析还原后的偶联物,以分析抗体重链的偶联情况。
如附图9所示,在纯化除去未偶联的抗体后,偶联抗体重链(H1)的比例相比未纯化时(附图5和附图6)要高;OFA-HL-vcMMAE偶联物中的重链偶联比率相比OFA-HL-MMAE偶联物更高,表明vc连接物有利于提高Sortase A酶催化抗体重链偶联的得率。
(3)偶联物中不同DAR组分的分离和分析
RP-HPLC分析结果表明,两个偶联物的重链并非全部都能偶联海兔毒素衍生物,因此进一步对偶联物的不同DAR组分进行分离。
所用层析柱为TOSOH Butyl-NPR(4.6mm×3.5cm)疏水柱,流动相A为1.5M(NH4)2SO4,25mM NaH2PO4,pH 7.0,流动相B为25mM NaH2PO4,25%异丙醇(IPA),流速0.8ml/min,柱温为室温。利用从流动相A到流动相B的梯度洗脱分离不同DAR的偶联物。
结果如附图10所示,Sortase A酶催化制备的OFA-HL-MMAE仅偶联了一个药物,DAR=1;而OFA-HL-vcMMAE则含有DAR=1和DAR=2两种ADC组分。
表明GGG-vc-PAB-MMAE对抗体重链的偶联效率更高,而GGG-PAB-MMAE则有利于制备DAR=1的ADC。可能的原因在于vc连接物增强了GGG接头的亲核性,或增加了连接臂自由度,使得GGG-vc-PAB-MMAE更易亲核攻击OFA-HL-Sortase A酶复合物。
由附图1可见,Sortase A酶的催化活性中心Cys184残基被包裹在其底部,底物接近该活性中心可能会受到空间位阻效应,此时连接臂自由度更高且更长的药物更占优势。
另外,附图10结果也表明,OFA-HL-vcMMAE中的两种组分也可轻易由疏水层析柱分离。而相比化学法制备的抗CD20的ADC(参考文献:LawC.L.et al.2004.Clin Cancer Res 10:7842-7851),其产物由DAR=2,4,6,8等多种ADC组成,最终DAR=7.5,相比之下所述的Sortase A酶法制备的偶联物具有更高的均一性。
5、Sortase A酶制备的抗CD20单克隆抗体-海兔毒素偶联物的偶联位点质谱鉴定
为确定海兔毒素是否如设计那样被偶联到了抗CD20单克隆抗体重链LPETG片段上,利用Q-TOF质谱分析其偶联位点。
所用液质为Waters UPLC Acquity Bio H Class以及Xevo G2-S Q TOF,将待检测的ADC用胰酶(Trypsin)酶切成片段,用装备在液质上的MassPREP Desalting column分离分离片段,柱温为80℃。多肽片段分离的梯度条件为12分钟内从流动相A(10%(v/v)乙腈/水+0.1%甲酸)到流动相B(90%(v/v)乙腈/水+0.1%甲酸)。质谱条件:capillary(kV),2.5;Sampling Cone(V),60;Source Temperature(℃),100;Desolvation Temperature(℃),500;Desolvation Gas Flow(L/Hr),800;Mass range(m/z),400to 4000。
同时,对两个海兔毒素衍生物做质谱测定,选择三个特征峰作为寻找ADC偶联部分片段的标志。
附图11为GGG-vc-PAB-MMAE的质谱测定结果,以及选定的三个特征碎片峰:(质荷比m/z 106.08,428.31和533.39)。
附图12为在紫外图谱41.3min处找到含有海兔毒素衍生物上述三个特征碎片峰的质谱信号,表明该多肽片段含有GGG-vc-PAB-MMAE。
附图13为上述多肽片段的二级质谱结果,并对该结果进行排列,证实该片段为LPETGGG-vc-PAB-MMAE(也简写为LPETGGG-vcMMAE),进一步表明海兔毒素被偶联在目标位置。
实施例3 Sortase A酶催化制备的ADC与CD20+肿瘤细胞亲和力的研究
将各浓度梯度的OFA,OFA-HL,OFA-HL-MMAE和OFA-HL-vcMMAE分别与含有106个Ramos细胞的冰冷的孵育缓冲液混匀(10%BSA的PBS,pH 7.4),在冰上放置30min;用预冷的PBS(pH 7.4)洗涤两次,然后加入含1%BSA的PBS稀释的FITC标记羊抗人二抗,冰上孵育30min;洗涤两次后,用流式细胞仪Cytomics FC 500MCL(Beckman Coulter)检测平均光密度值(MFI)。以样品浓度为横坐标,对应的MFI为纵坐标绘图。
附图14为抗CD20单克隆抗体OFA及其偶联物对Ramos细胞的亲和力。附图14可见,在OFA的重链C末端加上LPETG标签后会稍微降低其对Ramos细胞的亲和力,而利用Sortase A酶催化OFA-HL偶联小分子毒素后则进一步降低其亲和力,不过降低的幅度很小。这与化学法偶联毒素会小幅度降低单克隆抗体对靶细胞的亲和力这一结果相一致。
实施例4抗CD20单克隆抗体-海兔毒素偶联物在多种CD20阳性肿瘤细胞上的体外活性
选择四种CD20阳性(Ramos,Raji,Daudi和Wil2-s)和一种CD20阴性的肿瘤细胞(K562)检测OFA-HL-MMAE和OFA-HL-vcMMAE的体外特异性抗肿瘤活性。
将3000~5000个左右状态良好的各类细胞铺到96孔细胞板上,然后与不同浓度的两种ADC混匀(用含有10%胎牛血清的细胞培养基梯度稀释),在37℃和5%二氧化碳的条件下孵育四天,使得ADC能充分发挥其抗肿瘤活性。
空白孔用等体积含有10%胎牛血清的细胞培养基替代,阴性对照孔用含有10%胎牛血清的细胞培养基加上相同个数的肿瘤细胞。孵育四天后,加入10%体积比的CCK-8试剂,继续孵育至细胞培养液呈现明显的黄色。用BioRad Model 680酶标仪读取96孔板在450nm处的吸光光度值。然后计算各孔的相对细胞存活率。相对细胞存活率(%)=(实验孔-空白孔)/(阴性孔-空白孔)*100%。
结果如附图15所示,OFA-HL-vcMMAE和OFA-HL-MMAE均表现出高于OFA-HL的活性。其中OFA-HL-vcMMAE的体外活性极高,对四种CD20+的肿瘤细胞均可有效杀伤,对Ramos细胞的IC50可达5pg/mL,远高于(约8000倍)文献报道的化学法合成抗CD20单克隆抗体-海兔毒素偶联物体外活性(IC50为40ng/mL)(Law CL,et al.Efficient elimination of B-lineage lymphomas by anti-CD20-auristatin conjugates.Clinical cancer research 10,7842-7851(2004).)。
实施例5抗CD20单克隆抗体-海兔毒素偶联物诱导细胞凋亡的活性
利用Annexin V-PI双染法检测OFA-HL-MMAE和OFA-HL-vcMMAE诱导CD20+细胞凋亡的活性。
在六孔板内培养Ramos细胞,每孔5万个细胞,并在每孔各加入终浓度为100ng/mL的OFA-HL、OFA-HL-MMAE或OFA-HL-vcMMAE,在37℃条件下继续孵育72h;孵育结束后,用PBS洗涤细胞,再用Annexin V/PI双染试剂盒对细胞进行免疫染色;最后用Cytomics FC 500MCL流式细胞仪分析早期凋亡细胞(AnnexinV+/PI-)和晚期凋亡细胞(AnnexinV+/PI+)的百分比,以此分析各偶联药物的诱导细胞凋亡活性。
附图16为流式细胞仪分析OFA-HL-MMAE和OFA-HL-vcMMAE诱导CD20+细胞凋亡活性的结果图。OFA-HL-MMAE和OFA-HL-vcMMAE的诱导细胞凋亡的比例分别为38.6%(19.4%+19.2%)和71.2%(37.8%+33.4%),与两者的体外活性结果一致,且都高于未偶联MMAE的OFA-HL(22%)。
实施例6抗CD20单克隆抗体-海兔毒素偶联物的内吞能力
抗CD20单克隆抗体-海兔毒素偶联物在肿瘤细胞内发挥活性之前,需要首先被细胞内吞。因此对于抗体偶联药物而言,内吞能力显得尤为重要。
为检测OFA-HL-MMAE和OFA-HL-vcMMAE被CD20+肿瘤细胞内吞的能力,将生长状态良好的Ramos细胞用5ug/mL的OFA、OFA-HL、OFA-HL-MMAE或OFA-HL-vcMMAE处理12小时。
之后用低速离心的方式将悬浮的Ramos细胞固定在载玻片上,细胞密度以细胞不相互粘连为准;用PBS(pH 7.4)小心洗涤两次,洗去未内吞或未结合的抗体及抗体偶联药物;然后用4%多聚甲醛在室温条件下固定细胞10min;PBS洗涤两次后,用含0.1%Triton X-100和0.2%BSA的PBS室温条件下处理细胞10min,使细胞膜变得通透。
之后用含2%BSA的PBS室温封闭30min;在细胞上滴加1:200稀释(用1%BSA的PBS稀释)后的羊抗人IgG-FITC,避光孵育45min;PBS洗去多余的二抗,用DAPI避光染色细胞核2min,最后再用PBS轻轻洗涤;细胞上滴加抗淬灭剂后盖上盖玻片,小心除去气泡,封片;最后用Zeiss LSM 510Meta激光共聚焦显微镜观察抗体或抗体偶联药物的细胞内积累情况。所有片子用同一种设定,以平行比较荧光强度。
附图17为抗CD20单克隆抗体及其海兔毒素偶联物的内吞结果图。
抗CD20单克隆抗体OFA被Ramos细胞内吞的能力非常弱,与文献报道抗CD20单克隆抗体不易被内吞相一致。C末端融合了LPETG的OFA-HL相比OFA在内吞能力上有微弱的提高。OFA-HL-MMAE被Ramos细胞内吞的能力与OFA-HL接近。而OFA-HL-vcMMAE的内吞能力相比OFA则提高了近10倍,表明利用Sortase A酶催化合成的抗CD20单克隆抗体-海兔毒素偶联物结合vc linker可显著提高其内吞能力。该结果与实施例4和实施例5中OFA-HL-vcMMAE所表现出的高活性相一致。
实施例7抗CD20单克隆抗体-海兔毒素偶联物的体内抗肿瘤活性
将裸鼠分为以下6组:生理盐水组,Herceptin-vcMMAE(20mg/kg)(不结合对照)组,OFA-HL-MMAE(5mg/kg)实验组,OFA-HL-MMAE(20mg/kg)实验组,OFA-HL-vcMMAE(5mg/kg)实验组,and OFA-HL-vcMMAE(20mg/kg)实验组。
每只裸鼠在右侧腋下皮下注射100μL 5×106个Ramos细胞,等肿瘤平均大小长至400mm3时,按照上述分组给药。给药方式为小鼠尾静脉注射,给药周期为每四天给药一次,共给药三次。定期测量小鼠肿瘤大小,长和宽分别用L和W表示,肿瘤体积为V,计算公式为V=(L×W2)/2。
附图18为抗CD20单克隆抗体-海兔毒素偶联物的体内抗肿瘤活性结果。OFA-HL-vcMMAE无论是5mg/kg还是20mg/kg的剂量,均可快速清除小鼠皮下的移植瘤,表现出极强的体内抗肿瘤活性。OFA-HL-MMAE在20mg/kg的剂量下也可有效清除移植瘤,在5mg/kg剂量下则能清除80%(5只中的4只)的移植瘤。而作为不结合对照的Herceptin-vcMMAE,即便在20mg/kg的剂量下仍无法抑制肿瘤的生长,其抑制肿瘤的效果与生理盐水组无太大差异。
另外文献(Law CL,et al.Efficient elimination of B-lineage lymphomas by anti-CD20-auristatin conjugates.Clinical cancer research 10,7842-7851(2004).)中报道DAR为7.5的化学法合成抗CD20单克隆抗体-海兔毒素偶联物(Rituximab-vcMMAE)在3mg/kg的剂量下可抑制肿瘤生长,但无法清除,肿瘤在26天后复发并快速生长。同时,该文献所用的Rituximab-vcMMAE携带海兔毒素的量为OFA-HL-vcMMAE的3.2倍,肿瘤起始平均体积仅为本实施例所述的四分之一。因此,OFA-HL-vcMMAE在体内抗肿瘤活性方面远优于文献报道的同类偶联物。
实施例8抗CD20单克隆抗体-海兔毒素偶联物对小鼠的潜在全身毒性研究
定时测量实施例12中的各对照组和实验组小鼠体重,以此表征潜在的全身毒性。抗体偶联药物若是在体内不稳定,偶联在抗体上的剧毒小分子药物(如MMAE)会游离,杀伤正常细胞,进而影响小鼠某些器官的功能失常,导致体重不可逆地急遽下降。
附图19为各组小鼠的体重变化图,可见生理盐水组和不结合对照组(Her-vcMMAE组)小鼠体重稳步上升。相比之下,OFA-HL-MMAE和OFA-HL-vcMMAE组小鼠的体重则增长缓慢,但未出现体重下降的情况,且在30天后体重开始快速上升,表明两种偶联物在高低剂量下均未对小鼠造成严重的不可逆损伤,表现出这两种抗体偶联药物的安全性。
实施例9抗CD20单克隆抗体-海兔毒素偶联物对小鼠的潜在急性毒性研究
从实施例12中的对照组和高剂量(20mg/kg)组中随机抽取一只小鼠,时间点为第三次给药结束后24h。根据动物伦理委员会相关规定人道处死小鼠后,快速取出其各脏器:心脏、肝脏、肺和肾脏,用10%中性福尔马林洗净、固定。石蜡包埋、切片、脱蜡、HE染色。在光学显微镜下观察对照组和实验组各器官切片中的细胞形态变化,以此判断抗体偶联药物是否对小鼠的主要脏器造成了急性损伤。
附图20为各组小鼠的主要脏器切片HE染色结果图。可见生理盐水对照组、不结合对照(Her-vcMMAE,20mg/kg)组和各高剂量(20mg/kg)实验组(OFA-HL-MMAE和OFA-HL-vcMMAE组)组织切片中的细胞形态一致,并未发现明显的细胞损伤(细胞凋亡、坏死等)情况,表明Sortase A制备的抗CD20单克隆抗体-海兔毒素偶联物在高剂量的情况下对小鼠没有急性毒性。
- 还没有人留言评论。精彩留言会获得点赞!