一种分子探针及其制备方法和应用与流程
本发明属于分子探针技术领域,涉及一种分子探针及其制备方法和应用。
背景技术:
细胞自噬是细胞依靠溶酶体将细胞内受损、变性或衰老的蛋白质以及细胞器运输到溶酶体进行消化降解的过程。正常生理情况下,细胞自噬利于细胞保持自稳状态;在发生应激时,细胞自噬防止有毒或致癌的损伤蛋白质和细胞器的累积,抑制细胞癌变,维持细胞内环境稳定和代谢平衡。细胞自吞噬在生物体生长发育、细胞分化及对环境应激的应答方面极为关键,它参与了细胞生存、死亡、病原体清除、抗原呈递等过程,并与癌症、感染、神经退行性疾病等多种疾病相关。因此,研究其作用机制不仅可以进一步了解生命的奥秘,同时也为一些疾病的治疗提供新的思路。
对于细胞自噬研究所使用的检测手段,如TEM,LC3免疫沉淀法,GFP-LC3荧光检测等方法却不能提供实时的、定量的检测数据,并且这些方法不能应用于组织活体水平。因此,开发一种新型材料用于细胞自噬的体内体外检测对于进行细胞自噬的基础机理研究以及组织活体水平自噬相关疾病的诊断和治疗具有重大意义。
目前已有研究的是基于FRET效应的纳米探针,但由于其标记的荧光分子灵敏性不佳特异性不强并且纳米颗粒影响细胞的自噬过程,影响了其广泛应用。CN 103275697 A公开了一种双芘两亲型荧光探针,该探针能检测金属离子,响应速度快、灵敏度高、响应范围宽,但其无法应用于对细胞的检测。
聚集诱导发光现象(Aggregation-induced emission,AIE)克服了传统荧光材料在聚集状态时荧光淬灭的缺点,显著提高了生物探针的灵敏性,在生物成像等领域有着广泛的应用前景。但用于体内细胞自噬成像的具有特异性响应的分子探针还鲜有报道,因而基于荧光分子的AIE特征,研发生物安全性能高、灵敏且特异性强的分子探针作为体内体外细胞自噬的诊断成像剂,将为实现自噬相关疾病的诊断和治疗提供了可能。
光声成像技术是一种非入侵式的新型生物医学成像方法。当脉冲激光照射到生物组织时,组织的光吸收区域将产生超声信号,通过探测光声信号能重建出组织中的光吸收分布图像。光声成像结合了纯光学组织成像中高选择性和纯超声组织成像中深穿透特性的优点,可得到高分辨率和高对比度的组织图像。因此,基于光声成像技术,研发生物安全性高、灵敏且特异性好的光声造影剂作为体内组织部位细胞自噬水平检测的成像剂,将为癌症的诊断及治疗提供有效的解决方案,具有重要的临床意义。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种分子探针及其制备方法和应用。
为达到此发明目的,本发明采用以下技术方案:
一方面,本发明提供一种分子探针,其特征在于,所述分子探针包括水溶性载体分子、响应性多肽和信号分子;其中,所述响应性多肽的序列为(Xaa)m(Thr-Phe-Gly-Phe)(Xaa)nLys(Xaa)i,其中Xaa表示为任意氨基酸,i,n和m独立地为0-4;所述水溶性载体分子和信号分子以酰胺键与响应性多肽相连。
其中,所述Xaa可以为Ala,Arg,Asp,Cys,Glu,Gly,His,Ile,Leu,Lys,Phe,Ser,Thr,Trp,Try,Pro,或Met。
其中,所述i可以为0、1、2、3或4;n可以为0、1、2、3或4;所述m可以为0、1、2、3或4。
本发明中,所述响应性多肽是对细胞自噬标志酶ATG4特异响应的,正常环境中,分子探针保持无荧光或低光声信号的单分子状态,当细胞自噬激活时,分子探针中多肽被切割并释放出信号分子,信号分子的聚集特征赋予探针荧光或光声信号增强的特性。
本发明中,所述响应性多肽被切割的位置为保守序列中(Thr-Phe-Gly-Phe)甘氨酸羧基。
优选地,所述响应性多肽的长度为5-17个氨基酸,例如可以是5、6、7、8、9、10、11、12、13、14、15、16或17,优选为6-12个氨基酸,进一步优选为7个氨基酸。
优选地,所述信号分子为具有聚集诱导效应(AIE)的荧光信号分子和/或具有聚集导致光声信号增强的脂溶性信号分子。
优选地,所述具有聚集诱导效应(AIE)的荧光信号分子为双芘类衍生物和/或四苯乙烯类化合物,优选为双芘。
所述双芘类化合物结构式如下:
所述四苯乙烯类化合物结构式如下:
优选地,所述具有聚集导致光声信号增强的脂溶性信号分子为共轭环状结构的卟啉类衍生物,优选为紫红素-18。
所述紫红素-18结构式如下:
优选地,所述水溶性载体分子为树枝状类超分子和/或超支化类分子,优选为四代树枝状分子。
优选地,所述分子探针具有如下式I所示结构:
第二方面,本发明提供一种第一方面所述的分子探针的制备方法,包括以下步骤:
(1)利用Fmoc固相合成方法在不溶于水的树脂上合成所述响应性多肽;
(2)将响应性多肽与所述信号分子和水溶性载体分子相连。
优选地,步骤(1)所述的不溶于水的树脂为Wang树脂。
优选地,所述Wang树脂的修饰密度为0.3-0.4mM,例如可以是0.3mM、0.31mM、0.32mM、0.35mM、0.36mM、0.38mM或0.4mM,优选为0.35mM。
优选地,步骤(1)的具体步骤包括:
(a)将第一个氨基酸的氨基端用Fmoc保护,羧基端固定于树脂上;
(b)用六氢吡啶的DMF溶液脱去氨基端的Fmoc保护,下一个赖氨酸使用侧链氨基为Dde保护的氨基酸,羧基用4-甲基吗啉和苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸酯的DMF溶液进行活化,与脱保护的第一个氨基酸进行缩合反应;
(c)剩余氨基酸的氨基端用Fmoc保护,重复步骤(b),直到完成所有氨基酸的缩合。
优选地,所述步骤(2)具体包括:将所述信号分子羧基活化,并连接在响应性多肽的氨基端;将响应性多肽中赖氨酸支链氨基活化,并连接在所述的载体分子羧基端,再从树脂上脱除。
优选地,所述响应性多肽中赖氨酸支链氨基活化在含0.2%水合肼的DMF溶液中进行。
优选地,所述从树脂上脱除在4-甲基吗啉和苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸酯的DMF溶液中进行。
第三方面,本发明提供一种如第一方面所述的分子探针用于体内体外细胞自噬酶ATG4的检测或用于体内体外细胞自噬水平实时定量评估。
优选地,所述细胞为肿瘤细胞。
相对于现有技术,本发明具有以下有益效果:
本发明的分子探针具有良好的水溶性和稳定性,可以自由扩散及胞吞形式进入细胞内部,并通过信号改变强度反映胞内自噬标志酶的活性,进而对体内体外细胞自噬水平进行定量评估。因此本发明的分子探针,不仅具备良好的特异性及信号稳定性,而且丰富了细胞自噬检测手段,具有广阔的应用前景。
附图说明
图1是实施例1中所述分子的核磁图谱(1H NMR);
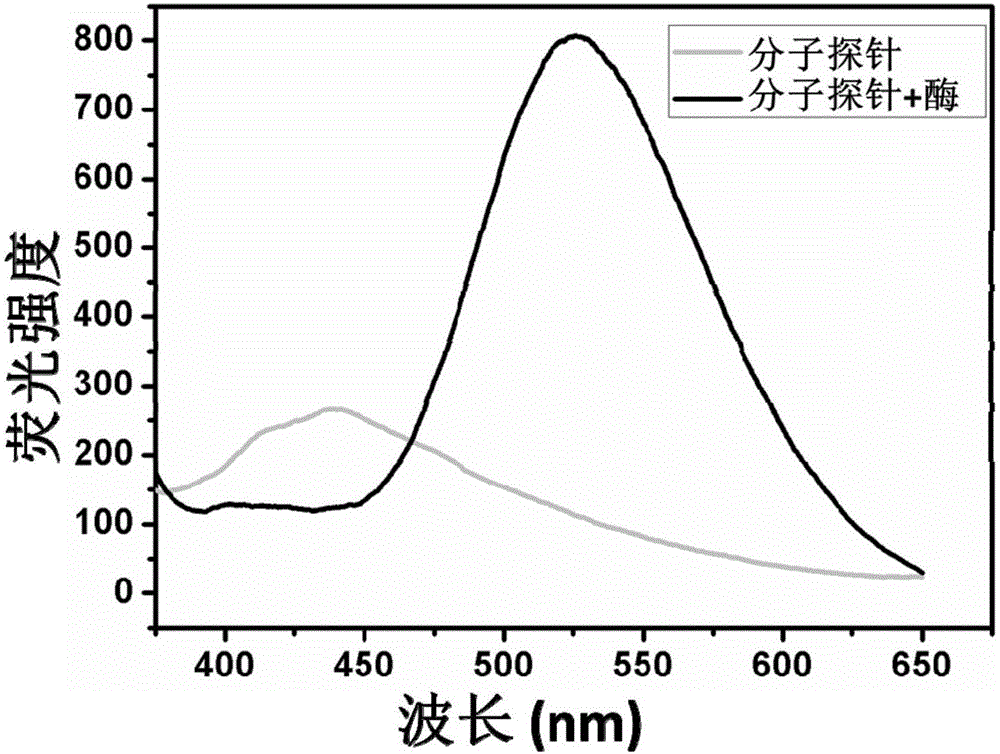
图2是实施例1中所述分子单体和聚集体的荧光光谱;
图3是实施例1中所述分子在不同浓度的分子探针在细胞自噬标志酶ATG4作用下的荧光光谱;
图4是实施例1中所述分子在雷帕霉素激活细胞自噬的MCF-7细胞模型中的荧光信号;
图5是实施例1中所述分子在雷帕霉素激活细胞自噬的MCF-7细胞模型中实时成像;
图6是实施例1中所述分子在雷帕霉素激活细胞自噬的MCF-7细胞模型中对细胞自噬水平的定量评价;
图7是实施例1中所述分子在MCF-7细胞自噬激活模型(雷帕霉素,饥饿两小时)和抑制模型(3甲基嘌呤,巴伐洛霉素)中的荧光成像;
图8是实施例1中所述分子在活体水平上细胞自噬激活模型中的荧光成像;
图9是实施例2中所述分子在活体水平上细胞自噬激活模型中的光声成像。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1:分子探针的制备
1、以AIE效应的双芘分子探针为例,响应性多肽序列为:
Gly-Lys-Gly-Ser-Phe-Gly-Phe-Thr-Gly。
多肽合成采用Fmoc固相合成法合成:(1)合成选用0.35mM修饰密度的Wang树脂,其中第一个氨基酸(甘氨酸)C端被固定于树脂上,N端被Fmoc保护,用20%(v/v)的六氢吡啶的DMF溶液脱去Fmoc保护,然后用茚三酮测试法测试去保护结果;
(2)将下一个氨基酸的羧基用0.4M的4-甲基吗啉和0.4M的苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸酯的DMF溶液活化,并加入到脱去保护的树脂中反应2小时,其中第二个氨基酸采用侧链氨基为Dde保护的赖氨酸,完成所有序列氨基酸的反应后,将双芘分子作为最后一个氨基酸重复上述步骤偶联在多肽的N端;
(3)将0.2%水合肼脱除第二个氨基酸(赖氨酸)的侧链氨基保护,将四代羧基树枝状分子偶联在赖氨酸侧链氨基上,再用含有2.5%水和2.5%三异丙基硅烷的三氟乙酸溶液将合成好的多肽从树脂上脱除,同时脱除其他氨基酸的侧链保护,将三氟乙酸用旋转蒸发法去除,然后产物用无水乙醚沉淀,洗涤并干燥,得到本发明所述的分子探针。
上述方法所得到的AIE效应的双芘分子探针的化学结构如下:
其核磁图谱如图1所示,从图中可以看出虚框中的峰为合成的双芘分子和响应性多肽的结构,四代树枝状分子结构有箭头标出,说明得到了设计的分子探针。
制备得到的分子探针的单体和聚集体的荧光光谱及在细胞自噬ATG4半胱氨酸酶作用下的荧光信号变化,其结果分别如图2、图3所示,由图2和图3可见,本发明的分子探针具有单体荧光淬灭和酶作用下产生聚集体并可见信号增强特性。
2、细胞水平细胞自噬成像实验:
选取MCF-7细胞为细胞自噬细胞模型。2×105个细胞首先接种在专用的细胞共聚焦培养皿中并在含10%的PBS DMEM 37℃以及5%CO2的条件下,孵育15个小时;再加入1μM的细胞自噬诱导剂雷帕霉素,保持在37℃以及5%CO2的条件下,孵育1个小时;将100μg/mL分子探针加入培养皿中,2小时后进行共聚焦成像。成像使用Zeiss LSM710激光共聚焦显微镜。激发光为405nm,收集450-600nm波段。从图4中可以看出,在雷帕霉素处理的细胞中检测有较强的荧光信号,说明该细胞处于自噬激活的状态;没有经过雷帕霉素处理的细胞中没有检测到荧光信号,说明该细胞处于自噬非激活的状态。另外通过应用细胞自噬诱导剂,我们检测了细胞自噬激活前后的实时状态。其结果如所图5所示,在雷帕霉素处理之前的细胞中并没有检测到荧光信号,但在雷帕霉素加入之后,随着时间的延长,检测到细胞内的荧光信号逐渐增强,说明雷帕霉素激活了细胞自噬,并随时间变化而增强。
我们验证了分子探针能否提供细胞自噬水平的定量信息。应用雷帕霉素建立细胞自噬水平不同的细胞模型,0μM雷帕霉素处理的细胞荧光信号定为100%。其结果如所图6所示,随着雷帕霉素浓度的增加,检测得到的荧光信号强度从100%(0μM)增强到154%(0.1μM)、268%(0.5μM)、350%(1.0μM),说明分子探针能够提供细胞自噬水平的定量信息。
3、分子探针特异性成像
选取EBSS缓冲液(饥饿)、雷帕霉素为细胞自噬诱导剂,选取3甲基嘌呤、巴伐洛霉素为细胞自噬抑制剂分别与MCF-7细胞孵育建立细胞自噬激活及抑制模型。100μg/mL分子探针加入培养皿中,2小时后进行共聚焦成像。成像使用Zeiss LSM710激光共聚焦显微镜。激发光为405nm,收集450-600nm波段。通过激光共聚焦显微镜观察分子探针对细胞自噬激活和非激活状态的响应。
结果如图7所示,在雷帕霉素和饥饿处理两个小时的细胞自噬激活模型中检测到较强的荧光信号;在3甲基嘌呤、巴伐洛霉素处理的细胞自噬抑制模型中,没有检测到荧光信号。结果说明分子探针对细胞自噬激活状态有特异性响应。
4、活体水平细胞自噬成像实验
选取2dpf斑马鱼胚胎为活体模型。首先2dpf斑马鱼胚胎在含1μM的细胞自噬诱导剂雷帕霉素的养鱼水中孵育24小时,将100μg/mL分子探针加入养鱼水中,4小时后进行共聚焦成像,确定分子探针可以用于活体水平细胞自噬的成像。
结果如图8所示,在生理盐水处理的细胞自噬抑制斑马鱼模型中,没有检测到荧光信号,但在雷帕霉素处理的细胞自噬激活模型中检测到较强的荧光信号,说明分子探针可用于活体水平细胞自噬成像实验。
实施例2:活体水平细胞自噬光声成像实验
以具有聚集产生增强光声信号特性的紫红素18分子探针在小鼠肿瘤模型中检测细胞自噬成像为例。其分子探针化学结构如下:
选取6-7周BALB/c裸鼠,在后腿部肌肉注射1×107个U87胶质瘤细胞建立小鼠后腿部肿瘤模型。通过尾静脉注入1μM的细胞自噬诱导剂雷帕霉素100μL细胞自噬激活肿瘤模型,之后通过尾静脉注入浓度为100μg/mL分子探针200μL,选取0.25、0.5、1、2、4、6、7、9、12和24小时时间节点,观察在不同的时间点对肿瘤部位细胞自噬水平的成像。
结果如图9所示,生理盐水处理的小鼠肿瘤部位,任何时间段都没有检测到荧光信号,说明生理盐水处理的小鼠肿瘤部位细胞自噬水平很低;在雷帕霉素处理的小鼠肿瘤部位,0.25小时时检测到微弱的荧光信号,随着时间延长,荧光信号强度也随之增强。7小时时,信号强度达到最大,但之后随着时间变化荧光信号强度随之变弱。说明雷帕霉素处理的小鼠肿瘤部位细胞处于自噬激活的状态,分子探针注入7小时时检测效果最好,之后肿瘤部位的分子探针可能被逐渐清除。
申请人声明,本发明通过上述实施例来说明本发明的基于双芘的酶响应自组装的多肽纳米材料及其制备方法和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!