葡聚糖硫酸钠诱导的鸡肠炎模型及其建立方法与流程
本发明涉及生物
技术领域:
,具体涉及葡聚糖硫酸钠诱导的鸡肠炎模型及其建立方法。
背景技术:
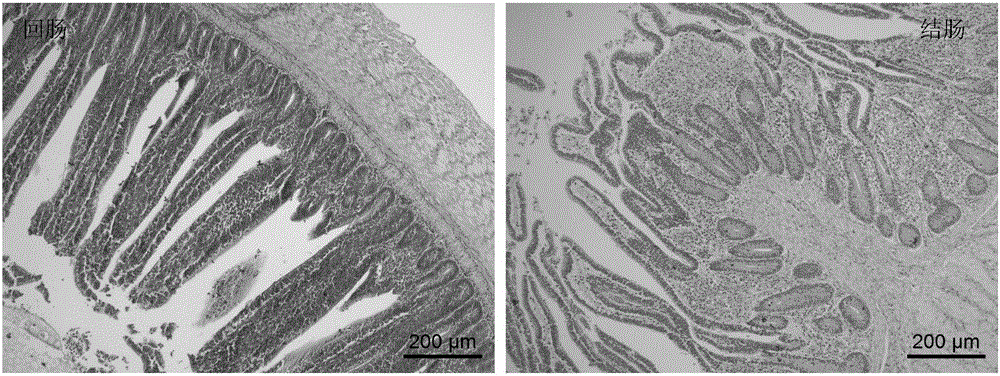
:随着高密度和集约化养殖生产的快速发展,家禽肠道疾病的复杂化日益明显,同时耐药菌株不断出现,严重威胁着鸡只的健康。我国每年因球虫病所致养鸡业的经济损失高达50亿元以上,仅仅药物一项就高达15.6~19.5亿元(平均每只肉鸡的抗球虫药支出约为0.12-0.15元)。加拿大农业与食品科学研究中心的Gong博士在2014年家禽营养与肠道健康国际学术交流会中指出,因坏死性肠炎导致的全球家禽业经济损失每年高达400亿美元。因此,养殖者越来越重视家禽肠道保健。有效调节鸡肠道功能,对于维护正常的消化吸收功能至关重要,不但能保证鸡获得良好的生产性能,而且能有效抵御疾病的侵袭。家禽的肠道疾病主要有球虫病、坏死性肠炎、沙门氏菌病等,在进行动物病理学、疫苗开发等研究,主要用上述疾病的病原菌或弱毒疫苗等造模。但这种造模方式,不仅要求在专门的动物隔离区进行试验,而且发病程度难以控制,还会引起其他并发症,给试验研究带来很多不确定因素,同时操作非常繁琐,较难在免疫应激或炎症研究中推广应用。目前普遍使用的细菌脂多糖(Lipopolysaccharides,LPS)诱发的肠道炎症模型,也存在因剂量大小和注射次数等差异而造成试验结果重复性差及稳定性低等缺点;而且,该模型的作用靶位点并不直接在肠道,不能作为专门的肠道炎症模型。葡聚糖硫酸钠(Dextransulfatesodium,DSS),是葡聚糖的聚阴离子衍生物,由Dextran和chlorosulfonicacid的酯化反应形成,具有增强或抑制细胞介导的免疫应答等作用。日本学者于1985年首次应用硫酸葡聚糖制备了小鼠UC模型,此后,该模型广泛用于筛选治疗人体炎症性肠病(IBD)的新方法和临床前新药物的开发及其发病机制的研究。但是,家禽和小鼠是两种不同纲的动物,在体型大小、消化系统和对DSS可耐受的剂量范围均具有较大差异,而且不同分子量的DSS会引发不同的病症,因此将小鼠UC模型运用到家禽上需另辟蹊径。近两年,有文献报道当鸡自由饮用分子量为40kDa的DSS溶液低于0.5%wt/vol(重量百分浓度)时未引起鸡任何病变,饮用0.75%wt/vol的DSS溶液会出现拉稀、便血等症状,6天后引起鸡只超过50%体重的下降,饮用1.5%-3%wt/vol的DSS溶液3天后鸡只全部死亡,若采用口服灌胃DSS0.45g/只/天(连续2天),则出现比饮用0.75%wt/volDSS溶液更严重的病症。但上述研究存在发病时间短、病情过于剧烈和有效剂量范围窄等一系列问题,口服灌喂还存在操作繁琐、重复性差和稳定性低等缺点,使其应用受到了限制。因此,研究出一种操作简单、有效剂量范围大、稳定可靠的鸡肠炎模型,是本领域技术人员亟待解决的问题。技术实现要素:为克服现有技术存在的缺陷,本发明的目的在于提供一种鸡肠道炎症模型的建立方法,为实现上述目的,本发明的技术方案如下:本发明的鸡肠炎模型的建立方法,包括以下步骤:(1)将葡聚糖硫酸钠溶于饮用水中,配制成葡聚糖硫酸钠溶液,现配现用;所述葡聚糖硫酸钠的分子量为36~50kDa;(2)选择14~18日龄鸡作为建立鸡肠炎模型的对象;(3)将所述步骤(2)中选择的鸡饲养在鸡舍中,自由饮用所述步骤(1)配制的葡聚糖硫酸钠溶液10天以上。优选的,所述葡聚糖硫酸钠溶液的重量百分浓度为0.75%~2.5%。更优选的,所述葡聚糖硫酸钠溶液的重量百分浓度为1.25%。优选的,所述鸡为健康快长型鸡。优选的,所述饲养采用笼养方式,连续光照进行饲养,保证充足饮水,自由采食,试验基础饲粮参考我国行业标准(NY/T33-2004)黄羽肉鸡营养需要配合而成,每天清扫鸡舍与定期清洗水箱,适时通风换气,保持良好的鸡舍卫生环境,并进行常规的免疫程序。优选的,所述自由饮用采用乳头式饮水器自由饮水。用本发明的上述方法可以得到鸡肠炎模型。本发明提供的鸡肠炎模型的建立方法可用于研究家禽肠道相关疾病的发病机制、筛选改善肠道炎症的方法、测试添加剂预防效果或药物的治疗效果,以提高肠道结构的完整性,从而增加对营养物质的吸收利用,减少在高密度和集约化家禽养殖过程中因肠道疾病引起的经济损失。与现有技术相比,本发明的DSS诱导鸡肠炎模型的建立方法操作简便,DSS有效剂量范围大,病理变化程度可调节,有利于在实验中进行大规模的推广和应用。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1为0.75%组显微镜下肠道病理学观察结果图(HE染色X100);图2为1.25%组显微镜下肠道病理学观察结果图(HE染色X100);图3为1.5%组显微镜下肠道病理学观察结果图(HE染色X100);图4为2.5%组显微镜下肠道病理学观察结果图(HE染色X100);图5为实施例1中不同浓度DSS溶液对肠道粘膜形态的影响结果,其中,不同字母表示差异显著。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明实施例中的一个优选实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1葡聚糖硫酸钠诱导的公鸡肠炎模型的建立本实施例的葡聚糖硫酸钠诱导的公鸡肠炎模型的建立方法按下述步骤操作:1、将分子量为36~50kDa的葡聚糖硫酸钠(美国MPBIO产品)溶于普通饮用水中,分别配制重量百分浓度为0.75%、1.25%、1.5%和2.5%的葡聚糖硫酸钠溶液,现配现用。2、选择240羽16日龄健康快长型公鸡,随机分为5组,每组3个重复,每个重复16只,饲养在种鸡育雏舍中。采用笼养方式,连续光照进行饲养,采用乳头式饮水器自由饮水。自由采食,试验基础饲粮参考我国行业标准(NY/T33-2004)黄羽肉鸡营养需要配合而成;每天清扫鸡舍与定期清洗水箱,适时通风换气,保持良好的鸡舍卫生环境,并进行常规的免疫程序。3、对照组自由饮用常规水,4个处理组分别自由饮用0.75%、1.25%、1.5%和2.5%wt/vol的葡聚糖硫酸钠溶液10天。4、试验期每天观察每重复组鸡只活动度、饮水量、饮食量、体重变化、粪便软硬度及便血情况,记录粪便软硬、便血和体重变化情况。5、10天后,每个重复组全群称重,并随机挑选3只鸡进行屠宰,采血用于细胞因子检测,采集3-5cm回肠和结肠组织用于H&E染色,进行常规病理学观察。实验结果:1、饮水中添加DSS浓度为0.75%wt/vol时,鸡只未发生便血、拉稀、死亡、体重下降等现象,其回肠黏膜长度和绒毛高度降低,回肠和结肠腔中有少许脱落的黏膜上皮,详见图1。2、饮水中添加DSS浓度为1.25%wt/vol时,鸡只发生轻微的便血、拉稀现象,体重略微下降,平均约5.7%体重的降低,给药10天死亡率为2.1%。其回肠黏膜长度和绒毛高度显著降低,结肠皱襞黏膜长度显著降低,回肠和结肠黏膜少许变性、脱落,详见图2。3、饮水中添加DSS浓度为1.5%wt/vol时,鸡只发生较严重的便血、拉稀现象,体重略微下降,平均约有6%体重的降低,给药10天死亡率为4.2%。其回肠黏膜长度和绒毛高度显著降低,结肠皱襞黏膜长度显著降低,回肠和结肠黏膜部分变性、崩解、脱落,黏膜少量淋巴细胞和异嗜白细胞浸润,详见图3。4、饮水中添加DSS浓度为2.5%wt/vol时,鸡只发生严重的便血、拉稀现象,体重下降非常明显,平均超过17%体重的降低,给药10天死亡率为20.8%。其回肠黏膜长度和绒毛高度极显著降低,回肠黏膜大部分变性、崩解、脱落,黏膜大量淋巴细胞和异嗜白细胞浸润;结肠大量淋巴细胞和异嗜白细胞浸润,甚至可达黏膜下层,绒毛和黏膜轮廓不清晰,部分腺体排列紊乱,详见图4。总结10天后,每组鸡只死亡率分别是:0、0、2.1%、4.2%和20.8%;表1为快长型公鸡16-27日龄体重变化,由表1结果可见,与对照组比,处理组给药10天后降低的体重分别为:1.1%、5.7%、6.0%和17.4%;由图5可知,病症严重程度为:2.5%组>1.5%组>1.25%组>0.75%组>对照组。表1组别试验期增加的体重:g试验后,与对照组比,体重降幅对照组455.83±10.14a0.75%组439.58±3.35a1.1%1.25%组406.25±7.83b5.7%1.5%组396.71±8.17b6.0%2.5%组296.67±15.66c17.4%注:不同字母表示差异显著实施例2葡聚糖硫酸钠诱导的母鸡肠炎模型的建立为进一步研究肠道炎症的适用范围及炎症发展程度,用本发明的方法,将试验对象为17日龄健康快长型母鸡随机分为2组,每组3个重复,每个重复16只鸡,对照组饮用常规水,处理组饮用1.5%wt/vol的DSS溶液,试验期为16天。饲养方式及管理同实施例1。实验结果观察:试验期间,鸡只前10天发病症状与实施例1中1.5%组基本一致,10天后,发病程度加快,发生严重的便血、拉稀现象,体重下降非常明显;16天试验结束后,对照组和处理组鸡只死亡率分别为2.1%和8.3%;表2为快长型母鸡18-32日龄体重变化,由表2结果可见,处理组降低的体重为20.4%。表2注:不同字母表示差异显著。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1