干细胞活性因子及其冻干粉剂的制作方法
本发明属于干细胞技术领域,具体涉及一种人源间充质干细胞因子及其冻干粉剂,以及其制备方法和用途,特别是涉及一种由脐带间充质干细胞制备干细胞活性因子的方法和干细胞因子冻干粉剂。本发明方法能够以高效、稳定的性能来制备干细胞活性因子和干细胞因子冻干粉剂。
背景技术:
近年来,随着对间充质干细胞研究的不断深入,其分泌因子已成为研究者们的热点。间充质干细胞可以分泌多种具有生物活性的细胞因子,这些细胞因子可有效地调控机体细胞信号传导、活化人体干细胞,进而生理性修复或替代机体损伤、病变及衰老的细胞。
干细胞在美容中的应用,最早是干细胞在整形外科中的运用,它是目前研究较多的一种干细胞美容技术。而在整形外科中应用得较多的干细胞种类主要亦是人脐带间充质干细胞、人脂肪间充质干细胞等。
传统上所谓的干细胞美容术,一般都是直接注射干细胞针剂。而这种注射用干细胞的来源主要是从流产的胚胎中提取的,所以难免会引起免疫排斥反应,而且存在一定的论理问题。即使是采用自体干细胞,如人脂肪间充质干细胞,但是在干细胞的培养扩增过程中亦难免会引入外源性的蛋白(胎牛血清),容易引起免疫排斥反应。所以,科学家们最近提出一种新干细胞应用方法,细胞培养上清活性因子及细胞裂解液的应用。
将细胞因子添加到美容化妆品,不仅具有一般化妆品的保湿美白功效,还能够修复受损皮肤,消除皮肤皱纹,收缩毛孔,改善面色等,越来越受到人们的关注。
含细胞因子的化妆品现已在多个国家上市,尤其是在以美容整形行业最为发达的韩国,细胞因子化妆品尤为甚行。我国亦有多家规模较大的干细胞公司开发出了细胞因子化妆品。但市面上的细胞因子化妆品一般采用干细胞培养上清液直接掺入或经冻干后掺入化妆品基质的方式制造,细胞因子含量较低,且含有大量糖分等其它杂质,使用这些化妆品后反而会造成皮肤干燥等不适感。
研究表明细胞培养上清液含有各种具有生物活性的细胞因子,它的应用可以避免干细胞美容时的产生的免疫排斥反应。但是,液态的培养上清在常温保存时间短,这就阻碍了它的推广和应用。
另外,针对目前的干细胞分选技术,比较常见是的磁珠分选,但常规的分选中,磁珠会随同干细胞一同进行后续的培养,即磁珠并没有从干细胞上脱离下来,这样对于干细胞的后期生产,必定会产生一定的影响,虽然有一些方法,如加入一些菌或者其他物质进行降解,但这样也相当于加入了其他的外源蛋白质等成分,造成对干细胞的二次污染,所以实际上并没有解决上述问题。
目前也有一些对干细胞培养上清液进行提取纯化的报道,但效果依然不佳,例如公告号为CN102600057B的专利公开了一种人胎盘干细胞提取物冻干粉的制备方法,对得到的细胞培养液采用单一的3000D滤膜进行超滤截留,其去掉了部分杂质,但是糖类等杂质仍未除掉,并且还导致细胞因子大量损失,修复效果不佳,而且同样也会造成皮肤干燥等不适感,实际应用价值较低。
此外,目前人们还难以以高效和/或稳定的性能来制取干细胞活性因子。
技术实现要素:
本发明目的在于提供一种以高效和/或稳定的性能来制取干细胞活性因子的方法。已经出人意料的发现,使用本发明方法可以实现本发明一个或多个方面的有益效果并制取干细胞活性因子及其冻干粉剂。本发明基于此发现而得以完成。
为此,本发明第一方面提供了一种干细胞活性因子冻干粉剂,其中包括干细胞活性因子以及冻干保护剂。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中所述冻干保护剂选自海藻糖、甘露醇、壳聚糖、右旋糖苷、甘氨酸、精氨酸、氨基乙酸。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其基本上是照包括如下步骤的方法制备得到的:
(1)脐带源间充质干细胞获取:
取健康足月剖宫产孕妇脐带,通过分离华通氏胶(Wharton's Jelly)法,使用华通氏胶悬浮法制备;将华通氏胶放于T75培养瓶,加入适量间充质干细胞(MSC)无血清培养基,置于37℃,5%的CO2培养箱内培养,培养7天以后出现细胞集落;约10-13天细胞达到饱和,可进行传代;细胞呈长梭形,是典型的成纤维细胞样形态;
(2)细胞扩增:
当细胞融合度达70-80%时,用生理盐水轻轻冲洗培养瓶细胞1-2次,添加3-5ml消化液,室温放置1-2分钟,镜下观察细胞接近球形,轻轻拍打瓶壁,中止消化,转移至离心管混匀,取样计数,按照8000个细胞/cm2进行传代,2-3天细胞密度达70-80%时,反复以上操作,以获得足够量的MSC,一般采用P3-P5代细胞制备;
(3)细胞鉴定检测:
细胞活率达90%以上时,流式检测标志物合格;
(4)干细胞活性因子的制备:
4i)细胞培养至最旺盛时,收集上清至离心管,0.22μm滤膜过滤上清除菌;
4ii)用生理盐水清洗2-3次培养瓶,弃去,然后采用细胞饥饿法加入10ml生理盐水/T225培养瓶继续培养12-24小时,待细胞变圆,吹打混匀后移至离心管,采用超声破碎仪破碎细胞后离心1400rpm,离心5min,收集的上清,经0.22μm滤膜过滤除菌;
4iii)将步骤4i)和4ii)的上清混合,采用截留分子量为10KD的纯化超滤系统浓缩,即得干细胞活性因子浓缩液;
(5)冷冻干燥:
5i)向步骤(4)所得干细胞活性因子浓缩液中添加冻干保护剂,分装到西林瓶中,半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(2)中所述消化液是0.25%胰酶。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(3)中所述流式检测标志物为:CD73、CD90、CD105表达阳性,HLA-DR、CD11b、CD19、CD34、CD45表达阴性。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(3)中所述流式检测标志物结果中显示细胞具有成脂、成骨、成软骨分化潜能。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(4)之4i)中细胞培养至最旺盛时是指细胞融合度约70-80%。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(4)之4ii)中采用超声破碎仪破碎细胞时,其程序为:4℃,500w,超声2秒,间隔8秒,86个循环。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(5)之5i)中所述冻干保护剂选自海藻糖、甘露醇、壳聚糖、右旋糖苷、甘氨酸、精氨酸、氨基乙酸。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(5)之5i)中所述冻干保护剂在所述浓缩液中的浓度为0.5%~10%,特别是1%~6%。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(5)之5i)中所述分装是以3ml/支的量将所述干细胞活性因子浓缩液添加到所述西林瓶中。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(5)之5ii)中所述冷冻干燥程序包括如下操作程序:
预冷冻:在常压下预冷冻3.5h(预冷冻温度通常为-30~-40℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-20~-25℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至33~37℃,在此条件下继续干燥2-5h。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其在制备时还进一步包括步骤(6),即对步骤(4)所得干细胞活性因子浓缩液或者步骤(5)所得干细胞活性因子冻干粉剂进行干细胞活性因子检测的操作,具体如下:
取干细胞活性因子浓缩液3ml,或者冻干前体积为3ml的干细胞活性因子冻干粉剂用3ml溶媒(溶媒可以是超纯水或透明质酸溶液)稀释,采用重组人源抗体包被的酶联免疫试剂盒(例如,本发明亦采用,R&D公司提供的商品化试剂盒)测定干细胞活性因子的含量。
已经发现,当在本发明步骤4ii)中采用细胞饥饿法加入10ml生理盐水/T225培养瓶继续培养12-24小时过程中,向所述生理盐水中添加0.1~0.2mmol/L浓度的枸橼酸钠时(此枸橼酸钠会引入到后面的超滤浓缩步骤),在步骤4iii)中进行超滤浓缩后,测定浓缩液中活性因子含量(以四种典型活性因子EGF、FGF、VEGF、IL-6总量表示,下同;以C1表示)与遗弃液中活性因子含量(以C2表示),按下式计算遗弃百分数:遗弃百分数=(C2÷C1)×100%。此遗弃百分数越低表示活性因子损失量越小。结果显示,在下文本发明制备干细胞活性因子浓缩液的各实施例中,当在上述步骤中添加0.1~0.2mmol/L浓度的枸橼酸钠时,遗弃百分数均小于1.7%,均在1.1~1.7%范围内;而当不添加枸橼酸钠时遗弃百分数达6~9%;例如,实施例1中遗弃百分数为7.6%,但是实施例1的步骤4ii)的10ml生理盐水中添加0.15mmol/L浓度的枸橼酸钠时遗弃百分数为1.2%。但在补充的试验中,本发明人照CN105543313A(201511016742.4)说明书[0037]~[0045]所述方法制备活性因子浓缩液,同时测定浓缩液和遗弃液中上述四种典型活性因子EGF、FGF、VEGF、IL-6总量并计算遗弃百分数,结果遗弃百分数为13.4%。
根据本发明第一方面任一实施方案的干细胞活性因子冻干粉剂,其中步骤(5)之5i)中,在添加冻干保护剂的同时,还添加醋酸钠,其量占浓缩液体积的0.02~0.05%(重量/体积百分数)。已经出人意料地发现,在添加醋酸钠后,干细胞活性因子冻干粉剂的活性因子残余百分数显著地高于未添加醋酸钠所得冻干粉剂。具体地说,本发明下文冻干粉例1至冻干粉例5所得全部冻干粉剂,它们的活性因子残余百分数均在81~86%范围内,而当在冻干粉例1至冻干粉例5步骤5i)中随冻干保护剂一起分别添加0.02%、0.035%、或0.05%时,所得的分部全部冻干粉剂它们的活性因子残余百分数均在94~97%范围内。
进一步的,本发明第二方面提供了一种制备干细胞活性因子的方法,其包括以下步骤:
(1)脐带源间充质干细胞获取:
取健康足月剖宫产孕妇脐带,通过分离华通氏胶(Wharton's Jelly)法,使用华通氏胶悬浮法制备;将华通氏胶放于T75培养瓶,加入适量间充质干细胞(MSC)无血清培养基,置于37℃,5%的CO2培养箱内培养,培养7天以后出现细胞集落;约10-13天细胞达到饱和,可进行传代;细胞呈长梭形,是典型的成纤维细胞样形态;
(2)细胞扩增:
当细胞融合度达70-80%时,用生理盐水轻轻冲洗培养瓶细胞1-2次,添加3-5ml消化液,室温放置1-2分钟,镜下观察细胞接近球形,轻轻拍打瓶壁,中止消化,转移至离心管混匀,取样计数,按照8000个细胞/cm2进行传代,2-3天细胞密度达70-80%时,反复以上操作,以获得足够量的MSC,一般采用P3-P5代细胞制备;
(3)细胞鉴定检测:
细胞活率达90%以上时,流式检测标志物合格;
(4)干细胞活性因子的制备:
4i)细胞培养至最旺盛时,收集上清至离心管,0.22μm滤膜过滤上清除菌;
4ii)用生理盐水清洗2-3次培养瓶,弃去,然后采用细胞饥饿法加入10ml生理盐水/T225培养瓶继续培养12-24小时,待细胞变圆,吹打混匀后移至离心管,采用超声破碎仪破碎细胞后离心1400rpm,离心5min,收集的上清,经0.22μm滤膜过滤除菌;
4iii)将步骤4i)和4ii)的上清混合,采用截留分子量为10KD的纯化超滤系统浓缩,即得干细胞活性因子浓缩液。
根据本发明第二方面任一实施方案的方法,其中步骤(2)中所述消化液是0.25%胰酶。
根据本发明第二方面任一实施方案的方法,其中步骤(3)中所述流式检测标志物为:CD73、CD90、CD105表达阳性,HLA-DR、CD11b、CD19、CD34、CD45表达阴性。
根据本发明第二方面任一实施方案的方法,其中步骤(3)中所述流式检测标志物结果中显示细胞具有成脂、成骨、成软骨分化潜能。
根据本发明第二方面任一实施方案的方法,其中步骤(4)之4i)中细胞培养至最旺盛时是指细胞融合度约70-80%。
根据本发明第二方面任一实施方案的方法,其中步骤(4)之4ii)中采用超声破碎仪破碎细胞时,其程序为:4℃,500w,超声2秒,间隔8秒,86个循环。
根据本发明第二方面任一实施方案的方法,其还进一步包括步骤(5),即对步骤(4)所得干细胞活性因子进行冷冻干燥的步骤。
根据本发明第二方面任一实施方案的方法,其中所述对干细胞活性因子进行冷冻干燥(以便于长期保存)的步骤包括如下操作:
5i)向步骤(4)所得干细胞活性因子浓缩液中添加冻干保护剂,分装到西林瓶中,半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂。
由此冷冻干燥所得冻干粉通常呈疏松的多孔组织,并且可以在室温下可以长期保存。
根据本发明第二方面任一实施方案的方法,其中步骤(5)之5i)中所述冻干保护剂选自海藻糖、甘露醇、壳聚糖、右旋糖苷、甘氨酸、精氨酸、氨基乙酸。
根据本发明第二方面任一实施方案的方法,其中步骤(5)之5i)中,在添加冻干保护剂的同时,还添加醋酸钠,其量占浓缩液体积的0.02~0.05%(重量/体积百分数)。
根据本发明第二方面任一实施方案的方法,其中步骤(5)之5i)中所述冻干保护剂在所述浓缩液中的浓度为0.5%~10%,特别是1%~6%。
根据本发明第二方面任一实施方案的方法,其中步骤(5)之5i)中所述分装是以3ml/支的量将所述干细胞活性因子浓缩液添加到所述西林瓶中。
根据本发明第二方面任一实施方案的方法,其中步骤(5)之5ii)中所述冷冻干燥程序包括如下操作程序:
预冷冻:在常压下预冷冻3.5h(预冷冻温度通常为-30~-40℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-20~-25℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至33~37℃,在此条件下继续干燥2-5h。
根据本发明第一方面任一实施方案的方法,其还进一步包括步骤(6),即对步骤(4)所得干细胞活性因子浓缩液或者步骤(5)所得干细胞活性因子冻干粉剂进行干细胞活性因子检测的操作,具体如下:
取干细胞活性因子浓缩液3ml,或者冻干前体积为3ml的干细胞活性因子冻干粉剂用3ml溶媒(溶媒可以是超纯水或透明质酸溶液)稀释,采用重组人源抗体包被的酶联免疫试剂盒(例如,本发明亦采用,R&D公司提供的商品化试剂盒)测定干细胞活性因子的含量。
本发明任一方面或该任一方面的任一实施方案所具有的任一技术特征同样适用其它任一实施方案或其它任一方面的任一实施方案,只要它们不会相互矛盾,当然在相互之间适用时,必要的话可对相应特征作适当修饰。下面对本发明的各个方面和特点作进一步的描述。
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
本发明所得干细胞活性因子或其冻干粉剂,可以直接搭配溶媒(溶媒可以是超纯水或透明质酸溶液),可直接用于美容护肤方面,包括美容、祛斑、修复疤痕等;或者,本发明所得干细胞活性因子或其冻干粉剂,可以直接添加到各种制剂的美容护肤产品中使用;或者,本发明所得干细胞活性因子或其冻干粉剂,可以直接作为针剂使用,或者作为面霜、乳液、水液、或常见的各种制剂使用。
本发明方法具有如下有益效果:
1、细胞来源具有均质性,符合干细胞的生物学特性,从而保证了干细胞源性活性因子的分泌量,及性能稳定性;
2、培养基不含致敏成分,如抗生素,胎牛血清,适合各种人群使用(尤其对青链霉素过敏人群)。
3、冻干粉制剂便于长途运输和长期保存。
附图说明
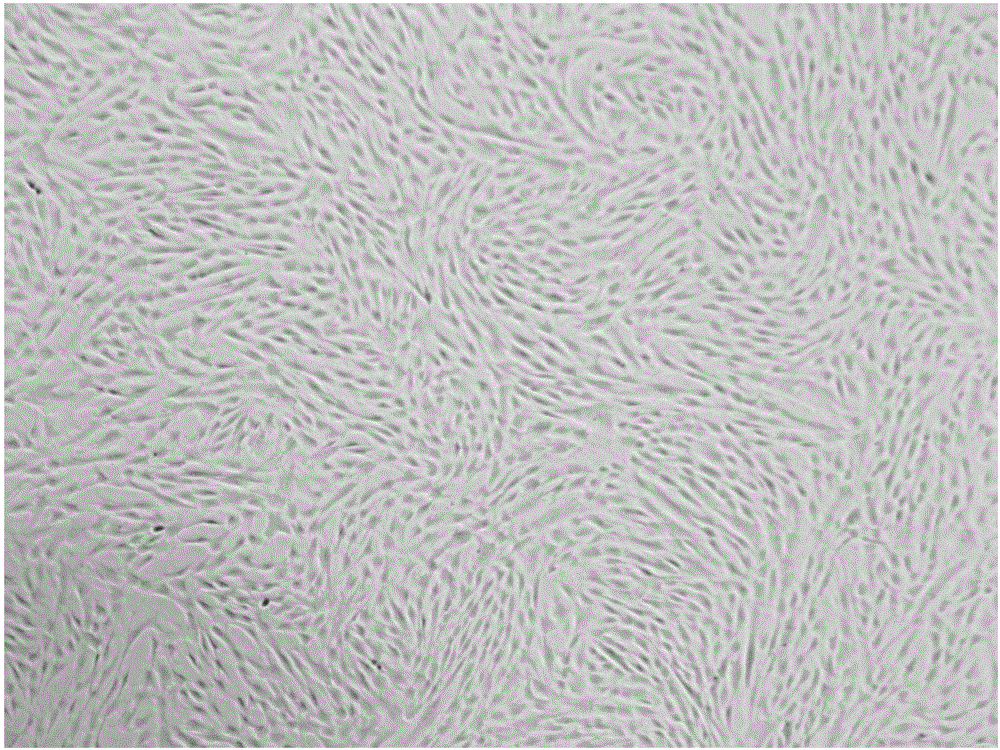
图1:P0代细胞图(×4)
图2:P5代细胞图(×10)
图3:P5代细胞流式标志物检测结果。
图4:P5代干细胞分化潜能检测,图中显示了对照组、成软骨组、成脂肪组、成骨组的检测结果。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。
实施例1:制备干细胞活性因子浓缩液
(1)脐带源间充质干细胞获取:
取健康足月剖宫产孕妇脐带,通过分离华通氏胶(Wharton's Jelly)法,使用华通氏胶悬浮法制备;将华通氏胶放于T75培养瓶,加入适量间充质干细胞(MSC)无血清培养基,置于37℃,5%的CO2培养箱内培养,培养7天以后出现细胞集落;约12天细胞达到饱和,可进行传代;细胞呈长梭形,是典型的成纤维细胞样形态(例如参见图1);
(2)细胞扩增:
当细胞融合度达70-80%时,用生理盐水轻轻冲洗培养瓶细胞1-2次,添加4ml消化液(0.25%胰酶),室温放置1-2分钟,镜下观察细胞接近球形,轻轻拍打瓶壁,中止消化,转移至离心管混匀,取样计数,按照8000个细胞/cm2进行传代,2-3天细胞密度达70-80%时,反复以上操作,以获得足够量的MSC,一般采用P3-P5代细胞制备(本例使用P5代细胞,其显微照片例如参见图2);
(3)细胞鉴定检测:
细胞活率达90%以上时,流式检测标志物合格,标准为:CD73、CD90、CD105表达阳性,HLA-DR、CD11b、CD19、CD34、CD45表达阴性(例如参见图3),且结果中显示细胞具有成脂、成骨、成软骨分化潜能(例如参见图4);
(4)干细胞活性因子的制备:
4i)细胞培养至最旺盛时(即细胞融合度约70-80%),收集上清至离心管,0.22μm滤膜过滤上清除菌;
4ii)用生理盐水清洗2-3次培养瓶,弃去,然后采用细胞饥饿法加入10ml生理盐水/T225培养瓶继续培养18小时,待细胞变圆,吹打混匀后移至离心管,采用超声破碎仪破碎细胞(其程序为:4℃,500w,超声2秒,间隔8秒,86个循环)后离心1400rpm,离心5min,收集的上清,经0.22μm滤膜过滤除菌;
4iii)将步骤4i)和4ii)的上清混合,采用截留分子量为10KD的纯化超滤系统浓缩,即得干细胞活性因子浓缩液。
测定活性因子:取干细胞活性因子浓缩液3ml,采用重组人源抗体包被的酶联免疫试剂盒(R&D公司供)测定干细胞活性因子(测定了四种典型活性因子EGF、FGF、VEGF、IL-6)的含量,以上述四种典型活性因子的总量作为浓缩液的总活性因子含量。另外,同法测定步骤4iii)所得遗弃液中的总活性因子含量。
另外,计算分别四种典型活性因子EGF、FGF、VEGF、IL-6的回收率,结果显示,本发明(实施例1~实施例3)方法中EGF、FGF、VEGF、IL-6四者的回收率分别大于92.2%、大于94.1%、91.6%、92.7%,表明本发明方法具有优异的活性因子回收率。CN105543313A(201511016742.4)说明书[0037]~[0060]所述方法制备活性因子时,测得IL-6的回收率小于87%。
实施例2:制备干细胞活性因子浓缩液
(1)脐带源间充质干细胞获取:
取健康足月剖宫产孕妇脐带,通过分离华通氏胶(Wharton's Jelly)法,使用华通氏胶悬浮法制备;将华通氏胶放于T75培养瓶,加入适量间充质干细胞(MSC)无血清培养基,置于37℃,5%的CO2培养箱内培养,培养7天以后出现细胞集落;约10天细胞达到饱和,可进行传代;细胞呈长梭形,是典型的成纤维细胞样形态;
(2)细胞扩增:
当细胞融合度达70-80%时,用生理盐水轻轻冲洗培养瓶细胞1-2次,添加5ml消化液(0.25%胰酶),室温放置1-2分钟,镜下观察细胞接近球形,轻轻拍打瓶壁,中止消化,转移至离心管混匀,取样计数,按照8000个细胞/cm2进行传代,2-3天细胞密度达70-80%时,反复以上操作,以获得足够量的MSC,一般采用P4代细胞制备;
(3)细胞鉴定检测:
细胞活率达90%以上时,流式检测标志物合格,标准为:CD73、CD90、CD105表达阳性,HLA-DR、CD11b、CD19、CD34、CD45表达阴性,且结果中显示细胞具有成脂、成骨、成软骨分化潜能;
(4)干细胞活性因子的制备:
4i)细胞培养至最旺盛时(即细胞融合度约70-80%),收集上清至离心管,0.22μm滤膜过滤上清除菌;
4ii)用生理盐水清洗2-3次培养瓶,弃去,然后采用细胞饥饿法加入10ml生理盐水/T225培养瓶继续培养12小时,待细胞变圆,吹打混匀后移至离心管,采用超声破碎仪破碎细胞(其程序为:4℃,500w,超声2秒,间隔8秒,86个循环)后离心1400rpm,离心5min,收集的上清,经0.22μm滤膜过滤除菌;
4iii)将步骤4i)和4ii)的上清混合,采用截留分子量为10KD的纯化超滤系统浓缩,即得干细胞活性因子浓缩液。
测定活性因子:取干细胞活性因子浓缩液3ml,采用重组人源抗体包被的酶联免疫试剂盒(R&D公司供)测定干细胞活性因子(测定了四种典型活性因子EGF、FGF、VEGF、IL-6)的含量,以上述四种典型活性因子的总量作为浓缩液的总活性因子含量。另外,同法测定步骤4iii)所得遗弃液中的总活性因子含量。
实施例3:制备干细胞活性因子浓缩液
(1)脐带源间充质干细胞获取:
取健康足月剖宫产孕妇脐带,通过分离华通氏胶(Wharton's Jelly)法,使用华通氏胶悬浮法制备;将华通氏胶放于T75培养瓶,加入适量间充质干细胞(MSC)无血清培养基,置于37℃,5%的CO2培养箱内培养,培养7天以后出现细胞集落;约13天细胞达到饱和,可进行传代;细胞呈长梭形,是典型的成纤维细胞样形态;
(2)细胞扩增:
当细胞融合度达70-80%时,用生理盐水轻轻冲洗培养瓶细胞1-2次,添加3ml消化液(0.25%胰酶),室温放置1-2分钟,镜下观察细胞接近球形,轻轻拍打瓶壁,中止消化,转移至离心管混匀,取样计数,按照8000个细胞/cm2进行传代,2-3天细胞密度达70-80%时,反复以上操作,以获得足够量的MSC,一般采用P3代细胞制备;
(3)细胞鉴定检测:
细胞活率达90%以上时,流式检测标志物合格,标准为:CD73、CD90、CD105表达阳性,HLA-DR、CD11b、CD19、CD34、CD45表达阴性,且结果中显示细胞具有成脂、成骨、成软骨分化潜能;
(4)干细胞活性因子的制备:
4i)细胞培养至最旺盛时(即细胞融合度约70-80%),收集上清至离心管,0.22μm滤膜过滤上清除菌;
4ii)用生理盐水清洗2-3次培养瓶,弃去,然后采用细胞饥饿法加入10ml生理盐水/T225培养瓶继续培养24小时,待细胞变圆,吹打混匀后移至离心管,采用超声破碎仪破碎细胞(其程序为:4℃,500w,超声2秒,间隔8秒,86个循环)后离心1400rpm,离心5min,收集的上清,经0.22μm滤膜过滤除菌;
4iii)将步骤4i)和4ii)的上清混合,采用截留分子量为10KD的纯化超滤系统浓缩,即得干细胞活性因子浓缩液。
测定活性因子:取干细胞活性因子浓缩液3ml,采用重组人源抗体包被的酶联免疫试剂盒(R&D公司供)测定干细胞活性因子(测定了四种典型活性因子EGF、FGF、VEGF、IL-6)的含量,以上述四种典型活性因子的总量作为浓缩液的总活性因子含量。另外,同法测定步骤4iii)所得遗弃液中的总活性因子含量。
冻干粉例1:制备干细胞活性因子冻干粉剂
5i)取步骤实施例1所得干细胞活性因子浓缩液,向其中添加冻干保护剂(海藻糖)并溶解,且使冻干保护剂在其中溶解后的浓度达4%,分装到西林瓶中(3ml/支),半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂;冷冻干燥程序如下:
预冷冻:在常压下预冷冻3.5h(预冷冻温度为-35℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-23℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至35℃,在此条件下继续干燥4h。
测定冻干粉剂的活性因子:
取干细胞活性因子冻干粉剂适量(约相当于冷冻干燥前浓缩液3ml的量,采用重组人源抗体包被的酶联免疫试剂盒(R&D公司供)测定干细胞活性因子(测定了四种典型活性因子EGF、FGF、VEGF、IL-6)的含量,以上述四种典型活性因子的总量作为浓缩液的总活性因子含量。比较冷冻干燥后相对于冷冻干燥前的总活性因子含量百分数,此百分数越接近于100%则越好。结果显示,冻干粉例1至冻干粉例5的全部冻干粉剂,其总活性因子含量百分数均在98~101%范围内,显示本发明冻干粉具有优异的性质,制备冷冻干燥粉剂过程中活性因子没有损失。
测定冻干粉剂在长时间放置后的活性因子残余百分数:将密封的细胞活性因子冻干粉剂置30℃温度下放置8个月,依上法分别测定0月时四种典型活性因子EGF、FGF、VEGF、IL-6的总含量以及8月时四种典型活性因子EGF、FGF、VEGF、IL-6的总含量,将8月四种活性因子总含量除以0月四种活性因子总含量再乘以100%所得的百分数,即为活性因子残余百分数。
冻干粉例2:制备干细胞活性因子冻干粉剂
5i)取步骤实施例2所得干细胞活性因子浓缩液,向其中添加冻干保护剂(甘露醇)并溶解,且使冻干保护剂在其中溶解后的浓度达1%,分装到西林瓶中(3ml/支),半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂;冷冻干燥程序如下:
预冷冻:在常压下预冷冻3.5h(预冷冻温度为-40℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-20℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至37℃,在此条件下继续干燥2h。
冻干粉例3:制备干细胞活性因子冻干粉剂
5i)取步骤实施例3所得干细胞活性因子浓缩液,向其中添加冻干保护剂(壳聚糖)并溶解,且使冻干保护剂在其中溶解后的浓度达6%,分装到西林瓶中(3ml/支),半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂;冷冻干燥程序如下:
预冷冻:在常压下预冷冻3.5h(预冷冻温度为-30℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-25℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至33℃,在此条件下继续干燥5h。
冻干粉例4:制备干细胞活性因子冻干粉剂
5i)分别取步骤实施例1、2、3所得干细胞活性因子浓缩液,向其中添加冻干保护剂(右旋糖苷)并溶解,且使冻干保护剂在其中溶解后的浓度达4%,分装到西林瓶中(3ml/支),半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂;冷冻干燥程序如下:
预冷冻:在常压下预冷冻3.5h(预冷冻温度为-35℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-25℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至35℃,在此条件下继续干燥3h。
冻干粉例5:制备干细胞活性因子冻干粉剂
5i)分别取步骤实施例1、2、3所得干细胞活性因子浓缩液,向其中添加冻干保护剂(甘氨酸)并溶解,且使冻干保护剂在其中溶解后的浓度达3%,分装到西林瓶中(3ml/支),半加塞,置冷冻干燥机内;
5ii)开启冷冻干燥机,按预定冷冻干燥程序对样品进行冷冻干燥,压塞密封,即得冻干粉剂;冷冻干燥程序如下:
预冷冻:在常压下预冷冻3.5h(预冷冻温度为-37℃);
冷冻干燥a:开启真空泵使真空度值为0.014mbar,在-38~-40℃温度下冷冻2h;
冷冻干燥b:维持真空度不变,升温至-25℃,在此条件下继续冷冻干燥12h;接着升温至-2~2℃,在此条件下继续干燥2h;
解析干燥:维持真空度不变,升温至35℃,在此条件下继续干燥4h。
- 还没有人留言评论。精彩留言会获得点赞!