生产干燥提取物的方法与流程
本发明涉及生产植物干燥提取物的方法和含有该提取物的药物制剂,特别是植物药物,其含有至少一种植物(药物)的乙醇/水提取物,其中所述植物选自:酸模(Rumex acetosa L.)、小酸模(Rumex acetosella L.)、钝叶酸模(Rumex obtusifolius L.)、巴天酸模(Rumex patientia L.)和皱叶酸模(Rumex crispus L.)(下文统称为“酸模药草(Rumicis herba)”);马鞭草(Verbena officinalis);西洋接骨木(Sambucus nigra);黄花九轮草(Primula veris)和黄龙胆(Gentiana lutea),以及它们的混合物。本发明还涉及用于治疗鼻咽区和/或鼻旁窦的炎症和/或感染性疾病的药物,以及涉及营养补充剂,并且还涉及它们的应用。
上述药用植物已知是上呼吸道感染、特别是旁窦炎时的分泌物分解剂(Sekretolytika)。其中每种单个药物都对组合物的独特功效起作用:
通常将黄龙胆的根(龙胆根)用于药物。在成分中特别发现了各种具有黏液溶解效果的裂环烯醚萜苷类。
通常将所述酸模种类(在下文中称作“酸模药草(Rumicis herba)”(酸模药草,Sorrel herb))的叶和茎用于药物。本申请中发现黄酮类和各种鞣剂为具有抗炎作用的成分,其还积极地支持身体自身的防御。
总称“酸模药草(Sorrel herb)”将被理解为指以下种的混合物:
酸模,同义词:Lapathum acetosa SCOP,同义词:Lapathum pratense LAM,同义词:Acetosa pratensis MILLER;
小酸模,同义词:Rumex infestus SALISB;
钝叶酸模,同义词Lapathum obtusifolium MOENCH,同义词Lapathum obtusantum MONTAD,同义词Rumex actus WALLR,同义词Rumex silvestris WALLR;
巴天酸模,同义词Rumex olympicus BOISS,同义词Lapathum hortense MOENCH;
皱叶酸模;
直根酸模(Rumex thyrsiflorus FINGERH.),同义词Acetosa thyrsiflora FINGERH,同义词Rumex acetosa subsp.auriculatus WALLR。
优选将马鞭草(马鞭药草)的叶和茎用于药物,其含有环烯醚萜苷类、苯乙醇苷类(Phenylethanoidglykoside)和黄酮类作为主要成分,从而获得黏液溶解和抗病毒效果。
通常将西洋接骨木的叶(接骨木花、西洋接骨木叶)用于药物,其成分含有各种黄酮醇苷类,并且含有接骨木苷(一种生氰糖苷)作为主要成分,其具有黏液溶解和抗病毒作用(Grabovac,A.和Ullmer,A., Apotheker-Verlagsgesellschaft m.b.H.,2003)。
黄花九轮草的花和萼片(报春花花朵)被用于药物。成分包括三萜皂苷类和酚苷类如报春花根苷。它们具有黏液溶解作用并抵抗病毒。该成分在治疗呼吸道疾病时作为温和的分泌物分解剂和祛痰剂起作用。
所述药用植物的组合被已知为注册商标名为仙露贝()的分泌物分解剂,并且其已上市约75年。中使用的药用植物被有目的地选择、测试和加工。由此获得的药物的恒定品质由制造商BIONORICA公司通过优化的应用和收获策略以及严格的质量控制实现。
所基于的组合物优选对于咽喉、鼻和耳区域的炎症和感染有效,并特别适于治疗急性和慢性旁窦炎和/或鼻旁窦炎。
急性和慢性窦炎都是经常发生的。在四分之三的情形中,窦炎是由于扩散到鼻旁窦的感冒而产生的,其伴有粘膜炎症。呼吸道从具有若干旁窦的主鼻腔到达肺泡。鼻旁窦包括额窦、筛窦、蝶窦和上颌窦。所有所述骨腔都在内部衬有粘膜并通过狭窄的开口(Ostien)伸向主鼻腔。
呼吸道表面覆盖有保护黏液,而与吸入的空气一起侵入的尘土颗粒和病原体,如病毒、细菌或真菌附着于所述黏液上。黏液含有抗体,其攻击侵入的物质并使它们无害。由此可将异物从身体清除出去,黏液通常借助于纤毛上皮的纤毛向咽喉的方向排出,在那里其可被吞咽。为了抵御感染诱发的呼吸道疾病,粘膜必须具有不受阻碍的保护和清洁机制。为了排出载有病原体的黏液,纤毛的不被阻碍的功能是必不可少的,所述纤毛由于波形运动而进一步转运黏液。随着上呼吸道的感染和炎症过程,粘膜的保护和清洁机制在功能上受到限制。
例如,病毒如鼻病毒、腺病毒或冠状病毒引起粘膜的炎症反应,由此粘膜变得肿胀并增加所产生的黏液。由此起初产生水性、然后是粘性的黏液流。在鼻粘膜的炎症过程中,旁窦口可肿胀并阻碍甚或阻止黏液的排出。这导致与粘性黏液相关联的旁窦中的堵塞,其导致纤毛的功能损伤或功能丧失。这最终引起粘膜的清洁机制损伤。
这样的微环境促进普遍存在的微生物的迅速增殖。长时间内,这些不利条件,如肿胀的粘膜和被粘性黏液粘着的纤毛,可导致慢性窦炎,引起对粘膜和纤毛上皮的永久性损伤。与呼吸道有关的病原体(其也被特别地理解为包括留在黏液中的HNO相关病菌)例如为金黄色葡萄球菌、表皮葡萄球菌、酿脓链球菌、肺炎链球菌、变异链球菌或流感嗜血菌。
在上呼吸道由于粘稠的黏液而黏连时,所使用的组合物的成分(黄龙胆:酸模药草:马鞭草:西洋接骨木:黄花九轮草=1:3:3:3:3)引起新鲜的稀薄黏液的形成,从而实现上述黏液溶解和转运过程以及炎症症状的减少并开始鼻粘膜的愈合过程。以温和的方式引起呼吸道自我清洁能力的重建并同时开发强的抗微生物效果。的特征是其良好的相容性,由BIONORICA开发的组合物和计量很少在患者中引起副作用,并且不已知其与其他药物相互作用。
大体上描述了植物干燥提取物并且已知植物干燥提取物来自水/乙醇提取物。
植物干燥提取物可例如根据EP0753306的技术教导被大量生产。
然而,存在提供新的植物干燥提取物的大的需求,该提取物具有植物组合的有利改善的效果。
德国药典(DAB)2010建立了针对药物质量的成分的最少含量,从而必须为了恒定和改善的质量而作出更多努力。特别是提取和干燥方法构成了植物药物的足够质量的瓶颈。
基于该现有技术,本发明的目的因此是提供生产植物干燥提取物的改善的方法以及改善的植物干燥提取物,所述方法包含至少一个乙醇/水提取步骤,其中植物选自:酸模、小酸模、钝叶酸模、巴天酸模和皱叶酸模(在下文和权利要求中被统称为“酸模药草”);马鞭草;西洋接骨木;黄花九轮草;和/或黄龙胆,以及它们的混合物。
令人惊讶地,可通过双重(zweifachen)提取获得改善的植物干燥提取物,其中在第一步骤中进行水/乙醇提取,并且在第二步骤中进行水提取。
令人惊讶地,在各总提取物中,可通过根据本发明的方法使有利活性成分在现有活性成分混合物中的含量在干燥之后被富集,从而实现获得的植物干燥提取物的改善的药理学功效。
因此,本发明涉及生产植物干燥提取物的方法,以下列步骤进行:
a.)醇/水提取酸模药草、马鞭草、西洋接骨木、黄花九轮草和黄龙胆,
b.)分离上清液,
c.)对来自a.)的余留物进行第二次水提取,
d.)分离上清液,
e.)合并从b.)和d.)获得的上清液,
f.)干燥上清液并获得植物干燥提取物。
根据该方法的改善在于实现了与常规的简单水-乙醇提取物相比更快的功效(参见实施例)。这是令人惊讶的,因为改变提取的溶剂最多能够预期线性的外推(例如,在只进行水/乙醇提取或只进行水提取的情形中)。
特别地,根据本发明的方法允许改善的剂量,从而用相同的剂量可实现提高的疗效。
因此,本发明还涉及植物干燥提取物,其根据本发明的方法获得或可获得(在下文中为根据本发明的(植物)燥提取物,仙露贝干燥提取物(TE))。
在根据本发明方法的其它优选实施方案中,黄龙胆:酸模药草:马鞭草:西洋接骨木:黄花九轮草的比率是1:3:3:3:3,各自下+/-0.3至0.5(例如,1:3.2:2.9:2.5:3.2:3)。
另外,优选以批量提供所有植物(药物)的植物全体,其中植物(药物)的比率如上文所述。另外,优选所提供的植物(药物)是经清洗和切割的。
在根据本发明的方法的其它优选实施方案中,步骤a.)中的水/醇提取剂具有40:60(v/v)至60:40(v/v),特别是41:59(v/v)或50:50(v/v)的水/醇含量。乙醇是优选的,然而也包括甲醇和丙醇或其混合物。另外,优选使用96%乙醇。
本发明还提供的是,步骤a.)和c.)中的提取在20至40℃下进行,其中步骤a.)和c.)中的提取进行2至8h。
在本发明的意义内,“分离上清液”可在根据本发明的提取之后通过排流、倾析、过滤、筛选或本领域技术人员已知的分离方法连续或间断地进行。
另外,优选根据步骤f.)的干燥在真空下在30至60℃、特别是40至50℃下进行,优选在真空搅动干燥器中进行。根据本发明的干燥提取物具有最多0.5%的残留乙醇含量。
将阐述其它适合的根据本发明的干燥方法:
常规地生产植物干燥提取物,其中植物材料借助于溶剂或溶剂混合物被提取(例如,通过浸渍或渗滤),并且在分离提取余留物之后,将所获得的流体提取物或所获得的酊剂浓缩至干燥。
根据本发明包括常规的干燥方法,并且包括流化床干燥或浓缩成稠的或浓缩的提取物和随后真空带式干燥或盘式干燥所述浓缩的提取物。
也可考虑通过流体提取物(或液体植物提取物)或酊剂生产根据本发明的植物干燥提取物的经典方法;其中,在随后的溶剂蒸馏之后,获得所谓的浓缩的提取物(粘稠提取物),常常向其中添加辅料和/或添加剂如乳糖、聚乙烯吡咯烷酮、蔗糖、二氧化硅等。然后该湿的粘稠物质在盘柜()或干燥器中成为所欲的干燥提取物制剂。
在干燥提取物生产中经常使用的方法是被称作真空带式干燥的方法。由此,经过下吸式蒸发器预干燥之后的浓缩的提取物成为干燥提取物制剂。
通过流化床干燥器的干燥方法需要大约47℃至117℃的温度。在该方法中干燥在正常压力条件下进行。
获得根据本发明的植物干燥提取物的温和干燥方法被描述于EP 0 753 306中。根据所描述的方法,将在提取中获得的来自植物材料的流体提取物根据本发明的方法引入真空干燥系统、优选真空搅动干燥器中,其具有带有自身驱动的、通过圆柱状混合和干燥室延伸的多柄搅拌器,以及任选地被提供以蒸汽过滤器、回洗装置、具有后冷却器和收集容器的溶剂冷凝器、回流冷凝器(Rückkondensator)和处理、控制及调节装置,和任选地提供以成粒喷嘴;并在装备有在混合和干燥室的整个深度内延伸且具有通过梳形定子旋转的刀片的切碎机的干燥器中干燥,其供应和返回温度在120℃和5℃之间、内室温度在10℃和80℃之间、蒸汽温度在15℃至55℃之间和压力在0.5至1000mbar之间,并且搅拌器旋转速度为0至10rpm,以及切碎机旋转速度为200至800rpm。根据EP 0 753 306使用的真空干燥系统例如由以前的公司Firmen Inox Glatt AG或Inox-Maurer AG以名称“IUT”或“INOX”销售。目前的制造商和配售商包括例如,De Dietrich Process Systems GmbH,Mainz,德国
通过该真空干燥系统,以批量方法将要干燥的流体提取物从上方泵入混合和干燥室和然后经受真空。
优选的真空干燥系统包括以下特征,如例如在已知的IUT/INOX装置(参见上面)中起作用的:
a.)通过圆柱状混合和干燥室延伸的多柄搅拌器,其具有自身驱动以及任选的蒸汽过滤器、回洗装置、具有后冷却器和收集容器的溶剂冷凝器、回流冷凝器、处理、控制和调节装置,以及任选的成粒喷嘴。
b.)另外,可提供在干燥和混合室的整个深度内延伸的切碎机,其具有独立于搅拌器的驱动以及任选的用于增加切碎机效果的梳形定子。
c.)另外,可任选地提供一个或多个喷嘴以将液体植物提取物从储蓄器引入干燥室,如在例如WO2002073108中所描述的。
将以该方式获得的植物干燥提取物被进一步加工以成为药物制剂。
具有抗菌效果的含有根据本发明的植物干燥提取物的试剂由此可有利地用于治疗由呼吸道相关病原体引发的感染。黏液溶解和抗炎效果通过附加的抗菌效果得到了补充。由此,除了减少加载了病原体的粘性黏液的释放外,还通过杀死细菌病原体和/或减少细菌病原体增殖而减少或甚至完全中断了上呼吸道感染。
通过上文描述的发明,不使用合成的化学成分而以温和的方式对患有例如窦炎和/或鼻窦炎和/或鼻旁窦的炎症(特别是每种的急性形式)的患者进行治疗。
具有抗菌效果的本发明的(药物)组合物对于抵抗与呼吸道相关的病原体特别有效,其中它特别针对下述显示出抗菌效果:革兰氏阳性球菌(如金黄色葡萄球菌、金黄色葡萄球菌(MRSA)、表皮葡萄球菌、酿脓链球菌、肺炎链球菌和变异链球菌);革兰氏阴性杆菌(如流感嗜血菌);以及肠杆菌科。还实现了抗病毒的效果。
抗菌剂的盖伦制剂可选自:滴剂、果汁、糖浆、片剂、锭剂、胶囊、缓释制剂、直肠或阴道栓剂、输注剂、特别是咽喉喷雾剂和消毒溶液;软膏、乳剂、粉剂、粉末、鼻喷雾剂、用于吸入的液体或固体配制物、敷布、填充物(特别是伤口和牙龈敷料)、填塞物(也用于牙齿)、冲洗液,特别是与生理和高渗浓度的盐或盐混合物相组合,优选食盐,特别是海盐。当然,所述制剂可含有药学上常规的辅料。
本发明因此还涉及根据本发明的抗菌剂(其含有根据本发明的植物干燥提取物)用于治疗由呼吸道相关病原体引发的感染的用途或应用,且涉及用于药物生产的用途,以及涉及药物本身。
在其它实施方案中,本发明涉及下述药物:其在窦炎和/或鼻窦炎和/或鼻旁窦的炎症(特别是每种的急性形式)中使用或应用,特别是用于治疗和预防窦炎和/或鼻窦炎和/或鼻旁窦的炎症,特别是每种的急性形式。
基于所测试的病原体的HNO相关性,根据本发明的试剂在可局部或表面地直接及立即攻击细菌的任何情形中都非常合适。
根据本发明的试剂因此可优选(除了全身应用外)在经污染部位直接施用,例如以可至100%生物降解的消毒溶液的形式,或当然也可用于人和动物中皮肤和粘膜的直接表面应用。对此考虑各种应用形式。特别合适的是在人类皮肤病学领域以及兽医医学中作为溶剂、乳液、软膏和乳剂的剂型。在本申请中,根据本发明的试剂可被直接施用到患病的皮肤部分和/或以浸透的敷布、填充物或填塞物的形式使用。
当然,根据本发明的试剂在整个呼吸道(特别是上呼吸道,本申请中优选在咽喉、鼻和鼻旁窦粘膜的区域)的全部患病区域中的应用是特别令人感兴趣的。特别有意义的是鼻冲洗,特别是与盐相结合,例如结合生理或高渗盐溶液。根据本发明,还包括含有根据本发明的试剂的鼻喷雾剂。
新应用可能性的广泛范围从咽感染时的扁桃体涂擦溶液和漱口液到粉末吸入配制物或雾化器吸入配制物。
其它的应用和适应症范围包括伤口和牙龈敷料,例如,以棉花填充物或棉纱填充物的形式,其被根据本发明的试剂浸透。
耳道感染时也可以考虑用含有根据本发明的试剂的溶液进行耳冲洗。
本发明因此还涉及用于下列疾病的用途和应用(特别是其治疗和预防)的药物:整个呼吸道,特别是上呼吸道,特别是在咽喉、鼻和鼻旁窦粘膜区域的疾病,呼吸系统疾病,特别是黏液粘稠病(囊性纤维化)。黏液粘稠病可特别有利地被治疗,参见图7A和7B。
其它的优选实施方案涉及含有根据本发明的试剂的营养补充剂,特别是以饮食组合物的形式。合适的根据本发明的营养剂或食物(包括水)为例如在2002年1月28日的法令(EG)第178/2002号中不排他地限定的那些,如焙烤食品和饮料以及儿童营养制剂。根据本发明的营养补充剂可与合适的生理学上相容的载体混合。
根据本发明的药物制剂可以以剂量单位的形式生产。这意味着该制剂可以以单独部分的形式(优选胶囊和安瓿)提供,其中植物干燥提取物的活性成分含量相应于部分或多个单一剂量。剂量单位可含有例如1、2、3或4个单一剂量或1/2、1/3或1/4的单一剂量。单一剂量优选含有下述根据本发明的植物干燥提取物(活性成分)的量:其在一次应用中施用且通常相应于日剂量的全部、1/2、1/3或1/4。优选的是每日三次的剂量,优选以片剂的形式,特别是在早晨、中午和晚上,任选地在进餐时间。
在其它优选的实施方案中,可选择钙包被片剂的盖伦制剂,如EP1392337中所公开的。
无毒的、惰性的药学上适合的载体物质将被理解为固体、半固体或液体稀释剂、填充剂以及任何类型的制剂辅料,如a)填充剂和稀释剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇、糊精、麦芽糖糊精和硅酸、高度分散的二氧化硅,b)粘合剂,例如,羧甲基纤维素、纤维素粉、微晶纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮,c)保湿剂,例如,甘油,d)崩解剂,例如,琼脂-琼脂、碳酸钙和碳酸钠,e)溶解阻剂,例如,石蜡和f)吸收促进剂,例如季胺化合物,g)湿润剂,例如鲸腊醇、单硬脂酸甘油酯,h)吸附剂,例如高岭土和膨润土,和i)润滑剂,例如滑石、硬脂酸钙和硬脂酸镁以及固体聚乙二醇,或a)至i)下所列物质的混合物。
片剂、锭剂、胶囊、丸剂和颗粒可以常规的、任选地含有不透明化试剂的包被和外壳被提供,例如(非排他地)羟丙甲纤维素、微晶纤维素、硬脂酸、二氧化钛,而且还可被组合而使得活性成分只在(或优选在)肠道的某个部分(任选地延缓)释放,其中可使用例如聚合物物质和蜡作为包埋物质。
实施例:
这些实施例仅意在阐释本发明,而不将本发明限制于这些实施例。
在下文中,“干燥提取物(TE)”指根据本发明生产的植物干燥提取物。
实施例1:
根据本发明的干燥提取物的抗病毒活性在许多体外试验中被证实。
在这些试验中,首先相对于已知的(醇/水)测试根据本发明的干燥提取物的一般细胞损伤(细胞毒性)作用。在将合适的细胞系(例如,HeLa、HEp-2)与不同的病毒一起温育一小时的时期后,用不同的浓度处理受感染的细胞系,然后测量对病毒增殖的作用。
通过致细胞病变效应的检测(Adeno5病毒)、噬斑减少测定(FluA、HRV14、RSV)或病毒特异性酶联免疫测定(ELISA;Adeno5、RSV)进行了抗病毒活性的体外定量确定。
在致细胞病变效过的检测中,用确定的病毒溶液感染汇合生长的病毒敏感细胞(M.O.I.,感染复数)。温育一小时之后,去除病毒接种物并清洗被感染的细胞层。然后加入生理物质浓缩物。培养各试验批次直到在未处理的病毒对照中在显微镜下观察到70-90%的致细胞病变效应(CPE),其使自身呈现为被破坏的细胞区域。将被破坏的细胞区域的面积定义为100%感染。相较而言对各试验批次的细胞面积进行评估,从而可将待分析的物质的抑制效果显示为抑制百分比(%抑制)。
在噬斑减少测定中,用确定的病毒溶液感染汇合生长的病毒敏感细胞(M.O.I.,感染复数)。温育一小时之后,去除病毒接种物并清洗被感染的细胞层。然后加入生理物质浓缩物和固体培养基成分(琼脂糖或甲基纤维素),并进一步温育。通过上覆的培养基中的固体成分对经感染的面积划界,从而产生一系列经感染的细胞(“噬斑”)。培养各试验批次直到在未处理的病毒对照中在显微镜下观察到指定的噬斑数(M.O.I.)。通过固定和染色细胞层,可使病毒噬斑可见为深着色的细胞层中的亮环。借助于图像处理系统来确定噬斑数。将未处理的对照的噬斑数定义为100%感染。相较而言对各试验批次的噬斑数进行评估从而试验物质的抑制效果可以抑制百分比(%抑制)被呈现。
在ELISA中分析病毒产生。具有抗特定病毒的抗体的测试条结合在经感染的细胞系的细胞培养物上清液中发现的病毒。为了使反应可见,引入用过氧化物酶标记的病原体特异性检测抗体。加入底物/色原体以及过氧化氢和四甲基联苯胺之后,发生颜色反应。通过光度计确定着色强度并且与病毒抗原的含量成比例。在用确定的病毒溶液感染汇合生长的病毒敏感细胞(M.O.I.,感染复数)之后分析经感染和处理的细胞的病毒产生。温育一小时之后,去除病毒接种物并清洗经感染的细胞层。然后加入生理物质浓缩物。培养各试验批次直到在未处理的病毒对照中在显微镜下观察到70-90%的致细胞病变效应(CPE)。新合成的病毒在该阶段位于细胞培养物上清液中。将通过光度计确定的未处理的对照的消光值定义为100%感染。相较而言对各试验批次的消光值进行评估,从而测试物质的抑制效果可呈现为抑制百分比(%抑制)。
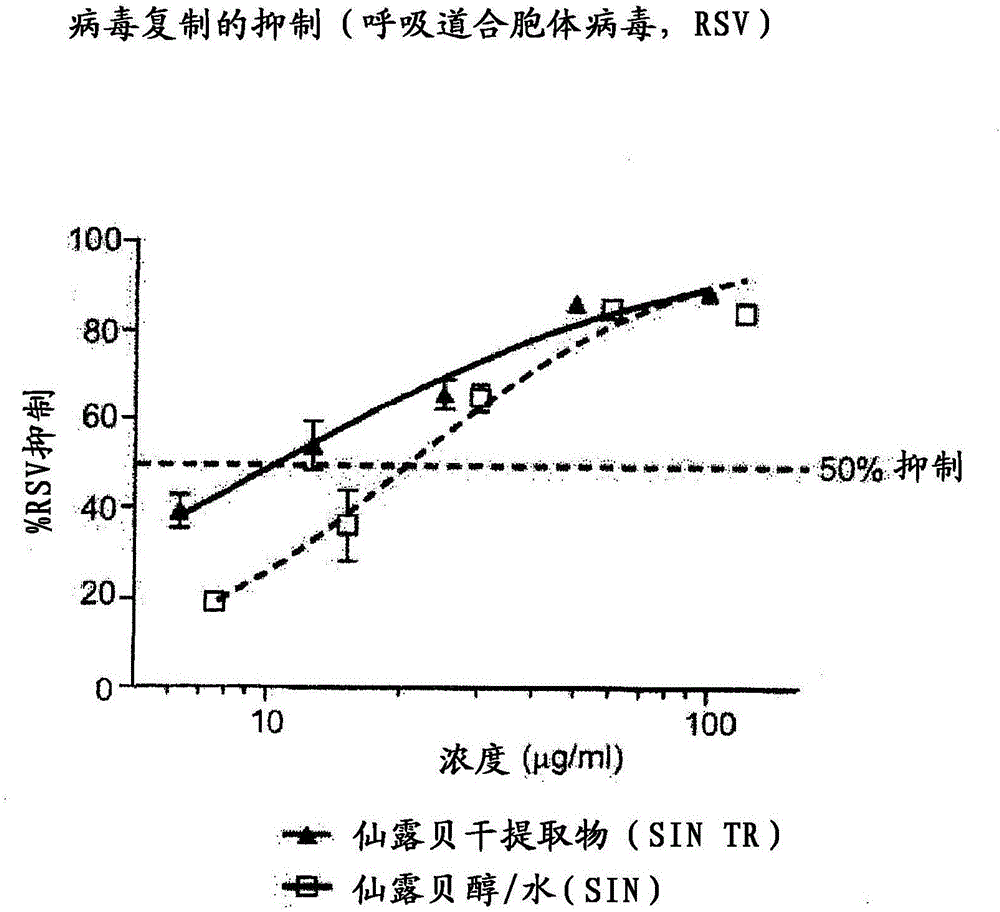
在所有试验中显示出对病毒增殖的显著抑制,即病毒负荷的减少(参见图1)。
根据本发明的干燥提取物抑制人(FluA)和猪(pFluA)流感病毒(Grippeviren)的增殖。124.8μg仙露贝/ml(FluA)或43.4μg仙露贝/ml(pFluA)的浓度足以抑制(减少)病毒(负荷)50%。与醇/水相比,根据本发明的仙露贝干燥提取物显示出对病毒株HRV 14、Adeno5和RSV的更低的EC50,和因此相应更大的功效(参见图1和2)。
表0:抗病毒效果
实施例2:
可在动物模型中证实仙露贝的抗炎活性。作为试验模型,可选择例如角叉菜诱导的大鼠(雄性Wistar Han大鼠,220-230g)爪水肿。在该模型中可检测测试物质的抗炎效果,其中测量它们对角叉菜引起的爪水肿或胸膜炎的抑制效果。下列用作参照物:(RS)-2-[4-(2-甲基丙基)苯基]丙酸()和2-[1-(4-氯苯)-5-甲氧基-2-甲基-1H-吲哚-3-基]乙酸(吲哚美辛,“indo”)。在前述检测中,用吲哚美辛、干燥提取物(SIN TR)或药物混合物(SIN,如商业上可获得的)处理各10只大鼠的组,并且在一小时后注射角叉菜。在角叉菜注射之后,在各时间点确定了试验和参照物对水肿形成的抑制,其中将只用角叉菜处理的动物的爪体积用作对照(媒介物=空白对照)。这些检测的结果显示在表1和2以及图3至6中并将在下文中阐释。
图3:在角叉菜模型中,发现角叉菜注射后30分钟,根据本发明的干燥提取物就抑制角叉菜诱导的爪水肿,并且与仙露贝药物混合物相比,其更强地抑制所述爪水肿,而在该早期时刻仍然没有显示抗炎效果。在水肿诱导后一个和两个小时,根据本发明的干燥提取物的抗炎效果仍然较和药物混合物(SIN)强。
表1显示在角叉菜诱导的胸膜炎的情况下(SIN)的效果,其是基于4h之后测量的炎症标记(PGE2、LTB4、TNFα、IL1β),。
对于大鼠(每组10只)每只用100mg/kg或500mg/kg SIN处理并且相比较地用5mg/kg吲哚美辛和空白样品处理,1小时之后注射角叉菜。
“炎性细胞”与PMN(多形核中性白细胞)积聚/浸润相关。
统计学:平均值+/-SEM,n=10,**p<0.01;***p<0.001vs媒介物(空白样品)(Tukey检验),p<0.05是统计学上显著的。
在图4中提供比较的图示说明
表2显示在角叉菜诱导的胸膜炎的情况下干燥提取物(SIN TR)的效果,其基于在4h之后测量的炎症标记(PGE2、LTB4、TNFα、IL1β)。
将大鼠(每组10只)每只用100mg/kg或500mg/kg SIN TR处理,以及相比较地用5mg/kg吲哚美辛和空白样品进行处理,1小时之后注射角叉菜。
“炎性细胞”与PMN(多形核中性白细胞)积聚/浸润相关。
统计学:平均值+/-SEM,n=10,**p<0.01;***p<0.001vs媒介物(空白样品)(Tukey检验),p<0.05是统计学上显著的。
在图4中提供了相比较的图示说明。
图5显示了药物混合物(SIN)和仙露贝干燥提取物(SIN TR)对大鼠肺中COX-2蛋白表达的效果。
将大鼠(每组10只)每只用100mg/kg或500mg/kg SIN或SIN TR处理,并且相比较地用5mg/kg吲哚美辛和空白对照进行处理,1小时之后注射角叉菜。各用30μg来自大鼠肺(匀质化)的蛋白在10%SDS聚丙烯酰胺凝胶上进行蛋白质印迹并且分析COX-2。
图6显示药物混合物(SIN)和仙露贝干燥提取物(SIN TR)对细胞因子的影响。
将大鼠(每组10只)每只用100mg/kg或500mg/kg SIN或SIN TR处理并且相比较地用5mg/kg吲哚美辛和空白样品处理,且1小时之后注射角叉菜。在角叉菜注射之后4h确定炎症标记IL1β和TNFα。
统计学:平均值+/-SEM,n=10,**p<0.01;***p<0.001vs媒介物(空白样品)(Tukey检验),p<0.05是统计学上显著的。
结论:
与药物混合物(SIN)相比,至少对于PGE2,根据本发明的仙露贝干燥提取物(SIN TR)显示出特别有利的显著抑制PGE2形成(30%;p<0.01;图4C、表2)。另外,与已知的药物混合物(SIN)相比,根据本发明的仙露贝干燥提取物(SIN TR)在更低的剂量下更有效。
实施例3:
下面的实施例显示根据本发明的干燥提取物在表面使用时活化氯化物分泌,其有可能是通过活化CFTR。此外,根据本发明的干燥提取物刺激纤毛摆动频率。
材料:细胞培养物:人支气管上皮细胞(HBE)获自Lonza(Walkersville,MD)并用来自Lonza(Walkersville,MD)的支气管上皮细胞生长培养基(BEGM)进行扩增。将250mg根据本发明的干燥提取物溶解于1ml 50%乙醇中并用超声以35kHz处理30分钟,随后在室温以3,000g离心10分钟。吸出上清液。将阿米洛利(Amiloride)(Sigma,St.Louis,MO)溶解于蒸馏的去离子水中并稀释1000倍。将福司柯林(Forskolin)(Kaliokemm,EMD,San Diego,CA)溶解于DMSO中并稀释1000倍。
使用尤斯室(Ussing-Kammer)(Physiology Instruments San Diego,CA,USA),其包含在37度进行的Transwell插入物(Corning Life Sciences)以及具有0伏特的端电压(VCC 600)的单层(Physiology Cal Instruments San Diego,CA,USA)(在设置了流阻之后)。将Transwell过滤器置于37度的溶液中并向溶液连续输入95%氧至5%CO2。根据欧姆定律的测量,利用计算机程序(Physiology Instruments San Diego,CA,USA)调节了在640ms、双极10mV电势时所述单层上的跨上皮电阻(RT)。根据定义,阳性结果是阴离子分泌或阳离子吸收。实验在HBE细胞培养物中重复至少3次。
使用的电解质溶液(以mM计):120NaCl、25NaHCO3、3.3KH2PO4、0.8K2HPO4、1.2MgCl2、1.2CaCl2和10葡萄糖。
按照根据Woodworth等的方法(Woodworth,BA,Zhang S,Tamashiro E,Zinc increases ciliary beat frequency in a calcium dependent manner,Am J Rhinol Allergy 24:6-10,2010)进行了纤毛摆动频率测量(CBF)。通过具有63x透镜的Leica Microsystems,Inc.,Bannockburn,IL(型号A 602f-2,High Speed Monogramme Digital Videokamera,Basler AG,Ahrensburg,Germany)产生图像。检测根据本发明的干燥提取物的跨上皮电解质转运。将干燥提取物以渐增的浓度量施加到尤斯室中HBE细胞的基底外侧表面,随后加入阿米洛利和福司柯林。
在图7a和7b中,根据本发明的干燥提取物在加入阿米洛利和福司柯林之后显示跨上皮的短路电流(ISC)的改变(7A),这样观察到了纤毛摆动频率测量(CBF)中剂量依赖性的上升(7B),其伴随氯化物离子的分泌。
这些结果表明根据本发明的干燥提取物(例如通过鼻喷雾剂)的有益用途,因为可实现改善的粘膜纤毛清除(MCC)。
结论:根据本发明的干燥提取物适于治疗呼吸系统疾病,特别是适于治疗黏液粘稠病(囊性纤维化)。
实施例4:
如下检测根据本发明的仙露贝干燥提取物和仙露贝滴剂(醇/水(“仙露贝OD”))的抗炎效果。
角叉菜诱导的爪水肿(参见上文):首先将试验动物(n=8只/组)在禁食状态下称重并测量了后爪的基本体积。喂给所述动物测试物质(10mL/kg体重)(仙露贝干燥提取物(TE):5mg/kg,等同于1mL滴剂/kg中的药物混合物的量;50mg TE/kg,相应于1倍人等同剂量(1x HED);仙露贝滴剂(仙露贝OD):1mL OD/kg,相应于1倍人等同剂量(1x HED);2.5mL OD/kg,等同于50mg TE/kg中的药物混合物的量;吲哚美辛:20mg/kg,作为阳性对照;10%v/v乙醇,作为媒介物对照)。60分钟之后,通过将角叉菜(0.1mL在生理食盐溶液中的1%w/v溶液)皮下注射到左后爪(以足底的方式)来刺激动物。在角叉菜注射之前(-1h)和之后(研究1:+1h(图8),研究2:+15min、+30min、+1h(图9))通过体积描记法确定所有动物的爪体积。对每个试验动物单独计算相对于媒介物对照的爪肿胀的抑制百分比。
在图8中相比较地显示结果(1小时之后的炎症抑制)。
图8:A:仙露贝TE和仙露贝OD的每种都以1倍人等同剂量施用。与仙露贝OD相比,仙露贝TE具有更快和更强的抗炎效果。1h之后,通过仙露贝TE而非仙露贝OD的炎症抑制与已知的消炎药吲哚美辛的抑制效果相当。
B、C:此处施用的仙露贝TE和仙露贝OD的剂量(基于各自生产用的量)与药物混合物(DM)相当(B:23.6mg/kg,C:223mg/kg)。与仙露贝OD相比,仙露贝TE具有更快和更强的抗炎效果。1h之后,通过仙露贝TE而非仙露贝OD产生的炎症抑制与已知的消炎药吲哚美辛产生的抑制效果相当。
在图9中相比较地显示了结果(+15min、+30min、+1h之后的炎症抑制)。
图9:仙露贝TE和仙露贝OD的施用剂量(基于各自生产用的量)与药物混合物相当(23.6mg药物混合物/kg)。与仙露贝OD相比,仙露贝TE的特征在于起效更早和且更强。仙露贝OD只从30min起发挥炎症抑制作用。在整个测试期间内,仙露贝TE以与已知的消炎药吲哚美辛相当的方式强和快地抑制炎症。
实施例5:
下面的实施例描述来自多物质混合物的特定标记化合物。
实施方案:
在单个提取步骤之后立即提取全部样品、过滤并以600mg/L的浓度(在30%体积MeOH中)进行质谱分析。使用对羟基苯甲酸甲酯作为内部标准。将样品加工两次和分析两次。使用了下面的参数和装置:MS:5600Triple ToF(ABSciex);HPLC:Agilent 1290软件:Analyst TF 1.5.1、MultiQuant 2.1.1、MarkerView 1.2.1固定相:Zorbax RRHD Eclipse Plus C18,2.1x 50mm,1.8μm LC方法:
A=H2O中的0.1%甲酸;B=乙腈
MS方法:
表3:特征成分的选择性富集或损耗
在通过参照标准定量时,成分的量以按[g]计的绝对含量被提供。否则,成分的含量以对于各总提取物的相对值[%](步骤f.)之后)被提供。数据来自于实验室批次A1以及生产批次P1。信号通过负离子化被检测。
表4:第一提取步骤中通常富集的成分通过随后的水提取而增加。
在通过参照标准定量时,成分的量以按[g]计的绝对含量被提供。否则,成分的含量以对于各总提取物的相对值[%](步骤f.)之后)被提供。数据来自于实验室批次A1以及生产批次P1。信号通过负离子化被检测。
- 还没有人留言评论。精彩留言会获得点赞!