Box‑Behnken效应面法优化制备氯诺昔康柔性脂质体的制作方法
本发明属于药物领域,特别提供一种采用Box-Behnken效应面法优化制备氯诺昔康柔性脂质体的方法。
背景技术:
氯诺昔康(Lornoxicam),是一种具有抗炎、镇痛和退热作用的非甾体类抗炎药,能高度选择性抑制环加氧酶抑制剂(COX-II)。临床上主要用于慢性关节炎症、手术和急性创伤后的疼痛、上呼吸道感染引起的发热等。目前,氯诺昔康在临床上有片剂、颗粒剂及干混悬剂等剂型,但由于其溶解度很小,生物利用度低,且波动性较大,局部浓度低,需频繁给药,有一定的胃肠道不良反应,且肝脏毒性较大。
脂质体作为外用药物载体具有靶向性、高效、长效、降低药物不良反应等优势。由于脂质体可以使药物具有较大的角质层透过量,而进入血液循环的药量较少,从而表现出相对的皮肤组织靶向性。柔性纳米脂质体(ultra flexible nano-niosomes,UNN)是将胆酸钠、吐温、司盘等表面活性剂加入到制备脂质体的类脂材料中制成,可高效地穿过比其自身小数倍的脂质载体,柔性脂质体具有高效渗透性、亲水性和高度柔韧性。氯诺昔康作为有效成分制备柔性纳米脂质囊泡,不仅能减少氯诺昔康对胃肠道及肝脏的不良反应,也避免了药物的首过效应,延长了镇痛时间。
Box-Behnken效应面法设计实验是适用于多因素考察的新型科学设计方法。其优势在于运用非线性拟合模型从而提高准确度,近年来多被研究者用来进行处方及工艺优化。
技术实现要素:
本发明的目的在于提供一种采用Box-Behnken效应面法筛选制备氯诺昔康柔性脂质体最佳处方的方法,效应面法具有试验设计全面、科学准确、可以研究多个因素交互作用等优点,针对制备柔性脂质体过程中影响较大的磷脂浓度,磷脂与胆固醇质量比,总脂质与吐温80质量比,总脂质与药物质量比四个因素分别进行考察,以包封率和粒径作为优化指标进行Box-Behnken效应面实验设计,优化氯诺昔康柔性脂质体的最佳处方。
本发明具体方案如下:
一种采用Box-Behnken效应面法优化制备氯诺昔康柔性脂质体的方法,其特征在于:采用薄膜分散水化法制备脂质体,分别以磷脂浓度、磷脂与胆固醇质量比、总脂质与吐温80质量比、总脂质与药物质量比为考察对象,以包封率、粒径为评价指标,采用4因素3水平Box-Behnken效应面设计法筛选氯诺昔康柔性脂质体的最佳处方。
本发明所述采用Box-Behnken效应面法优化制备氯诺昔康柔性脂质体的方法,其特征在于:采用葡聚糖G50微柱离心法测定包封率,动态激光散射法测定脂质体的粒径和ζ-电位。
采用本发明所述方法优化而成的制备氯诺昔康柔性脂质体的方法,其特征在于:将氯诺昔康与大豆卵磷脂、胆固醇、吐温80混合,加入溶剂溶解,然后减压除去溶剂,得到淡黄色透明均匀薄膜;加入重蒸水水化,50-60℃条件下水化15-25min后,探头超声3-5min,然后过0.22μm滤膜,得淡黄色氯诺昔康柔性脂质体混悬液。由体外释放考察中可知,相比于原料药溶液组,优化后制得的氯诺昔康柔性脂质体包封率较高,大小分布均匀,具有缓释特点。
其中,最优处方工艺条件为:大豆卵磷脂浓度为16.94mg/mL,大豆卵磷脂与胆固醇质量比为4.46:1,总脂质与吐温80质量比为8.12:1,总脂质与药物质量比为18.65:1。以最优处方制备的氯诺昔康柔性脂质体平均粒径较小(93.86±7.58)nm、ζ-电位较好(-20.21±2.31mV)、包封率较高(90.23±1.46)%,实际值与预测值偏差较小。82.06%的药物在24h内从脂质体中释放出来,具备明显的缓释特性。
本发明所述制备氯诺昔康柔性脂质体的方法,其特征在于:所述溶剂为无水氯仿;水化条件优选为:55℃条件下水化20min。
本发明通过Box-Behnken效应面法得到优化的氯诺昔康柔性脂质体制备工艺,按该处方制备3批脂质体,同时对其包封率和粒径进行测定。从测定结果看,实际值与预测值相差较小,证明该方法预测性能良好,是脂质体处方工艺优化的有效方法。优化后制得的氯诺昔康柔性脂质体包封率较高,大小分布均匀,具有缓释特点,这为后期将其制成亲水凝胶提供了较好的实验基础。
附图说明
图1氯诺昔康柔性脂质体洗脱曲线。
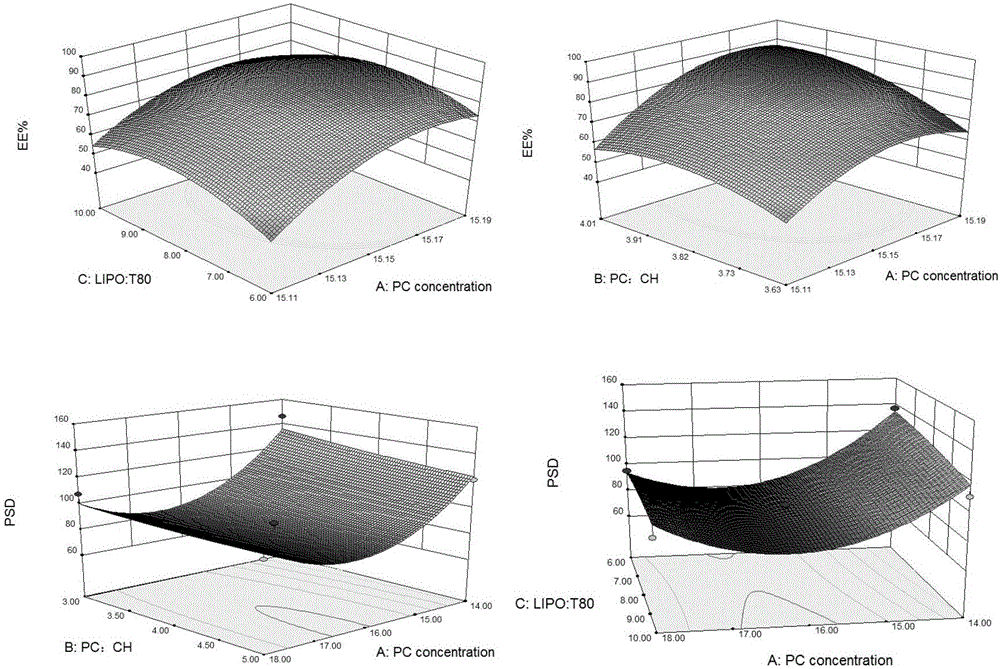
图2因素交互作用对包封率和粒径的曲面效应图。
图3氯诺昔康柔性脂质体的粒径分布(a)。
图4氯诺昔康柔性脂质体的ζ-电位(b)。
图5氯诺昔康柔性脂质体的透射电镜照片。
图6氯诺昔康溶液和氯诺昔康柔性脂质体体外释放。
具体实施方式
1仪器与材料
JY9222D超声波细胞粉碎机(宁波新芝科器研究所),SHZ-D(Ⅲ)循环水式真空泵(巩义市英峪华仪器厂),旋转蒸发仪(上海亚荣生化仪器厂),DL-180型超声波清洗机(浙江省象山县石浦海天电子仪器厂),TGL-16C台式离心机(上海安亭科学仪器厂),UV-9100紫外可见分光光度计(北京瑞利分析仪器公司),JEM-1200EX透射电子显微镜(日本Electron株式会社),FA1104电子天平(上海民桥精密科学仪器有限公司),Spectrum-754PC型紫外扫描仪(上海光谱仪器有限公司),DF-101S集热式恒温加热磁力搅拌器(巩义市英峪华仪器厂),ZetasizerNano ZS-90激光粒径测定仪(英国Malvern Instru-ments公司)。
氯诺昔康(东京化成工业株式会社),大豆卵磷脂(PC>96%,上海艾伟特医药科技有限公司),胆固醇(生化纯,天津市博迪化工股份有限公司),葡聚糖G50(如吉生物科技有限公司),其他试剂均为分析纯。
2方法与结果
2.1氯诺昔康柔性脂质体的制备
称取大豆卵磷脂64mg、胆固醇16mg、吐温80 10mg、氯诺昔康4mg于250mL茄型瓶中,加入10mL无水氯仿溶解后在50℃减压除去无水氯仿,得到淡黄色透明均匀薄膜,加入重蒸水4mL水化,55℃条件下水化20min后,探头超声(200W)3min后,过0.22μm滤膜2次,得淡黄色氯诺昔康柔性脂质体混悬液,同法制备空白脂质体。
2.2含量测定方法学的建立
2.2.1检测波长的选择
取制备的空白脂质体适量,分别对氯诺昔康和空白脂质体进行紫外全波长扫描。氯诺昔康在378nm处有最大吸收,且空白脂质体不干扰测定,因此选择氯诺昔康检测波长为378nm。
2.2.2标准曲线的制备
精密称取氯诺昔康对照品5mg于50mL棕色容量瓶中,以甲醇配成质量浓度为100μg·mL-1的储备液,分别精密量取0.1、0.2、0.5、1.0、1.5、2.0mL储备液于10mL棕色量瓶中,用甲醇定容后得到浓度分别为1、2、5、10、15、20μg·mL-1的氯诺昔康溶液并于378nm测定其吸光度(A)。以吸光度(A)对药物质量浓度(C)进行线性回归,得标准曲线方程为:C=44.455A-3.2031(R2=0.9999)。结果表明,氯诺昔康质量浓度在1~20μg·mL-1内与吸光度呈良好线性关系。
2.3氯诺昔康柔性脂质体包封率的测定
2.3.1柱分离度的考察
a微型柱的制备
取四只2.5mL注射针筒,底部放一层脱脂棉,加入3.0g经PBS溶液浸泡饱和过,并用蒸馏水洗至中性的葡聚糖凝胶(Sephadex G50),将装好的微柱放入套管中4000r·min-1离心5min,除去微柱中残留的水,备用。
b洗脱曲线的考察
精密吸取氯诺昔康柔性脂质体0.2mL,缓缓加入柱顶中心处,4000r·min-1离心5min后在柱顶部加入0.2mL蒸馏水,4000r·min-1离心5min,收集滤过液,再于柱顶部加入同体积的蒸馏水,重复以上操作。收集1~8管滤液分别置于5mL容量瓶中,甲醇定容,采用紫外-可见分光光度计,以甲醇为对照,于378nm处测定吸光度值,制备洗脱曲线(图1)。
由图1可知,洗脱曲线呈单峰。用双蒸水洗脱一次后即可把脂质体全部洗脱下来。最终确定洗脱条件为脂质体混悬液上样离心后再用同体积双蒸水洗脱一次。
2.3.2空白脂质体回收实验
精密量取0.2mL空白脂质体上样,收集滤过液,用同体积双蒸水洗脱一次,合并滤过液并置于5mL容量瓶中,双蒸水定容至刻度,摇匀,于500nm处测定吸光度值定为Aa;精密量取空白脂质体0.2mL于5mL容量瓶中,双蒸水定容至刻度,摇匀,于500nm处测定吸光度值定为Ab,计算回收率(R),R(%)=(Aa/Ab)×100%,结果见表1。
表1脂质体回收率实验(n=3)
2.3.3脂质体包封率的测定
分别精密量取氯诺昔康柔性脂质体0.2mL 2份。1份加于G50柱顶,离心后以重蒸水进行洗脱,合并洗脱液并置于10mL容量瓶中,用甲醇定容并超声破乳后在378nm处测定吸光度为A1;另1份直接加入10mL的容量瓶中,加甲醇定容并超声破乳于378nm处测定吸光度为A2。包封率(EE/%)计算方法如下:
EE/%=(A1/A2)×100%
2.4Box-Behnken效应面法试验设计
在预试验基础上,根据单因素实验考察结果,选择对氯诺昔康柔性脂质体制剂学性质影响较为明显的4个因素:磷脂浓度(X1)、磷脂与胆固醇质量比(X2)、总脂质与吐温80质量比(X3)、总脂质与药物质量比(X4),在低中高3个水平上进行优化,同时以包封率(Y1,EE/%)及粒径(Y2,d/nm)为评价指标进行实验考察,影响因素及水平见表2,实验设计和评价指标结果见表3。
表2 Box-Behnken效应面法中的变量
2.4.1二次回归模型的建立
利用Box-Behnken实验软件对表2实验数据进行回归分析,得拟合方程为:
EE/%=-1051.67+104.44X1+2.27X2+43.37X3+7.71X4+2.00X1X2-0.56X1X3-0.26X1X4+2.89X2X3+0.48X2X4-0.25X3X4-3.04X12-7.48X22-2.52X32-0.13X42(R2=0.8604,P<0.0001) (1)
dPD=2004.03-264.79X1-35.54X2-15.20X3+41.55X4+1.40X1X2+1.40X1X3-0.54X1X4+1.48X2X3-0.66X2X4-0.39X3X4+7.86X12+1.41X22-0.42X32-0.72X42(R2=0.8085,P=0.0001) (2)
2.4.2方差显著性检验
两个拟合方程R2值说明该模型拟合程度较好,可以用此模型对处方工艺进行预测分析。从表4回归系数显著性检验可知,模型1中,X1(P<0.0001)、X2(P=0.0005)、X12(P<0.0001)、X22(P=0.0038)、X32(P=0.0004)极显著,X4(P=0.0683)、X2X3(P=0.0540)显著,其他项不显著。模型2中,X1(P<0.0001)、X12(P<0.0001)极显著,其他项不显著。
表3 Box-Bchnken效应面法优化Lor-FLS处方的组合和相应值
表4回归方程中系数的显著性检验
2.4.3效应面优化与预测
根据回归方程,应用Design Expert 8.0.6试验设计软件,绘制影响较大的2个因素对于各指标三维曲面图(图2)。根据Box-Behnken效应面实验结果最优处方为X1=16.94,X2=4.46,X3=8.12,X4=18.65。按此最优处方制备3批柔性脂质体,其包封率、粒径见表5。从表5可知,实测值和模型预测值偏差都较小,说明该模型预测性良好。对于优化处方制备的制剂进行了ζ电位的测定,从图4可看出,氯诺昔康柔性脂质体的ζ电位为-20.23mV。通常ζ电位在±20mV以上时,由于静电排斥会阻止微粒间相互碰撞,使制剂不易沉降,从而有利于制剂的稳定。
表5 Lor-FLS的实际值和预测值
2.5氯诺昔康柔性质体的透射电镜检查
取适量氯诺昔康柔性脂质体混悬液滴在喷碳铜网上,以2.0%磷钨酸染色,采用JEM-1200EX透射电子显微镜观察载药脂质体的形态。从图5可知,氯诺昔康柔性脂质体大小较均一,表面光滑,近似成球形。
2.6体外释放度实验
采用透析法对氯诺昔康柔性脂质体进行体外释放考察。根据最优处方制备适量脂质体于40C冰箱保存备用。由于氯诺昔康的溶解度在pH 8.0较大,能够符合漏槽条件,因此选择PBS(pH 8.0)缓冲液为溶出介质。具体方法如下:取氯诺昔康柔性脂质体混悬液5mL于截留分子量为2000的透析袋中,同时以等量的氯诺昔康PBS(pH 8.0)缓冲液溶液为对照,分别置于含有200mL的PBS(pH 8.0)缓冲液的锥形瓶中,于37℃水浴震荡,分别于0.25、0.5、0.75、1、2、3、4、6、8、10、12、16、20、24h吸取1mL释放介质,同时补加1mL PBS缓冲液并按照“2.2.2”方法测定释放介质中药物浓度,计算药物累计释放百分率。由图6可知,溶液组在4h内就可完全释放,而脂质体组在24h内有82.06%药物从脂质体中释放出来,存在明显的缓释作用。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!