本发明涉及生物与医药新剂型、制剂技术领域,更具体涉及一种基于细胞源性微囊泡的肿瘤靶向递送载体,同时还涉及一种基于细胞源性微囊泡的肿瘤靶向递送载体的制备方法,方法便捷高效,同步实现细胞源性微囊泡表面叶酸和磁双重标记;还涉及一种基于细胞源性微囊泡的靶向递送载体在制备治疗或预防肿瘤的局部化疗药物和基因治疗载体中的应用,适用于科研及临床实践中利用这一肿瘤靶向递送载体用于药物或治疗基因的特异性靶向输送,用以预防或治疗以下疾病:1、宫颈癌、卵巢癌、子宫内膜癌、睾丸癌、胃癌、肾癌、肺腺癌、脑瘤等高表达叶酸受体的恶性肿瘤;2、位于浅表部位的恶性肿瘤,如皮肤癌、口腔癌;3、位于浅表部位的脉管性疾病,如皮肤或黏膜血管瘤、静脉畸形、淋巴管畸形。
背景技术:
化学疗法是目前治疗恶性肿瘤最广泛采用的临床选择之一,然而过低的药物靶向递送效率严重限制了其治疗效果。不仅如此,传统的化学疗法中,药物在全身的非特异性分布还损害机体正常细胞和组织器官的功能,导致不可避免的副作用和严重的全身毒性。另一方面,近年来蓬勃发展的基因治疗正成为未来肿瘤治疗最具潜力的前进方向。针对肿瘤发生的遗传学背景,将外源性目的基因引入肿瘤细胞或其他体细胞内以纠正过度活化或补偿缺陷的基因功能,从而达到治疗肿瘤的目的,即为肿瘤的基因治疗。虽然RNA干扰(RNAi)现象的发现与研究为基因治疗带来了新的契机,但是当前的基因治疗策略与化学治疗一样,仍然极大受限于过低的靶向性,从而限制了临床疗效,并造成了诸多难以避免的全身副作用。综上,临床急需更安全可靠、更生物友好、更具有靶向性的药物或治疗基因递送载体,以降低全身的副反应,增强治疗效果。近年来,基于纳米载体的药物递送系统得到了迅猛的发展,这一方面得益于肿瘤病变部位因紊乱的脉管系统增强了局部的“渗透和保留效果”,导致纳米载体被动聚集于实体瘤部位,另一方面也是因为不同的修饰方法赋予了纳米载体主动地肿瘤靶向性。这些基于纳米载体的药物递送系统可以保护荷载药物在递送过程中免于生物降解,表现为更优良的活体稳定性和更长的药物半衰期,从而大极大增加药物在肿瘤病变部位的作用时间,改善临床疗效。
细胞源性的微囊泡,作为一种生物源性纳米级别的膜性结构(直径约100-1000nm),几乎所有细胞均可分泌,可以实现在细胞间传递多种生物活性分子(包括蛋白质、RNAs、DNAs等)。它作为一种天然的生物信息传递平台,已受到广泛关注,并且其作为治疗载体的应用价值也逐渐被认识和开发。相比于传统的人工合成的纳米载体,细胞源性微囊泡作为药物或基因递送载体具备以下优点:
1、微囊泡的磷脂双分子层外膜不仅可以作为天然的屏障,保护内容物在循环过程中不被降解,还可以通过与受体细胞膜的相互作用或直接融合增强内容物被受体细胞内吞的效率;
2、得益于其来源和结构特点,微囊泡具备穿透体内生物屏障,将药物直接递送至颅内等深在部位的潜能;
3、即使不经过任何人工修饰,细胞源性微囊泡也具备固有的天然肿瘤靶向性;
4、微囊泡在体内循环过程中具备良好的生物稳定性;
5、微囊泡具备优异的生物安全性,多项临床试验已经证实自体同源的微囊泡几乎不存在免疫原性。
然而,伴随着细胞源性微囊泡迅速转化为实践应用的纳米载体,面临的问题不断涌现,诸如缺乏方便快速的用于分离富集细胞源性微囊泡的技术和方法,缺乏可扩展的高效装载内容物的方法,以及受限的肿瘤特异靶向性等,这些缺陷严重阻碍了这一新技术新领域的发展和应用。
叶酸受体(folate receptor,FR)是一类糖基磷脂酰肌醇锚定的膜蛋白,对叶酸(folate,FA)具有极高的亲和性,并且通过受体介导的胞吞作用摄取叶酸。研究发现,叶酸受体选择性高表达于卵巢肿瘤以及许多上皮来源恶性肿瘤,诸如子宫内膜癌、肾癌、肺癌、乳腺癌、脑瘤等,而其在正常组织中呈现为极低甚至可忽略的表达水平。上述结果提示叶酸/叶酸受体(FA/FR)系统具备极大的肿瘤靶向性研究价值,一方面可以实现对肿瘤细胞的特异高选择性,降低对正常组织的毒副作用,另一方面又可以利用这一受体介导的胞吞作用促进肿瘤细胞对治疗药物的摄取,改善临床疗效。
磁性纳米颗粒结合外源性磁场(magnetic field,MF)已经被用于改善药物载体的靶向性,这一技术被称为磁性药物靶向。通过将磁性材料与细胞共培养,可以获取内部装载有超顺磁性纳米颗粒的微囊泡,结合外源性磁场可以实现这些微囊泡在特定部位的富集。并且,装载有磁性纳米颗粒的微囊泡还可以作为造影剂用于核磁共振成像检查以及热温治疗。此外,利用外源性磁场促进此种微囊泡在肿瘤部位的大量富集可以有效降低受体介导的靶向定位过程中发生的脱靶效应。然而,此种修饰策略中细胞对磁性纳米颗粒的吞噬以及微囊泡对内吞磁性颗粒的包裹完全是非选择性和不可控的。因此,这一“间接包装”策略仍然存在效率不高,产量过低以及产物不均匀的弊病,这些都严重限制了它的临床应用。通过与膜上特异受体结合的免疫磁性分离方法已经广泛用于分离天然囊泡,并且相较于超速离心方法,其展现出了诸多优势(例如便捷,高效等)。然而,这种策略也极大的受限于因微囊泡特征性表面标志物的缺乏而造成的产量过低。综上,当前急需一种生物友好的、高效的、通用的标记策略以克服上述弊端,尤其是实现已改造微囊泡的可扩展的生产。
技术实现要素:
本发明的目的是在于提供了一种基于细胞源性微囊泡的肿瘤靶向递送载体,微囊泡的磷脂双分子层外膜不仅可以作为天然的屏障,保护内容物在循环过程中不被降解,还可以通过受体细胞膜的相互作用或直接融合增强内容物被受体细胞内吞的效率;得益于其来源和结构特点,微囊泡具备穿透体内生物屏障,将药物直接递送至颅内等深在部位的潜能;即使不经过任何人工修饰,细胞源性微囊泡也具备固有的天然肿瘤靶向性;此外本发明制备的细胞源性囊泡还具有受体/配体、磁双重靶向,其靶向性得到进一步提升;微囊泡在体内循环过程中具备良好的生物稳定性;微囊泡具备优异的生物安全性,多项临床试验已经证实自体同源的微囊泡几乎不存在免疫原性。本发明制备的一种基于细胞源性微囊泡的药物和治疗基因靶向递送载体可以有效增强荷载药物或治疗基因在肿瘤部位的富集,适用于多种肿瘤的治疗;增强抗肿瘤疗效。
本发明的另一个目的是在于提供了一种基于细胞源性微囊泡的肿瘤靶向递送载体的制备方法,该方法一次性实现细胞源性微囊泡表面的叶酸和磁的双重标记;方法易行,操作简便,适用性广,可用于获得各种细胞源性功能化微囊泡;制备方法不依赖于复杂实验设备,适合广泛推广;制备效率高,节省人力物力财力,在微囊泡收集前的培养过程中同步实现双重修饰改造过程;利用前期修饰过程简化了微囊泡载体的分离步骤,同时避免了潜在的蛋白聚合物、凋亡小体等杂质的污染,极大改善了产物纯度;制备产物均一性好,且产量具备扩展性;实现了快速方便、经济高效的制备一种具备叶酸和磁双靶向性的药物递送载体。
本发明的另一个目的是在于提供一种基于细胞源性微囊泡的药物和治疗基因靶向递送载体在制备治疗或预防肿瘤的局部治疗药物中的应用。通过电穿孔方法向改造后的微囊泡载体中载入不同的敏感性化疗药物或治疗基因,针对不同的肿瘤,配合外源性磁场的应用,可以有效增强荷载药物或治疗基因在肿瘤部位的富集,适用于多种肿瘤的治疗;增强抗肿瘤疗效,改善了当前化学治疗或基因治疗的临床效果;在维持肿瘤局部有效治疗浓度的同时可以降低血药浓度,从而有效降低了药物的全身副作用。这一应用具备的优势为肿瘤的临床治疗带来了新的希望。
为了达到上述的目的,本发明采用以下技术措施:
其技术构思是:一种基于细胞源性微囊泡的肿瘤靶向递送载体,由细胞源性微囊泡、磷脂-聚乙二醇-生物素(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000],DSPE-PEG-Biotin)(Avanti Polar Lipids,Alabaster,AL)、磷脂-聚乙二醇-叶酸(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[folate(polyethylene glycol)-2000],DSPE-PEG-FA)(Avanti Polar Lipids,Alabaster,AL)和链霉亲和素修饰氧化铁纳米颗粒(Streptavidin-conjugated iron oxide nanoparticles,SA-IONPs)(Enriching Biotechnology,Shanghai,China)四部分组成,修饰过程为:利用磷脂替换策略将DSPE-PEG-Biotin和DSPE-PEG-FA修饰在细胞膜表面,然后饥饿处理所得的细胞,使细胞分泌细胞源性囊泡至培养上清中,最后将SA-IONPs加入到上清中,使SA-IONPs与上清中的细胞源性囊泡结合,最后利用磁性分离的方法收集FA/IONP-MVs。
各部分结构式如下:
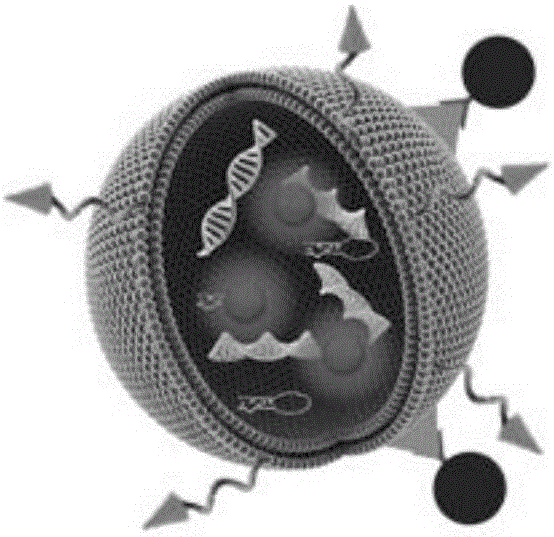
细胞源性微囊泡(MVs):(结构示意图见图1)。
DSPE-PEG-Biotin:
DSPE-PEG-FA:SA-IONPs:
一种基于细胞源性微囊泡的肿瘤靶向递送载体(FA/IONP-MVs-DOX/siRNA/miRNA):(结构示意图见图2)。一种基于细胞源性微囊泡的肿瘤靶向递送载体的制备方法,其步骤是:
1、配置条件培养基:基础培养基(HyClone,Waltham,MA,USA)中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)(HyClone,Waltham,MA,USA)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin,(50ug/mL)和DSPE-PEG-Folate(5ug/mL),4℃保存,获得条件培养基;
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约46-50h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基继续培养46-50h,以促进细胞释放微囊泡,收集培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的培养上清在4℃条件下用2000g离心20min,然后取上清,在4℃条件下继续50000g离心60min,将获取的沉淀用无菌PBS重悬,重悬后液体在4℃条件下继续50000g离心60min,获取的修饰后微囊泡用适宜体积无菌PBS重悬,冻存于-80℃。
4、将步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体与抗生物素和抗叶酸的抗体在37℃条件下孵育28-32min,通过蔗糖密度梯度离心法去除游离抗体后,进行流式细胞学检测和荧光显微镜观察,确定上述制备的种基于细胞源性微囊泡的肿瘤靶向递送载体上叶酸和生物素双重标记的效率为92%左右。获得膜表面经叶酸及氧化铁纳米颗粒双重修饰效率达到约92%的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
5、将步骤2中获得的培养上清在3-5℃条件下用1800-2200g离心18-22min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育28-32min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,用PBS重悬并洗脱数次(3-7次),最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
6、将步骤5中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体进行透射电镜观察、动态光散射分析和分子生物学分析,发现相较于对照组未修饰微囊泡,以及经常规超速离心分离的已修饰微囊泡,此种改造方法对微囊泡的水流动力学直径、界面电动势等物理性质,以及内部包裹的蛋白质、核酸等特征性分子的表达无明显影响。上述结果证明这一基于细胞源性微囊泡的肿瘤靶向递送载体的制备过程具备良好的生物友好性。获得理化特性及生物学特征未见明显改变的一种基于细胞源性微囊泡的肿瘤靶向递送载体。
7、将正常未修饰微囊泡和步骤5中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体与肿瘤细胞共培养,检测不同浓度上述微囊泡载体对细胞增殖和活力等功能的影响。将正常未修饰微囊泡和上述制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体分别经尾静脉注射入裸鼠体内,三周后对裸鼠进行肝肾功能分析、血液学分析,以及肿瘤组织学分析,相较于性别、年龄和体重配对的对照组裸鼠,上述制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体对裸鼠的肝肾功能,血液成分等指标均无明显的影响,并且未发现潜在的免疫毒性,证明这一种基于细胞源性微囊泡的肿瘤靶向递送载体具备优良的活体生物安全性,不存在明显的副反应。获得无明显活体毒副作用的一种基于细胞源性微囊泡的肿瘤靶向递送载体。
8、将步骤5中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体与细胞共培养,发现该递送载体可有效被细胞摄取,并且其摄取效率受到培养基中游离叶酸的竞争性抑制,而在外源性磁场的作用下,又可削弱培养基中游离叶酸的竞争性抑制,促进细胞摄取该递送载体。获得可有效被肿瘤细胞经叶酸受体介导的胞吞作用摄取的一种基于细胞源性微囊泡的肿瘤靶向递送载体。
9、将步骤5中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体用近红外荧光探针DiR标记后经尾静脉注射于移植瘤模型的裸鼠体内,相较于对照组未修饰的微囊泡,上述基于细胞源性微囊泡的肿瘤靶向递送载体更显著地聚集于肿瘤部位,并且在肿瘤部位施加外源磁场的作用下,此种聚集效率可明显增强,通过对总荧光信号的分析,在注射后4h,对照组未修饰微囊泡在肿瘤部位的聚集效率为5.31%,单纯修饰氧化铁纳米颗粒的微囊泡辅助外源性磁场约为13.23%,而靶向递送载体辅助外源性磁场为25.89%,证明这一基于细胞源性微囊泡的肿瘤靶向递送载体具备优异的活体内肿瘤靶向性。获得具备良好活体内主动及外源磁场介导的被动肿瘤靶向性的一种基于细胞源性微囊泡的肿瘤靶向递送载体(其结构示意图见附图图3)。该载体的外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体的内部为各种来源于母细胞的生物信息分子,如DNA、mRNA、microRNA和蛋白质。
一种基于细胞源性微囊泡的肿瘤靶向递送载体在制备治疗或预防肿瘤的局部化疗药物中的应用,步骤如下:
1、配置条件培养基:基础培养基中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50ug/mL)和DSPE-PEG-Folate(5ug/mL),4℃保存,获得条件培养基;
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约46-50h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基(DMEM,Hyclone)继续培养46-50h,以促进细胞释放微囊泡,收集培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的收集的上清在3-5℃条件下用1800-2200g离心18-22min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育28-32min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的微囊泡载体。
4、将步骤3中收集的肿瘤靶向递送载体与水溶性抗肿瘤药物,如阿霉素(Doxorubicin,DOX)(40μg/mL)混合,利用电穿孔方式载入抗肿瘤药物,在37℃温箱中孵育28-32min,在外源性磁场作用下分离肿瘤靶向递送载体,去除游离药物,用PBS重悬并洗脱数次(4-8次),最后将沉淀用PBS重悬。获得载有抗肿瘤药物阿霉素的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
5、将步骤4中获得的载有抗肿瘤药物阿霉素的基于细胞源性微囊泡的肿瘤靶向递送载体利用荧光显微镜、流式细胞学、小动物活体成像等多种技术手段检验药物载入效率以及载药后肿瘤靶向递送载体的保存稳定性和活体稳定性。
6、将步骤4中获得的载有抗肿瘤药物阿霉素的基于细胞源性微囊泡的肿瘤靶向递送载体与肿瘤细胞共培养,发现其可有效的被肿瘤细胞内吞,并且其内吞效率受到培养基中游离叶酸的竞争性抑制以及外源性磁场的正向促进。
7、将正常未修饰微囊泡、游离DOX、载有DOX的正常未修饰微囊泡、未载药的靶向递送载体以及步骤4中获得的载有抗肿瘤药物阿霉素的基于细胞源性微囊泡的肿瘤靶向递送载体分别经尾静脉注射于移植瘤裸鼠模型体内,每三天监测裸鼠体重及肿瘤大小变化,结果发现上述载药后肿瘤靶向递送载体发挥了最优异的抗肿瘤生长效果,并且在辅助外源性磁场的条件下,上述载药后肿瘤靶向递送载体几乎完全抑制了肿瘤的生长,而对裸鼠体重无明显影响。安乐处死裸鼠,收获肿瘤行组织学分析,结果发现上述载药后肿瘤靶向递送载体有效促进肿瘤细胞的凋亡,抑制其增殖。
所述的肿瘤为宫颈癌、卵巢癌、子宫内膜癌、睾丸癌、胃癌、肾癌、肺腺癌、脑瘤等高
表达叶酸受体的恶性肿瘤;
所述的肿瘤位于浅表部位的恶性肿瘤,具体为皮肤癌、口腔癌;
所述的位于浅表部位的脉管性疾病,具体为皮肤或黏膜血管瘤、静脉畸形、淋巴管畸形。
一种基于细胞源性微囊泡的肿瘤靶向递送载体在制备治疗或预防肿瘤的基因治疗药物中的应用,步骤如下:
1、配置条件培养基:基础培养基中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50ug/mL)和DSPE-PEG-Folate(5ug/mL),4℃保存,获得条件培养基;
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约46-50h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基(DMEM,Hyclone)继续培养46-50h,以促进细胞释放微囊泡,收集培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的收集的上清在3-5℃条件下用1800-2200g离心18-22min,然后取上清,每100mL培养上清中添加400μL SA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育28-32min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的微囊泡载体。
4、将步骤3中收集的肿瘤靶向递送载体与治疗基因(例如siRNA、miRNA等)混合,利用电穿孔方式载入抗肿瘤药物,在37℃温箱中孵育28-32min,在外源性磁场作用下分离肿瘤靶向递送载体,去除游离治疗基因,用PBS重悬并洗脱数次(4-8次),最后将沉淀用PBS重悬。获得载有抗肿瘤治疗基因的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
5、将步骤4中获得的载有抗肿瘤治疗基因的基于细胞源性微囊泡的肿瘤靶向递送载体利用荧光显微镜、流式细胞学、小动物活体成像等多种技术手段检验治疗基因载入效率以及载药后肿瘤靶向递送载体的保存稳定性和活体稳定性。
6、将步骤4中获得的载有抗肿瘤治疗基因的基于细胞源性微囊泡的肿瘤靶向递送载体与肿瘤细胞共培养,发现其可有效的被肿瘤细胞内吞,并且相应治疗基因在肿瘤细胞内高度富集,而其内吞效率受到培养基中游离叶酸的竞争性抑制以及外源性磁场的正向促进。最后检测肿瘤细胞内相应靶基因的调节变化,以及对肿瘤增殖等功能活动的影响。
7、将正常未修饰微囊泡、游离治疗基因、装载有治疗基因的正常未修饰微囊泡、未载入治疗基因的靶向递送载体以及步骤4中获得的载有治疗基因的基于细胞源性微囊泡的肿瘤靶向递送载体分别经尾静脉注射于移植瘤裸鼠模型体内,每三天监测裸鼠体重及肿瘤大小变化,结果发现上述载药后肿瘤靶向递送载体发挥了最优异的抗肿瘤生长效果,并且在辅助外源性磁场的条件下,上述载药后肿瘤靶向递送载体几乎完全抑制了肿瘤的生长,而对裸鼠体重无明显影响。安乐处死裸鼠,收获肿瘤行组织学分析,结果发现上述载药后肿瘤靶向递送载体有效促进肿瘤细胞的凋亡,抑制其增殖。
所述的肿瘤为宫颈癌、卵巢癌、子宫内膜癌、睾丸癌、胃癌、肾癌、肺腺癌、脑瘤等高表达叶酸受体的恶性肿瘤;
所述的肿瘤位于浅表部位的恶性肿瘤,具体为皮肤癌、口腔癌;
所述的位于浅表部位的脉管性疾病,具体为皮肤或黏膜血管瘤、静脉畸形、淋巴管畸形。
本发明与现有技术相比,具有以下优点和效果:
1、本发明选择细胞源性微囊泡构建肿瘤靶向递送载体,利用微囊泡的天然属性,相较于人工合成的纳米载体,在体内具备良好的生物稳定性和生物安全性,几乎无免疫原性和细胞毒性,同时天然的磷脂双分子膜结构可以保护载入内容物的循环稳定性,并且可以直接穿透体内的生物屏障,将荷载药物递送至颅内等特殊脏器,发挥优良的抗肿瘤效果;
2、利用膜修饰的方式一次性实现微囊泡表面叶酸和氧化铁纳米颗粒的双重标记,快捷高效;
3、利用膜修饰方式实现微囊泡表面氧化铁纳米颗粒标记,相较于之前通过培养细胞实现微囊泡非选择性随机包裹氧化铁纳米颗粒的方式,本发明的标记操作更高效、方便,标记效率更高,标记密度完全可控,且在胞膜上标记,节省了微囊泡内部的空间,为肿瘤治疗药物的荷载预留了场所;
4、利用膜修饰的方式实现微囊泡表面氧化铁纳米颗粒的标记,继而利用磁特性实现微囊泡载体的分离富集,相较于之前通过超速离心的方式或者免疫磁性方式分离微囊泡,本发明操作简洁高效,只需一步,分离用时少于1小时,可实现高达92%的微囊泡的分离富集,不再受限于表面标志物的缺乏,提高了产量,可以满足临床用量的需求;避免了蛋白聚集物或诸如凋亡小体等其他颗粒的污染,保证产物的纯度和均一性,有助于降低副反应;温和的分离操作环境避免了微囊泡的聚集或者破损,有助于保持其功能活性;
5、本发明利用膜修饰的方式实现微囊泡表面氧化铁纳米颗粒标记,为该肿瘤靶向递送载体赋予了磁特性,有助于后续应用扩展,例如后续可利用外源性磁场增强药物的肿瘤靶向性创造了条件;
6、本发明利用膜修饰的方式实现微囊泡表面叶酸的标记,操作简洁高效,标记效率高,且标记密度稳定可控。由于大多数上皮来源肿瘤及卵巢肿瘤高表达叶酸受体,而正常组织则低表达叶酸受体,经叶酸修饰的肿瘤靶向递送载体可以经由受体介导的途径被肿瘤细胞迅速高效内吞,有效增强该肿瘤靶向递送载体的肿瘤靶向性,同时减少被正常组织的摄取,降低全身副反应。
7、本发明利用电穿孔的方式实现抗肿瘤药物或治疗基因的载入,操作简洁高效,相较于直接给药,微囊泡的天然膜结构可有效增强荷载物在体内循环过程中的稳定性,减少给药浓度,降低副反应。
8、本发明具备良好的可扩展性,可根据病人选择自体同源的微囊泡构建肿瘤靶向递送载体,同时根据肿瘤对药物或治疗基因的敏感性选择合适的载入药物,实现肿瘤的个体化治疗。
附图说明
图1为一种细胞源性微囊泡(MVs)的结构示意图。
图2为一种基于细胞源性微囊泡的肿瘤靶向递送载(FA/IONP-MVs-DOX/siRNA/ miRNA)的结构示意图。其中:O代表氧原子,HO代表羟基,N代表氮原子,NH代表亚氨基,NH2代表氨基,NH4+代表铵根,C代表碳原子,P代表磷原子,S代表硫原子。
图3为一种具备良好活体内主动及外源磁场介导的被动肿瘤靶向性的基于细胞源性微囊泡的肿瘤靶向递送载体的结构示意图。该载体的外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体的内部为各种来源于母细胞的生物信息分子,如DNA、mRNA、microRNA和蛋白质。
图4为一种膜表面经插入叶酸及氧化铁纳米颗粒修饰的基于细胞源性微囊泡的肿瘤靶向递送载体的结构示意图。该载体的外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体的内部为来源于母细胞的生物信息分子,如DNA、mRNA、microRNA和蛋白质。
图5为一种载有化疗药物的基于细胞源性微囊泡的肿瘤靶向递送载体的结构示意图。该载体外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体内部为来源于母细胞的生物信息分子,如DNA、mRNA、micro-RNA和蛋白质;此外,载体内部还装载有抗肿瘤药物阿霉素(DOX)。
图6为一种载有针对survivin的抗肿瘤siRNA的基于细胞源性微囊泡的肿瘤靶向递送载体的结构示意图。该载体外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体内部为来源于母细胞的生物信息分子,如DNA、mRNA、micro-RNA和蛋白质;此外,载体内部还装载有具备抗肿瘤作用的siRNA。
图7为一种本发明内容模式图。
图8为一种细胞源性微囊泡表面DSPE-PEG-Biotin和DSPE-PEG-Folate同步标记效率。
将经条件培养基培养48h,再饥饿48h后收获的细胞上清经常规高速离心后收获修饰后细胞微囊泡,将其与抗生物素和抗叶酸荧光抗体孵育,通过蔗糖密度梯度离心法去除游离抗体后利用流式细胞术检测双阳性微囊泡的比例,结果提示微囊泡表面DSPE-PEG-Biotin和DSPE-PEG-Folate同步标记效率约为92%。
图9为一种利用外源性磁场快速分离该肿瘤靶向递送载体的操作图。
图10为一种肿瘤靶向递送载体(FA/IONP-MVs)在双重标记及磁介导的分离过程中对微囊泡固有生物学特性无明显影响。
将常规超速离心的正常未修饰细胞微囊泡[MVs(DC)],常规超速离心的叶酸和生物素双修饰微囊泡[FA/Biotin-MVs(DC)]、经常规超速离心的肿瘤靶向递送载体[FA/IONP-MVs(DC)]和磁介导分离的肿瘤靶向递送载体[FA/IONP-MVs(MS)]分别提取核酸和蛋白质进行RT-qPCR和Westernblot实验,检验不同组微粒所携带的标志性核酸及蛋白质的差异。结果表明这一肿瘤靶向递送载体(FA/IONP-MVs)在双重标记及磁介导的分离过程中对微囊泡固有生物学特性无明显影响。
图11为一种肿瘤靶向递送载体(FA/IONP-MVs)在不载入药物的状态下对肿瘤细胞增殖或活力等功能影响相较于正常未修饰细胞微囊泡(MVs)无明显差异,提示该肿瘤靶向递送载体具备良好的生物安全性。
图12为一种静脉注射该肿瘤靶向递送载体(FA/IONP-MVs)对移植瘤裸鼠模型的体重无明显影响。
将PBS(Control)、正常未修饰微囊泡(MVs)和该肿瘤靶向递送载体(FA/IONP-MVs)分别经尾静脉注射进入移植瘤裸鼠模型体内,每三天一次,同时监测裸鼠体重,结果表明三组无显著差异。
图13为一种相较于PBS(Control)或正常未处修饰细胞微囊泡(MVs),尾静脉注射该肿瘤靶向递送载体(FA/IONP-MVs)对移植瘤裸鼠的肝肾功能及血液学指标影响无显著差异。
图14为一种肿瘤靶向递送载体(FA/IONP-MVs)能更高效的被细胞摄取,并且其摄取效率受共培养体系中游离叶酸(Free FA)的竞争性抑制和外源性磁场(MF)的正向促进。
将正常未修饰细胞微囊泡(MVs)和制备的肿瘤靶向递送载体(FA/IONP-MVs)用近红外荧光探针DiR进行标记染色,然后将他们分别与肿瘤细胞HeLa共培养,在共聚焦显微镜下观察细胞摄取效率以及当在共培养体系中添加游离叶酸(FA)前后,或施加外源性磁场(MF)前后的摄取效率变化。
图15为一种肿瘤靶向递送载体(FA/IONP-MVs)在移植瘤裸鼠体内具备良好的肿瘤靶向性。
将正常微囊泡(MVs),该肿瘤靶向递送载体(FA/IONP-MVs)和单纯氧化铁纳米颗粒标记的微囊泡(IONP-MVs)分别用近红外荧光探针DiR染色标记后经尾静脉注射进移植瘤裸鼠体内,然后在活体荧光成像系统中观察注射前以及注射后1h、注射后2h、注射后4h裸鼠体内荧光信号的分布,最后将裸鼠麻醉处死后单独观察每组裸鼠内脏及肿瘤中荧光信号的分布。结果表明,在外源性磁场(MF)的辅助下,该肿瘤靶向递送载体(FA/IONP-MVs)具备最优异的肿瘤靶向性。
图16为一种肿瘤靶向递送载体载入肿瘤化疗药物的效率。
利用电穿孔的方式向该肿瘤靶向递送载体内载入化疗药物DOX,然后采用流式细胞学技术分析在电穿孔操作时不同药物浓度(1μg/mL、5μg/mL、20μg/mL、40μg/mL、60μg/mL)对载入效率的影响,结果发现载入效率与药物浓度成正相关;将载入药物后的肿瘤靶向递送载体用CFSE进行染色,然后在荧光显微镜下可以观察到化疗药物DOX荧光信号和微囊泡信号的共定位。
图17为一种载入化疗药物DOX后该肿瘤靶向递送载体可有效地抗宫颈癌肿瘤生长作用及低生物毒性。
将PBS、游离DOX(Free DOX)、载有DOX的正常未处理细胞微囊泡(MVs-DOX)、载有DOX的单纯氧化铁纳米颗粒标记的微囊泡(IONP-MVs-DOX)以及载入DOX后的肿瘤靶向递送载体(FA/IONP-MVs-DOX)分别经尾静脉注射入宫颈癌移植瘤裸鼠模型体内,每3天一次,同时监测肿瘤体积变化(宽*宽*长/2)和裸鼠体重变化。结果发现配合肿瘤局部外源性磁场作用,载入化疗药物DOX后该肿瘤靶向递送载体具备良好的抗肿瘤生长作用,并且对裸鼠体重无明显影响。
具体实施方式
实施例1:
一种基于细胞源性微囊泡的肿瘤靶向递送载体的制备方法,其步骤是:
1、条件培养基:基础培养基(HyClone,Waltham,MA,USA)中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)(HyClone,Waltham,MA,USA)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50ug/mL)和DSPE-PEG-Folate(5ug/mL),4℃保存,获得条件培养基。
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约48h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基继续培养细胞,以促进细胞释放微囊泡,培养46-50h后收集细胞培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的培养上清在4℃条件下用2000g离心20min,然后取上清,在4℃条件下继续50000g离心60min,将获取的沉淀用无菌PBS重悬,重悬后液体4℃条件下继续50000g离心60min,获取的微囊泡用适宜体积无菌PBS重悬,冻存于-80℃。
4、将步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体与抗生物素和抗叶酸的抗体在37℃条件下孵育28-32min,通过蔗糖密度梯度离心法去除游离抗体后,进行流式细胞学检测和荧光显微镜观察,确定上述制备的种基于细胞源性微囊泡的肿瘤靶向递送载体上叶酸和生物素双重标记的效率为92%左右。获得膜表面经叶酸及氧化铁纳米颗粒双重修饰效率达到约92%的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。(图2)
5、将步骤2中获得的收集的上清在4℃条件下用2000g离心20min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育30min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,弃去上清,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存(该载体的结构示意图见图4)。该载体的外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体的内部为来源于母细胞的生物信息分子,如DNA、mRNA、microRNA和蛋白质。
实施例2:
一种基于细胞源性微囊泡的肿瘤靶向递送载体的体内外生物安全性检测,其步骤如下:
1、条件培养基:基础培养基(HyClone,Waltham,MA,USA)中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)(HyClone,Waltham,MA,USA)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50ug/mL)和DSPE-PEG-Folate(5ug/mL),4℃保存,获得条件培养基。
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约48h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基继续培养细胞,以促进细胞释放微囊泡,培养46-50h后收集细胞培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的收集的上清在4℃条件下用2000g离心20min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育30min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,弃去上清,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
4、将步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体进行透射电镜观察,动态光散射分析,结果发现相较于对照组正常未修饰微囊泡,以及经常规超速离心分离的已修饰微囊泡,此种制备方法对微囊泡的水流动力学直径、界面电动势等物理性质无明显影响。
5、将步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体进行分子生物学分析,提取总蛋白质进行Westernblot分析,提取核酸进行RT-qPCR分析,检测细胞微囊泡携带的蛋白质、核酸等特征性分子的表达,结果表明此种制备方法对微囊泡的内容物无明显影响。上述结果证明这一基于细胞源性微囊泡的肿瘤靶向递送载体的制备过程是生物友好性的。(图4)
6、将正常未修饰细胞微囊泡(20μg/mL)和步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体(20μg/mL)分别与肿瘤细胞HeLa共培养,然后用细胞活力计数仪检测细胞的增殖和活力变化,发现即使在载体浓度高达40μg/mL的浓度,连续培养70-74h,该肿瘤靶向递送载体对细胞的增殖和活力的影响均无显著差异。(图5)
7、将PBS(100μL,n=5),未修饰微囊泡(100μL,1mg/mL,n=5)和上述制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体(100μL,1mg/mL,n=5)分别经尾静脉注射入周龄和体重配对的雌性C57BL/6小鼠体内,每三天记录一次小鼠体重,三周后对小鼠进行肝肾功能分析、血液学分析、以及肿瘤组织学分析。相较于PBS组小鼠,未修饰微囊泡和上述制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体对小鼠的体重、肝肾功能、血液成分等指标均无明显的影响,并且未发现潜在的免疫毒性,证明这一种基于细胞源性微囊泡的肿瘤靶向递送载体具备优良的活体生物安全性,不存在明显的副反应。(图6、图7)
实施例3:
一种基于细胞源性微囊泡的肿瘤靶向递送载体的体内外肿瘤靶向性检测,其步骤如下:
1、条件培养基:基础培养基(HyClone,Waltham,MA,USA)中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)(HyClone,Waltham,MA,USA)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50μg/mL)和DSPE-PEG-Folate(5μg/mL),4℃保存,获得条件培养基。
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约48h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基继续培养细胞,以促进细胞释放微囊泡,培养46-50h后收集细胞培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的收集的上清在4℃条件下用2000g离心20min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育30min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,弃去上清,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
4、将正常未处理细胞微囊泡(20μg/mL)和步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体(20μg/mL)分别用CFSE进行荧光染色标记,然后将他们分别与用cellmask进行荧光染色标记的肿瘤细胞HeLa进行共培养,然后在荧光显微镜下观察,发现该递送载体可有效被细胞摄取;然后在共培养体系中添加游离叶酸(1mM),结果发现肿瘤细胞对该肿瘤靶向递送载体的摄取效率受到培养基中游离叶酸的竞争性抑制;如果在培养瓶的底部放置磁铁(100×50×20mm,0.6T),结果发现外源性磁场的辅助作用又可削弱培养基中游离叶酸的竞争性抑制,促进细胞摄取该递送载体。(图8)
5、将正常未修饰的微囊泡,单纯氧化铁颗粒标记的微囊泡和步骤3中制备的一种基于细胞源性微囊泡的肿瘤靶向递送载体用近红外荧光探针DiR(300μg/mL)标记后经尾静脉注射于移植瘤模型的裸鼠体内,然后于注射前、注射后1h、注射后2h和注射后4h分别用活体荧光成像系统检测裸鼠体内荧光信号分布。相较于对照组正常未修饰的微囊泡,上述基于细胞源性微囊泡的肿瘤靶向递送载体更显著地聚集于肿瘤部位,并且在肿瘤部位施加外源磁场时,该聚集效率可明显增强,通过对总荧光信号分析,在注射后4h,对照组未修饰微囊泡在肿瘤部位的聚集效率为5.31%,单纯修饰氧化铁纳米颗粒的微囊泡辅助外源磁场为13.23%,而靶向递送载体辅助外源磁场为25.89%,证明这一基于细胞源性微囊泡的肿瘤靶向递送载体具备优异的活体内肿瘤靶向性。(图9)
所述的肿瘤为宫颈癌、卵巢癌、子宫内膜癌、睾丸癌、胃癌、肾癌、肺腺癌、脑瘤等高表达叶酸受体的恶性肿瘤。
实施例4:
一种载有化疗药物的基于细胞源性微囊泡的肿瘤靶向递送载体的制备方法,其步骤如下:
1、条件培养基:基础培养基(HyClone,Waltham,MA,USA)中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)(HyClone,Waltham,MA,USA)和1%(v/v) 抗生素,同时添加DSPE-PEG-Biotin(50μg/mL)和DSPE-PEG-Folate(5μg/mL),4℃保存,获得条件培养基。
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约48h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基(DMEM,Hyclone)继续培养细胞,以促进细胞释放微囊泡,培养46-50h后收集细胞培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的收集的上清在4℃条件下用2000g离心20min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育30min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,弃去上清,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的微囊泡载体。
4、将步骤3中收集的肿瘤靶向递送载体(100μg,50μL)与不同浓度(0-60μg/mL)的水溶性抗肿瘤药物,如阿霉素(Doxorubicin,DOX)(Actavis Italy S.p.A.)混合,添加电穿孔缓冲液,将体系配成250μL,利用电穿孔方式(条件为250V和350μF,Bio-Rad Gene PulserXcellTM Electroporation System)载入抗肿瘤药物,在37℃温箱中孵育30min,在外源性磁场作用下分离肿瘤靶向递送载体,去除游离药物,用PBS重悬并洗脱数次(4-8次),最后将沉淀用PBS重悬。利用流式细胞学技术分析不同药物浓度对药物载入效率的影响,最终确定40μg/mL的DOX浓度为最适宜的选择,用于后续实验。获得载有抗肿瘤药物阿霉素的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。(图10)
5、将步骤4中制备的一种载有化疗药物的基于细胞源性微囊泡的肿瘤靶向递送载体在37℃条件下储存7天,随后用流式细胞学技术分析其载入的DOX的荧光信号,结果发现相较于新制备的一种载有化疗药物的基于细胞源性微囊泡的肿瘤靶向递送载体,该条件下长达7天的储存未明显改变其内的DOX信号,表明本方法制备的一种载有化疗药物的基于细胞源性微囊泡的肿瘤靶向递送载体具备极好的稳定性(该载体的结构示意图见图5)。该载体外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体内部为来源于母细胞的生物信息分子,如DNA、mRNA、micro-RNA和蛋白质;此外,载体内部还装载有抗肿瘤药物阿霉素(DOX)。
实施例5:
一种载有化疗药物的基于细胞源性微囊泡的肿瘤靶向递送载体对肿瘤细胞的靶向性,其步骤如下:
1、配置条件培养基:基础培养基中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50μg/mL)和DSPE-PEG-Folate(5μg/mL),4℃保存,获得条件培养基。
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约48h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基(DMEM,Hyclone)继续培养48h,以促进细胞释放微囊泡,收集培养上清,用于后续分离获得功能化的微囊泡。
3、将步骤2中获得的收集的上清在4℃条件下用2000g离心20min,然后取上清,每100mL培养上清中添加400μLSA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育30min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,弃去上清,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的微囊泡载体。
4、将步骤3中收集的肿瘤靶向递送载体(100μg,50μL)与水溶性抗肿瘤药物,如阿霉素(Doxorubicin,DOX)(Actavis Italy S.p.A.)(40μg/mL)混合,添加电穿孔缓冲液,将体系配成250μL,利用电穿孔方式(条件为250V和350μF,Bio-Rad Gene PulserXcellTMElectroporation System)载入抗肿瘤药物,在37℃温箱中孵育30min,在外源性磁场作用下分离肿瘤靶向递送载体,去除游离药物,用PBS重悬并洗脱数次(4-8次),最后将沉淀用PBS重悬。获得载有抗肿瘤药物阿霉素的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存。
5、将游离DOX、载有DOX的正常未修饰的微囊泡(20μg/mL)、载有DOX的单纯氧化铁颗粒标记的微囊泡(20μg/mL)和步骤4中制备的一种载有化疗药物DOX的基于细胞源性微囊泡的肿瘤靶向递送载体(20μg/mL)与肿瘤细胞HeLa共培养,在共培养的起始一小时,在培养皿底部放置一块磁铁(100×50×20mm,0.6T),经过4h的共培养后用PBS洗涤3次,再用4%多聚甲醛固定10min,最后对细胞核进行DAPI染色,随后在荧光显微镜下观察不同组内细胞中DOX的荧光信号密度。结果发现步骤4中制备的一种载有化疗药物DOX的基于细胞源性微囊泡的肿瘤靶向递送载体被细胞摄取然后释放DOX的效率最高,表明其良好的肿瘤靶向性。
6、步骤4中制备的一种载有化疗药物DOX的基于细胞源性微囊泡的肿瘤靶向递送载体(20μg/mL)与肿瘤细胞HeLa进行共培养,观察在共培养体系中添加游离叶酸或不添加游离叶酸,以及在培养初期辅助外源性磁场或不适用外源性磁场的条件下,该递送载体被肿瘤细胞摄取的效率变化。结果发现肿瘤细胞对该肿瘤靶向递送载体的摄取效率受到培养基中游离叶酸的竞争性抑制,同时外源性磁场的辅助作用又可削弱培养基中游离叶酸的竞争性抑制,促进细胞摄取该递送载体。
实施例6:
一种基于细胞源性微囊泡的肿瘤靶向递送载体在制备治疗或预防宫颈癌的局部化疗药物中的应用,其步骤如下:
1、将Hela细胞(200μL溶液含107个肿瘤细胞)种植于裸鼠(体重约18~20g)皮下,构建裸鼠移植瘤模型,模型构建成功后每三天记录肿瘤体积(宽*宽*长/2),待肿瘤体积达到150mm3后将裸鼠随机均分为7组,用于后续实验。
2、将7组裸鼠分别用尾静脉注射PBS(100μL;G1),尾静脉注射游离DOX(100μL、5mg/kg;G2),尾静脉注射正常未修饰微囊泡(100μL;G3),尾静脉注射载有DOX的正常未修饰微囊泡(100μL;G4),尾静脉注射单纯氧化铁颗粒修饰的载药微囊泡加外源磁场(100μL;G5),尾静脉注射叶酸和氧化铁纳米颗粒双修饰的载药微囊泡(100μL;G6),尾静脉注射叶酸和氧化铁颗粒双修饰的载药微囊泡加外源性磁场(100μL;G7)这7种治疗方式处理,以DOX的用量为5mg/kg确定每组载体的具体用量,药物注射每3天一次,共持续4次,同时每3天记录裸鼠体重和肿瘤体积(宽*宽*长/2)。
3、最后,将裸鼠麻醉处死,获取肿瘤组织,拍照并称量肿瘤重量,并对获取的肿瘤组织进行组织学分析(TUNEL细胞凋亡检测)。
4、相较于其他组,上述载药后肿瘤靶向递送载体辅助外援磁场发挥了最优异的抗肿瘤生长效果,几乎完全抑制了肿瘤的生长,而对裸鼠体重无明显影响。肿瘤组织学分析发现上述载药后肿瘤靶向递送载体有效促进肿瘤细胞的凋亡,抑制其增殖。(图11)
实施例7:
一种载有治疗基因的基于细胞源性微囊泡的肿瘤靶向递送载体的制备方法,其步骤如下:
1、配置条件培养基:基础培养基(HyClone,Waltham,MA,USA)中补充10%(v/v)胎牛血清(fetal bovine serum,FBS)(HyClone,Waltham,MA,USA)和1%(v/v)抗生素,同时添加DSPE-PEG-Biotin(50μg/mL)和DSPE-PEG-Folate(5μg/mL),4℃保存,获得条件培养基。
2、将步骤1中获得的条件培养基用于细胞的培养,在标准条件下培养约48h,待细胞生长至融合度达到80%左右时更换培养基,用不含血清的基础培养基(DMEM,Hyclone)继续培养细胞,以促进细胞释放微囊泡,培养46-50h后收集细胞培养上清,用于后续分离获得功能化微囊泡。
3、将步骤2中获得的收集的上清在4℃条件下用2000g离心20min,然后取上清,每100mL培养上清中添加400μL SA-IONPs溶液(10μg/μL),用涡旋仪轻柔混匀混合液,然后在37℃温箱中孵育30min,接着使用一块磁铁(100×50×20mm,0.6T)将混合液中SA-IONPs标记成功的微囊泡分离出来,弃去上清,用PBS重悬并洗脱数次,最后将沉淀用PBS重悬,冻存于-80℃。获得膜表面经插入叶酸及氧化铁纳米颗粒修饰的微囊泡载体。
4、将步骤3中收集的肿瘤靶向递送载体(100μg)与针对survivin的抗肿瘤siRNA(500nM)混合,添加电穿孔缓冲液,将体系配成250μL,利用电穿孔方式(条件为250V和350μF,Bio-Rad Gene PulserXcellTM Electroporation System)载入抗肿瘤治疗基因,在37℃温箱中孵育30min,在外源性磁场作用下分离肿瘤靶向递送载体,去除游离治疗基因,用PBS重悬并洗脱数次(4-8次)。获得载有针对survivin的抗肿瘤siRNA的基于细胞源性微囊泡的肿瘤靶向递送载体,以溶液形式保存(该载体结构示意图见图6)。该载体外膜是类似于细胞膜的磷脂双分子层,叶酸及生物素通过DSPE-PEG嵌合于磷脂双分子层中,SA-IONPs与生物素结合,包绕于载体外侧;载体内部为来源于母细胞的生物信息分子,如DNA、mRNA、micro-RNA和蛋白质;此外,载体内部还装载有具备抗肿瘤作用的siRNA。
实施例8:
一种基于细胞源性微囊泡的肿瘤靶向递送载体在制备治疗或预防宫颈癌的局部基因治疗药物中的应用,其步骤如下:
1、将Hela细胞(200μL溶液含107个肿瘤细胞)种植于裸鼠(体重约18~20g)皮下,构建裸鼠移植瘤模型,模型构建成功后每三天记录肿瘤体积(宽*宽*长/2),待肿瘤体积达到150mm3后将裸鼠随机均分为7组,用于后续实验。
2、将7组裸鼠分别用尾静脉注射PBS(100μL,n=6),尾静脉注射游离针对survivin的抗肿瘤siRNA(100μL,20μM,n=6),尾静脉注射正常未修饰微囊泡(100μL,1mg/mL,n=6),尾静脉注射载有针对survivin的抗肿瘤siRNA的正常未修饰微囊泡(100μL,1mg/mL,n=6),尾静脉注射单纯氧化铁颗粒修饰的载有针对survivin的抗肿瘤siRNA微囊泡加外源磁场(100μL,1mg/mL,n=6),尾静脉注射叶酸和氧化铁纳米颗粒双修饰的载有针对survivin的抗肿瘤siRNA微囊泡(100μL,1mg/mL,n=6),尾静脉注射叶酸和氧化铁颗粒双修饰的载药微囊泡加外源性磁场(100μL,1mg/mL,n=6)这7种治疗方式处理,药物注射每3天一次,共持续4次,同时每3天记录裸鼠体重和肿瘤体积(宽*宽*长/2)。
3、最后,将裸鼠麻醉处死,获取肿瘤组织,拍照并称量肿瘤重量,并对获取的肿瘤组织进行组织学分析(TUNEL细胞凋亡检测,survivin、Ki-67等指标表达检测)。
4、相较于其他组,上述载药后肿瘤靶向递送载体辅助外援磁场发挥了最优异的抗肿瘤生长效果,几乎完全抑制了肿瘤的生长,而对裸鼠体重无明显影响。肿瘤组织学分析发现上述载药后肿瘤靶向递送载体有效促进肿瘤细胞的凋亡,抑制其增殖。
