青光眼手术治疗的辅助装置及其制备方法与流程
本发明属于医疗器械领域,具体涉及一种青光眼手术治疗的辅助装置及其制备方法。
背景技术:
青光眼治疗中唯一经过多中心验证、有确切临床疗效的治疗方案就是降低患者的眼压。尽管越来越多的证据表明药物治疗在青光眼的早期阶段具有确切的疗效,但大部分就诊患者已处于疾病的中、晚期,药物已经不能满足“靶眼压”的需要,因此手术仍是最主要的治疗方法。滤过性手术是青光眼手术治疗中最常用的手术,其成功的关键是建立有效的永久性房水流出通道,以此来降低眼压,临床上以形成功能性滤过泡为特征。青光眼滤过性手术不同于其他眼部手术和其他青光眼手术,对伤口的愈合有其独特而严格的要求,即球结膜伤口愈合要完全,而结膜下组织要愈合不全,巩膜瓣以及滤过内口则要完全不愈合,这样才能建立功能性滤过泡。尽管各类青光眼有其不同的自身原因所在,但滤过性手术失败的共同点多系滤过通道的成纤维细胞过度增殖,形成瘢痕,造成滤过通道堵塞而不能形成功能性滤过泡。如何减少滤过性手术后的滤过道瘢痕化,即减少成纤维细胞增殖、减少胶原纤维合成和抑制纤维血管肉芽组织形成,一直是困扰青光眼手术治疗的难题。
目前临床上使用伤口愈合调节剂是目前较为普遍的促进滤过通道形成的方式,常用的有丝裂霉素C和抗代谢药5-氟尿嘧啶。5-氟脲嘧啶抑制成纤维细胞和血管内皮细胞是作用于分裂增殖的细胞(S期),而丝裂霉素C抑制成纤维细胞和血管内皮细胞是作用于整个细胞周期,是更为常用的方法。丝裂霉素C的具体用法:作成结膜瓣及巩膜瓣后,用海绵或棉片吸含一定浓度的MMC溶液,置于巩膜床面,将巩膜瓣和结膜瓣覆盖其上,也有将含MMC的海绵或棉片置放于结膜瓣下,达到一定的设计时间后,除去海绵或棉片,用平衡盐液或生理盐水充分冲洗创面,再作小量切除、虹膜周边切除,巩膜瓣、结膜瓣复位缝合。5-氟尿嘧啶通常的用药方法是在术后2周内连续多次结膜下注射。这两种药物只能一定程度抑制纤维化,不能持续作用。而且两种药物的使用还会引起滤过泡坏死、低眼压、感染性眼内炎、眼组织机械性损伤、角膜毒性等毒副作用和并发症,并发症发生率和手术医生的经验有关,两种药物过多应用会引起毒副作用,过少又无法有效发挥作用。
为了提高青光眼滤过性手术的成功率和减少手术并发症,临床上还应用了术后可松解或可拆除的巩膜瓣调节缝线、巩膜瓣下或结膜瓣下高分子化合物填充或可吸收降解生物材料(如透明质酸生物胶、胶原引流条以及羊膜等)填充等方法。
可松解或可拆除的巩膜瓣调节缝线的具体方法是在青光眼滤过性手术中巩膜瓣两侧边缘缝合1~2针可拆除的调节缝线,术后密切观察并根据前房、滤过泡及眼压情况必要时在表面麻醉下行可调节缝线松解术,这种方法没有本质上抑制纤维化,效果不甚理想。而且可调节缝线的拆除时间不宜确定,且拆除时易损伤滤过泡。
巩膜瓣下或结膜瓣下高分子化合物填充或可吸收降解生物材料填充的具体方法是在抗青光眼术中植入不同类型的植入物于浅层巩膜瓣下的减压室中或结膜瓣下,维持术后的滤过功能,仅起到机械支撑作用,但是不会抑制纤维增殖,虽然形成腔隙,但是通道仍会阻塞。
技术实现要素:
有鉴于此,本发明的目的在于针对现有技术的缺陷,提供一种青光眼手术治疗的辅助装置及其制备方法。本发明所述青光眼手术治疗的辅助装置具有机械支撑作用可形成功能化滤过泡,且吡非尼酮长时间持续释放,有效抑制纤维化增殖,持续有效抑制青光眼术后滤过通道疤痕化。
为实现本发明的目的,本发明采用如下技术方案:
一种青光眼手术治疗的辅助装置,包括支撑膜和负载在支撑膜上的吡非尼酮。
优选的,所述支撑膜为壳聚糖。
优选的,所述辅助装置在干燥状态下厚度为0.2-0.5mm,复水厚度为0.8-1.1mm。
本发明还提供了所述青光眼手术治疗的辅助装置的制备方法,吡非尼酮溶于壳聚糖溶液后倒入表面皿中干燥。
优选的,所述吡非尼酮与壳聚糖的质量比为5:95。
优选的,所述壳聚糖溶液为壳聚糖的醋酸水溶液,按g/ml计,所述壳聚糖溶液中壳聚糖浓度为10%-20%。
优选的,所述壳聚糖溶液中的醋酸水溶液中醋酸的浓度为1~10wt%。
优选的,还包括碱洗液中和的步骤。
优选的,所述碱洗液中和的具体方法为在碱洗液中浸泡、水漂洗,干燥。
进一步,优选的,所述碱洗液为10-15wt%的NaOH水溶液与等体积无水乙醇的混合液;所述浸泡的时间为3-5min;所述漂洗为漂洗至pH中性
由上述技术方案可知,本发明提供了一种青光眼手术治疗的辅助装置及其制备方法。本发明所述青光眼手术治疗的辅助装置包括支撑膜和负载在支撑膜上的吡非尼酮。所述具有机械支撑作用可有效形成功能性滤过泡。同时所述青光眼手术治疗的辅助装置中的吡非尼酮能够长时间持续作用,可减少药物浓度,降低眼内毒性,提高药物有效性和安全性,能够安全、持续、高效的抑制青光眼术后滤过通道的瘢痕化,提高青光眼手术成功率。本发明所述辅助装置可在青光眼手术中放置于患眼中,术中一次性作用,病人依从性高。本发明所述辅助装置的制备方法为将吡非尼酮溶于壳聚糖溶液后在表面皿中干燥,操作简单,成本低。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示吡非尼酮标准曲线(用于计算药物缓释);
图2示实施例2中青光眼手术治疗的辅助装置中吡非尼酮的缓释曲线;
图3示实施例3手术切口位置图,其中,图A为实施例1制得的青光眼手术治疗的辅助装置组;图B为未载药的支撑膜组;图C为空白对照组;图D为羊膜阳性对照组;
图4示实施例3术后14d手术区病理切片HE染色结果图(×40倍高倍镜,箭头所示虹膜根切处),其中,图A为实施例1制得的青光眼手术治疗的辅助装置组;图B为未载药的支撑膜组;图C为空白对照组;图D为羊膜阳性对照组;
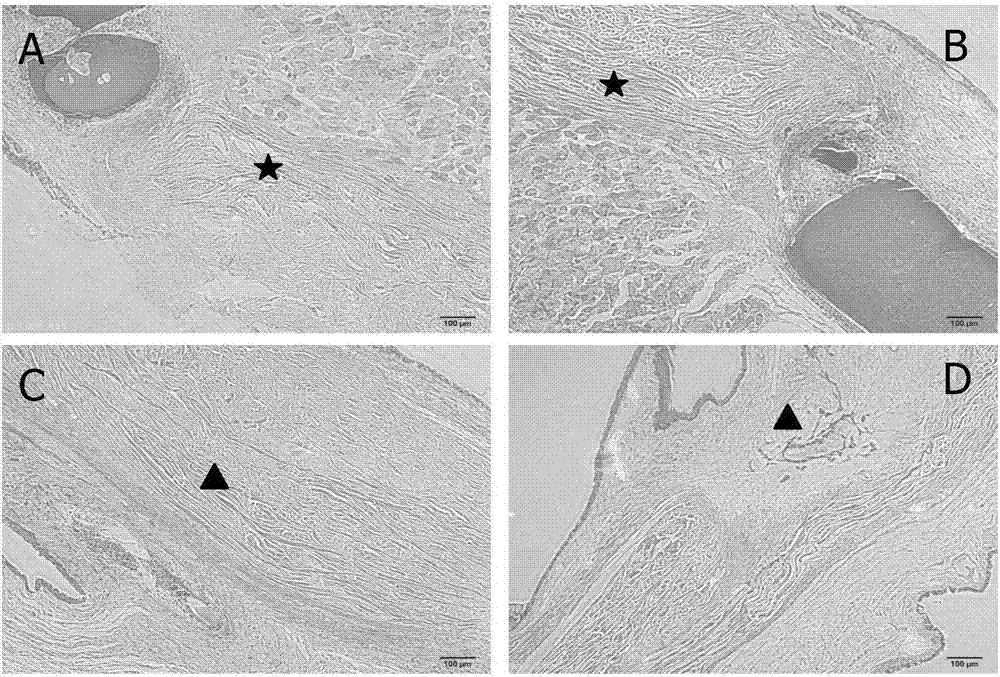
图5示实施例3术后28d手术区病理切片HE染色结果图(×100倍高倍镜),其中,图A为实施例1制得的青光眼手术治疗的辅助装置组;图B为未载药的支撑膜组;图C为空白对照组;图D为羊膜阳性对照组。
具体实施方式
本发明公开了一种青光眼手术治疗的辅助装置及其制备方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供了一种青光眼手术治疗的辅助装置,包括支撑膜和负载在支撑膜上的吡非尼酮。
本发明所述青光眼手术治疗的辅助装置,具有机械支撑作用可形成功能化滤过泡,同时可以有效的改善吡非尼酮的药物生物活性,并且长时间持续释放吡非尼酮,持续抑制青光眼术后滤过通道瘢痕化。
其中,优选的,所述辅助装置在干燥状态下厚度为0.2-0.5mm,复水厚度为0.8-1.1mm。
本发明还提供了所述青光眼手术治疗的辅助装置的制备方法,吡非尼酮溶于壳聚糖溶液后倒入表面皿中干燥。
优选的,所述吡非尼酮与壳聚糖的质量比为0.5%-1%。
本发明所述青光眼手术治疗的辅助装置的制备方法中所述壳聚糖溶液为壳聚糖的醋酸水溶液。
其中,作为优选,按g/ml计,所述壳聚糖溶液中壳聚糖浓度为10%-20%。即每100ml所述壳聚糖溶液中含壳聚糖10g~20g。
作为优选,所述壳聚糖溶液中的醋酸水溶液中醋酸的浓度为1~10wt%。即每100g水中含醋酸1g~10g。
本发明所述青光眼手术治疗的辅助装置中吡非尼酮溶于壳聚糖溶液后在表面皿中干燥即得。所述干燥优选为真空干燥。在一些实施方案中,所述干燥具体为置于真空烘箱内,抽真空直至溶液挥发完毕。
进一步的,本发明所述青光眼手术治疗的辅助装置的制备方法,还包括碱洗液中和的步骤,以中和制备方法中的醋酸,使制得的所述青光眼手术治疗的辅助装置保持中性。
在一些实施方案中,所述碱洗液中和的具体方法为在碱洗液中浸泡、水漂洗,干燥。在碱洗液中浸泡中和醋酸,随后水漂洗至pH中性除去多余的碱液,最后干燥制得所述青光眼手术治疗的辅助装置。
其中,所述碱洗液浸泡的时间依赖于碱洗液碱性强弱。
在某一具体实施例中,所述碱洗液为10-15wt%的NaOH水溶液与等体积无水乙醇的混合液。所述浸泡的时间为3-5min。
本发明所述制备方法制得的所述青光眼手术治疗的辅助装置干燥状态下其厚度约0.2mm,质稍硬,复水厚度约0.8mm,质软。
由上述技术方案可知,本发明提供了一种青光眼手术治疗的辅助装置及其制备方法。本发明所述青光眼手术治疗的辅助装置包括支撑膜和负载在支撑膜上的吡非尼酮。所述具有机械支撑作用可有效形成功能性滤过泡。同时所述青光眼手术治疗的辅助装置中的吡非尼酮能够长时间持续作用,可减少药物浓度,降低眼内毒性,提高药物有效性和安全性,能够安全、持续、高效的抑制青光眼术后滤过通道的瘢痕化,提高青光眼手术成功率。本发明所述辅助装置可在青光眼手术中放置于患眼中,术中一次性作用,病人依从性高。本发明所述辅助装置的制备方法为将吡非尼酮溶于壳聚糖溶液后在表面皿中干燥,操作简单,成本低。
为了进一步理解本发明,下面结合具体实施例对本发明进行详细阐述,如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。
实施例1
取10g醋酸加入100g(ml)水中溶解得到100ml 10%醋酸水溶液。取10g壳聚糖加入100ml 10%醋酸水溶液中溶解得到100ml 10%壳聚糖溶液。
取60mg吡非尼酮与10ml的10%壳聚糖溶液充分混合,倒入表面皿中,真空烘箱内37℃真空干燥,然后置于碱洗液(10-15wt%NaOH水溶液与等体积无水乙醇的混合物)中浸泡3-5min,去离子水漂洗至中性,真空烘箱内37℃真空干燥至恒重,得到青光眼手术治疗的辅助装置,即负载吡非尼酮的壳聚糖支撑膜,密封备用。制得的青光眼手术治疗的辅助装置干燥状态下其厚度约0.3mm,质稍硬,复水厚度约0.9mm,质软。
另取10ml的10%壳聚糖溶液倒入表面皿中,真空烘箱内37℃真空干燥,得到未载药的支撑膜。干燥状态下其厚度约0.35mm,质稍硬,复水厚度约0.45mm,质软。
实施例2
将实施例1制得的青光眼手术治疗的辅助装置浸泡于200mL pH 7.4的5%甲醇的PBS溶液中进行释放实验,高效液相色谱制备吡非尼酮标准曲线,具体操作为利用高效液相色谱Agilent 1200高效液相色谱仪(美国安捷伦科技有限公司,VWD检测器)进行检测,色谱柱为C18柱,柱温为35℃,以pH 7.4、30%乙腈的PBS缓冲液为流动相,流速为1ml/min,上样体积为20μL,吡非尼酮的保留时间为10.97min。制得的吡非尼酮标准曲线如图1所示。
再利用高效液相色谱在相同条件下检测不同时间缓释溶液(PBS溶液)中吡非尼酮的浓度,从而计算缓释量制备缓释曲线,结果如图2。
图2结果显示,实施例1制得的青光眼手术治疗的辅助装置浸泡于体外缓释体系中前8天的缓释速度比较快,后12天缓释速度较慢。缓释20天基本达到缓释平台期,不再有药物的缓慢释放,其中前期的快速释放药物具有局部高药物浓度的特点可以对抗手术后快速的组织增殖,随后进入缓慢释放药物的阶段,巩固组织滤过泡的形成,最终保持青光眼术后形成完整的滤过通道,提高手术成功率。
实施例3组织病理观察
以新西兰白兔为实验对象,分别为4组:A组实施例1制得的青光眼手术治疗的辅助装置组;B组未载药的支撑膜组;C组空白对照组;D组羊膜阳性对照组。
手术时术眼上方沿角膜缘做以穹窿为基底的结膜瓣,于11:00-13:00方位做以角膜缘为基底的3.0mm×4.0mm长方形巩膜瓣,1/2巩膜厚度,切除深部巩膜1.0mm×2.0mm小梁组织,虹膜周边切除,术中分别将2.0mm×3.0mm实施例1制得的青光眼手术治疗的辅助装置(A组)、未载药的支撑膜(B组)、羊膜(D组)置于巩膜瓣下,C组巩膜瓣下不做任何处理。然后间断缝合巩膜游离角2-3针(如图3箭头所示为手术切口位置)。分别于术后14d和28天取手术区组织进行病理切片,HE染色观察,结果见图4和图5。
术后14天组织病理切片显示,A组植入的实施例1制得的青光眼手术治疗的辅助装置轻微降解,周围无明显纤维包裹,未见明显的炎症浸润(如图4A,箭头);B组未载药支撑膜少许降解,周围无明显纤维包裹,未见明显的炎症浸润,增殖较为严重(如图4B,箭头);C组术区可见明显纤维增生(如图4C,箭头);D组术区可见瘢痕化(如图4D,箭头)。
术后28天组织病理切片显示,A组术区可见少量纤维增生,纤维排列不规则,纤维增生组织间可见明显的间隙(如图5A,星形),房水可通过组织间隙渗出到巩膜吸收,降低眼压;B组术区可见纤维增生,纤维排列较规则,组织间隙结合紧密(如图5B,星形),房水难以排除;C组瘢痕化增生严重,可见瘢痕组织质地紧密(如图5C,三角形),堵塞青光眼手术滤过通道,阻碍房水外流导致青光眼手术失败;D组术区可见瘢痕化化增生,瘢痕化较轻,可见不太明显的滤过道(如图5D,三角形),基本维持青光眼术后眼压稳定。
- 还没有人留言评论。精彩留言会获得点赞!